修回日期: 2005-01-15
接受日期: 2005-01-20
在线出版日期: 2005-03-01
目的: 为增强HepG2细胞的氨和苯二氮 类代谢活性, 在Enosawa et al的HepG2-GS细胞基础上以转基因技术, 建立一种谷氨酰胺合成酶(glutamine sythetase, GS)和细胞色素P450 3A4(CYP 3A4)都过表达的HepG2-GS-3A4细胞. 并在人工肝脏循环器中培养此细胞, 以检测此人工肝脏的氨和安定(Diazapam, DZP)的代谢率.
方法: 以Western杂交和免疫组化等方法证实CYP 3A4蛋白过表达后, 将HepG2-GS-3A4细胞接种于一种人工肝脏循环器, 待细胞数量增至足够后, 充入含NH4Cl和安定的培养液, 孵育24 h, 定时取样, 分别以Berthelot反应法检测氨浓度, 以HPLC法检测DZP及其代谢产物.
结果: CYP 3A4蛋白在HepG2-GS-3A4细胞中表达显著强于HepG2细胞(P=0.02). 在接种有HepG2-GS-3A4细胞的生物人工肝脏循环器中与HepG2细胞和无细胞组相比, 氨浓度明显降低(P=0.04), 氨浓度约降低约31.7%; DZP浓度也明显降低(P=0.03), 且有DZP的代谢产物生成产生, DZP浓度约降低36.7%.
结论: 接种有HepG2-GS-3A4细胞的生物人工肝脏有明显的DZP和氨的代谢能力, 代谢能力虽弱于文献中的猪原代肝细胞, 但具有性质稳定, 易于传代和储存, 获取细胞数量不受限制等优点.
引文著录: 王宁, 陈洋, 郭仁宣, 郭克建. HepG2细胞构成的生物人工肝脏体外氨与安定的代谢能力. 世界华人消化杂志 2005; 13(5): 648-652
Revised: January 15, 2005
Accepted: January 20, 2005
Published online: March 1, 2005
AIM: To establish a bioartificial liver (BAL) that can metabolize both ammonia and diazepam (DZP).
METHODS: HepG2-GS-3A4 cell line was produced by transfecting cytochrome P450 3A4 (CYP3A4) gene into HepG2-GS, a cell line established by Enosawa et al by introducing glutamine sythetase (GS) gene into HepG2 cells. After the expression of CYP3A4 was verified by Western blot and immunohistochemistry, HepG2-GS-3A4 cells were inoculated in a BAL circulatory reactor. When the cells grew to enough number, medium containing NH4Cl and DZP was infused. Samples were collected at fixed time. The concentrations of ammonia, DZP and its metabolites were analyzed by Berthelot reaction and HPLC.
RESULTS: The expression of CYP3A4 in HepG2-GS-3A4 was much stronger than that in HepG2 (P = 0.02). The BAL with HepG2-GS-3A4 showed much higher capacities of ammonia and DZP metabolisms than those with HepG2 or no cells (P = 0.04 and 0.03). The concentrations of ammonia and DZP were decreased by 31.7% and 36.7%, respectively.
CONCLUSION: BAL with HepG2-GS-3A4 processes strong activities of ammonia and DZP metabolism, with advantages of stability, easy subculture and storage, and abundance of cells.
- Citation: Wang N, Chen Y, Guo RX, Guo KJ. Ammonia and diazepam metabolism capacities of a novel bioartificial liver with HepG2 cells. Shijie Huaren Xiaohua Zazhi 2005; 13(5): 648-652
- URL: https://www.wjgnet.com/1009-3079/full/v13/i5/648.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i5.648
肝性脑病的发生是多因素共同作用的结果, 血氨和内生性苯二氮 共同增高发挥了重要作用[1]. Basile et al[2]发现血浆苯二氮 浓度与肝性脑病程度相关, 并在暴发性肝功衰竭导致的肝性脑病患者血浆中检测到安定和去甲基安定. Itzhak et al[1]认为血氨增高可导致肝衰小鼠的脑外周型苯二氮 受体和亲和力的增加. Bauer et al[3]发现以苯二氮 受体拮抗剂氟马西尼可逆转患者的肝昏迷. 肝性脑病时产生的内生性苯二氮 有着与安定及其代谢产物去甲基安定、去甲羟基安定等相似的化学结构, 血氨增高可增加外周型苯二氮 受体和亲和力和GABA能抑制性神经传导[4], 因此建立一种既能代谢氨又能代谢苯二氮 类物质的解毒型人工肝脏将能改善和治疗肝性脑病. 我们应用的生物人工肝脏循环器有可重复使用, 无菌操作较安全, 细胞密度高, 营养与废物在培养液和细胞之间交换更充分等优点. Enosawa et al曾将过表达谷氨酰胺合成酶(glutamine synthetase, GS)的HepG2(HepG2-GS)细胞接种于该循环器, 并使其数量增生至4×109, 而后用其治疗、降低了急性肝功不全猪的血氨浓度, 但生存时间并未显著延长[5]. 细胞色素P450 3A4(Cytochrome P450 3A4, CYP 3A4)有较高的苯二氮 类代谢活性[6]. 因此, 在Enosawa et al基础上, 利用转基因技术, 建立了即过表达GS和又过表达CYP 3A4的HepG2细胞(HepG2-GS-3A4). 并以HepG2-GS-3A4细胞接种于上述生物人工肝脏循环器, 并使其活细胞数目增生至最大之后, 测定其体外代谢氨和苯二氮 类代表性物质安定的代谢能力.
HepG2购于Riken Cell Bank(Tsukuba, Japan). HepG2-GS细胞及培养液(RDF)由 Enosawa惠赠(National Research Institute for Child Health and Development, Tokyo, Japan). 构建HepG2-GS-3A4的方法: 以含有2个多克隆位点, 分别以human cytomegalovirus(CMV)和human elongation 1-α subunit(EF-1α)基因做为启动子, 和zeocin耐药基因的质粒做载体. 将hamster鼠的GS 和人CYP 3A4基因分别插入上述2多克隆位点. 再以脂质体转染法转染于HepG2细胞[7]. HepG2-GS-3A4细胞培养于含100 mL/L小牛血清和 Zeocin 200 mg/L的D-MEM/F12: RPMI 1: 1培养液; HepG2细胞培养于含100 mL/L小牛血清和青霉素100 kU/L和链霉素100 mg/L 的D-MEM/F12: RPMI 1: 1培养液; 细胞均置于37℃, 含50 mL/L CO2的孵箱中培养.
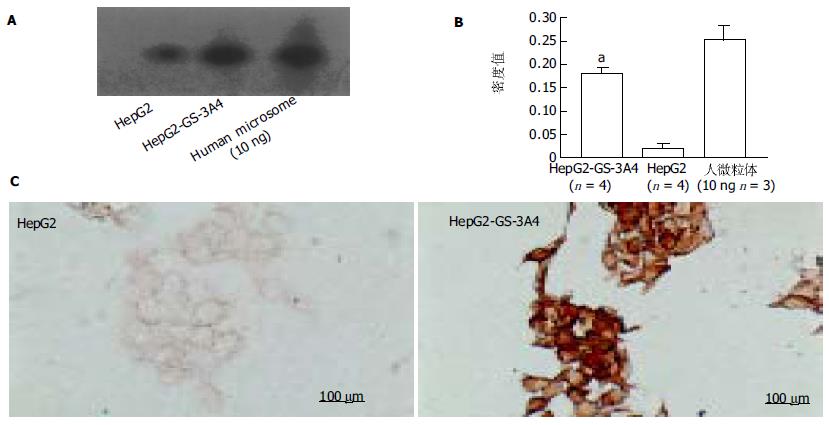
1.2.1 Western杂交和免疫组化法检测CYP: 3A4 将105个细胞置于等张的缓冲液中, 用氮气气穴法(cavit-ation)破碎. 将20 μg蛋白置于70 g/L SDS-PAGE胶电泳, 再转到醋酸纤维膜上, 并以人CYP3A4抗体杂交(WB human CYP3A4 kit, BDGenetest, MA, USA), 以人肝微粒体作参照, 密度测量作定量分析. 免疫组化法, 先将细胞培养于分格载玻片上, 待细胞数目增生足够后, 固定, 再以上述抗体, 用LSAB2/HRP(DAB)-kit试剂盒(DakoCytomation, Denmark), 进行免疫组化检测.
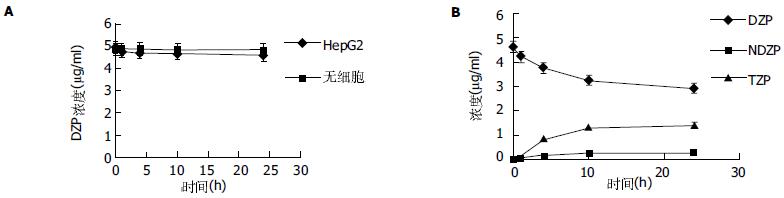
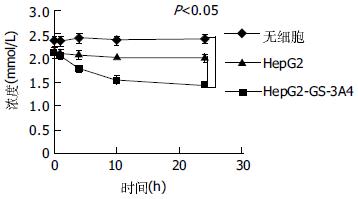
1.2.2 离体检测其DZP和氨的代谢率: 将HepG2-GS-3A4细胞接种于Enosawa et al应用的同样的生物人工肝脏循环器中(US patent 5270207[1993]). 在循环器的反应器中, 肝细胞附着于一种缠绕于中轴的玻璃纤维膜上. 该反应器外腔内有温水循环, 使其内腔保持37℃. 培养液、O2和CO2可从反应器上面不断地输入.首先, 将约4.0×108 HepG2的细胞接种于反应器内.24 h后, 新鲜的培养液以1 L/d的速度输入反应器, 在反应器内充分混合后, 以同样速度排出[5,19]. 实验按接种的细胞不同分3组: HepG2-GS-3A4细胞; HepG2细胞和无细胞. 每组实验各重复4次. 接种细胞后约7 d, 通过检测反应器内培养液的葡萄糖和乳酸含量, 了解到反应器内细胞近汇合时, 开始测定DZP和氨的代谢率.首先, 停止培养液循环. 然后将含DZP和NH4Cl的培养液充入反应器, 使其终浓度达到DZP 5 mg/L; NH4Cl, 2.5 mmol/L. 保持反应器内恒温于37℃左右. 持续充入含50 mL/L CO2的O2. 分别于0, 1, 4, 10, 24 h取样. 并以HPLC法检测DZP及其代谢产物, 去甲基安定(nordiazepam, NDZP)、羟基安定(temazepam, TZP)、去甲基羟基安定(oxazepam, OZP)的浓度[8], 以Berthelot反应法检测氨浓度[9].
统计学处理 结果以mean±SD表示. 以ANOVA对数据进行统计学分析, P<0.05时认为有显著差异.
Western杂交结果显示, CYP 3A4蛋白在HepG2-GS-3A4细胞和HepG2细胞中都可以检测到(图1A, B). 然而, HepG2-GS-3A4细胞中的CYP 3A4含量约为HepG2的9(0.18+0.014/0.02+0.009)倍(P<0.05)(图2B). 免疫组化结果显示, CYP 3A4蛋白在HepG2-GS-3A4细胞胞质中信号明显强于HepG2细胞呈强阳性(图 1C).
在未接种有肝细胞的生物人工肝脏循环器中, DZP浓度无明显降低(P>0.05); 在接种有HepG2细胞的生物人工肝脏循环器中, DZP浓度有降低, 然而无统计学意义(P>0.05), 且无NDZP, TZP 和OZP的生成(图2A). 在接种有HepG2-GS-3A4细胞的生物人工肝脏循环器中, DZP浓度明显降低(P<0.05). 且有NDZP, TZP产生, TZP产量约为NDZP的5.2(1.3 975+0.072/0.2 701+0.015)倍. 约929.01+ 50.33 μg DZP被代谢, NDZP, TZP分别有148.55+ 7.54, 768.63+40.64 μg产生. DZP浓度约降低36.7%, 开始的4 h内平均速度为0.0 587+0.004 pg/(h·cell), 而24 h平均速度为0.0 194+0.008 pg/(h·cell)(图2B).
在未接种有肝细胞的生物人工肝脏循环器中, 氨浓度无明显降低; 在接种有HepG2细胞的生物人工肝脏循环器中(图3), 氨浓度有降低, 然而无统计学意义(P>0.05); 在接种有HepG2-GS-3A4细胞的生物人工肝脏循环器中, 氨浓度明显降低(P<0.05). 氨浓度约降低31.7%, 开始的4 h内平均速度为0.435×10-6+ 0.028 nmol/(min·cell), 而24 h平均速度为0.075+ 0.005×10-6 nmol/(min·cell).
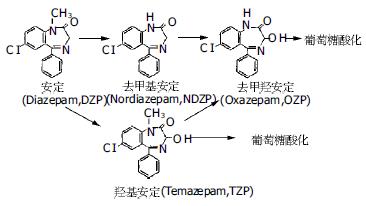
肝脏有很多重要的生理功能, 解毒是其中的一项重要功能. 肝功能衰竭将导致很多毒素的蓄积, 如氨和内生性苯二氮 等[10]. 人工肝脏被寄希望于能够帮助自身肝脏执行其功能, 以延缓等待肝移植的时间, 甚至使自身肝脏得到修复而恢复正常功能[11-13]. 肝脏的大多数功能是由肝细胞来执行的. 动物传染病是猪等动物肝细胞应用的最大弊病[14]. 人正常肝细胞获得困难; 以已建立的人肝细胞系可以克服人正常肝细胞来源不足的缺陷. 有人曾以HepG2细胞构成的人工肝脏进行临床研究[15-16]. 虽然他们是否尚保留足够的肝细胞功能还有待评价, 然而通过基因工程人为地增加一些酶的表达来增强一些功能, 也不失为一个好的办法[13]. Enosawa et al曾将GS基因转染于HepG2细胞使其过表达, 并接种于人工肝脏循环器, 并使其数量增生至4×109, 而后用其治疗、降低了急性肝功不全猪的血氨浓度, 但生存时间并未显著延长[5]. 血氨和内生性苯二氮 共同增高是肝性脑病的重要发病机制之一, CYP 3A4有较高的苯二氮 类代谢活性. 因此, 我们在Enosawa et al基础上, 利用转基因技术, 建立了即过表达GS和又过表达CYP 3A4的HepG2细胞(HepG2-GS-3A4). 在培养皿中HepG2-GS-3A4细胞的氨的代谢能力与HepG2-GS细胞无明显差异(P>0.05)均显著高于HepG2细胞(P<0.05). 这也间接地证明了GS在HepG2-GS-3A4细胞中的过表达. Western杂交和免疫组化结果显示CYP 3A4蛋白表达显著强于HepG2细胞. 因此, HepG2-GS-3A4细胞安定和氨的代谢能力明显强于HepG2. 该部分实验显示了接种有HepG2-GS-3A4细胞的生物人工肝脏循环器有明显的DZP和氨的代谢能力. DZP和氨的代谢率与培养皿中所测得的结果相近, 说明该生物人工肝脏循环器可提供适合于HepG2-GS-3A4细胞生长的环境. 其开始4 h的代谢率较高, 分析原因为, 氨开始时渗透压高, 经HepG2-GS-3A4细胞代谢后浓度逐渐降低, 其进入HepG2-GS-3A4细胞的渗透压也逐渐降低, 故代谢速度逐渐降低. 而DZP为非水溶性, 需主动转运入细胞, 可能由于载体的饱和和耗能增加, 转运速度的下降, 代谢速度也逐渐降低. 在用于治疗时, 氨和内生性苯二氮 增高的血浆持续流入反应器, 其代斜率也许会更高一些. Bader et al[4]曾将原代猪肝细胞接种于一种多层膜状的人工肝脏系统, 并以其代谢4.8 μg DZP, 并于接种后第1 d DZP的清除率为0.47+0.37 pg/(h·cell), 约为本实验所用人工肝脏系统的8倍. 分析原因, 原代肝细胞中含有相对健全的酶系. 而在肝细胞的第I 相反应中不仅CYP 3A4能代谢DZP, 而且其他如3A5、2C19、2B6等都可代谢DZP; 而在肝细胞的第Ⅱ相反应中还可以将DZP的代谢产物OZP和TZP葡萄糖醛酸化, 再随尿排出体外, 从而降低CYP 3A4催化的产物浓度, 而使该反应继续右移. CYP 3A4虽只催化第I相反应, 但在用于治疗时, 自身肝脏细胞会完成第Ⅱ相反应的进行, 随着DZP的代谢产物OZP和TZP于自身的肝细胞内葡萄糖醛酸化, 苯二氮 的代谢率也许会比体外实验更高一些. 正常情况下DZP在人体内主要代谢成NDZP, TZP和OZP三种代谢产物, 分别通过NDZP, TZP 2个途径(图4). NDZP是在正常人体和狗体内都是其主要代谢产物[17], 他与DZP的药理活性相近, 但半衰期更长(30-200 h). 然而, TZP和OZP的半衰期(10-20 h, 5-15 h), 却比DZP(20-100 h)的要短得多. 因此, NDZP的排除需要时间更长, 在DZP中毒或肝功不全时危害更大. 而HepG2-GS-3A4细胞主要将DZP代谢为TZP而不是NDZP, 所以如将其应用于生物人工肝脏系统中, 将大大减少了清除DZP及其代谢产物的时间, 为DZP的代谢提供很大帮助. Enosawa et al曾将HepG2-GS细胞接种于本实验所用人工肝脏反应器, 并培养40 d后测得其对2.3 mmol/L氨的清除率为0.5-0.6 fmol/(min·cell)[5]. 而本实验氨的清除率为0.435 fmol/(min·cell), 因为本实验氨的实际初始浓度为2.098 mmol/L略低, 故氨的代谢率也略低, 而实际氨的清除率基本一致. Enosawa et al还曾将HepG2-GS细胞和猪原代肝细胞分别接种于生物人工肝脏循环器中, 并发现其体外代谢氨的能力为猪原代肝细胞的1/7-1/8左右[18]. 上述分析显示, HepG2-GS-3A4细胞的代谢能力明显弱于猪原代肝细胞. 猪原代肝细胞虽然功能广泛、强大, 然而其功能发挥时间较短(约10 d), 且可释放出异种蛋白和细胞碎屑. 原代肝细胞每获取一次, 需自生体切除, 提取、传代均较困难, 而且有传播动物疾病的危险. 而HepG2虽然功能较差, 但性质稳定, 易于传代和储存, 获取细胞数量不受限制. 随着生物工程学技术的发展, 可通过转基因的方法使其具有多重、增强的功能[5]. 而且通过增加治疗时间, 和或加快血浆流经该循环器的速度, 一定能够增强其于体内代谢DZP和氨的代谢量. 而且, 在不远的将来, 由于生物工程的进步, 一定能获得肝细胞密度更高的人工肝脏, 和功能更强大的重组肝细胞, 而进一步增强其代谢能力.
编辑: 张海宁 电编: 潘伯荣
| 1. | Itzhak Y, Roig-Cantisano A, Dombro RS, Norenberg MD. Acute liver failure and hyperammonemia increase peripheral-type benzodiazepine receptor binding and pregnenolone synthesis in mouse brain. Brain Res. 1995;705:345-348. [PubMed] |
| 2. | Basile AS, Hughes RD, Harrison PM, Murata Y, Pannell L, Jones EA, Williams R, Skolnick P. Elevated brain concentrations of 1, 4-benzodiazepines in fulminant hepatic failure. N Engl J Med. 1991;325:473-478. [PubMed] |
| 3. | Bauer TM, Ritz R, Haberthur C, Ha HR, Hunkeler W, Sleight AJ, Scollo-Lavizzari G, Haefeli WE. Prolonged sedation due to accumulation of conjugated metabolites of midazolam. Lancet. 1995;346:145-147. [PubMed] |
| 4. | Bader A, De Bartolo L, Haverich A. High level benzodiazepine and ammonia clearance by flat membrane bioreactors with porcine liver cells. J Biotechnol. 2000;81:95-105. [PubMed] |
| 5. | Enosawa S, Miyashita T, Suzuki S. In Vivo estimation of bioartificial liver with recombinant HepG2 cells using pigs with ischemic hepatic failure. Cell Transplant. 2001;10:429-433. [PubMed] |
| 6. | Ono S, Hatanaka T, Miyazawa S, Tsutsui M, Aoyama T, Gonzalez FJ, Satoh T. Human liver microsomal diazepam metabolism using cDNA-expressed cytochrome P450s: role of CYP2B6, 2C19 and the 3A subfamily. Xenobiotica. 1996;26:1155-1166. [PubMed] |
| 7. | Miyashita T, Enosawa S, Suzuki S, Tamura A, Tanaka H, Amemiya H, Matsumura T, Omasa T, Suga K, Aoki T. Development of a bioartificial liver with glutamine synthetase-transduced recombinant human hepatoblastoma cell line, HepG2. Transplant Proc. 2000;32:2355-2358. [PubMed] |
| 8. | Azzam RM, Notarianni LJ, Ali HM. Rapid and simple chromatographic method for the determination of diazepam and its major metabolites in human plasma and urine. J Chromatogr B Biomed Sci Appl. 1998;708:304-309. [PubMed] |
| 9. | Hindriks FR, Groen A. Evaluation of the enzymatic ammonia method for urine on the Du Pont automatic clinical analyzer. J Clin Chem Clin Biochem. 1978;16:289-291. [PubMed] |
| 10. | Awad SS, Hemmila MR, Soldes OS, Sawada S, Rich PB, Mahler S, Gargulinski M, Hirschl RB, Bartlett RH. A novel stable reproducible model of hepatic failure in canines. J Surg Res. 2000;94:167-171. [PubMed] |
| 11. | Naruse K, Makuuchi M. Development and perspectives of bioartificial liver support. Hepatogastroenterology. 2002;49:91-95. [PubMed] |
| 12. | Yamashita Y, Shimada M, Ijima H, Nakazawa K, Funatsu K, Sugimachi K. Hybrid-artificial liver support system. Surgery. 2002;131:S334-340. [PubMed] |
| 13. | Strain AJ, Neuberger JM. A bioartificial liver--state of the art. Science. 2002;295:1005-1009. [PubMed] |
| 14. | Weiss RA. The Leeuwenhoek Lecture 2001. Animal origins of human infectious disease. Philos Trans R Soc Lond B Biol Sci. 2001;356:957-977. [PubMed] |
| 15. | Sussman NL, Chong MG, Koussayer T, He DE, Shang TA, Whisennand HH, Kelly JH. Reversal of fulminant hepatic failure using an extracorporeal liver assist device. Hepatology. 1992;16:60-65. [PubMed] |
| 16. | Sussman NL, Gislason GT, Conlin CA, Kelly JH. The Hepatix extracorporeal liver assist device: initial clinical experience. Artif Organs. 1994;18:390-396. [PubMed] |
| 17. | Klotz U, Antonin KH, Bieck PR. Pharmacokinetics and plasma binding of diazepam in man, dog, rabbit, guinea pig and rat. J Pharmacol Exp Ther. 1976;199:67-73. [PubMed] |
| 18. | Enosawa S, Miyashita T, Suzuki S, Li XK, Tsunoda M, Amemiya H, Yamanaka M, Hiramatsu S, Tanimura N, Omasa T. Long-term culture of glutamine synthetase-transfected HepG2 cells in circulatory flow bioreactor for development of a bioartificial liver. Cell Transplant. 2000;9:711-715. [PubMed] |