修回日期: 2004-11-28
接受日期: 2004-12-08
在线出版日期: 2005-02-15
目的: 观察大鼠非酒精性脂肪肝模型肝组织纤维化形成过程中基质金属蛋白酶-13(MMP-13)和基质金属蛋白酶抑制物-1(TIMP-1)表达的变化, 探讨其在非酒精性脂肪肝纤维化发生发展机制中的意义.
方法: SD大鼠40只, 随机分为模型组和对照组, 模型组大鼠通过高脂饮食制备高脂血症性脂肪肝模型, 并在20 wk、22 wk分批处死, 采用半定量逆转录聚合酶链反应(RT-PCR)检测肝组织MMP-13mRNA和TIMP-1 mRNA的表达, 并与肝脏组织学改变进行对照研究.
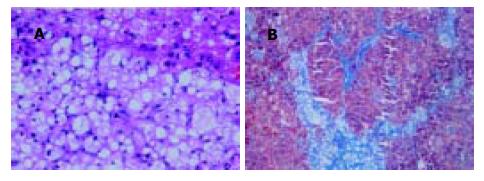
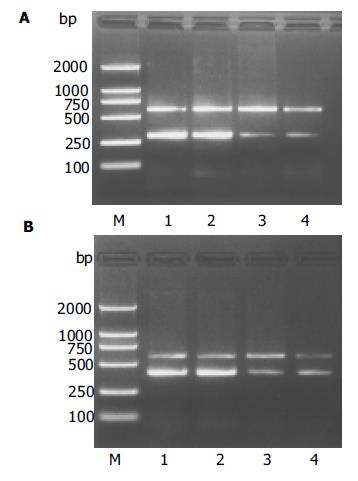
结果: 模型组肝组织出现明显的脂肪变性及炎症坏死并伴有程度不同的纤维化, 部分大鼠出现早期肝硬化. 在20 wk肝组织MMP-13mRNA表达, 模型组(1.14±0.29)明显高于正常对照组(0.71±0.08), 有显著性差异(t = 3.71, P<0.01)而TIMP-1mRNA 表达, 模型组(0.73±0.16)虽高于正常组(0.60±0.03), 但差异无显著性. 在22 wk MMP-13mRNA模型组(0.84±0.10)表达明显下降, 而TIMP-1mRNA 模型组(0.75±0.12)表达则显著高于正常对照组(0.60±0.10), (t = 3.13, P<0.01). 肝组织HE和Masson染色提示肝脂肪变性和纤维化改变.
结论: 非酒精性脂肪肝炎, 随着纤维化进程MMP-13mRNA表达由强到弱, TIMP-1mRNA表达逐渐增强, 提示其可能参与非酒精性脂肪肝炎纤维化的机制.
引文著录: 张洁, 陈晓宇, 彭延申, 李继强. 大鼠非酒精性脂肪性肝炎肝组织MMP-13及TIMP-1表达变化与肝纤维化的关系. 世界华人消化杂志 2005; 13(4): 512-515
Revised: November 28, 2004
Accepted: December 8, 2004
Published online: February 15, 2005
AIM: To investigate the implications of matrix metallopro-teinase-13 (MMP-13) and tissue inhibitors of metallopro-teinase1 (TIMP-1) in the development of liver fibrosis in experimental nonalcoholic steatohepatitis (NASH).
METHODS: Sprague-Dawley (S-D) rats were randomly allocated into the normal group and the model group. NASH model was established by feeding rats with fat-rich diet; other rats fed with normal diet were taken as controls. All the rats were sacrificed at the 20th and 22nd week. The expression levels of MMP-13 and TIMP-1 were assayed by semi-quantitative RT-PCR. Conventional histological examinations of all the rats were performed after HE and Masson staining.
RESULTS: At the 20th week, hepatic MMP-13 mRNA expression (1.14±0.29) was increased in the model group compared with the normal group (0.71±0.08, P<0.01). TIMP-1 mRNA level was also increased in the model rats, but the difference between the two groups (0.73±0.16 vs 0.60±0.03) was not statistically significant. At the 22nd week, MMP-13 mRNA expression was remarkably decreased (0.84±0.10), whereas TIMP-1 mRNA expression was significantly increased compared with the control group (0.75±0.12 vs 0.60±0.10, P<0.01). Remarkable steatosis and fribrosis were also revealed by HE and Masson staining.
CONCLUSION: Although MMP-13 expression is increased transiently in the early stage of NASH, TIMP-1 expression is enhanced continuously. The latter may inhibit MMP-13-induced collagen degradation, resulting in collagen accumulation in the liver. These data suggest that TIMP-1 plays an important role in the pathogenesis of NASH with liver fibrosis.
- Citation: Zhang J, Chen XY, Li YS, Li JQ. Expression of MMP-13 and TIMP-1 in rat liver with nonalcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 512-515
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/512.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.512
近年来由于饮食结构和生活方式的改变, 由肥胖, 高脂血症, 糖尿病等所致的非酒精性脂肪肝有不断上升趋势, 非酒精性脂肪肝炎(nonalcoholic steatoh-epatitis, NASH)是隐匿性肝硬化的一个重要原因[1-4]. 非酒精性脂肪肝纤维化是Ⅰ, Ⅲ型胶原为主的细胞外基质(extra cellular matrix, ECM)成分过度沉积导致的病理改变, 与胶原生成过多及降解受阻有关[5-8]. 基质金属蛋白酶(matrix metalloproteinases, MMPs)是一族依赖Zn离子降解ECM的水解酶, 基质金属蛋白酶抑制物(tissue inhibitor of metallopro-teinase, TIMP-1)是MMPs的抑制剂, MMPs与TIMP-1不平衡表达与肝纤维化密切相关[9-12]. 我们观察大鼠NASH模型, 运用半定量逆转录聚合酶链反应(reversal transcription-polymerase chain reaction, RT-PCR)检测MMP-13 mRNA和TIMP-1 mRNA在非酒精性脂肪肝炎肝组织的表达水平, 探讨他们在非酒精性脂肪肝纤维化发病机制中的作用.
SD大鼠40只, ♂,购自中科院实验动物中心, 质量140-160 g. Trizol(Invitrogen公司), M-MLV、RNasin、PCR Marker(Promega公司), 其他试剂均为国产分析纯. Hema-480DNA扩增仪(珠海黑马科技公司), 电泳仪、凝胶成像系统(上海天能科技公司), 紫外分光光度计UV1240(日本岛津公司), 贝克曼 LX20全自动生化分析仪.
动物[13]随机分为2组. 对照组15只以普通饲料喂养, 模型组25只以普通饲料+200 g/kg猪油+20 g/kg胆固醇+50 g/kg蛋黄粉+10 g/kg胆酸钠. 20 wk处死7只对照组大鼠和7只模型组大鼠, 22 wk处死所有剩余26只大鼠, 处死前隔夜禁食, 次日称质量后, 以2 g/L戊巴比妥钠麻醉, 腹主动脉采血处死, 取肝称肝湿重, 取0.5 g肝组织放入Eppendorf管中快速冷冻, 而后转入-70 ℃冰箱保存待测. 其余肝组织固定于40 g/L甲醛溶液中供病理检查. 每只大鼠各取块2 cm×1 cm大小的肝组织常规脱水、包埋和切片, 作HE和Masson三色2种染色, 参照Brunt的分级和分期标准[14], 判断大鼠肝脏炎症活动度和肝纤维化程度, 并仔细观察肝脏脂肪变性的程度. 谷丙转氨酶(ALT), 甘油三酯(TG), 总胆固醇(TCh)等生化指标在贝克曼LX20全自动生化分析仪上检测. 取100 mg左右肝组织按照Trizol reagent说明书提取总RNA, 紫外分光光度计定量. 逆转录cDNA的合成, 按照Promega公司说明书操作. 总RNA经RT反应后, 进行PCR扩增, 采用2对引物在同一体系中进行PCR, 其中β-actin作为内参(引物序列见表1).25 mL PCR体系包括: 1×PCR缓冲液(10 mmol/L Tris-HCL, PH 8.5, 50 mmol/L KCL), 1.5 mmol/L MgCl2, dNTP各为200 mmol/L, 目的基因正负链各10 pmol/L, β-actin 引物各2.5 pmol/L, RT产物3 mL, Taq酶1 U.MMP-13反应条件: 94 ℃预变性5 min, 94 ℃ 40 s, 55 ℃ 40 s, 72 ℃ 90 s, 30次循环, 72 ℃延伸3 min. TIMP-1反应条件: 94 ℃预变性5 min, 94 ℃ 40 s, 55 ℃ 30 s, 72 ℃ 60 s, 28次循环, 72 ℃延伸3 min. 扩增结束后20 g/L琼脂糖凝胶上进行电泳, 在紫外灯下观察结果并拍照保存. 利用密度扫描仪对特异性条带进行扫描, 测得其灰度值A, 与相应的β-actin灰度之比表示MMP-13mRNA和TIMP-1mRNA的相对水平.
| 名称 | 引物序列 | 扩增长度bp |
| MMP-13 | 5'-AGCTTGGCCACTCCCTCGGTCTG-3' | 364 |
| 5'-GTCTCGGGATGGATGCTCGTATG-3' | ||
| TIMP-1 | 5'-TTCGTGGGGACACCAGAAGTC-3' | 485 |
| 5'TATCTGGGACCGCAGGGACTG-3' | ||
| β-actin | 5'-CATTTGCGGTGCACGATGGAG-3' | 599 |
| 5'-GCCATCCTGCGTCTGGACCTG-3' |
统计学处理 采用SPSS 10.0软件进行统计分析, 计量资料用mean±SD表示, 组间比较采用t检验.
于造模的20 wk, 22 wk分别处死7, 18只模型组大鼠(其中1只因麻醉意外死亡). 随着时间的推移, 大鼠肝细胞脂肪变性加重, 脂肪空泡增大, 炎症程度亦随之加重, 并出现不同程度的肝纤维化, 部分大鼠可见早期肝硬化表现(表2, 图1A-B). 而对照组大鼠肝小叶结构正常, 未见上述变化.
| T/wk | 炎症活动度 | 纤维化程度 | 脂肪变性(%) |
| 20 | 0.86±0.38 | 1.00±0.58 | 30-50 |
| 22 | 2.71±1.49 | 2.47±1.00 | 30-60 |
20 wk和22 wk模型组大鼠肝指数都显著高于对照组, TG在20 wk模型组大鼠与对照组相比差异无显著性, 而在22 wk两组相比就有显著性差异, 20 wk和22 wk模型组大鼠血清TCH都显著高于对照组, 20 wk和22 wk模型组大鼠血清ALT显著高于对照组(表3).
在高脂饮食20 wk肝脏MMP-13mRNA表达显著高于对照组, TIMP-1 mRNA表达虽高于正常对照组, 但无显著性差异. 在22 wk肝脏MMP-13mRNA表达仍高于对照组, 但增高的趋势与20 wk相比明显下降, 而TIMP-1 mRNA表达在22 wk则显著升高, 与对照组有显著性差异. 高脂饮食组MMP-13/TIMP-1比例随着时间的推移22 wk与20 wk相比显著下降(P<0.05)(表4, 图2A-B).
非酒精性脂肪性肝炎(NASH)是目前已被公认为隐原性肝硬化或非活动性小结性肝硬化的前期病变, NASH的组织学改变与酒精性肝病相似, 肝脂肪变可能是肝纤维化、肝硬化的早期表现. 非酒精性脂肪性肝炎时过量的脂肪在肝实质细胞内积累, 导致体内游离脂肪酸(FFA)增多, FFA的细胞毒性可引起线粒体肿胀, 膜渗透性增加, 溶酶体易脆性增加, 也可损害胰岛素信号转导. 线粒体内b氧化增加, 不平衡的氧化磷酸化导致自由基形成[15], 引起肝细胞损害、肝星状细胞(HSC)激活[16], 胶原合成增加, 降解减少, 发展为纤维化[17-21]. 肝纤维化的发生不仅是由于肝内的细胞外基质(ECM)合成过多, 而且与ECM降解水平密切有关, 在肝内参与ECM降解的主要是一组名为基质金属蛋白酶(MMPs)的酶系, 其特异性抑制物-组织金属蛋白酶抑制因子(TIMPs)可对该酶系活性产生抑制作用. 二者与肝内ECM降解密切相关, 在肝纤维化进程中发挥重要作用[22-24]. 肝内MMPs来源主要是肝星状细胞(HSC)和Kupffer细胞, HSC在早期肝损伤等条件下被激活, 由静态转化为肌成纤维样细胞, 合成MMP-13等参与肝内ECM降解[25-26]. 而作为MMPS的特异性抑制因子TIMP-1, 当肝星状细胞被激活后, 其表达明显增强. 肝脏在急性损伤期已经有肝星状细胞激活, 并有细胞外基质合成增加, 在急性和亚急性肝细胞坏死病程中, 随着胶原大量沉积于纤维间隔内; 基质金属蛋白酶基因表达增强, 并且增加高峰于纤维化中期, 而在纤维化中、晚期基质金属蛋白酶活性逐渐降低. 基质金属蛋白酶抑制因子-1在纤维化初期转录增强, 表现出很强对抗基质金属蛋白酶的作用. 许多研究认为, 肝纤维化在一定程度上与基质金属蛋白酶抑制因子基因高水平表达有关[27-29]. 本研究通过高脂饮食建立S-D大鼠NASH模型, 第20 wk组织学检查显示大鼠肝脏有50%发生脂肪变性, 少数汇管区纤维组织轻度增生, 肝MMP-13mRNA表达显著高于正常对照组, 血清总胆固醇和ALT也显著升高, 说明了持续的高脂饮食造成体内脂质代谢紊乱, 脂质过氧化产物损伤肝细胞造成脂肪性肝炎, 就可激活肝星状细胞, 增加胶原生成, 此时处在肝纤维化早期, HSC和Kupffer细胞合成的MMP-13参与降解ECM, 以对抗纤维化. 当造模22 wk模型组大鼠肝脏组织炎症和纤维化明显加重, 肝实质内出现多处点状坏死灶伴中性粒细胞浸润此时肝细胞炎症加剧, 纤维组织明显增生, 部分有假小叶形成趋势. 此时肝组织MMP-13mRNA升高趋势与20 wk相比显著缓解, 而TIMP-1mRNA表达显著升高. MMP-13/TIMP-1的比率由20 wk的1.51下降到22 wk的1.17. 随着脂肪肝程度的加剧, 肝组织MMP-13 mRNA表达呈逐渐下降趋势, TIMP-1mRNA则相反表现出持续增高, MMP-13的活性被逐渐增多的TIMP-1所抑制, 造成肝损伤后增生的ECM成分尤其是Ⅰ、Ⅲ型胶原降解明显下降而沉积加速, 肝纤维化进程随之加速.
总之, 我们的研究结果表明, 尽管肝MMP-13mRNA的表达在NASH初期很高, 这可能是机体的一种保护机制. 但随着致病因素的持续存在, 肝脂肪变性程度的加剧, 由活化的HSC或肝细胞表达TIMP-1增高, MMP-13mRNA表达水平急剧下降, 其活性被抑制, 肝内ECM沉积大于降解, 最终导致肝纤维化, 甚至肝硬化.
编辑: 潘伯荣 审读:张海宁
| 3. | Brunt EM. Alcoholic and nonalcoholic steatohepatitis. Clin Liver Dis. 2002;6:399-420. [PubMed] [DOI] |
| 4. | Brunt EM. Nonalcoholic steatohepatitis. Semin Liver Dis. 2004;24:3-20. [PubMed] [DOI] |
| 5. | Alcolado R, Arthur MJ, Iredale JP. Pathogenesis of liver fibrosis. Clin Sci (Lond). 1997;92:103-112. [PubMed] [DOI] |
| 6. | 高 春芳, 陆 伦根. 纤维化疾病的基础和临床. 第1版, 上海: 上海科学技术出版社 2004; 265-311. |
| 7. | Benyon RC, Arthur MJ. Extracellular matrix degradation and the role of hepstellate cells. Semin Liver Dis. 2001;21:373-384. [PubMed] [DOI] |
| 8. | McCrudden R, Iredale JP. Liver fibrosis,the hepatic stellate cell and tissue inhibitors of metalloproteinases. Histol Histopathol. 2000;15:1159-1168. [PubMed] |
| 9. | Arthur MJ, Fibrogenesis II. Metalloproteinases and their inhibitors in liver fibrosis. Am J Physiol Gastrointest Liver Physiol. 2000;279:G245-G249. [PubMed] |
| 10. | Zhu YK, Wang BE, Shen FJ, Wang AM, Jia JD, Ma H. Dynamic evolution of MMP-13, TIMP-1, type I and III collagenand their interaction in experimental liver fibrosis. Zhonghua Ganzangbin Zazhi. 2004;12:612-615. [PubMed] |
| 11. | Knittel T, Mehde M, Grundmann A, Saile B, Scharf JG, Ramadori G. Expression of matrix Metalloproteinases andtheir inhibitors during hepatic tissue repair in the rat. Histochem Cell Biol. 2000;113:443-453. [PubMed] |
| 12. | Arthur MJ, Iredale JP, Mann DA. Tissue inhibitors of metalloproteinases: role in liver fibrosis and alcoholic liverdisease. Alcohol Clin Exp Res. 1999;23:940-943. [PubMed] [DOI] |
| 13. | Koteish A, Diehl AM. Animal models of steatosis. Semin Liver Dis. 2001;21:89-104. [PubMed] [DOI] |
| 14. | Brunt EM. Nonalcoholic steatohepatitis: definition and pathology. Semin Liver Dis. 2001;21:3-16. [PubMed] [DOI] |
| 15. | Chitturi S, Farrell GC. Etiopathogenesis of nonalcoholic steatohepatitis. Semin Liver Dis. 2001;21:27-41. [PubMed] [DOI] |
| 16. | Reeves HL, Friedman SL. Activation of hepatic stellate cells-a key issue in liver fibrosis. Front Biosci. 2002;7:d808-826. [PubMed] [DOI] |
| 20. | Falck-Ytter Y, Younossi ZM, Marchesini G, McCullough AJ. Clinical features and natural history of nonalcoholicsteatosis syndromes. Semin Liver Dis. 2001;21:17-26. [PubMed] [DOI] |
| 24. | Watanabe T, Niioka M, Hozawa S, Kameyama K, Hayashi T, Arai M, Ishikawa A, Maruyama K, Okazaki I. Geneexpression of interstitial collagenase in both progressive and recovery phase of rat liver fibrosis induced by carbontetrachloride. J Hepatol. 2000;33:224-235. [PubMed] [DOI] |
| 25. | Zhu GF, Yu CH, Zhang Y, Li YM. Gene expression of interstital collagenase MMP-13 progressive phase of rat liverfibrosis induced by ethanol. Zhonghua Ganzangbing Zazhi. 2003;11:660-662. [PubMed] |
| 27. | Vaillant B, Chiaramonte MG, Cheever AW, Soloway PD, Wynn TA. Regulation of hepatic fibrosis and extracellularmatrix genes by the th response: new insight into the role of tissue inhibitors of matrix metalloproteinases. J Immunol. 2001;167:7017-7026. [PubMed] [DOI] |
| 28. | Lee HS, Huang GT, Miau LH, Chiou LL, Chen CH, Sheu JC. Expression of matrix metalloproteinases in spontaneousregression of liver fibrosis. Hepatogastroenterology. 2001;48:1114-1117. [PubMed] |
| 29. | Yoshiji H, Kuriyama S, Yoshii J, Ikenaka Y, Noguchi R, Nakatani T, Tsujinoue H, Yanase K, Namisaki T, Imazu H. Tissue inhibitor of metalloproteinases-1 attenuates spontaneous liver fibrosis resolution in the transgenicmouse. Hepatology. 2002;36:850-860. [PubMed] [DOI] |