修回日期: 2004-11-21
接受日期: 2004-11-29
在线出版日期: 2005-02-15
目的: 探讨EGFR信号通路对人结肠癌Caco-2细胞增生、黏附和侵袭的影响及其分子机制.
方法: 应用细胞培养技术培养Caco-2细胞; 以MTT法检测EGF, AG1478和PD98059对Caco-2细胞增生和生长的影响; Matrigel黏附实验、侵袭实验和RT-PCR技术检测EGF, AG1478和PD98059对Caco-2细胞黏附力、侵袭力和MMP-2, MMP-9, TIMP-1和TIMP-2基因转录的影响; Western blot蛋白免疫印迹法检测EGF和AG1478对Caco-2细胞P-EGFR蛋白表达的影响.
结果: 外源性EGF(10 mg/L)可明显地促进Caco-2细胞的增生和生长, 24 h细胞生长率提高了23.4%(P<0.01); 而AG1478(20mmol/L)和PD98059(40 mmol/L)则明显地抑制细胞的增生和生长, 其抑制作用没有时间效应关系, AG1478最强抑制时间为第48 h, 细胞生长率下降了45.7%(P<0.01), PD98059最强抑制时间为第72 h, 细胞生长率下降了54.6%(P<0.01). Matrigel黏附实验、侵袭实验揭示了, EGF(10 mg/L)提高EGFR活性后能明显地增加Caco-2细胞的体外黏附力(P<0.05)和侵袭力(P = 0.001); 而且AG1478和PD98059分别阻断EGFR和ERK1/2后能使EGF的促细胞黏附力和侵袭力的作用消失(P<0.01). RT-PCR测定显示, EGF能增加Caco-2细胞MMP-2, MMP-9 mRNA的表达, 同时也能减少TIMP-1和TIMP-2 mRNA的表达; 而AG1478和PD98059均能逆转EGF对Caco-2细胞基因的影响, 使MMP-2和MMP-9 mRNA的表达下降, TIMP-1和TIMP-2 mRNA的表达上升, 结果MMP-2/TIMP-2比值和MMP-9/TIMP-1比值均下降(P<0.001).
结论: EGFR信号可能通过下游MAPK通路传递信息, 改变MMP-2, MMP-9, TIMP-1和TIMP-2基因功能, 从而有助于结肠癌Caco-2细胞的侵袭与转移.
引文著录: 张晓晶, 张亮, 刘云鹏, 候科佐, 王舒宝. EGFR信号通路影响Caco-2细胞黏附和侵袭的分子机制. 世界华人消化杂志 2005; 13(4): 483-488
Revised: November 21, 2004
Accepted: November 29, 2004
Published online: February 15, 2005
AIM: To investigate the effect of epidermal growth factor receptor (EGFR) pathway on proliferation, adhesion and invasion of Caco-2 cell line and its molecular mechanism.
METHODS: Tetrazolium-based colorimetric assay was used to evaluate the effect of EGF, AG1478 or PD98059 on proliferation and growth of cultured human colon carcinoma Caco-2 cells. Matrigel experiment and cell adhesion assay were used to examine the invasiveness of Caco-2 cells. The transcription of MMP-2, MMP-9, TIMP-1 and TIMP-2 of Caco-2 cells was detected by reverse transcription polymerase chain reaction (RT-PCR). The expression of P-EGFR protein in Caco-2 cells was determined by Western-blot.
RESULTS: Exogenous EGF significantly enhanced the growth and proliferation of Caco-2 cells. The growth ratio was increased by 23.4% at 24 h (P<0.01). AG1478 (20 mmol/L, 48 h) and PD98059 (40 mmol/L, 72 h) inhibited the growth and proliferation of Caco-2 cells in a time-independent manner, and the growth rates were decreased by 45.7% and 54.6%, respectively (P<0.01). Matrigel experiment showed that EGF increased the adhesion (P<0.05) and invasion (P = 0.001) ability of Caco-2 cells in vitro at the concentration of 10 mg/L. AG1478 or PD98059 inhibited EGF-induced adhesion and invasion of Caco-2 cells (P<0.01) by blocking the activity of EGFR and ERK1/2. After treatment with EGF the protein of P-EGFR was increased, which was abolished by AG1478. RT-PCR assays revealed that exogenous EGF up-regulated mRNA levels of MMP-2 and MMP-9 and down-regulated mRNA levels of TIMP-1 and TIMP-2. Meanwhile AG1478 and PD98059 reversed the effect of EGF by decreasing the levels of MMP-2, MMP-9 mRNA and increasing the levels of TIMP-1 and TIMP-2 mRNA. The MMP-2 to TIMP-2 ratio and the MMP-9 to TIMP-1 ratio were decreased significantly by AG1478 or PD98059(P <0.001).
CONCLUSION: In human colon carcinoma, EGFR changes MMP-2, MMP-9, TIMP-1 and TIMP-2 transcription via MAPK signal pathway, which may contribute to the invasiveness and metastasis of Caco-2 cells.
- Citation: Zhang XJ, Zhang L, Liu YP, Hou KZ, Wang SB. Molecular mechanism of epidermal growth factor receptor pathway mediated adhesion and invasion of Caco-2 cell line. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 483-488
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/483.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.483
表皮生长因子受体(epidermal growth factor receptor, EGFR)是Mr170 000具有酪氨酸蛋白激酶(TK)活性的膜受体, 与生长因子(配体)结合后可使其磷酸化激活并将信号传入细胞内, 再经胞内多条信号传导通路传至核内调节靶基因的功能. EGFR信号传导通路参与调节绝大多数肿瘤的发生、发展过程[1]. 结肠癌预后因素复杂, 已证实EGFR表达水平与结肠癌转移潜能相关[2], 但EGFR信号如何影响结肠癌生物学行为仍不确切, 弄清结肠癌转移机制是改善治疗和提高生存率的关键. 我们探讨EGFR信号传导通路影响结肠癌Caco-2细胞增生、黏附和侵袭转移的分子机制如下.
Caco-2细胞株来源于人结肠黏液腺癌, 购于中国科学院上海细胞库; EGF购于北京科宇联合干细胞库; EGFR阻断剂AG1478由美国BIOMOL研究实验室提供; p42/p44MAPK阻断剂PD98059购于Promega公司; Matrigel基质胶和8 mm聚碳酸酯膜分别购于BD和Milipore公司; Boyden Chamber由北大医学部病理系提供; McCoy's 5A无血清培养基和逆转录试剂均为GIBCO公司产品; 胰岛素购于上海第一生化制药有限公司; 转铁蛋白为Sigma公司产品; P-EGFR小鼠mAb购于Santa Cruz公司; RT-PCR试剂盒Ver1.1购于Takara公司; 引物由大连博瑞得生物技术有限公司合成.
Caco-2细胞生长在含100 mL/L FBS, 100 ku/L青霉素和100 mg/L链霉素的高糖DMEM培养液中, 37 ℃, 50 mL/L CO2培养箱中培养, 隔日换液, 长满瓶时用含0.2 g/L EDTA+2.5g/L胰酶消化细胞, 按1:2或1:4传代; 取对数生长期细胞进行实验.
1.2.1 MTT法检测细胞增生: 将生长活力良好的细胞以4103/孔接种于96孔板, 待细胞在37 ℃, 50 mL/L CO2 培养24 h贴壁后换成含4 mg/L转铁蛋白和20 mg/L胰岛素的McCoy's5A无血清培养基; 无血清培养24 h后实验组(1), (2), (3)分别加入EGF 10mg/L, AG1478 20 mmol/L和PD98059 40 mmol/L; (2), (3)组作用1 h后各加EGF 10 mg/L, 对照组加等体积的PBS液, 另有培养基无细胞组, 每组设9复孔. 继续培养24-96 h, 检测前4 h加MTT(5 g/L)20 mL, 4 h后弃上清, 加DMSO 100 mL, 避光振荡15 min, 用全自动酶标仪测570 nm处的吸光度(A570)值, 细胞生长率(%) = (A实验-A空白)/(A对照-A空白)×100%.
1.2.2 Caco-2细胞黏附实验: 将Caco-2细胞悬液调整为1×108/L, 每孔3 mL分别接种于无菌6孔板中; 培养24 h细胞均贴壁, 培养液改为含4 mg/L转铁蛋白和20 mg/L胰岛素的McCoy's5A无血清培养基; 饥饿48 h后更换McCoy's5A培养基并加药. 实验组(1)EGF 10 mg/L, 实验组(2)EGF10 mg/L+AG1478 20 mmol/L, 实验组(3)EGF10 mg/L+PD98059 40 mmol/L, 其中AG1478与PD98059均在EGF用药前1 h加药, 对照组加等体积PBS, 在37 ℃, 50 mL/L CO2 培养24 h后分别收集各孔细胞, 离心去上清, 每组均用无血清培养液调成6×108/L细胞悬液. 取96孔培养板覆以Matrigel胶26 mg/孔, 4 ℃过夜, 实验前于37 ℃烤箱中孵育1 h, PBS洗后加入100 mL预处理癌细胞悬液(6×104个/孔), 37 ℃作用90 min; 弃上清, PBS及无血清DMEM培养液冲洗, 然后按MTT法检测490 nm单波长下各组吸光度(A490)值, 计算细胞相对黏附率, 相对黏附率(%) = (A实验/A对照)×100%[4].
1.2.3 Matrigel体外细胞侵袭实验: 取对数生长期Caco-2细胞用0.2 g/L EDTA+2.5 g/L胰酶消化、培养液洗涤终止消化, 再用含100 mL/L FBS培养液配成3×108/L的细胞悬液待用; 取Boyden小室, 上下室间用8 mm微孔滤膜隔开, 下室加200 mL McCoy's 5A无血清培养液, 实验组(1), (2), (3)下室分别加EGF10 mg/L, EGF10 mg/L+AG1478 20 mmol/L和EGF10 mg/L+PD98059 40mmol/L, 对照组为加入等体积PBS, 上室各加200 mL细胞悬液, 37 ℃, 50 mL/L CO2孵育箱内作用24 h后取膜, 甲醇固定并行HE染色, 400倍镜下记数9个视野细胞数, 取均值.
1.2.4 Westerin blot检测P-EGFR蛋白表达: 将经EGF10 mg/L和EGF10 mg/L+AG1478 20 mmol/L处理和未处理的细胞(2×1010/L)加细胞裂解液, 冰浴下超声粉碎后裂解40 min, 离心去除细胞碎片, 测细胞裂解产物的蛋白含量, 取等量蛋白在120 g/L的SDS-聚丙烯凝胶中电泳, 将蛋白转印至硝酸纤维素膜上, 经封闭阻断后, 加小鼠抗人P-EGFR(1:200)mAb, 4 ℃过夜, 碱性磷酸酶标记的马抗小鼠IgG抗体(1:500)室温孵育2 h, NBT/ BCIP显色, GDS8000成象分析仪分析图像.
1.2.5 RT-PCR方法检测MMP-2, MMP-9, TIMP-1和TIMP-2 mRNA表达: 收集经EGF10 mg/L, EGF10 mg/L+AG1478 20mmol/L和EGF10 mg/L+PD98059 40 mmol/L处理及未处理的细胞, 采用异硫氰酸胍一步法提取总RNA, RNA引物序列(表1). 逆转录(RT)反应体系20 mL, 含2椿撼逡10 mL, dNTP(10 mmol/L)1 mL, RNAsin(40MU/L)0.5 mL, Oligo(dT)15引物(1 g/L)1 mL, AMV逆转录酶(22 MU/L)1 mL, RNA样品2 mg. 反应条件: 65 ℃ 1 min, 30 ℃ 5 min, 迅速升温至65 ℃再作用30 min后, 98 ℃预变性5 min灭活AMV Rtase, 5 ℃ 5 min. PCR反应: 在20 mL RT反应产物中, 加入15 mmol/L MgCl2 8 mL, 4磀NTP 2 mL, 上游引物1mL, 95 ℃ 5 min, 加入2 mL Taq DNA聚合酶(1MU/L). 循环条件: 94 ℃ 1 min, 58 ℃ 1 min, 72 ℃ 1 min, 共30个循环, 最后72 ℃延长7 min. 取PCR产物10 mL, 经12 g/L琼脂糖凝胶电泳鉴定, 紫外灯下观察结果. 以各指标和b-action扩增条带的吸光面积积分值的比值来评定各指标mRNA的表达水平, 进行半定量分析.
| 名称 | 引物序列 | 扩增片段长度(bp) | 循环次数 |
| β-actin | 5′-GATTGCCTCAGGACATTTCTG-3′ | 690 | 30 |
| 5′-GATTGCTCAGGACATTTCTG-3′ | |||
| MMP-2 | 5′-TCAACGGTCGGGAATACA-3′ | 307 | 35 |
| 5′-CCCACAGTGGACATAGCG-3′ | |||
| MMP-9 | 5′-TCGAACTTTGACAGCGACAAGAA-3′ | 215 | 35 |
| 5′-TCAGGGCGAGGACCATAGAGG-3′ | |||
| TIMP-1 | 5′-CTTCCACAGGTCCCACAACC-3′ | 285 | 30 |
| 5′-CAGCCCTGGCTCCCGAGGC-3′ | |||
| TIMP-2 | 5′-AAACGACATTTATGGCAACCCTATC-3′ | 265 | 35 |
| 5′-ACAGGAGCCGTCACTTCTCTTGATG-3′ |
统计学处理 全部数据用SPSS10.0软件包进行统计学处理. 计量资料用mean±SD表示; 各组组间比较采用t检验. P<0.05差异有统计学意义.
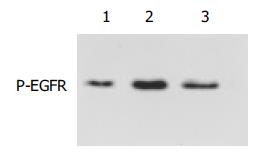
Caco-2细胞为P-EGFR蛋白表达细胞, 经外源性EGF(10 mg/L)作用24 h后P-EGFR蛋白表达明显增加, 而AG1478(20 mmol/L)能完全阻断外源性EGF对Caco-2细胞EGFR的激活作用, 使P-EGFR蛋白表达明显下降(图1).
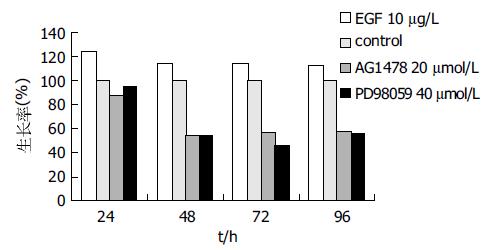
外源性EGF 10 mg/L促进Caco-2细胞生长作用在24 h时最强, 细胞生长率提高了23.4%(P<0.01), 随着作用时间延长至48 h时其促进作用略有下降, 但与对照组相比仍维持在一个相对高的生长状态(P<0.01). AG1478(20 mmol/L)和PD98059(40 mmol/L)分别作用Caco-2细胞1 h后均能阻断EGF的促细胞生长作用, 24 h时细胞生长受到抑制, 48 h时AG1478的抑制作用达到最强, 细胞生长率下降了45.7%(P<0.01), 72 h时PD98059的抑制作用达到最强, 细胞生长率下降了54.6%(P<0.01), 但AG1478和PD98059的抑制作用不随作用时间的延长而增强(图2).
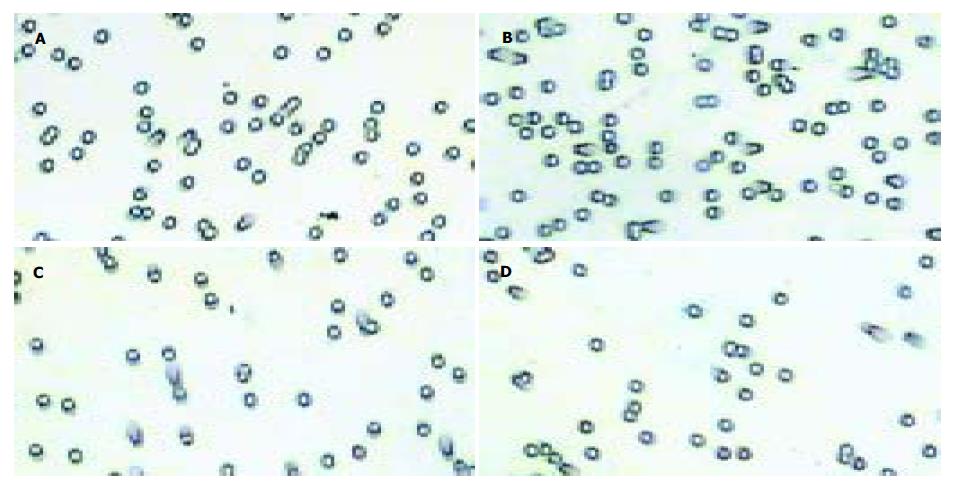
EGF10 mg/L作用Caco-2细胞24 h后可明显地增强Caco-2细胞对ECM的黏附性, 相对黏附性是对照组细胞的1.49±0.13倍(P<0.05); 而AG1478 20 mmol/L和PD98059 20 mmol/L分别作用Caco-2细胞1 h封闭EGFR和MAPK信号传导通路后, EGF则不能行使促Caco-2细胞黏附于ECM的作用, 相对黏附性分别由1.49±0.13降为0.98±0.03和0.51±0.01, 二组比较差异均有统计学意义(P<0.01). EGF处理组的黏附细胞数明显多于未处理组; EGF+AG1478和EGF+PD98059处理组的黏附细胞数均显著低于EGF处理组的细胞数(图3).
EGF10 mg/L, AG1478 20 mmol/L和PD98059 40 mmol/L分别作用Caco-2细胞24 h 后, 检测细胞对Matrigel体外侵袭力发现, EGF明显增加Caco-2细胞的过膜细胞数(过膜细胞数由正常的208±3个增至241±5个)(P = 0.001); 而AG1478不仅能减少Caco-2细胞本身的过膜能力(过膜细胞数由正常的208±3个减为170±4个)(P<0.01), 而且也能阻止EGF对Caco-2细胞侵袭力的调节(过膜细胞数由EGF作用的241±5个减为171±2个)(P = 0.001); 同样PD98059也能阻止EGF对Caco-2细胞侵袭力的调节(过膜细胞数由EGF作用的241±5个减为164±6个)(P = 0.001). EGF处理组Caco-2细胞侵袭人工基底膜后, 不仅数目多, 而且表现出形态各异的伪足; 而AG1478和PD98059处理组的细胞形态较圆, 伪足数目相对较少(图4). 结果表明, EGFR信号通过MAPK通路调节Caco-2细胞的侵袭力.
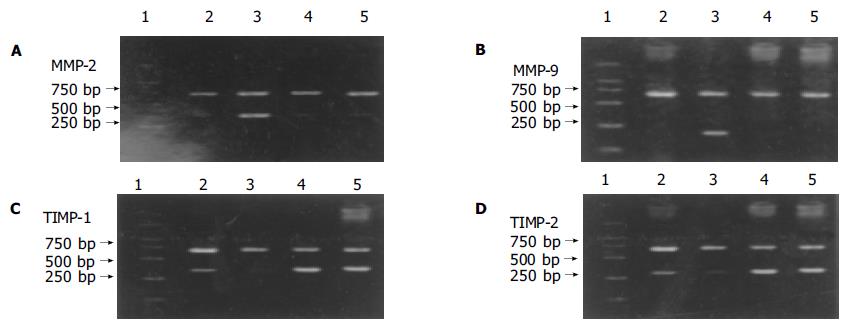
EGF10 mg/L, EGF10 mg/L+ AG1478 20mmol/L和EGF10 mg/L+PD98059 40 mmol/L分别作用Caco-2细胞24 h 后检测MMP-2, MMP-9, TIMP-1和TIMP-2 mRNA表达发现, EGF使MMP-2 307 bp和MMP-9 215 bp分别与b-action 690 bp扩增带的吸光面积积分比值均高于对照组, 灰度值分别是对照组的2.2倍和3.3倍(P<0.01), 使TIMP-1 285 bp和TIMP-2 265 bp分别与b-action 690bp扩增带的吸光面积积分比值均低于对照组, 灰度值分别减少了36.7%和25.4%且差异有统计学意义(P<0.01); 而AG1478和PD98059均可抑制EGF对Caco-2细胞的影响, 使MMP-2 mRNA表达分别减少了63.9%和61.5%(P<0.001), MMP-9 mRNA表达分别减少了63.5%和70.8%(P<0.001), 使TIMP-1 mRNA表达灰度值分别是EGF组的2.3倍和2.7倍(P<0.001), TIMP-2 mRNA表达灰度值分别是EGF组的1.9倍和2.4倍(P<0.001), 结果MMP-2/TIMP-2和MMP-9/TIMP-1的比值明显下降, 差异均有统计学意义(P<0.001)(图5).
肿瘤的侵袭、转移是一个多步骤、多基因参与的极其复杂的过程. EGFR在正常组织中几乎不表达, 呈关闭状态; 而在肿瘤组织中呈活跃的开放状态, 而且其表达程度与肿瘤病情进展呈正相关, 说明EGFR信号通路参与调节肿瘤的病理发展. 表皮样生长因子(如EGF, TGF-a等)能与胞膜上EGFR结合, 使其磷酸化激活, 再经PI3K/AKT或MAPK信号通路将信号传递至核内, 促进或抑制特定靶基因的表达, 调节细胞的增生、黏附、运动、蛋白水解酶的分泌等[1]. EGF和EGFR信号通路对肿瘤细胞生物学行为的影响是目前的研究热点, 而且对不同来源肿瘤的作用机制并不相同. Pouliot et al[3]报道EGF和TGF-a通过EGFR信号通路能改变结肠癌细胞的增生和生存能力, 而且EGFR促细胞增生作用的发挥与细胞外基质层蛋白作用的发挥具有协同性; 同时EGF作用EGFR后能诱导整合素的表达, 从而提高结肠癌细胞的黏附、扩散和转移能力. 但EGF对不同结肠癌细胞株的作用结果有所不同. Sawhney et al[4]研究证实EGF并不影响结肠癌HCT116细胞DNA的合成, 但能通过上调细胞表面整合素的表达而影响细胞的黏附和运动能力. 由于结肠癌肿瘤组织中EGFR的表达量与结肠癌病情进展和肝转移事件的发生相一致, 所以EGFR可作为结肠癌治疗新的靶点. 尽管结肠癌对常规化疗并不敏感, 但通过EGFR阻断治疗具有抑制EGF和TGF-对结肠癌进展的影响, 同时具有诱导细胞凋亡和化疗增敏作用[1,5]. 我们发现EGFR信号通路的激活与失活能改变结肠癌细胞的生长, 当EGF激活EGFR使P-EGFR蛋白表达增加时Caco-2细胞的增生能力和生存能力均提高; 当AG1478阻断EGFR和PD98059阻断MAPK通路后, Caco-2细胞的生长受到抑制, 从而推测EGF对高分化结肠癌细胞具有促进生长和提高增生能力的作用, 可能是EGFR信号通过MAPK通路传递作用靶基因的结果.
一般认为细胞增生活性是肿瘤侵袭、转移的基础和前提, 但侵袭与转移的实现还取决于肿瘤细胞对正常组织的破坏能力. 细胞外基质(ECM)是肿瘤侵袭和转移的天然屏障, 主要成分是胶原、糖蛋白、蛋白多糖和氨基葡聚糖, 以基底膜(BM)和细胞间结缔组织形式存在. ECM的降解和BM的破坏是一个关键步骤, 而基质金属蛋白酶(MMPs)及其组织抑制因子(TIMPs)家族是其中关键因素之一. MMPs与ECM, BM成分的破坏、降解相关, TIMPs是MMPs的特异性抑制因子, 二者的动态平衡维持了ECM, BM的完整[6]. MMP-2和MMP-9主要降解Ⅳ型胶原及明胶[7]. EGF具有使乳腺癌和皮肤鳞状细胞癌MMP-2和MMP-9基因活性增高, 提高肿瘤细胞侵袭和转移能力的作用[8-9]. O-charoenrat et al[10]发现EGFR信号通过MAPK和PI3K/AKT二条通路增加MMP-9蛋白表达, 进而提高头颈鳞癌细胞对Matrigel的侵袭力, 但不改变MMP-2的基因活性. 我们对低浸润Caco-2细胞的Matrigel黏附、侵袭、Western blot和RT-PCR测定表明, EGF10 mg/L作用24 h激活EGFR信号通路后能明显提高Caco-2细胞对Matrigel的黏附力和穿透基底膜胶原纤维移向下室的体外侵袭力, 使Caco-2细胞P-EGFR蛋白表达和MMP-2和MMP-9的mRNA表达均升高, 使TIMP-1和TIMP-2的mRNA表达均下降, 说明基质金属蛋白酶具有增加结肠癌细胞异质黏附性和促进转移的作用; 而EGFR抑制剂AG1478和MAPK抑制剂PD98059则能阻断EGF对细胞黏附力和侵袭力的影响. AG1478使Caco-2细胞P-EGFR蛋白表达和MMP-2和MMP-9的mRNA表达均明显下降, 使TIMP-1和TIMP-2的mRNA表达升高, 进而MMP-2/TIMP-2和MMP-9/TIMP-1的比值均明显下降(P<0.001). 结果表明EGFR被EGF激活后通过MAPK信号通路将信号传递至核内, 改变Caco-2细胞的基质溶解相关基因MMP-2, MMP-9, TIMP-1和TIMP-2的转录水平, 进而提高大肠癌细胞的转移能力. 可见EGFR信号通路的激活是结肠癌病情进展的关键机制, 可作为理想的治疗靶点.
编辑: 潘伯荣 审读:张海宁
| 1. | Ciardiello F, Tortora G. A novel approach in the treatment of cancer: targeting the epidermal growth factor receptor. Clin Cancer Res. 2001;7:2958-2970. [PubMed] |
| 2. | Shen Y, Vogel I, Kalthoff H. Comparative study of metastasis-associated characteristics of tumor cells with differentmetastatic capacities. Zhonghua Zhongliu Zazhi. 2000;22:201-204. [PubMed] |
| 3. | Pouliot N, Connolly LM, Moritz RL, Simpson RJ, Burgess AW. Colon cancer cells adhesion and spreading on autocrinelaminin-10 is mediated by multiple integrin receptors and modulated by EGF receptor stimulation. Exp Cell Res. 2000;261:360-371. [PubMed] [DOI] |
| 4. | Sawhney RS, Zhou GH, Humphrey LE, Ghosh P, Kreisberg JI, Brattain MG. Differences in sensitivity of biologicalfunctions mediated by epidermal growth factor receptor activation with respect to endogenous and exogenous ligands. J Biol Chem. 2002;277:75-86. [PubMed] [DOI] |
| 5. | Liu B, Fang M, Schmidt M, Lu Y, Mendelsohn J, Fan Z. Induction of apoptosis and activation of the caspase cascadeby anti-EGF receptor monoclonal antibodies in DiFi human colon cancer cells do not involve the c-jun N-terminalkinase activity. Br J Cancer. 2000;82:1991-1999. [PubMed] |
| 8. | Menashi S, Serova M, Ma L, Vignot S, Mourah S, Calro F. Regulation of extracellular matrix metalloproteinase inducerand matrix metalloproteinase expression by amphiregulin in transformed human breast epithelial cells. Cancer Res. 2003;63:7575-7580. [PubMed] |
| 9. | Huang YT, Hwang JJ, Lee LT, Liebow C, Lee PP, Ke FC, Lo TB, Schally AV, Lee MT. Inhibitory effects of a luteinizinghormone-releasing hormone agonist on basal and epidermal growth factor-induced cell proliferation andmetastasis-associated properties in human epidermoid carcinoma A431 cells. Int J Cancer. 2002;99:505-513. [PubMed] [DOI] |
| 10. | Ocharoenrat P, Wongkajornsilp A, Rhys-Evans PH, Eccles SA. Signaling pathways required for matrixmetalloproteinase-9 induction by betacellulin in head-and-neck squamous carcinoma cells. Int J Cancer. 2004;111:174-183. [PubMed] [DOI] |