修回日期: 2004-12-11
接受日期: 2004-12-28
在线出版日期: 2005-02-15
目的: 探讨加味左金丸三种组成中药的主要单体成分小檗碱、吴茱萸碱和靛玉红对人胃癌细胞生长抑制、诱导凋亡和细胞
周期的影响.
方法: 人胃癌细胞株为低分化黏液腺癌MGC803细胞; 小檗碱、吴茱萸碱和靛玉红购自中国药品与生物制品检定所. 苔盼蓝染色细胞计数法测定细胞存活率和凋亡率, 流式细胞技术进行细胞周期、凋亡百分比分析, 甲基绿-派诺宁联合染色法观测凋亡形态, 琼脂糖凝胶电泳分析DNA损伤情况.
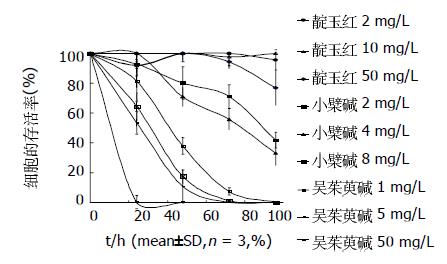
结果: 96 h内小檗碱、吴茱萸碱各组细胞存活率不断下降, 其中48 h存活率对照组为100.0±7.9%, 小檗碱4 mg/L和8 mg/L组分别为72.9±6.2%(t = 4.67, P<0.01)和17.4±4.8%(t = 15.48, P<0.001), 吴茱萸碱1 mg/L和5 mg/L组分别为37.8±5.7%(t = 11.06, P<0.001)和10.7±11.1%(t = 11.35, P<0.001); 各组均与对照组比较(n = 3); 对生长的抑制作用呈时间、药物浓度依赖性. 甲基绿-派诺宁原位染色, 细胞表现出凋亡特征. 小檗碱与吴茱萸碱组脱落的悬浮死细胞中有较高比例胞膜完整、抗拒苔盼蓝和酚红染色的凋亡细胞, 其中48 h凋亡率对照组为0.3±0.0%, 小檗碱8 mg/L组为65.2±9.5%(t = 11.83, P<0.001); 吴茱萸碱1 mg/L组为58.9±11.4%(t = 8.90, P<0.001), 而阿霉素组脱落死细胞不能抗拒苔盼蓝和酚红染色. 流式细胞仪检测表明小檗碱与吴茱萸碱组均出现亚二倍体凋亡峰; 细胞周期分别阻滞于G0-G1、G2期; 凋亡百分比与对照组11.8±2.5比较, 小檗碱4 mg/L组48 h为18.9±2.7(t = 3.34, P<0.05), 72 h为23.9±3.3(t = 5.06, P<0.01), 吴茱萸碱1 mg/L组72 h为16.6±1.6(t = 2.80, P<0.05). 琼脂糖凝胶电泳表明, 小檗碱组DNA裂成大片段, 吴茱萸碱组和阿霉素组DNA断裂呈涂抹状. 靛玉红各组对细胞生长、凋亡无影响, DNA无损伤.
结论: 小檗碱与吴茱萸碱均能诱导人胃癌细胞凋亡, 且作用较阿霉素温和; 靛玉红对胃癌细胞的体外作用不明显.
引文著录: 谭宇蕙, 陈蔚文, 吴映雅, 陈冠林, 李茹柳. 小檗碱、吴茱萸碱和靛玉红对人胃癌细胞的作用比较. 世界华人消化杂志 2005; 13(4): 472-476
Revised: December 11, 2004
Accepted: December 28, 2004
Published online: February 15, 2005
AIM: To explore the effects of berberine, evodiamine and indirubin, the major constituents of Chinese medicinal herbs Coptis, evodia fruit and natural indigo, respectively, on the proliferation and apoptosis of human gastric cancer cells.
METHODS: Human gastric cancer cell line MGC803 was derived from low differentiatedmucous adenocarcinoma. Berberine, evodiamine and indirubin were purchased from National Institute for the Control of Pharmaceutical and Biological Products. Cell viability and apoptosis were determined by trypan blue exclusion assay. Cell cycle distribution and the percentage of apoptosis were determined by flow cytometry. The apoptosis morphology was observed through methyl green and pyronin staining. Nucleosomal DNA fragmentation was assayed by agarose gel electrophoresis.
RESULTS: The cell viability was decreasing continuously during 96 h treatment with berberine and evodiamine. At 48 h, the viability was 100% in control group, while the viability in 4 mg/L and 8 mg/L berberine groups were 72.9±6.2% (t = 4.67,P<0.01) and 17.4±4.8% (t = 15.48,P<0.001), respectively. The viability in 1 mg/L and 5 mg/L groups evodiamine were 37.8±5.7% (t = 11.06, P<0.001) and 10.7±11.1% (t = 11.35, P<0.001). The inhibition effects were dose- and time-dependent. MGC-803 cells showed typical apoptosis morphology when stained by methyl green and pyronin. High proportion of trypan blue and phenol red excluding apoptotic cells with integrate membrane were observed in the suspending dead cells in berberine and evodimine groups. At 48 h, the apoptosis cell ratios were 0.30.0% in the control group, 65.2±9.5% (t = 11.83, P<0.001) in 8 mg/L berberine group, and 58.9±11.4% (t = 8.90, P<0.001) in 1 mg/L evodiamine group. No such cells were observed in adriamycin group. Flow cytometry analysis indicated that the apoptotic cell death induced by berberine or evodiamine was accompanied with cell cycle arrest in the G0/G1 or G2 phase, respectively. Both exhibited a sub-diploid apoptotic peak. The percentages of apoptosis were 11.8±1.5 % in control group, 18.9±2.7% (t = 3.34, P<0.05) at 48 h, 23.93.3 % (t = 5.06,P<0.01) at 72 h in 4 mg/L berberine group, and 16.6±1.6 % (t = 2.80, P<0.05) at 72 h in 1 mg/L evodiamine group. Agarose gel electrophoresis assay showed that the MGC-803 cell DNA was degraded into large fragments when treated with berberine, and smear fragments when treated with evodiamine and adriamycin. At the given concentration, indirubin had no effect on MGC-803.
CONCLUSION: Berberine and evodiamine induce apoptotic cell death of MGC-803 gastric cancer cells. The effects are milder than adriamycin. Indirubin has insignificant effect on MGC-803 in vitro.
- Citation: Tan YH, Chen WW, Wu YY, Chen GL, Li RL. Effects of berberine, evodiamine and indirubin on gastric cancer cell. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 472-476
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/472.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.472
加味左金丸(连黛片)由黄连、吴茱萸和青黛组成, 临床用于治疗肝胃不和、心下痞痛等. 本方有减少MNNG诱发的大鼠胃癌以及大鼠溃疡胃癌发生率的作用[1-2], 可抑制胃癌模型动物的癌基因ras, c-erbB2过表达[2], 减少MNNG引起的ras基因甲基化点突变[3], 黄连的主要药效成分小檗碱有诱导人胃癌细胞凋亡的作用[4]. 我们用加味左金丸的三种主要药效单体成分小檗碱、吴茱萸碱以及靛玉红(青黛的主要药效成分), 分别在体外作用于人胃癌细胞株MGC803, 并观察药物对细胞的影响. 比较、探讨他们在诱导癌细胞凋亡及对DNA损伤、细胞周期方面的不同药理效应.
人胃癌细胞株为低分化黏液腺癌MGC803细胞, 由中山医科大学提供; RPMI1640培养基; 胰蛋白酶、蛋白酶K、Hepes调节液、甲基绿、派诺宁、琼脂糖等细胞培养及分子生物学试剂为Gibco, Sigma, Biowest等公司的产品; 小檗碱、吴茱萸碱和靛玉红购自中国药品与生物制品检定所. 主要仪器有美国Biorad公司的Gel.Doc凝胶图像分析仪; Amersham公司的DNA/RNA计算器, Coulter公司的流式细胞仪等.
配制完全培养液, 接种细胞[4]起始密度均为5×107/L; 用完全培养基在大培养瓶(100 mL)中置50 mL/L CO2、37 ℃培养24 h后, 传代到15 mL小瓶中分成11组: 吴茱萸碱、靛玉红500 mg/L母液分别用超声波振荡处理成微粒直径小于10 mm的均匀悬浮液, 光镜下检查未见颗粒体, 用完全培养基把靛玉红稀释为2, 10, 50 mg/L 3个剂量组; 把吴茱萸碱稀释为1, 5, 50 mg/L3个剂量组; 小檗碱用稀盐酸溶解后加超纯水配成100 mg/L母液, 超滤除菌, 再用完全培养基稀释至2, 4, 8 mg/L三个剂量组; 完全培养基为空白对照组; 20 mg/L阿霉素为阳性对照组. 各组培养基均含等量Hepes调节液, Hepes终浓度均为15 mmol/L, 使pH能稳定在7.3-7.4; 各组均设3个平行样本(n = 3), 培养24, 48, 72, 96 h后, 分别收集细胞进行: (1)形态学观察. 在倒置显微镜下, 用苔盼蓝染色, 进行细胞计数, 测定细胞在不同时间、不同药物及剂量下的存活率(加药组活细胞数/对照组活细胞数100%); (2)用甲基绿-派诺宁染色, 观察细胞的凋亡形态[5]. (3)分别离心收集各浓度的不同药物、不同作用时间的脱落细胞, 苔盼蓝染色细胞计数, 并按文献[5-6]方法用琼脂糖凝胶电泳分析DNA损伤情况, 用Gel.Doc凝胶图像分析仪观察拍照. (4)收集经小檗碱、吴茱萸碱作用48 h, 72 h后的细胞, 按文献[5-6]方法进行流式细胞仪分析.
统计学处理 用t检验.
靛玉红各剂量组96 h内细胞生长密度及细胞形态与空白对照组没有明显差别, 均呈梭形、多角形等, 贴壁牢固, 脱落的悬浮细胞少; 而吴茱萸碱和小檗碱各组随药浓度增加细胞密度逐渐变疏, 细胞变圆、变小, 贴壁松散, 晃动易脱落, 培养液中悬浮细胞随药物浓度的增加而增多.
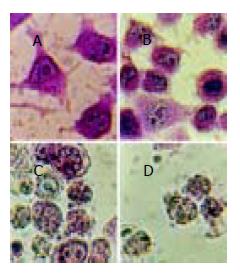
贴壁细胞用甲基绿-派诺宁原位染色, 吴茱萸碱及小檗碱组在培养24 h后, 细胞表现出典型的凋亡染色特征: 核皱缩, 染色质被甲基绿染成绿色, 与派诺宁的红色混合而呈蓝黑色, 并凝聚成不规则块状或断裂成碎片, 但核膜仍较完整. 细胞质被派诺宁(只染RNA)染成红色, 说明RNA大量合成. 高浓度组72 h均观察到部分细胞胞膜已破, 细胞质不被派诺宁染色或仅染成浅红色, 细胞核膨胀破碎呈绿色, 这是坏死细胞的特征, 是终末期凋亡细胞崩溃、坏死导致的. 阿霉素组细胞不被派诺宁染色(图1).
结果显示阿霉素阳性对照组、小檗碱及吴茱萸碱的多个剂量组均可抑制MGC 803细胞的存活率, 在96 h内小檗碱、吴茱萸碱各组和阳性对照组细胞存活率不断下降, 其中48 h细胞存活率空白对照组为100.0±7.9%; 小檗碱4 mg/L和8 mg/L组分别为72.9±6.2%(t = 4.67, P<0.01)和17.4±4.8%(t = 15.48, P<0.001); 吴茱萸碱1 mg/L和5 mg/L组分别为37.8±5.7%(t = 11.06, P<0.001)和10.7±11.1%(t = 11.35, P<0.001).72 h细胞存活率空白对照组为100.0±14.3%; 小檗碱4 mg/L和8 mg/L组分别为55.6±6.9%(t = 4.84, P<0.01)和1.1±0.8%(t = 11.96, P<0.001); 吴茱萸碱1 mg/L和5 mg/L组分别为9.3±2.5%(t = 10.82, P<0.001)和0.0±0.0%(t = 12.11, P<0.001). 吴茱萸碱50 mg/L组、阿霉素阳性对照组24 h已无苔盼蓝拒染的活细胞. 试药各组均与对应时间的空白对照组比较, 存活率均有显著下降, 而且呈作用时间、药物浓度依赖性(图2). 靛玉红各个浓度组72 h内对细胞存活率无明显影响, 仅50 mg/L组培养96 h后对细胞存活才有一定抑制但差异不明显(P>0.05).
凋亡细胞与坏死细胞比较, 胞膜相对较完整, 可用苔盼蓝染色计数法对脱落的悬浮细胞计数估测凋亡率, 凋亡率等于拒染的脱落死细胞占总细胞(活细胞加脱落细胞之和)百分比. 培养不同时间收集脱落的悬浮细胞观测, 阿霉素组基本上被苔盼蓝染色, 而且还被培养基中酚红染色. 小檗碱各组脱落的细胞胞膜仍完整, 有较高比例抗拒苔盼蓝染色并完全抗拒酚红染色, 表现出凋亡的典型特征, 其中48 h凋亡率对照组为0.3±0.0%, 小檗碱4 mg/L和8 mg/L组分别为16.9±1.6%(t = 17.97, P<0.001)和65.2±9.5%(t = 11.83, P<0.001), 吴茱萸碱1 mg/L和5 mg/L组分别为58.9±11.4%(t = 8.90, P<0.001)和37.0±7.6% (t = 8.36, P<0.001); 吴茱萸碱组脱落的死细胞先随时间、药浓度的增加而增加, 然后随着悬浮细胞较快地崩解, 拒染的脱落死细胞数在逐步减少, 50 mg/L组48 h细胞几乎已崩解、坏死. 结果表明凋亡率与药物浓度、作用时间有依赖性(表1).
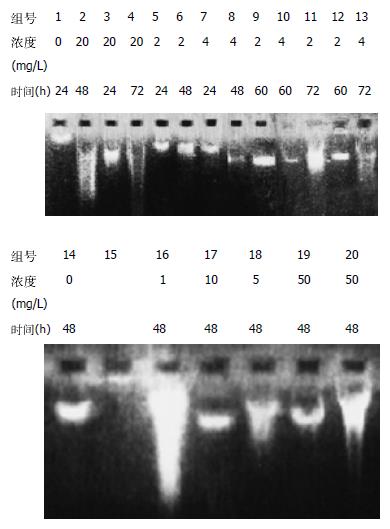
DNA凝胶电泳图谱呈现DNA特异损伤的梯状条带, 是经典细胞凋亡的标志. 小檗碱作用后, 癌细胞的DNA损伤是特异的, 断裂成的片段比原染色体DNA短, 但分子量依然较大; 最初只断裂成大片段, 没有断成小片段, 没有坏死细胞DNA的拖带涂抹现象, 说明DNA仍是在核小体间某些特异位点被切开; 随着作用时间增加开始出现小片段, 但没有呈清晰的梯状带, 估计是作用时间较长, 凋亡终末期细胞增多, 所降解的DNA碎片干扰的缘故. 吴茱萸碱组DNA损伤较明显, 但未呈梯状带而是涂抹状; 靛玉红各组细胞DNA与对照组DNA分子未见明显差别, 说明DNA无明显损伤(图3).
小檗碱组、吴茱萸碱均出现细胞凋亡的亚二倍体峰, DNA复制下降; 小檗碱组细胞阻滞于G0/G1期, 吴茱萸碱组细胞阻滞于G2期. 凋亡百分比与对照组11.8±1.5比较, 小檗碱4 mg/L组48 h为18.9±2.7(t = 3.34, P<0.05), 72 h为23.9±3.3
(t = 5.06, P<0.01); 吴茱萸碱1 mg/L组48 h为13.0±1.7(t = 0.69, P>0.05), 72 h为16.6±1.6(t = 2.80, P<0.05), 检测细胞数目均为10 000(表2).
本研究结果表明, 小檗碱和吴茱萸碱对胃癌细胞MGC803作用显著, 起效浓度较低, 小檗碱仅4 mg/L 72 h的抑制率已达44.4%, 其作用后细胞凋亡的形态特征明显, DNA是特异损伤, 切割DNA的作用较温和, 表明小檗碱促进细胞死亡的机制是诱导凋亡为主; 吴茱萸碱5 mg/L对MGC803细胞作用显著, 48 h抑制率已达79.7%, DNA损伤也发生于细胞膜破损之前, 但DNA降解未呈典型凋亡的梯状带, 表明吴茱萸碱促进细胞死亡的机制可能既有诱导凋亡也有坏死. 靛玉红已被证明是抗癌药, 但临床多用于白血病的治疗, 体外对单核淋巴细胞增生抑制作用显著[6-7], 其对肿瘤细胞的抑制作用有选择性, 我们观察到靛玉红对胃癌MGC803细胞诱导凋亡作用不明显, 对DNA无损伤作用. 关于小檗碱体外诱导肿瘤细胞凋亡的药理活性近年有较多的报道[4,8-16], 进一步的研究发现小檗碱诱导凋亡的机制与抑制拓扑异构酶、细胞周期蛋白cyclin B1、CDC2激酶等有关[17-18,20].Mitani et al[19]用小檗碱给小鼠灌胃14 d能明显抑制肺癌细胞自发性纵隔淋巴结转移并有剂量依赖关系. 关于吴茱萸碱抗肿瘤活性目前国内外报道较少[22-31], Zhang et al[22-25]报道吴茱萸碱能调节BAX和bcl-2表达, 诱导癌细胞株HeLa, L929, A357-S2等的凋亡; 也能启动非caspase依赖途径诱导A357-S2坏死; Ogasawara et al[26-29]报道吴茱萸碱可抑制小鼠26-L5, LLC, B16-F10等癌细胞的转移与浸润. 而我们既往的研究也初步证明以黄连、吴茱萸等组成的加味左金丸能阻断MNNG诱发的大鼠胃癌癌变, 中药治疗在造模16 wk开始疗效要比24 wk后加中药好得多, 这与 Anis et al[21] 对小檗碱的报道一致; 加味左金丸含药血清对胃癌细胞的诱导凋亡效应要比吴茱萸碱、小檗碱单独体外作用弱, 是否与血清抑制细胞对小檗碱吸收、而左金丸含吴茱萸量又很低有关?含吴茱萸量较高的反左金丸能否提高整体水平的抗肿瘤效果?小檗碱、吴茱萸碱单独作用和配伍作用的分子机制有何不同, 二者是否有协同效应等等有待进一步研究.
编辑: 潘伯荣 审读:张海宁
| 2. | 陈 蔚文, 李 茹柳, 张 礼康, 吕 有勇, 王 建华, 谭 宇蕙, 徐 勤, 叶 富强, 陈 冠林, 马 伟. 连黛胶囊抗胃癌的药理特性与临床应用. 世界华人消化杂志. 2000;8:34. [DOI] |
| 6. | Xiao Z, Hao Y, Liu B, Qian L. Indirubin and meisoindigo in the treatment of chronic myelogenous leukemia in China. Leuk Lymphoma. 2002;43:1763-1768. [PubMed] |
| 7. | Knockaert M, Blondel M, Bach S, Leost M, Elbi C, Hager GL, Nagy SR, Han D, Denison M, Ffrench M. Independent actions on cyclin-dependent kinasesand aryl hydrocarbon receptor mediate the antiproliferative effects of indirubins. Oncogene. 2004;23:4400-4412. [PubMed] |
| 8. | Kuo CL, Chou CC, Yung BY. Berberine complexes with DNA in the berberine-induced apoptosis in human leukemicHL-60 cells. Cancer Lett. 1995;93:193-200. [PubMed] |
| 9. | Wang DY, Yeh CC, Lee JH, Hung CF, Chung JG. Berberine inhibited arylamine N-acetyltransferase activity and geneexpression and DNA adduct formation in human malignant astrocytoma (G9T/VGH)and brain glioblastoma multiforms(GBM 8401)cells. Neurochem Res. 2002;27:883-889. [PubMed] |
| 10. | Lin S, Tsai SC, Lee CC, Wang BW, Liou JY, Shyu KG. Berberine inhibits HIF-1αlpha expression via enhancedproteolysis. Mol Pharmacol. 2004;66:612-619. [PubMed] |
| 11. | Lin CC, Ng LT, Hsu FF, Shieh DE, Chiang LC. Cytotoxic effects of Coptis chinensis and Epimedium sagittatum extractsand their major constituents (berberine, coptisine and icariin)on hepatoma and leukaemia cell growth. Clin Exp Pharmacol Physiol. 2004;31:65-69. [PubMed] |
| 12. | Colombo ML, Bugatti C, Mossa A, Pescalli N, Piazzoni L, Pezzoni G, Menta E, Spinelli S, Johnson F, Gupta RC. Cytotoxicity evaluation of natural coptisine and synthesis of coptisine from berberine. Farmaco. 2001;56:403-409. [PubMed] |
| 16. | Kang MR, Chung IK. Down-regulation of DNA topoisomerase IIalpha in human colorectal carcinoma cells resistant toa protoberberine alkaloid, berberrubine. Mol Pharmacol. 2002;61:879-884. [PubMed] |
| 17. | Li XK, Motwani M, Tong W, Bornmann W, Schwartz GK. Huanglian, A chinese herbal extract, inhibits cell growthby suppressing the expression of cyclin B1 and inhibiting CDC2 kinase activity in human cancer cells. Mol Pharmacol. 2000;58:1287-1293. [PubMed] |
| 18. | Iizuka N, Oka M, Yamamoto K, Tangoku A, Miyamoto K, Miyamoto T, Uchimura S, Hamamoto Y, Okita K. Identificationof common or distinct genes related to antitumor activities of a medicinal herb and its major component byoligonucleotide microarray. Int J Cancer. 2003;107:666-672. [PubMed] |
| 19. | Mitani N, Murakami K, Yamaura T, Ikeda T, Saiki I. Inhibitory effect of berberine on the mediastinal lymph nodemetastasis produced by orthotopic implantation of Lewis lung carcinoma. Cancer Lett. 2001;165:35-42. [PubMed] |
| 20. | Jagetia GC, Baliga MS. Effect of Alstonia scholaris in enhancing the anticancer activity of berberine in the Ehrlichascites carcinoma-bearing mice. J Med Food. 2004;7:235-244. [PubMed] |
| 21. | Anis KV, Rajeshkumar NV, Kuttan R. Inhibition of chemical carcinogenesis by berberine in rats and mice. J Pharm Pharmacol. 2001;53:763-768. [PubMed] |
| 22. | 张 莹, 张 起辉, 吴 立军, 田 代真一, 小 野寺敏, 池 岛乔. 吴茱萸碱诱导人宫颈癌HeLa细胞凋亡过程中非caspase 调控因素. 中国药理学通报. 2004;20:61-64. |
| 23. | Zhang Y, Zhang QH, Wu LJ, Tashiro S, Onodera S, Ikejima T. Atypical apoptosis in L929 cells induced by evodiamineisolated from Evodia rutaecarpa. J Asian Nat Prod Res. 2004;6:19-27. [PubMed] |
| 24. | Zhang Y, Wu LJ, Tashiro S, Onodera S, Ikejima T. Intracellular regulation of evodiamine-induced A375-S2 cell death. Biol Pharm Bull. 2003;26:1543-1547. [PubMed] |
| 25. | Zhang Y, Wu LJ, Tashiro S, Onodera S, Ikejima T. Evodiamine induces tumor cell death through differentpathways: apoptosis and necrosis. Acta Pharmacol Sin. 2004;25:83-89. [PubMed] |
| 26. | Ogasawara M, Matsubara T, Suzuki H. Screening of natural compounds for inhibitory activity on colon cancer cellmigration. Biol Pharm Bull. 2001;24:720-703. [PubMed] |
| 27. | Ogasawara M, Matsubara T, Suzuki H. Inhibitory effects of evodiamine on in vitro invasion and experimental lungmetastasis of murine colon cancer cells. Biol Pharm Bull. 2001;24:917-920. [PubMed] |
| 28. | Ogasawara M, Suzuki H. Inhibition by evodiamine of hepatocyte growth factor-induced invasion and migration oftumor cells. Biol Pharm Bull. 2004;27:578-582. [PubMed] |
| 29. | Ogasawara M, Matsunaga T, Takahashi S, Saiki I, Suzuki H. Anti-invasive and metastatic activities of evodiamine. Biol Pharm Bull. 2002;25:1491-1493. [PubMed] |
| 30. | Fei XF, Wang BX, Li TJ, Tashiro S, Minami M, Xing de J, Ikejima T. Evodiamine, a constituent of Evodiae Fructus,induces anti-proliferating effects in tumor cells. Cancer Sci. 2003;94:92-98. [PubMed] |
| 31. | Kan SF, Huang WJ, Lin LC, Wang PS. Inhibitory effects of evodiamine on the growth of human prostate cancer cellline LNCaP. Int J Cancer. 2004;110:641-651. [PubMed] |