修回日期: 2004-12-19
接受日期: 2004-12-21
在线出版日期: 2005-02-15
目的: 探讨诱导型一氧化氮合酶(iNOS)基因启动子在不同细胞系中转录活性的差别.
方法: 利用生物信息学技术确定iNOS基因的启动子区域(iNOSp), 聚合酶链反应(PCR)扩增iNOSp, 克隆至真核报告载体pCAT3-Basic中, 构建pCAT3-iNOSp报告载体; 以该质粒分别转染正常人肝细胞株L02, 人肝母细胞瘤细胞系HepG2, 小鼠成纤维细胞NIH-3T3, 人贮脂细胞(Lipocyte Ito Cell)和肝癌细胞株SMMC-7721, 用ELISA法检测氯霉素乙酰转移酶(CAT)在不同细胞系中的表达活性.
结果: 成功获得iNOS基因启动子的正确克隆, 克隆的iNOS启动子有顺式激活下游基因的活性. pCAT3-iNOSp瞬时转染HepG2细胞的CAT表达活性最强, 肝贮脂细胞Ito中CAT表达活性最弱.
结论: 不同细胞中iNOS启动子的表达活性不同, 其表达活性与细胞类型与细胞状态密切相关.
引文著录: 郭风劲, 成军, 纪冬, 刘妍, 王琳, 张黎颖, 戴久增, 宋方洲. 诱导型一氧化氮合酶基因启动子在不同细胞系中的转录活性. 世界华人消化杂志 2005; 13(4): 460-463
Revised: December 19, 2004
Accepted: December 21, 2004
Published online: February 15, 2005
AIM: To investigate the transcription activation of inducible nitric oxide synthase (iNOS) gene in different cell lines.
METHODS: The coding sequence of iNOS promoter (iNOSp) was amplified by PCR from genomic DNA of human hepatoblastoma cell line HepG2, and cloned into pEGM-Teasy vector to yield Teasy- iNOSp. The iNOSp gene was cut from Teasy-iNOSp by KpnI and XhoI, and then subcloned into pCAT3-Basic to produce a construct named pCAT3-iNOSp. pCAT3-iNOSp was transfected into HepG2 cell line, SMMC-7721 human hepatocellular carcinoma cell line, NIH-3T3 mouse fibroblast cell line, Ito human lipocyte cell line, and L02 human normal liver cell line by FuGENE 6 transfection reagent. Cells transfected with pCAT3-Basic or pCAT3-Promoter were used as negative and positive controls. The activity of CAT, which reflects the transcription activation of the iNOS gene promoter, was detected by ELISA after 48 hours of transfection.
RESULTS: The report vector pCAT3-iNOS was successfully constructed, as confirmed by restriction enzyme digestion and sequencing. The activity of CAT was highest in HepG2 cells transfected with pCAT3-iNOSp, and lowest in Ito cells.
CONCLUSION: The iNOS gene promoter can transactivate its downstream genes. Its transcription activity varies in different cell lines.
- Citation: Guo FJ, Cheng J, Ji D, Liu Y, Wang L, Zhang LY, Dai JZ, Song FZ. Transcription activation of Inducible Nitric Oxide Synthase gene in different cell lines. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 460-463
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/460.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.460
一氧化氮(nitric oxide, NO)是细胞内广泛存在的一种新型生物信号分子, 作为第二信使和神经递质发挥着多种不同的功能, 具有广泛的生物学效应和抗病毒作用, 参与机体的多种生理及病理过程. 近来研究发现, iNOS基因与病毒性肝炎有密切关系, 肝细胞中NO具有保护功能, iNOS的表达可以作为减少炎症损伤的一个衡量因子. 正常肝细胞中iNOS基因表达量极低, 一旦病毒侵入肝细胞后就会诱导肝细胞激活iNOS基因并使其表达, 产生大量的NO, NO作为细胞内一种活跃的信号分子在其信号传递过程中发挥抗病毒功能[1-2]. 我们构建iNOS基因启动子的报告载体, 分别导入人肝母细胞瘤细胞系HepG2, 正常人肝细胞株L02, 小鼠成纤维细胞NIH-3T3, 人贮脂细胞Ito和肝癌细胞株SMMC-7721中, 以验证该启动子在不同细胞中的转录活性, 旨在探讨NO在不同细胞中的表达机制, 为进一步揭示NO在细胞中的信号转导机制奠定基础, 有助于阐明NO的广泛生物学效应和抗病毒机制.
人肝母细胞瘤细胞系HepG2, 正常人肝细胞株L02, 小鼠成纤维细胞NIH-3T3, 人贮脂细胞(Ito Cell)和肝癌细胞株SMMC-7721及大肠杆菌DH5a菌株为本室保存. Tag DNA聚合酶、T4 DNA连接酶及限制性内切酶均购自Takara公司. 质粒DNA提取试剂盒, 中间载体pGEM-T easy及报告质粒pCAT3-Basic均购自Promega公司; CAT-ELISA检测试剂盒及质粒DNA转染试剂盒购自Roche公司. 其他生化试剂购自Sigma公司, 玻璃奶纯化试剂盒购自博大公司.
1.2.1 iNOS启动子的结构分析及PCR扩增: 根据GenBank中iNOS以及iNOS启动子的基因序列[3], 确定iNOS的翻译起始点(ATG), 选取其上游-936-21 bp为目的片段, 设计并由上海博亚公司合成引物, 在上、下游引物的5'-端分别加上Kpn I/Xho I酶切位点(划线部分). 上游引物: 5'- GGTACCAAACCCAGTCTCTACCAAAAAC -3', 下游引物: 5'-CTCGAGTTCGACTCGCTACAAAGTTATG-3'.以HepG2细胞基因组为模板, 进行聚合酶链反应(PCR)反应(PE9600 PCR仪), 扩增条件: 94 ℃预变性5 min, 95 ℃变性1 min, 63 ℃退火1 min, 72 ℃延伸1 min, 循环35次后, 72 ℃保温10 min.PCR产物经10 g/L琼脂糖凝胶电泳, 切胶, 玻璃奶法回收纯化.
1.2.2 pCAT3-iN0Sp的构建: 回收产物在T4 DNA连接酶的作用下, 与pGEM-Teasy载体连接, 转化大肠杆菌DH5a感受态细胞, 挑取在选择平皿(Amp, X-gal/IPTG)生长的白色菌落提取质粒, 经酶切(Kpn I/Xho I)鉴定. Kpn I/Xho I双酶切重组质粒pGEM-T-iNOS, 玻璃奶纯化回收酶切产物, 定向克隆至pCAT3-Basic载体, 构建成重组质粒pCAT3-iNOSp, 经酶切及DNA测序鉴定(上海博亚公司). 磁珠法提取质粒以备转染.
1.2.3 pCAT3-iNOSp的瞬时转染: 分别在含100 mL/L胎牛血清的DMEM中培养人肝母细胞瘤细胞系HepG2, 正常人肝细胞株L02, 小鼠成纤维细胞NIH-3T3, 人贮脂细胞Ito和肝癌细胞株SMMC-7721, 于35 mm平皿中生长至50-80%融合时采用脂质体转染法, 具体转染方法参照FuGENE6 Transfection Reagent说明书进行, pCAT3-iNOSp转染剂量为1 mg, 设置pCAT3-Basic(1 mg)为阴性对照组, pCAT3-promoter(1 mg)为阳性对照组, 转染24-48 h后收获细胞, 收集细胞裂解液, 用于CAT活性检测以验证所克隆片段的启动子活性, 并比较pCAT3-iNOS在不同细胞系中的转录活性, 所有实验严格平行操作.
1.2.4 CAT含量检测: 按照CAT ELISA试剂盒说明书进行, 取1.0 mg/L 的CAT标准品(试剂盒提供)及细胞裂解液200 mL, 加入已包被抗体的96孔板中, 37 ℃温育1 h, 再依次加入第一抗体(地高辛标记的抗-CAT)、第二抗体(耦联有过氧化物酶的地高辛抗体抗-DIG-POD)各200 mL, 37 ℃温育1 h后, 加入过氧化物酶的底物室温显色20 min, 用酶标仪检测标本在415 nm检测波长, 490 nm参考波长下的吸光度A值, 其数值反映细胞提取物中的CAT表达水平.
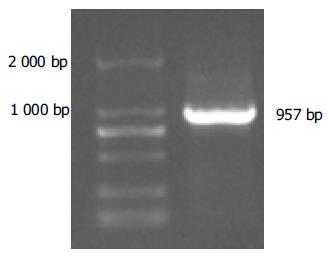
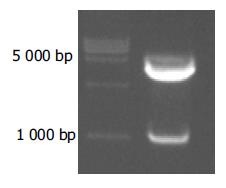
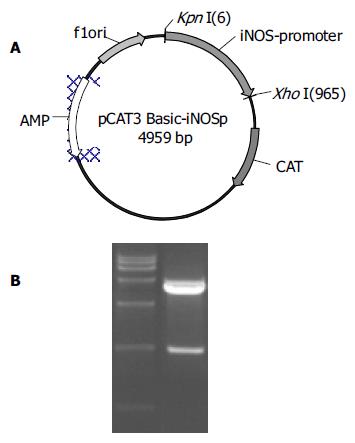
利用自行设计的引物成功扩增出iNOS基因的启动子序列, 经1%琼脂糖凝胶电泳分析显示扩增片段约957 bp, 与预期片段符合(图1). 将扩增产物与pGEM-Teasy载体连接, 双酶切鉴定, 10 g/L琼脂糖凝胶电泳分析显示两条带(3 015 bp的pGEM-Teasy载体和957 bp的iNOS启动子DNA片段), 与预期一致(图2). 图3A为pCAT3-iNOSp质粒结构图. 将双酶切产物与pCAT3-Basic载体连接, 双酶切鉴定如图3B所示(4 027 bp的pCAT3-Basic载体和957 bp的iNOSp DNA片段), DNA测序结果和GenBank中iNOS启动子的基因序列完全一致.
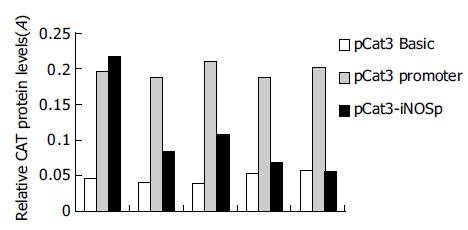
将重组质粒pCAT3-iNOSp分别转染人肝母细胞瘤细胞系HepG2, 正常人肝细胞L02, 贮脂细胞Lipocyte Ito, 小鼠成纤维细胞(NIH-3T3), 肝癌细胞株SMMC-7721, CAT ELISA检测吸光度, 比较pCAT3-iNOSp在这五种不同细胞中的转录活性, 每一组细胞系都设立空载体阴性对照组pCAT3-Basic和阳性对照组pCAT3-promoter, 分别检测重组质粒pCAT3-iNOSp在这些细胞系中的表达活性(表1). 结果pCAT3-iNOSp在HepG2细胞中的转录活性是最强的, 是pCAT3-Basic的4.6倍, 其次是SMMC-7721, 在L02, NIH-3T3, 贮脂细胞中活性低或者没有活性(图4).
| 细胞类型 | pCAT3-Basic | pCAT3-promoter | pCAT3-iNOSp |
| HepG2 | 0.047 | 0.198 | 0.216 |
| L02 | 0.041 | 0.187 | 0.085 |
| SMMC-7721 | 0.039 | 0.211 | 0.107 |
| NIH-3T3 | 0.053 | 0.189 | 0.069 |
| Lipocyte Ito | 0.058 | 0.203 | 0.057 |
一氧化氮是一种结构简单、分子质量小的生物自由基, 参与肝细胞的多项生理功能, 参与各种肝病的病理过程. 肝细胞中NO具有保护功能, iNOS的表达可以作为减少炎症损伤的一个衡量因子. 正常肝细胞中iNOS基因表达量极低, 一旦病毒侵入肝细胞后就会诱导肝细胞激活iNOS基因并使其表达, 产生大量的NO, NO作为细胞内一种活跃的信号分子在其信号传递过程中发挥抗病毒功能[4-8]. 我们分别在人肝母细胞瘤细胞系HepG2, 正常人肝细胞株L02, 小鼠成纤维细胞NIH-3T3, 人贮脂细胞和肝癌细胞株SMMC-7721中导入pCAT3-iNOSp报告载体, 旨在探讨不同细胞中iNOS基因启动子的表达调控机制, 为进一步揭示细胞中NO的信号转导调控机制奠定基础. Geller et al[9-10]1993年采用肿瘤坏死因子a(TNFa)、白介素1(IL-1)、干扰素g(IFNg)和脂多糖(LPS)诱导肝细胞表达iNOS基因后, 成功克隆并表达了iNOS基因, 并进一步采用Northern blot技术分析不同因子刺激后iNOS基因表达量的变化, 发现单因子TNFa刺激和TNFa、IL-1双因子共刺激, iNOS基因表达量高于其他对照组. 他们发现肝细胞iNOS有80%氨基酸序列与巨噬细胞iNOS同源, 与其他NOS同工酶一致的是, 肝细胞中iNOS也含有FMN、FAD、NADPH和Ca2+-CaM结合位点, 与巨噬细胞iNOS和神经型NOS、内皮细胞型不同的是, 肝细胞iNOS必须经过诱导才能表达, 是一种诱导表达的活性形式. 随后, Nunokawa et al[11]1994年分析了心肌细胞iNOS基因启动子结构, 指出iNOS启动子含有8个IFN-γ反应元件和一个血清应答元件(SRE)、NF-IL6, NF-κB一致性结合序列, 解释了IFN-γ, TNF-α和内毒素可以诱导激活iNOS启动子表达iNOS的原因. 1995年, Rockey et al[12]在肝贮脂细胞中也发现iNOS 基因在用肿瘤坏死因子a(TNFa)、脂多糖(LPS)、白介素1(IL-1)、干扰素g(IFNg)等因子刺激后, iNOS mRNA水平增加, 在刺激4 h后达到峰值. 当肝胆管结扎以后造成周围组织肝损伤, 此时会刺激肝贮脂细胞iNOS基因的表达, 研究者认为肝损伤时, 肝贮脂细胞iNOS基因会被激活, NO是肝贮脂细胞一个潜在的调控因子, 可作为肝细胞损伤的一个重要调节因子, 该因子通过细胞自分泌或内分泌机制完成这一调控. Sakitani et al[13]发现肝细胞中CCAAT增强子结合蛋白b和核转录因子NF-KappaB协同调控iNOS基因的表达. 2003年Guo et al[14]发现肝细胞中iNOS基因有自己特有的转录分子机制, 在人肝细胞iNOS基因启动子区-192 bp有一特异的A-激活域结合位点(AABS)可以特异性连接C/EBPb转录因子, 二者的结合可以介导肝细胞内特异的基因表达, 因此启动子中AABS作用元件是一个介导肝细胞特异iNOS转录活性的顺式作用元件, 这一位点突变会导致肝细胞中iNOS启动子活性丧失, 并会抑制细胞因子诱导的启动子活性. 最近, Kleinert et al[15]发现, NO调控iNOS的过程是非常复杂的, iNOS表达产物NO具有抗病毒、抗寄生、抗微生物、抗肿瘤和免疫调节效应, 可是一旦在错误的地点、错误的时间诱导其表达, iNOS就会具有多种负面的效应, 因此, NO参与人体的多种生理及病理过程, 具有广泛的病理生理效应. 他还进一步指出iNOS在不同细胞的表达和调控机制是不同的. 通常情况下, 一旦激活核转录因子NF-κB和信号转导激活转录因子STAT-1a, 就会激活iNOS启动子, 这是iNOS基因表达的一个重要调控步骤, 这一调控属于转录后调控机制. Yu et al[16]发现STAT3和NF-κB是调节iNOS基因表达的重要转录因子, 在这一调节过程中, STAT3 DNA结合域对于NF-κB p65 调控iNOS的转录活性是必需的. 因此, 可以认为细胞在病理状态下会增加iNOS的表达量, 导致NO产量的增多, 发挥其抗病毒效应, 这是细胞的一种自我保护机制; 但同时产生的NO又可通过细胞毒作用损伤正常组织, 造成细胞死亡. NO这两种作用的强弱主要取决于NO的浓度和NO的细胞来源, 浓度在一定范围内以及来源于内皮细胞者对组织器官起保护作用, 否则起毒性作用[17].
我们发现人肝母细胞瘤细胞系HepG2和肝癌细胞株SMMC-7721中CAT的表达强于3组正常细胞(L02, NIH-3T3, Ito Cell), 说明iNOS基因在HepG2和SMMC-7721细胞中的表达强于其他三组正常细胞. 因此, 我们认为不同细胞中iNOS基因启动子的活性是有差别的, 不同细胞中iNOS基因的表达量也是不同的. 至于是否iNOS基因在异常细胞中的表达强于正常细胞, 还需要进一步扩大细胞类型作深入的研究. NO作为一种多功能的信号分子, 在肝细胞内涉及了极其广泛的信号调控过程, 不同的细胞, 由于其细胞内环境的不同, 每一种细胞内差异表达的基因也不同, 这些因素都会影响iNOS基因的表达, 影响细胞内NO的信号转导过程, 其中具体的机制尚需要进一步进行详细的研究.
编辑: 潘伯荣 审读:张海宁
| 1. | Taylor BS, Alarcon LH, Billiar TR. Inducible nitric oxide synthase in the liver: regulation and function. Biochemistry (Mosc). 1998;63:766-781. [PubMed] |
| 2. | Rockey DC, Chung JJ. Regulation of inducible nitric oxide synthase and nitric oxide during hepatic injury and fibrogenesis. Am J Physiol. 1997;273:G124-G130. [PubMed] |
| 3. | Geller DA, Lowenstein CJ, Shapiro RA, Nussler AK, Di Silvio M, Wang SC, Nakayama DK, Simmons RL, Snyder SH, Billiar TR. Molecular cloning and expression of inducible nitric oxide synthase from human hepatocytes. Proc Natl Acad Sci USA. 1993;90:3491-3495. [PubMed] [DOI] |
| 4. | Majano PL, Medina J, Zubía I, Sunyer L, Lara-Pezzi E, Maldonado-Rodríguez A, López-Cabrera M, Moreno-Otero R. N-Acetyl-cysteine modulates inducible nitric oxide synthase gene expression in human hepatocytes. J Hepatol. 2004;40:632-637. [PubMed] [DOI] |
| 5. | Sheffler LA, Wink DA, Melillo G, Cox GW. Exogenous nitric oxide regulates IFN-γamma plus lipopolysaccharide-induced nitric oxide synthase expression in mouse macrophages. J Immunol. 1995;155:886-894. [PubMed] |
| 7. | 成 军, 刘 妍, 洪 源, 王 建军, 杨 倩, 王 琳. 乙型肝炎病毒和丙型肝炎病毒反式调节靶基因的抑制性消减杂交 和基因芯片分析结果的比较. 世界华人消化杂志. 2004;12:327-331. [DOI] |
| 9. | Geller DA, Nussler AK, Di Silvio M, Lowenstein CJ, Shapiro RA, Wang SC, Simmons RL, Billiar TR. Cytokines, endotoxin, and glucocorticoids regulate the expression of inducible nitric oxide synthase in hepatocytes. Proc Natl Acad Sci USA. 1993;90:522-526. [PubMed] [DOI] |
| 10. | Chartrain NA, Geller DA, Koty PP, Sitrin NF, Nussler AK, Hoffman EP, Billiar TR, Hutchinson NI, Mudgett JS. Molecular cloning, structure, and chromosomal localization of the human inducible nitric oxide synthase gene. J Biol Chem. 1994;269:6765-6772. [PubMed] |
| 11. | Nunokawa Y, Ishida N, Tanaka S. Promoter analysis of human inducible nitric oxide synthase gene associated with cardiovascular homeostasis. Biochem Biophys Res Commun. 1994;200:802-807. [PubMed] [DOI] |
| 12. | Rockey DC, Chung JJ. Inducible nitric oxide synthase in rat hepatic lipocytes and the effect of nitric oxide on lipocyte contractility. J Clin Invest. 1995;95:1199-1206. [PubMed] [DOI] |
| 13. | Sakitani K, Nishizawa M, Inoue K, Masu Y, Okumura T, Ito S. Synergistic regulation of inducible nitric oxide synthase gene by CCAAT/enhancer-binding protein beta and nuclear factor-kappaB in hepatocytes. Genes Cells. 1998;3:321-330. [PubMed] [DOI] |
| 14. | Guo Z, Shao L, Feng X, Reid K, Marderstein E, Nakao A, Geller DA. A critical role for C/EBPbeta binding to the AABS promoter response element in the human iNOS gene. FASEB J. 2003;17:1718-1720. [PubMed] |
| 15. | Kleinert H, Pautz A, Linker K, Schwarz PM. Regulation of the expression of inducible nitric oxide synthase. Eur J Pharmacol. 2004;500:255-266. [PubMed] [DOI] |
| 16. | Yu Z, Kone BC. The STAT3 DNA-binding domain mediates interaction with NF-kappaB p65 and inducible nitric oxide synthase transrepression in mesangial cells. J Am Soc Nephrol. 2004;15:585-591. [PubMed] [DOI] |