修回日期: 2005-08-10
接受日期: 2005-08-26
在线出版日期: 2005-11-28
目的: 将α-防御素-1(HNP-1)基因与J链基因进行重组使其成为一种新的杀菌肽分子J-HNP-1, 并将其构建于能有效表达和分泌活性J-HNP-1杀菌肽的哺乳动物细胞表达系统.
方法: 应用PCR技术从不同的质粒中获得J链基因和HNP-1基因, 然后应用重组PCR技术将这两个不同的基因连接在一起而成为J-HNP-1基因. 将此基因克隆入哺乳动物细胞表达载体pcDNA3.1(-)/Myc-HisC中. 用脂质体转染法将此重组子导入COS-7细胞, 分别从mRNA和蛋白质水平采用RT-PCR和Western blot分析J-HNP-1的表达情况, 并体外检测细胞可溶性蛋白及培养上清的抗菌活性.
结果: 获得的J链基因和HNP-1基因大小分别为489和297 bp. 采用RT-PCR法从被转染的细胞中扩增出一条约786 bp的片段, 其大小与预测相符; 采用Western blot印迹法, 用抗His抗体检测到细胞可溶性蛋白及培养上清在约Mr 24000处有强反应条带显示; 抗菌活性检测显示, 经rpcDNA3.1(-)/Myc-HisC/J-HNP-1转染的COS-7细胞的可溶性蛋白和培养上清均有明显的抗菌活性, 抑菌圈的直径分别为34和43 mm.
结论: 重组J-HNP-1基因构建到哺乳动物细胞表达系统, 并体外表达, 具有抑菌作用.
引文著录: 刘贤华, 白晓东, 仝青英, 张韶峰. J-HNP-1 多肽的重组及体外抗菌作用研究. 世界华人消化杂志 2005; 13(22): 2640-2644
Revised: August 10, 2005
Accepted: August 26, 2005
Published online: November 28, 2005
AIM: To construct the recombinant of J chain and human neutrophil peptide-1 (HNP-1) gene, and to express it in the mammalian cell system.
METHODS: The J chain and HNP-1 cDNA were ampli-fied from the different plasmids by polymerase chain reaction (PCR), respectively, then the two kinds of cDNA fragments were recombined to obtain J-HNP-1 gene by recombinant PCR. After the J-HNP-1 cDNA fragment was inserted into the mammalian express vector pcDNA3.1(-)/Myc-HisC, the recombinant vector was transfected to the COS-7 cells by lipid transfection. The expression of J-HNP-1 mRNA and protein were detected by reverse transcription RCP (RT-PCR) and Western-blot, respectively. The antibacterial activities of cellular soluble protein and culture supernatant were examined in vitro.
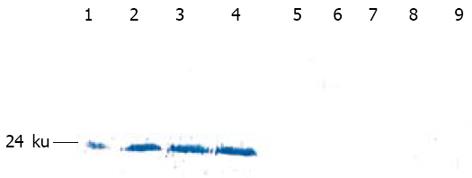
RESULTS: The lengths of amplified J chain and HNP-1 were 489 bp and 297 bp, respectively. A band of 786 bp was amplified from COS-7 cells transfected by the recombinant plasmid. Western blot analysis revealed that the lysate of COS-7 cells transfected by rpcDNA3.1(-)/Myc-His /J-HNP-1 had a strong band with molecular weight of about 24 ku. After transfection, the soluble protein and supernatant of the COS-7 cells had significant antibacterial activity, and the diameters of their bacterial inhibition ring were 34 and 43 mm, respectively.
CONCLUSION: The J-HNP-1 recombinant is successf-ully constructed and expressed in vitro, and it has a fa-vorable antibacterial effect.
- Citation: Liu XH, Bai XD, Tong QY, Zhang SF. Preliminary study on recombination of J-HNP-1 and its antibacterial effect in vitro. Shijie Huaren Xiaohua Zazhi 2005; 13(22): 2640-2644
- URL: https://www.wjgnet.com/1009-3079/full/v13/i22/2640.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i22.2640
肠源性感染的致病菌主要是条件致病菌, 其中多为耐药菌. 其感染常见于严重创伤、烧伤[1-3]、移植术后[4]、腹部外科感染性疾病[5]、成人免疫缺陷综合征[6]、恶性肿瘤[7]等重症患者. 目前尚无良好的预防手段. 黏膜上皮细胞膜上具备多聚IgA受体(pIgR). 连有J链的IgA分子通过J链与pIgR结合后, 将IgA分子转运入黏膜细胞内. 我们将HNP-1(属α-防御素)与J链cDNA连接, 然后在哺乳动物细胞系统中表达, 并初步检测其产物体外抗菌活性, 为进一步研究其细胞内杀菌功能提供依据.
哺乳动物细胞表达载体pcDNA3.1(-)/Myc-HisC购自Invitrogen公司; pCH-J质粒由挪威奥斯陆大学Johansen教授赠送; 人防御素真核表达质粒pBabeNeo-HNP-1由华西医科大学赠送; 金色葡萄球菌标准菌株6538、COS-7细胞由北京军事医学科学院提供. RT-PCR Kit, PCR产物克隆试剂盒购自北京天象邦定生物科技有限公司; 兔抗多聚组氨酸抗体(即His抗体)购自北京华美生物公司; 脂质体转染试剂购自北京天为时代; 根据J链序列设计引物并在所设计的引物的上游插入BamHⅠ酶切位点, 下游引入4个与甘氨酸相对应的氨基酸序列. J 链上游引物(P1)为: 5'-gga tcc atg aag aac cat ttg ctt-3'; J链下游引物(P2)为5'-acc acc acc acc gtc agg ata gca ggc atc-3'. 根据HNP-1序列设计引物并在所设计的引物的上游引入4个与甘氨酸相对应的氨基酸序列, 下游插入BamHⅠ酶切位点. HNP-1的上游引物(P3)为: 5'-ggt ggt ggt ggt atg agg acc ctc gcc atc-3'; 下游引物(P4)为: 5'-gga tcc gca gca gaa tgc cca gag-3'. 根据预测rpcDNA3.1(-)/Myc-HisC/J-HNP-1 DNA序列设计PCR引物: P5: 5'-atg aag aac cat ttg ctt ttc tgg g-3'; P6: 5'- gca gca gaa tgc cca gag tc-3'. 以上引物均由北京军事医学科学院合成.
1.2.1 重组哺乳动物细胞表达载体rpcDNA3.1(-)/Myc-HisC/J-HNP-1的构建: 利用PCR方法以P1、P2为引物从原质粒pCH-J中扩增出J链片段. 利用PCR方法以P3、P4为引物从原质粒pBabeNeo-HNP-1中扩增出HNP-1片段. 利用重组PCR技术, 以J链扩增产物和HNP-1扩增产物的混合物为模板, 以P1、P4位引物扩增获取J-HNP-1基因. 将此杂合基因J-HNP-1 DNA 片段先与pGM-T Easy载体相连接, 再用限制性内切酶BamHⅠ进行酶切以获取J-HNP-1 DNA片段. 将J-HNP-1 DNA片段插入真核表达质粒pcDNA3.1(-)/Myc-HisC的多克隆位点并紧邻报告基因Myc表位和6×His的上游, 从而构建成重组真核表达载体rpcDNA3.1(-)/Myc-HisC/J-HNP-1. 用该重组质粒转化大肠杆菌TOP10, 并接种于含100 mg/L氨苄青霉素的LB培养基, 过夜培养后挑取阳性克隆, 提取质粒DNA, 随机挑取8个阳性克隆提取质粒DNA, 用限制性内切酶BamHⅠ进行酶切鉴定. 并对阳性克隆质粒进行DNA测序. 由北京军事医学科学院应用Beckman CEQ2000自动测序仪进行DNA序列测定. 正向引物为T7, 反向引物为BGH-rev.
1.2.2 转染后COS-7培养细胞总RNA的提取及RT-PCR[8]: 基因脂质法[9]转染入COS-7细胞, 以正常的COS-7细胞为空白对照和转染空质粒pcDNA3.1(-)/Myc-HisC的COS-7细胞为阴性对照. 转染后24 h换液后将细胞依次于浓度为(100 mL/L, 0.2 mL/L, 0 mL/L)胎牛血清的培养基中, 继续培养12 h, 培养过程均无抗生素. 转染细胞培养增殖36 h后, 分别收集实验组及对照组(转染pcDNA3.1(-)/Myc-HisC和正常的COS-7)培养细胞, 提取总RNA. 先进行逆转录, 再以P5, P6为引物进行PCR.
1.2.3 Western Blot检测: 于转染后36 h收集各组细胞及培养上清提取蛋白[10], 用抗His抗体, 按常规Western Blot方法检测.
1.2.4 细胞可溶性蛋白及培养上清的抗菌活性试验: 将金色葡萄球菌标准菌株ATCC6538种于固体LB培养基上. 纸片扩散法检测. 设置LVF阳性对照组(左氧氟沙星纸片), COS-7细胞阴性对照组(包括细胞可溶性蛋白和培养上清)以及rpcDNA3.1(-)/Myc-HisC/J-HNP-1转染COS-7细胞实验组(包括细胞可溶性蛋白和培养上清).
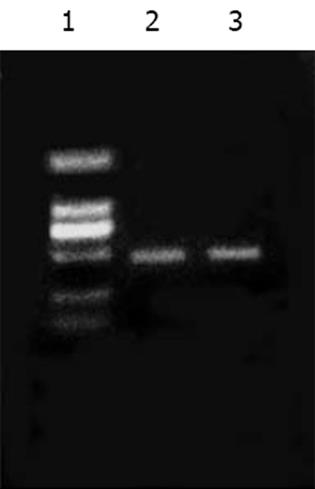
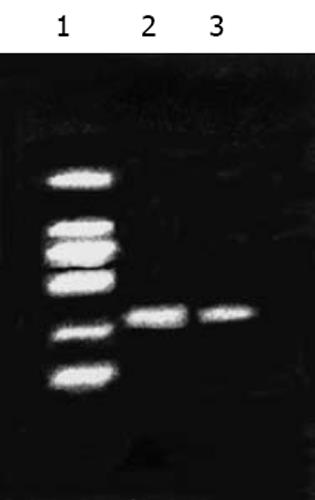
从pCH-J质粒中扩增出J链, 产物大小为: 489 bp(图1); 从pBabeNeo-HNP-1质粒中扩增出HNP-1, 产物大小为: 297 bp(图2). 重组PCR产生了包含J链和HNP-1这两个不同基因的融合基因. 将此融合基因与pGM-T Easy载体通过连接与转化, 产生阳性克隆菌落. 挑菌, 培养, 提取质粒, BamHⅠ酶切质粒pGM-T Easy/J-HNP-1, 获取J-HNP-1片段, 再次克隆入哺乳动物细胞表达载体pcDNA3.1(-)/Myc-HisC.
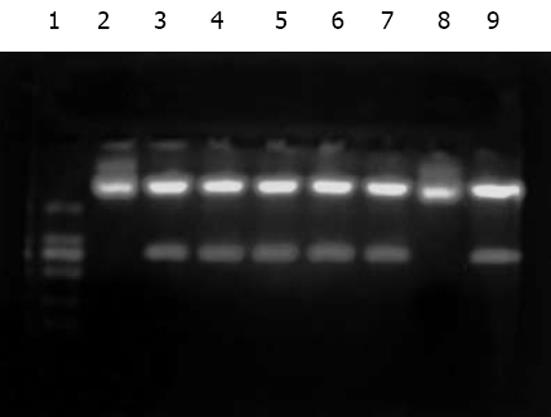
随机挑取8个阳性克隆提取质粒DNA, 用限制性内切酶BamHⅠ进行酶切鉴定(图3). 并对阳性克隆质粒进行DNA测序. 测序结果显示: 使用正向T7引物和反向BGH-rev引物对重组质粒rpcDNA3.1(-)/Myc-HisC/J-HNP-1进行DNA序列测定, 插入片断为786 bp, 且有4个为正向插入. 并且在两个不同基因之间顺利插入了4个甘氨酸分子. 该结果表明: 所提质粒为rpcDNA3.1(-)/Myc-HisC/J-HNP-1转化的阳性重组子(图4).
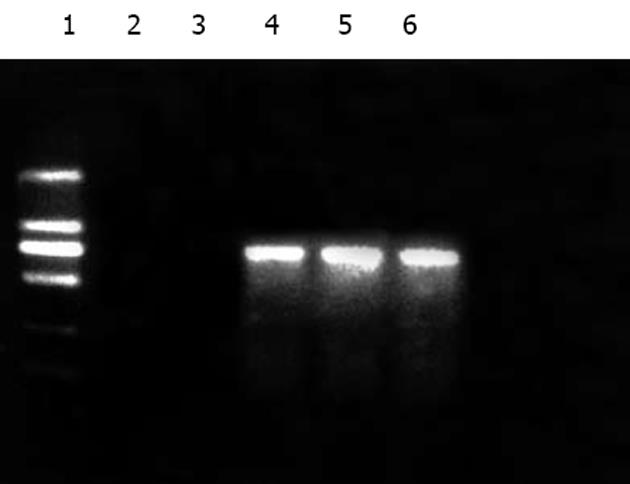
用rpcDNA3.1(-)/Myc-HisC/J-HNP-1中J-HNP-1插入子的特异性引物(P5, P6), 对经rpcDNA3.1(-)/Myc-HisC/J-HNP-1转染并分别培养与含不同的胎牛血清(100 mL/L, 0.2 mL/L, 0 mL/L)的3种COS-7细胞的总RNA进行RT-PCR扩增, 结果均扩增出一条约786 bp大小的片段, 其长度与预测相符. 在相同RT-PCR扩增条件及加样量下, 同步转染空质粒pcDNA3.1(-)/Myc-HisC的COS-7细胞的总RNA无相应条带扩出(图5).
Western Blot印迹检测结果表明: 经rpcDNA3.1(-)/Myc-HisC/J-HNP-1转染的COS-7细胞可溶性蛋白及细胞的培养上清在约24 kd处均有强反应条带显示. 对照组转染空质粒pcDNA3.1(-)/Myc-HisC的COS-7细胞和培养上清均未见相应条带显示(图6).
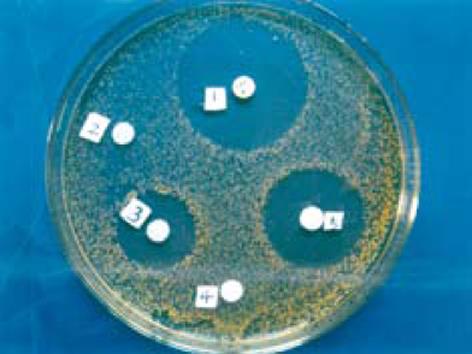
抗菌活性结果显示(图7), 在金色葡萄球菌标准菌株ATCC6538标准菌株的LB平板上, 阳性抗菌药LVF(5 μg/片)显示直径约为55 mm的抑菌圈; 转染pcDNA3.1(-)/Myc-HisC(即空质粒)的COS-7细胞的可溶性蛋白和培养上清未见抑菌圈显示; 而3/4rpcDNA3.1(-)/Myc-HisC/J-HNP-1转染的COS-7细胞的可溶性蛋白和培养上清均呈现出明显的抑菌圈, 其直径分别为34 mm和43 mm. 该结果提示: 转染rpcDNA3.1(-)/Myc-HisC/J-HNP-1的COS-7细胞表达和分泌的产物具有抗菌活性.
肠源性感染问题一直困扰着医学界, 人们尝试着各种途径去解决[11-14]. 有研究分析腹部外科感染性疾病病原菌的构成比和药物敏感率的变化, 发现几乎所有菌种都是人体正常菌种, 条件致病菌和内源性细菌感染是腹部外科感染的特征[15]. 74%的开腹外科患者感染并发症是肠道移位细菌引发[16]. 肠道黏膜来源的条件病原微生物种类多, 包括需氧菌(如大肠杆菌、铜绿假单胞杆菌)、厌氧菌(如脆弱类杆菌)、真菌(如白色念珠菌). 在体内菌群失调的情况下, 条件致病菌首先在黏膜表面侵袭、局部定植, 然后尚有可能向体内其他部位播散, 通过直接或间接的方式, 引发全身炎症反应综合征. 研究表明各种病理情况导致免疫低下、黏膜组织缺血、缺氧, 进入肠上皮细胞的细菌数量明显增加[17,18]. 其次, 由于耐药性以及免疫识别等问题, 上皮细胞内病原体能有效逃避体内免疫系统对其识别和杀灭. 再次, 由于各种原因例如细菌的变异, 抗生素的滥用等等造成细菌对传统抗生素产生了耐药[19-22]. 因此, 如何杀灭黏膜表面侵袭和黏膜细胞内的致病菌, 从源头上预防条件致病菌感染, 促使许多研究者尝试着各种途径去解决. 目前研究表明[23,24], 内源性抗菌肽防御素(defensin)通过攻击靶细胞膜而杀菌, 具备同时杀灭真菌和细菌甚至HIV病毒的能力, 完全不同于传统抗生素, 不会产生耐药性.
防御素体内分布以中性粒细胞为主, 属胞内抗菌物质; HNP-1 (human netrophil peptide-1)是人中性粒细胞的主要防御素分子, Mr 3 000-5 000, 主要存在于人中性粒细胞的溶酶体颗粒内, 是迄今发现的含量最多、活性最强的杀菌分子[25]. HNP-1不但是哺乳动物中性粒细胞溶酶体颗粒内主要杀菌分子, 对革兰阳性和阴性菌、霉菌、厌氧菌、螺旋体、分枝杆菌以及包膜病毒如流感病毒、艾滋病毒等均有很强杀伤活性, 也是黏膜抗感染的重要防御成分[26-28]. 因此将防御素用于临床感染性疾病的防治是国内外医学界感兴趣的课题. J链是一小分子多肽, 由黏膜和腺体细胞表达, 可调节IgA多聚体的形成. J链结合多聚IgA(PIgA)后抗原结合点的高效价, 适合于凝集细菌和病毒; 具有刺激补体旁路途径的潜力; 只有含J链的多聚体才显示出与多聚IgA受体(pIgR)的高亲和性[29]. 我们正是设想利用HNP1具有的特点与J链的生物学特点, 将这两者进行优势互补. 中性粒细胞中的HNP-1仅能在该细胞内发挥杀菌作用, 对粒细胞以外的病原菌难以发挥作用; 而小肠黏膜分泌的其他天然防御素又由于其活性作用局限于细胞膜而对上皮细胞内的细菌难以发挥作用. 防御素主要存在于肠道、女性生殖道黏膜系统中, 而黏膜上皮细胞又有一个共同的特点, 即在细胞膜上具备多聚IgA受体(pIgR). 连有J 链的IgA分子通过J链与pIgR结合后, 将IgA分子转运入黏膜细胞内. 我们利用J链的生物学特点及HNP-1的抗菌优势以及黏膜上皮细胞的共同特点, 将J链与HNP-1融合, 使HNP-1分子的一端为J链, 另一端为防御素, 称之为多聚IgA受体(pIgA)配体样杀菌肽. 希望这种外源性防御素借助于J链的作用被送入黏膜上皮细胞内, 使黏膜上皮获得象中性粒细胞一样的杀菌功能而杀灭细胞内移位菌. 从而有效地将HNP-1的杀菌功能拓展到上皮细胞内, 从而杀灭细胞内移位菌.
为了检测经过翻译后表达出的蛋白质是否具有抗菌活性, 本试验应用纸片扩散法对同一样品的细胞可溶性蛋白和细胞培养上清进行抑菌试验, 其结果表明: 转染rpcDNA3.1(-)/Myc-HisC/J-HNP-1重组质粒36 h的COS-7细胞的细胞可溶性蛋白和细胞培养上清对金黄色葡萄球菌标准菌株ATCC6538菌有明显的抑制作用, 而且细胞培养上清的抗菌活性明显强于细胞可溶性蛋白. 可能原因分析: 在COS-7细胞中表达的是J-HNP-1的前体, 前体J-HNP-1需经过翻译修饰后而分泌到细胞外才能成为成熟的J-HNP-1, 只有成熟的抗菌肽才表现其阳离子肽的特性而显示强抗菌活性; 在COS-7细胞中表达并分泌到胞外的由于是成熟的J-HNP-1, 成熟的J-HNP-1是一个含6个组氨酸的嵌合肽, 组氨酸为碱性氨基酸, 这就极大地增强了J-HNP-1/Myc-HisC嵌合肽的阳离子性, 从而显示其强抗菌活性. 推测根据是有研究报道[30], 抗菌肽的抗菌机制是抗菌肽分子依靠其带正电荷的特点而吸附于微生物表面并插入微生物细胞胞膜而形成孔道. 本研究为防御素有效送入黏膜上皮细胞内发挥杀菌作用这一工作奠定了基础.
电编: 张敏 编辑: 潘伯荣 审读: 张海宁
| 3. | Pirnay JP, De Vos D, Cochez C, Bilocq F, Pirson J, Struelens M, Duinslaeger L, Cornelis P, Zizi M, Vanderkelen A. Molecular epidemiology of Pseudomonas aeruginosa colonization in a burn unit: persistence of a multidrug-resistant clone and a silver sulfadiazine-resistant clone. J Clin Microbiol. 2003;41:1192-1202. [PubMed] [DOI] |
| 4. | Rayes N, Seehofer D, Hansen S, Boucsein K, Muller AR, Serke S, Bengmark S, Neuhaus P. Early enteral supply of lactobacillus and fiber versus selective bowel decontamination: a controlled trial in liver transplant recipients. Transplantation. 2002;74:123-127. [PubMed] [DOI] |
| 6. | Antinori S, Galimberti L, Magni C, Casella A, Vago L, Mainini F, Piazza M, Nebuloni M, Fasan M, Bonaccorso C. Cryptococcus neoformans infection in a cohort of Italian AIDS patients: natural history, early prognostic parameters, and autopsy findings. Eur J Clin Microbiol Infect Dis. 2001;20:711-717. [PubMed] [DOI] |
| 8. | C.W.迪芬巴赫, G.S.德维克斯勒. PCR技术实验指南. 第1版. 北京: 科学出版社 1998; 201-261. |
| 9. | 蔡绍晖, 杜军, 陈新年, 黄宁, 长濑文彦, 长谷川高明, 王伯瑶. C端带Myc和多聚组氨酸双标记的重组人 b-防御素-2在COS-7细胞的转染表达. 生物医学工程学杂志. 2003;20:255-259. |
| 10. | J.萨姆布鲁克, E.F.弗里奇, T.曼尼阿蒂斯. 分子克隆实验指南. 第2版. 北京: 科学出版社 1992; 888-897. |
| 13. | Bai XD, Liu XH, Tong QY. Intestinal colonization with Candida albicans and mucosal immunity. World J Gastroenterol. 2004;10:2124-2126. [PubMed] [DOI] |
| 15. | Johansen FE, Natvig Norderhaug I, Roe M, Sandlie I, Br-andtzaeg P. Recombinant expression of polymeric IgA: incor-poration of J chain and secretory component of human origin. Eur J Immunol. 1999;29:1701-1708. [PubMed] [DOI] |
| 16. | O'Boyle CJ, MacFie J, Mitchell CJ, Johnstone D, Sagar PM, Sedman PC. Microbiology of bacterial translocation in humans. Gut. 1998;42:29-35. [PubMed] [DOI] |
| 17. | Berg RD. Bacterial translocation from the gastrointestinal tract. Adv Exp Med Biol. 1999;473:11-30. [PubMed] [DOI] |
| 18. | Wells CL, VandeWesterlo EM, Jechorek RP, Erlandsen SL. Effect of hypoxia on enterocyte endocytosis of enteric bacteria. Crit Care Med. 1996;24:985-991. [PubMed] [DOI] |
| 23. | Mackewicz CE, Yuan J, Tran P, Diaz L, Mack E, Selsted ME, Levy JA. alpha-Defensins can have anti-HIV activity but are not CD8 cell anti-HIV factors. AIDS. 2003;17:F23-32. [PubMed] [DOI] |
| 24. | Chang TL, Francois F, Mosoian A, Klotman ME. CAF-mediated human immunodeficiency virus (HIV) type 1 transcriptional inhibition is distinct from alpha-defensin-1 HIV inhibition. J Virol. 2003;77:6777-6784. [PubMed] [DOI] |
| 25. | Mallow EB, Harris A, Salzman N, Russell JP, DeBerardinis RJ, Ruchelli E, Bevins CL. Human enteric defensins. Gene structure and developmental expression. J Biol Chem. 1996;271:4038-4045. [PubMed] [DOI] |
| 27. | Cole AM, Lehrer RI. Minidefensins: antimicrobial peptides with activity against HIV-1. Curr Pharm Des. 2003;9:1463-1473. [PubMed] [DOI] |
| 30. | Lohner K, Latal A, Lehrer RI, Ganz T. Differential scanning microcalorimetry indicates that human defensin, HNP-2, interacts specifically with biomembrane mimetic systems. Biochemistry. 1997;36:1525-1531. [PubMed] [DOI] |