修回日期: 2004-09-17
接受日期: 2004-10-11
在线出版日期: 2005-01-15
目的: 研究肝细胞癌(HCC)中端粒酶逆转录酶基因hTERT表达, 探讨其在HCC发生、发展及预后复发中的意义. 探讨抗端粒酶在肝细胞癌治疗中的意义.
方法: 采用免疫组化法检测42例HCC组织中hTERT的表达, 并对hTERT与临床病理特征的关系进行分析. 将反义hTR真核表达载体经脂质体介导转染人肝癌细胞系HepG2, 体外培养及接种裸鼠观察其基因转染细胞的细胞周期、超微结构变化及致瘤性.
结果: HCC中hTERT基因阳性率分别为71.4%(30/42); hTERT与在正常肝脏组织中阳性表达率0%相比, 有显著性差异(P<0.01). hTERT在I, II和Ⅲ级HCC中的表达率分别为40.0%(4/10), 70.0%(14/20), 100%(12/12). I与Ⅲ级、II与Ⅲ级比较差异显著(P<0.05). hTERT阳性表达率与患者复发有显著相关性(P<0.05). 形态学观察, 转染后HepG2细胞出现典型的凋亡现象. FCM检测发现G1期前出现凋亡峰. 在裸鼠皮下的致瘤性明显降低. 荷瘤鼠存活时间延长.
结论: hTERT表达异常可能与肝脏肿瘤的发生、发展有关. 检测hTERT表达可作为预测肝脏肿瘤预后复发的潜在指标. 提示HCC是由多基因参与的疾病. 转染端粒酶反义RNA能抑制肝癌HepG2细胞的恶性表型, 促进其凋亡.
引文著录: 张东, 李开宗, 窦科峰, 宋振顺, 赵青川. 端粒酶逆转录酶基因hTERT在肝细胞癌中的表达及端粒酶反义基因对人肝癌细胞HepG2细胞凋亡的影响. 世界华人消化杂志 2005; 13(2): 175-179
Revised: September 17, 2004
Accepted: October 11, 2004
Published online: January 15, 2005
AIM: To examine the expression of human telomerase reverse transcriptase (hTERT) gene in human hepatocellular cancer (HCC), to investigate its relevance with the carcinogenesis, development and recurrence of HCC, and to explore the potential of antisense RNA of human telemerase (hTR) gene in the treatment of HCC.
METHODS: Immunohistochemistry was used to detect the expression of hTERT protein in 42 specimens of HCC. The relationship between hTERT expression and the clinical and pathological characteristics was analyzed. HepG2 cell line was transfected with antisense hTR expression vector (pBBS-hTR) with lipofectin. The transfected cells were cultured in vitro and then inoculated into nude mice. The cell cycle, ultrastructure and tumorigenicity of the transfected cells were examined.
RESULTS: The positive rate of hTERT gene expression in HCC was significantly higher (30/42) than that in normal liver tissues (71.4% vs 0%, P < 0.01), and the positive rates were also significantly different between HCC with pathological grades I (4/10), II(14/20) and III(12/12) (40.0% vs 70.0% vs 100%, respectively, P < 0.05). The expression of hTERT was positively correlated to the recurrence of patients (P < 0.05). The transfected cells manifested typical apoptotic morphology, and the apoptotic peak appeared before G1 phase of cell cycle. Tumorigenesis of the transfected cells in nude mice was significantly inhibited. The survival time of nude mice inoculated with transfected cells was markedly prolonged, in comparison with that of control mice.
CONCLUSION: The aberrant expression of hTERT gene may be related to the pathogenesis and progression of HCC. The highly expressed hTERT gene may be regarded as a marker for the recurrence of HCC. The growth of HepG2 cells can be effectively inhibited and the apoptosis can be promoted by transfection of antisense telomerase RNA.
- Citation: Zhang D, Li KZ, Dou KF, Song ZS, Zhao QC. Expression of human telomerase reverse transcriptase gene in hepatocellular carcinoma and effect of antisense telomerase gene on apoptosis of hepatocellular cancer cell line HepG2. Shijie Huaren Xiaohua Zazhi 2005; 13(2): 175-179
- URL: https://www.wjgnet.com/1009-3079/full/v13/i2/175.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i2.175
癌细胞永生化是肿瘤细胞区别于正常细胞的重要特征之一. 肿瘤细胞永生化的"端粒-端粒酶"假说已被越来越多的实验所证实. 端粒酶是目前发现的一个广谱肿瘤标志物, 80%以上的肿瘤有端粒酶的表达. 体外实验发现野生型P53可抑制端粒酶活性[1], 病理标本检测却得出两种相反的结果[2-3]. 人类端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)是新近克隆的端粒酶催化亚单位, 是端粒酶活性的限速因素, 在端粒酶阳性的肿瘤中常见hTERT高表达[4-16]. 研究报道大多数肝细胞肝癌(HCC)中可检测到hTERT表达, 但其阳性定位及调控机制尚不十分清楚. 端粒酶在维持肿瘤的增生中起着极为重要的作用, 这使人们对抑制端粒酶的肿瘤治疗产生了浓厚的兴趣. 端粒酶是恶性肿瘤细胞无限增生的重要分子基础, 他已成为新的肿瘤标志物及肿瘤治疗的新靶点, 抑制端粒酶已成为治疗肿瘤的新策略[17-23]. 设计以端粒酶为靶点来抑制癌细胞的端粒酶活性, 阻止端粒继续延长, 可使癌细胞重获致死性[24], 同时利用端粒酶在癌细胞和正常组织中的表达差异又可减少端粒酶抑制剂对机体的毒副作用. 所以, 利用反义核酸抑制端粒酶活性在抑制肿瘤的生长中可能具有较强的特异性和潜在的应用价值. 为探讨hTERT基因在肝脏肿瘤形成中的作用以及端粒酶在肝细胞癌治疗中的意义, 我们采用免疫组化法检测42例HCC组织中hTERT基因的表达并采用脂质体介导的基因转染方法, 将端粒酶反义RNA导入肝癌细胞系HepG2中, 以探讨其对肝癌HepG2细胞增生的影响.
收集第四军医大学西京医院肝胆外科手术切除及活检肝癌标本42例, 其中, 男28例, 女14例, 平均年龄58.6(52-68岁). 常规固定, 石蜡包埋, 制成5 μm厚连续切片, HE染色复查证实诊断, 均获得随访. 病理分级按WHO分级标准: Ⅰ级10例, Ⅱ级20例, Ⅲ级12例. 另选5例正常肝组织取自手术切除肝血管瘤远离部分, 作为对照. 兔抗人hTERT多克隆抗体(美国Santa Cruz公司). S-P试剂盒(北京中山生物技术公司). pBBS212-hTR质粒由美国Geron Corporation, Villeponteau博士惠赠, 该质粒由一个200 bp含端粒酶RNA模板序列的TRC3反义基因片段插入至pBBS212载体的EcoRⅠ酶切位点而构建, 在mpsv启动子控制下表达反义hTR[1], 潮霉素(hygromycin)为Sigma产品. 大肠杆菌JM109由第四军医大学生化教研室惠赠. 核酸内切酶购自Promega, 脂质体转染试剂盒购自GIBICO. HepG2细胞由第四军医大学病理教研室保存.
1.2.1 链霉素亲生物素-过氧化物酶法染色: 常规微波抗原修复, 染色步骤按说明书进行. 阴性对照为PBS代替一抗的空白对照和正常兔血清替代一抗的替代对照, 正常对照为正常肝脏组织. 细胞无棕色反应或背景同空白对照者为阴性(-); 细胞呈清晰棕色反应者为阳性, 根据阳性肿瘤细胞所占比例及表达强度分为: (+)细胞呈淡棕黄色颗粒或阳性细胞率<25%者; (++)细胞呈棕黄色颗粒或阳性细胞率于25-50%之间者; (+++)细胞呈深棕黄色颗粒或阳性细胞率>50%者.
1.2.2 pBBS212-hTR质粒转染HepG2细胞: (1)pBBS212-hTR质粒的扩增提取: 按常规方法进行, 将pBBS212-hTR质粒转化JM109大肠杆菌, 扩增提取质粒, 经核酸内切酶EcoRⅠ酶切后, 电泳鉴定质粒片段大小正确. (2)pBBS212-hTR质粒转染HepG2细胞: 把处于对数生长期的HepG2细胞分为三组: 对照组HepG2细胞、空载体组HepG2/pBBS212细胞和实验组HepG2/pBBS212-hTR细胞, 转染方法按脂质体转染试剂盒说明书操作步骤进行, 培养48 h后传代加入含HyR350 mg/L的培养液筛选抗性细胞. 继续培养2 wk后可见细胞克隆形成.
1.2.3 细胞周期分析: 收集不同处理的HepG2细胞, 750 mL/L乙醇固定, 检测前离心去乙醇, 加入250 mg/LPI(碘化丙啶)0.2 mL, 暗处放置30 min, 上机检测. 测定细胞周期, 观察是否存在细胞凋亡.
1.2.4 透射电镜观察: 1×106细胞经0.01 mol/L pH7.4PBS洗两次, 用3%戊二醛固定, 锇酸后固定, 脱水, 包埋, 超薄切片, 醋酸双氧铀和柠檬酸铅染色, 电镜下观察不同处理的细胞发生凋亡.
1.2.5 裸鼠皮下移植瘤实验: 将BALB/c-nu裸鼠随机分成3组, 即转染pBBS-hTR组及空载体组和未转染组, 胰酶消化, PBS洗涤3次后离心, 取各组细胞0.2 mL, 含活细胞数为5×106, 接种于裸鼠右侧腹部皮下. 连续观察3 wk, 记录裸鼠皮下成瘤及一般情况. 按以下公式计算肿瘤近似体积(cm3) = π/6(长纯泶高). 并进一步计算瘤体抑制率(瘤体抑制率 = [(对照组瘤体净增体积-实验组瘤体净增体积)/对照组瘤体净增体积] ×100%).
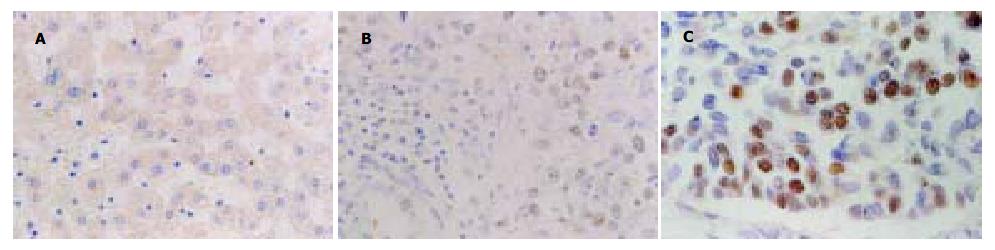
hTERT阳性着色主要定位于肿瘤细胞的胞核内, 呈棕黄色细颗粒状, 其阳性细胞呈局灶性和弥漫性分布, 少数病例可见细胞质着色. 42例HCC中, hTERT基因30例阳性表达, 阳性率为71.4%. 5例正常肝脏组织中hTERT基因均阴性表达, 二者比较有显著差异(P<0.01, 图1).
hTERT基因在Ⅰ, Ⅱ和Ⅲ级肿瘤中的异常表达率分别为40.0%(4/10), 70.0(14/20)和100%(12/12), 随着HCC分级增加, hTERT基因阳性表达率及表达强度均增加, Ⅰ与Ⅲ级, Ⅱ与Ⅲ级比较差异显著(P<0.05). 在30例复发病例中, hTERT基因阳性25例, 阳性率83.3%. 而未复发的病例中, hTERT基因阳性5例, 阳性率41.7%. 复发病例hTERT基因阳性率明显高于未复发病例, 有显著差异(P<0.05).
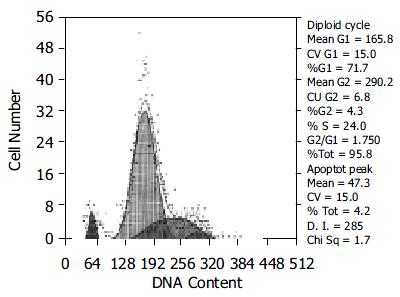
转染反义端粒酶RNA的HepG2细胞生长缓慢, 贴壁性能差, 易于消化, 且早期有较多的细胞脱离瓶壁漂浮死亡, 而在同样培养条件下的对照组细胞生长良好. 收集转染反义端粒酶RNA基因稳定表达后的第四代细胞作FCM检测, 结果显示在G1期前有一亚二倍体的凋亡峰存在, 凋亡细胞占全部细胞的4.2%(图2). 对照组细胞则未见有凋亡峰出现, 细胞周期结果(表1).
| 分组 | G1(%) | G2(%) | S(%) |
| 对照组 | 55.3±1.7 | 15.7±1.0 | 29.1±1.6 |
| 空载体组 | 60.2±1.2 | 7.1±0.6 | 32.7±1.8 |
| 实验组 | 71.7±1.1 | 4.3±0.4 | 24.0±1.9 |
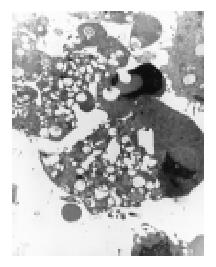
转染反义端粒酶RNA的HepG2细胞体积缩小, 可见典型的细胞凋亡特征: 核膜完整, 染色质凝集并边集于核膜, 细胞器如内质网、线粒体等结构完整, 未见破坏, 胞质内可见有空泡形成, 表现出典型的细胞凋亡的形态(图3). 对照组细胞的超微结构基本正常, 未见有细胞凋亡发生.
端粒是染色体末端DNA多个重复序列与特异性结合蛋白的复合体, 端粒长度反映细胞分裂增生能力. 端粒酶是由端粒RNA和端粒酶蛋白组成的一种特殊逆转录酶, 能以自身RNA为模板合成端粒序列以稳定端粒长度使细胞获得永生. 端粒的长短和稳定性决定了细胞寿命, 并与细胞衰老和癌变密切相关. 随着细胞分裂, 当端粒缩短到一定程度时, 少数细胞中的端粒酶被激活, 使端粒功能得以恢复, 染色体得以稳定从而获得永生. 由此发展为具有无限增生能力的肿瘤细胞, 细胞"临界点"上游的顺式调控元件和端粒酶的激活是肿瘤细胞持续生长的重要因素. hTERT是近年来发现的端粒酶催化蛋白亚基. 他的作用是在DNA复制期(S期)的线性染色体末端添加片段, 使细胞无限增生导致肿瘤发生和细胞永生化[25]. hTERT是人类端粒酶的活性中心, 其表达是端粒酶活化的必需前提[26]. 端粒酶活化是细胞永生化或癌变的重要条件, 端粒酶在各系统恶性肿瘤中都有较高的表达率. 已有研究表明: 多数肝细胞肝癌端粒酶为阳性, 因此认为, 端粒酶活化可能发生在肿瘤的早期阶段, 并与肿瘤的恶性进程密切相关[27].
本研究初步证实, hTERT基因在肝细胞肝癌中有高表达, 阳性率为71.4%, 而在正常肝脏组织中无阳性表达二者比较有显著差异(P<0.05). 说明hTERT基因表达异常可能激活端粒酶, 使正常肝细胞的端粒长度不再缩短, 从而参与肝细胞癌发生. hTERT基因分布随肝癌的病理分级的增加而增加, 且有显著性差异(P<0.05). hTERT表达的强弱与肿瘤细胞分级有关. 表明hTERT基因异常表达可能在肝癌形成中具有重要的作用. 我们还发现有复发倾向患者的hTERT基因表达显著高于未复发者(P<0.05). 提示hTERT基因异常表达可作为预测肝脏肿瘤预后复发的潜在指标.
端粒是位于真核细胞染色体末端的具有特殊功能的DNA帽, 对维持染色体的完整性和稳定性有重要作用. 端粒随细胞分裂而进行性缩短, 最终导致细胞衰
老或凋亡. 端粒酶是催化合成并维持端粒一定序列的一种核糖核蛋白[28], 他能以自身的RNA为模板合成端粒, 以弥补复制造成的端粒缩短. 端粒酶RNA是端粒酶的必要组成部分, 其基因序列含有与端粒DNA互补的模板区序列及锚定区序列, 针对该模板区序列设计反义核苷酸可抑制端粒酶合成端粒DNA. Norton et al[29]和Wan et al[30]分别设计了针对hTR模板区不同长度的反义肽核苷酸(PNA)和锤头状核酶(TeloRZ), 实验结果均表现出对转染肿瘤细胞提取物中端粒酶活性的抑制. 反义技术作为基因封条能够特异性封闭或抑制其靶基因的表达, 这为利用反义技术抑制端粒酶活性、探索肿瘤治疗的新途经提供了条件.
采用以PCR为基础的TRAP法, 人们已经检测发现绝大多数肿瘤细胞都呈端粒酶阳性, 而在正常人体组织中却无表达(人生殖细胞、一些淋巴细胞和造血干细胞除外). 体细胞每分裂一次, 端粒将缩短50-200 bp, 当缩短到一定程度, 将导致染色体不稳定, 细胞死亡. 故端粒酶的活化是细胞获得无限增生能力, 成为不死化细胞的关键因素. 恶性肿瘤主要表现为细胞失去控制, 无限制增长, 其端粒活性普遍增高. 所以, 从理论上讲, 如果使恶性肿瘤端粒酶的活化受到抑制, 便能从根本上控制和治愈恶性肿瘤.
我们采用hTR真核表达载体转染HepG2细胞, 不仅在体外培养中观察到基因转染肝癌细胞染色质边集、浓缩、出现凋亡小体和凋亡峰等改变, 以及细胞悬浮和死亡现象增多, 而且对基因转染细胞接种裸鼠移植瘤观察也发现致瘤性明显降低. 表明外源性人hTR既可封闭端粒合成模板的逆转录过程, 又可阻止肝癌细胞的增生和在动物体内的生长. 而且, 这种抗瘤作用可能主要是通过反义hTR诱导肝癌细胞凋亡而引起的, 表明反义hTR将是一种很有发展前景的抗癌新药.
编辑: 潘伯荣 审读: 张海宁
| 1. | Kusumoto M, Ogawa T, Mizumoto K, Ueno H, Niiyama H, Sato N, Nakamura M, Tanaka M. Adenovirus-mediated p53 gene transduction inhibits telomerase activity independent of its effects on cell cycle arrest and apoptosis in human pancreatic cancer cells. Clin Cancer Res. 1999;5:2140-2147. [PubMed] |
| 2. | Brown T, Aldous W, Lance R, Blaser J, Baker T, Williard W. The association between telomerase, P53, and clinical staging in colorectal cancer. Am J Surg. 1998;175:364-366. [DOI] |
| 3. | Wu X, Kemp B, Amos CI, Honn SE, Zhang W, Walsh GL, Spitz MR. Associations among telomerase activity, p53 protein overexpression, and genetic instability in lung cancer. Br J Cancer. 1999;80:453-457. [PubMed] [DOI] |
| 4. | Liu SX, Sun WS, Cao YL, Ma CH, Han LH, Zhang LN, Wang ZG, Zhu FL. Antisense oligonucleotide targeting at the initiator of hTERT arrests growth of hepatoma cells. World J Gastroenterol. 2004;10:366-370. [PubMed] |
| 5. | Chen CJ, Kyo S, Liu YC, Cheng YL, Hsieh CB, Chan DC, Yu JC, Harn HJ. Modulation of human telomerase reverse transcriptase in hepatocellular carcinoma. World J Gastroenterol. 2004;10:638-642. [PubMed] [DOI] |
| 6. | Wang W, Luo HS, Yu BP. Expression of NF-kappaB and human telomerase reverse transcriptase in gastric cancer and precancerous lesions. World J Gastroenterol. 2004;10:177-181. [PubMed] |
| 7. | Hao ZM, Luo JY, Cheng J, Wang QY, Yang GX. Design of a ribozyme targeting human telomerase reverse transcriptase and cloning of it's gene. World J Gastroenterol. 2003;9:104-107. [PubMed] [DOI] |
| 8. | Lan J, Xiong YY, Lin YX, Wang BC, Gong LL, Xu HS, Guo GS. Helicobacter pylori infection generated gastric cancer through p53-Rb tumor-suppressor system mutation and telomerase reactivation. World J Gastroenterol. 2003;9:54-58. [PubMed] [DOI] |
| 9. | Du QY, Wang XB, Chen XJ, Zheng W, Wang SQ. Antitumor mechanism of antisense cantide targeting human telomerase reverse transcriptase. World J Gastroenterol. 2003;9:2030-2035. [PubMed] [DOI] |
| 10. | Jiang YA, Luo HS, Zhang YY, Fan LF, Jiang CQ, Chen WJ. Telomerase activity and cell apoptosis in colon cancer cell by human telomerase reverse transcriptase gene antisense oligodeoxynucleotide. World J Gastroenterol. 2003;9:1981-1984. [PubMed] [DOI] |
| 11. | Li C, Wu MY, Liang YR, Wu XY. Correlation between expression of human telomerase subunits and telomerase activity in esophageal squamous cell carcinoma. World J Gastroenterol. 2003;9:2395-2399. [PubMed] |
| 12. | Shen ZY, Xu LY, Li EM, Cai WJ, Chen MH, Shen J, Zeng Y. Telomere and telomerase in the initial stage of immortalization of esophageal epithelial cell. World J Gastroenterol. 2002;8:357-362. [PubMed] |
| 13. | Zhang RG, Guo LX, Wang XW, Xie H. Telomerase inhibition and telomere loss in BEL-7404 human hepatoma cells treated with doxorubicin. World J Gastroenterol. 2002;8:827-831. [PubMed] [DOI] |
| 14. | Yao XX, Yin L, Sun ZC. The expression of hTERT mRNA and cellular immunity in gastric cancer and precancerosis. World J Gastroenterol. 2002;8:586-590. [PubMed] [DOI] |
| 15. | Meyerson M, Counter CM, Eaton EN, Ellisen LW, Steiner P, Caddle SD, Ziangra L, Beijersbergen RL, Davidoff MJ, Liu QY. hEST2, the putative human telomerase catalytic subunit gene, is up-regulated in tumor cells and during immortalization. Cell. 1997;90:785-795. [DOI] |
| 16. | Counter CM, Meyerson M, Eaton EN, Ellisen LW, Caddle SD, Haber DA, Weinberg RA. Telomerase activity is restored in human cells by ectopic expression of hTERT (hEST2), the catalytic subunit of telomerase. Oncogene. 1998;16:1217-1222. [PubMed] [DOI] |
| 24. | Feng J, Funk WD, Wang SS, Weinrich SL, Avilion AA, Chiu CP, Adams RR, Chang E, Allsopp RC, Yu J. The RNA component of human telomerase. Science. 1995;269:1236-1241. [DOI] |
| 25. | Zhang LP, Jiang JK, Tan RA, Liu XS, Zhang Y, Xu XR, Liu BZ, He YJ, Kang GF. Effects of matrine on telomerase activity and cell cycle in K562 cell. Chin J oncol. 1998;20:328-329. |
| 26. | Yasui W, Tahara E, Tahara H, Fujimoto J, Naka K, Nakayama J, Ishikawa F, Ide T. Immunohistochemical detection of human telomerase reverse transcriptase in normal muscosa and precancerous leisions of the stomach. Jpn J Cancer Res. 1999;90:589-595. [DOI] |
| 27. | Maruyama Y, Hanai H, Fujita M, Kaneko E. Telomere length and telomerase activity in carcinogenesis of the stomach. Jpn J Clin Oncol. 1999;27:216-220. [DOI] |
| 29. | Norton JC, Piatyszek MA, Wright WE, Shay JW, Corey DR. Inhibition of human telomerase activity by peptide nucleic acids. Nat Biotechnol. 1996;14:615-619. [PubMed] [DOI] |
| 30. | Wan MS, Fell PL, Akhtar S. Synthetic 2'-O-methyl-modified hammerhead ribozymes targeted to the RNA component of telomerase as sequence-specific inhibitors of telomerase activity. Antisense Nucleic Acid Drug Dev. 1998;8:309-317. [PubMed] [DOI] |