修回日期: 2005-07-20
接受日期: 2005-07-28
在线出版日期: 2005-09-15
目的: 探讨幽门螺杆菌(Helicobacter pylori, H. pylori)cagA菌株感染及环氧合酶-2 (cyclooxygenase-2, COX2)表达在胃癌发生中的作用及两者的关系.
方法: 采用原位聚合酶链反应(PCR)技术及免疫组织化学技术检测56例胃癌手术标本cagA基因及COX2蛋白表达情况.
结果: 胃癌组织H. pylori cagA菌株感染率为55.4%, COX2在胃癌组织中表达率为71.4%. COX2表达水平在Ⅲ-Ⅳ期胃癌组显著高于Ⅰ-Ⅱ期胃癌组(14/30 vs 5/26, P<0.05); 有淋巴结转移组明显高于无淋巴结转移组(4/19 vs 15/37, P<0.01); H. pylori cagA菌株感染与TNM分期及淋巴结转移无关(P>0.05). COX2表达水平在H. pylori cagA阳性组显著高于H. pylori cagA 阴性组(15/31 vs 4/25, P<0.05).
结论: H. pylori cagA菌株感染与胃癌的恶性进展无关; COX2的表达参与胃癌的发生及恶性进展. H. pylori cagA菌株感染能上调胃癌组织COX2的表达.
引文著录: 张勇, 蒋明德, 曾维政, 徐辉, 王钊, 陈虹彬. 胃癌组织环氧合酶-2表达与幽门螺杆菌cagA+菌株感染. 世界华人消化杂志 2005; 13(17): 2141-2144
Revised: July 20, 2005
Accepted: July 28, 2005
Published online: September 15, 2005
AIM: To explore the relations of cagA+Helicobacter pylori infection with the expression of cyclooxygenase-2 (COX2) in human gastric carcinogenesis.
METHODS: In situ polymerase chain reaction (PCR) was used to detect the expression of H. pylori cagA gene, and immunohistochemical technique was used to detect the expression of COX2 in 56 patients with gastric carcinoma.
RESULTS: The rates of cagA+H. pylori infection and COX2 expression were 55.4% and 71.4%, respectively, in gastric carcinoma. The level of COX2 expression was significantly higher in the gastric carcinoma of Ⅲ-Ⅳ stage than Ⅰ-Ⅱ stage (14/30 vs 5/26, P <0.05), and was also higher in gastric carcinoma with lymph node metastasis than that without lymph node metastasis (4/19 vs 15/37,P <0.01). CagA+H. pylori infection was not correlated with TNM stage and lymph node metastasis in gastric carcinoma (P >0.05). The level of COX2 expression was significantly higher in cagA+H. pylori group than that in cagA-H. pylori group (15/31 vs 4/25, P <0.05).
CONCLUSION: CagA+H. pylori infection is not related with the malignant progression of gastric carcinoma, but COX2 expression is involved in the carcinogenesis and malignant progression of gastric carcinoma. CagA+H. pylori infection up-regulates the expression of COX2 in gastric cancer.
- Citation: Zhang Y, Jiang MD, Zeng WZ, Xu H, Wang Z, Chen HB. Relationship between expression of cyclooxygenase-2 and cagA+ Helicobacter pylori infection in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(17): 2141-2144
- URL: https://www.wjgnet.com/1009-3079/full/v13/i17/2141.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i17.2141
在胃癌发生的诸多因素中, 幽门螺杆菌(Helicobacter pylori, H. pylori)被世界卫生组织国际癌症研究机构列为一类致癌因子. 而含cagA基因的H. pylori菌株为高毒菌株, 与胃癌的关系可能更为密切[1], 但其确切的致癌机制仍不清楚. 环氧合酶-2(cyclooxygenase-2, COX2)是与肿瘤发生密切相关的前列腺素合成酶之一, 许多类型的炎症细胞因子、各种促癌因素等均可诱导体内组织产生COX2.H. pylori cagA菌株能引起胃黏膜的炎症反应, 其能否诱导COX2的表达及两者在胃癌发生、发展中的关系值得探讨.我们采用原位聚合酶链反应(PCR)及免疫组织化学技术检测胃癌组织中H. pylori cagA基因及COX2表达情况, 探讨H. pylori cagA菌株感染、COX2表达在胃癌发生中的作用及其相互关系, 为胃癌的防治提供理论依据.
选择我院1998年以来手术切除胃癌胃组织标本56例. 诊断均经病理检查证实.其中男31例, 女25例, 年龄32-69岁, 平均50.8岁. 有淋巴结转移37例, 无淋巴结转移19例. TNM分期: 参照1978年制定的我国胃癌TNM分期法, Ⅰ期 11例, Ⅱ期15例, Ⅲ期 17例, Ⅳ期13例.
1.2.1 原位PCR扩增检测cagA基因感染率: H. pylori cagA基因引物序列由中国军事医学科学院二所合成.引物序列: 引物1: 5'-ATAATGCTAAATTAGACAACTTGAGCGA-3'; 引物2: 5'-TTAGAATAATCAACAAACATCACGCCAT-3'. 常规石蜡切片, 二甲苯脱蜡、梯度酒精水化, 0.2 mmol/L HCl酸化, 1 mg/L蛋白酶K消化, RNA酶消化, 40 g/L多聚甲醛固定; PCR扩增: 在10 µL/张切片的反应液中,含4 mmol/L MgCl2、400 µmol/L dNTPs(其中1/4 dUTP由Bio-11-dUTP取代)、1UTaq酶、cagA基因引物各2 mg/L, 加盖硅化玻片, 指甲油密封, 热循环条件: 94℃预变性5 min; 94℃ 1 min, 60℃ 1 min, 72℃ 1 min, 35个循环; 72℃ 10 min延伸.检测: 30 g/L BSA封闭1 h, AV-AP 37℃ 30 min, BCIP和NBT显色, 核固红复染, 紫蓝色颗粒为阳性. 分别以无Bio-11-dUTP,无Taq酶及无引物条件下作为阴性对照.
1.2.2 免疫组织化学检测环氧合酶蛋白表达: 常规石蜡切片; 10 mL/L H2O2甲醇孵育15 min, 山羊血清封闭15 min; 滴加1∶50稀释的COX2一抗, 37℃孵育2 h, 滴加生物素化二抗(1∶200), 37℃ 30 min; 滴加辣根过氧化物酶标记的卵白素, 37℃ 30 min; DAB显色; 苏木素复染; 脱水透明、中性树脂封片.同时用PBS代替一抗作为空白对照, 以已知阳性反应的大肠癌组织作阳性对照.光镜下(×400)随机选取10个视野, 每个视野计数100个细胞, 取其均值, 无表达或阳性细胞数5%为表达阴性(-) , <30%为弱阳性(+) , 30-50%为阳性(++),>50%为强阳性(+++).
统计学处理 各组H. pylori cagA感染率用百分数表示, 进行χ2检验, COX2用等级资料表示, 进行秩和检验, P<0.05为差异有显著意义.
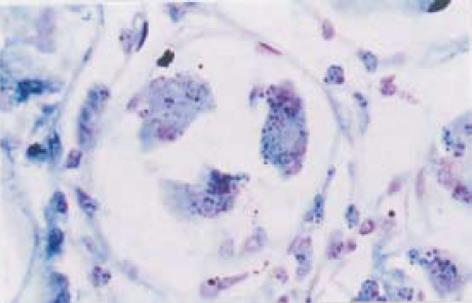
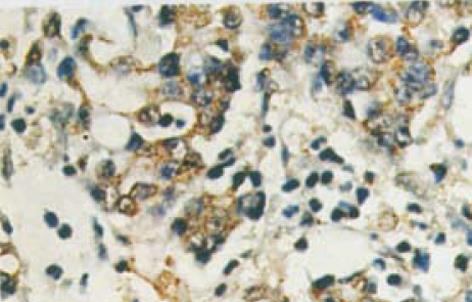
H. pylori cagA基因在胃癌组织中表达率为55.4%, COX2在胃癌组织中表达率为71.4%. COX2表达水平在Ⅲ-Ⅳ期胃癌组显著高于Ⅰ-Ⅱ期胃癌组(P<0.05); 有淋巴结转移组明显高于无淋巴结转移组(P<0.01), 提示COX2表达水平与TNM分期及淋巴结转移有关. H. pylori cagA基因表达水平与TNM分期及淋巴结转移无关(P>0.05) (表1). cagA基因阳性信号为紫蓝色颗粒, cagA基因分布于癌组织及癌旁组织胞浆、胃腺腔、黏膜上皮细胞表面(图1), 且以癌旁组织表达为主.COX2阳性信号为棕黄色颗粒, 主要表达于肿瘤细胞胞浆及核膜, 间质细胞少量表达(图2).
流行病学资料提示长期H. pylori感染可导致胃黏膜萎缩、肠上皮化生及异型增生, 最终形成胃癌[2]. cagA基因株为高毒菌株, 与胃癌及癌前疾病关系更为密切[3-4].Kuiper et al[5]发现血清cagA抗体阳性患者萎缩性胃炎发生率为62.0%, 阴性组为32.0%, 差异显著.Parsonnet et al[6]通过对14a前库存血液作H. pylori cagA抗体的检测及随访, 发现cagA阳性感染者与H. pylori阴性者相比, 发生胃癌的危险性明显增高(OR值约为2.2). 我们在以往的研究[7]显示cagA基因在癌前病变中有较高的表达率, 且能引起胃黏膜更为明显的炎症反应, 导致胃黏膜上皮细胞的损伤. 提示cagA菌株感染是胃癌发生的一个早期事件. 其引起胃癌发生的机制尚不清楚, 可能与以下因素有关, cagA菌株感染后胃黏膜壁细胞损害, 导致胃酸分泌减少, 胃内细菌过度生长,促使硝酸盐降解为亚硝酸盐和亚硝胺等致癌物[1]; 激活炎症反应中多种细胞因子、自由基和一氧化氮(NO)的释放, 导致DNA损伤及刺激细胞增生; cagA蛋白可能促进细胞凋亡抑制基因Bcl-2表达, 诱导抑癌基因p53突变,从而使细胞增生和凋亡失平衡, 最终导致胃癌的发生[8].其与进展期胃癌的关系如何?该研究结果提示cagA基因在Ⅲ-Ⅳ期、Ⅰ-Ⅱ期胃癌组中均表达; 有、无淋巴结转移组无显著差异,且cagA基因在胃癌组织中的表达以癌旁组织为主, 推测随着疾病由慢性胃炎→萎缩→肠化→异型增生→胃癌的发展, H. pylori生存的局部环境发生变化, 不利于细菌生长, 使H. pylori难以定植, 或导致H. pylori死亡, H. pylori的致病作用逐渐减小, 故H. pylori cagA菌株感染与胃癌的恶性进展无关.
许多研究显示COX2在胃癌前病变及胃癌组织中表达增加.Lim et al[9]检测胃癌组织标本104例, 发现70.2%的病例有COX2蛋白的高表达, 而正常黏膜没有COX2蛋白表达. 汪步海 et al[10]对内镜诊断并手术证实的36例H. pylori阳性胃癌患者的癌组织及其邻近组织标本中COX2的表达状况进行了回顾性分析, 免疫组化染色显示, COX2蛋白在肠上皮化生、异型增生和胃癌中阳性率分别为72.2%(13/18)、77.8%(14/18)和83.3%(15/18),三组间无显著性差异. 但也有研究[11]认为, 随着癌前病变的进展COX2蛋白表达递增. 说明COX2的过表达是胃癌发生的早期事件, 其与胃癌的恶性进展关系如何? 该研究结论显示COX2在胃癌组织中表达率为71.4%, 且COX2表达水平在Ⅲ-Ⅳ期胃癌组显著高于Ⅰ-Ⅱ期胃癌组(P<0.05)、有淋巴结转移组明显高于无淋巴结转移组(P<0.01), 提示COX2表达水平与TNM分期及淋巴结转移相关. 说明COX2不仅与早期胃癌的发生有关, 同时与胃癌的恶性进展密切相关, 在胃癌的发生﹑ 发展中起着重要的作用. 其机制可能经多种途径[12,13]如促进细胞增生、抑制细胞凋亡、调节肿瘤新生血管形成和增加癌细胞的侵袭性等而发挥致癌和促癌作用.
cagA菌株感染及COX2表达两者在胃癌变中的作用是两个独立的因素或是相互关联尚不清楚. 近来体外研究[14]显示H. pylori能诱导胃黏膜细胞株COX2的表达. 国内陆红 et al[15]研究显示H. pylori感染可使慢性胃炎患者胃黏膜COX2表达增加, 根除H. pylori后其COX2表达水平下降. H. pylori的高毒菌株-cagA阳性菌株感染与胃癌中COX2的表达关系如何值得探讨. 我们的结果显示COX2表达在cagA阳性组明显高于cagA阴性组, 提示胃癌组织中cagA菌株感染能上调COX2的表达. cagA菌株感染可通过介导COX2的表达在胃癌的发生中起重要作用. cagA菌株诱导COX2表达可能与其引起胃黏膜炎性反应、上皮细胞损伤、刺激生长因子及炎症介质的释放有关. 本组资料显示cagA阴性的胃癌组织中仍有COX2表达, 提示除H. pylori cagA菌株感染之外尚有其他因素及机制参与调节COX2的表达. 因此根除H. pylori和COX2抑制剂是预防和控制胃癌发生的重要途径.
编辑: 王谨辉 审读: 张海宁
| 1. | Farinati F, Cardin R, Russo VM, Busatto G, Franco M, Rugge M. Helicobacter pylori CagA status, mucosal oxidative damage and gastritis phenotype: a potential pathway to cancer? Helicobacter. 2003;8:227-234. [PubMed] [DOI] |
| 2. | Wang J, Chi DS, Kalin GB, Sosinski C, Miller LE, Burja I, Thomas E. Helicobacter pylori infection and oncogene expressions in gastric carcinoma and its precursor lesions. Dig Dis Sci. 2002;47:107-113. [PubMed] [DOI] |
| 3. | 张 沥, 张 玲霞, 张 宁霞, 刘 永国, 阎 小君, 韩 锋产, 侯 瑜. 幽门螺杆菌细胞毒素相关蛋白A与胃癌关系的病例对照研究. 世界华人消化杂志. 2002;10:593-595. [DOI] |
| 4. | 卢 启明, 张 丽萍, 姜 瑞, 张 岫兰, 李 淑兰, 曹 萍, 石 丽清, 陈 翔, 薛 群基. 胃癌高发区人群CagA+幽门螺杆 菌与胃黏膜病变的关系. 世界华人消化杂志. 2005;13:408-410. [DOI] |
| 5. | Kuipers EJ, Perez-Perez GI, Meuwissen SG, Blaser MJ. Helicobacter pylori and atrophic gastritis: importance of the cagA status. J Natl Cancer Inst. 1995;87:1777-1780. [PubMed] [DOI] |
| 6. | Parsonnet J, Friedman GD, Orentreich N, Vogelman H. Risk for gastric cancer in people with CagA positive or CagA negative Helicobacter pylori infection. Gut. 1997;40:297-301. [PubMed] [DOI] |
| 9. | Lim HY, Joo HJ, Choi JH, Yi JW, Yang MS, Cho DY, Kim HS, Nam DK, Lee KB, Kim HC. Increased expression of cyclooxygenase-2 protein in human gastric carcinoma. Clin Cancer Res. 2000;6:519-525. [PubMed] |
| 13. | Kim JM, Kim JS, Jung HC, Song IS, Kim CY. Upregulated cyclooxygenase-2 inhibits apoptosis of human gastric epithelial cells infected with Helicobacter pylori. Dig Dis Sci. 2000;45:2436-2443. [PubMed] [DOI] |
| 14. | Smith GV, Farthing MJ. The effect of ascorbic acid on Helicobacter pylori induced cyclooxygenase 2 expression and prostaglandin E2 production by gastric epithelial cells in vitro. Helicobacter. 2005;10:83-89. [PubMed] [DOI] |