修回日期: 2005-07-01
接受日期: 2005-07-09
在线出版日期: 2005-08-28
目的: 探讨p15INK4B(p15)基因转染对食管鳞癌细胞系EC109细胞增殖的影响.
方法: 根据转染质粒的不同和是否进行质粒转染分为3组: p15转染组, 空载体转染组, 未转染组.应用PCR检测外源性p15基因, Western blot方法检测转染细胞的P15蛋白变化; 流式细胞仪分析细胞周期变化, 应用MTT、集落形成实验、流式细胞仪和透射电镜检测转染外源p15基因对EC109细胞增殖和凋亡的影响.
结果: p15转染细胞存在外源p15基因, 并有P15蛋白高表达; EC109-p15细胞生长速度低于对照细胞EC109-空载体组和未转染组, 集落形成率显著低于对照细胞EC109-空载体组和未转染组(20.8±1.3% vs 54.3±3.2%, 56.8±2.3%, P<0.01); 流式细胞仪观察到P15蛋白高表达使EC109细胞发生G1/S阻滞, G1期细胞比例显著高于空载体组和未转染组(62.4±7.1% vs 38.0±5.8%, 34.4±1.0%, P<0.01), S期比例显著低于空载体组和未转染组(21.1±1.3% vs 35.5±2.4%, 36.3±0.7%, P<0.01), 并出现亚G1峰(凋亡峰). 透射电镜亦发现p15转染组发生细胞凋亡.
结论: p15基因转染可以抑制人食管鳞癌细胞系EC109细胞增殖并能诱导其发生细胞凋亡.
引文著录: 张学彦, 刘铁夫, 于旸, 刘伟, 崔希威. p15INK4B基因转染对人食管鳞癌细胞EC109增殖的抑制作用. 世界华人消化杂志 2005; 13(16): 1945-1950
Revised: July 1, 2005
Accepted: July 9, 2005
Published online: August 28, 2005
AIM: To investigate the effect of p15INK4B (p15) gene transfection on the proliferation of esophageal squamous cell carcinoma cell line EC109.
METHODS: The EC109 cells were divided into 3 groups: p15 transfection group, empty plasmid transfection group and non-transfection group. pCDNA3.1(+)-p15 and pCDNA3.1(+)-neo plasmid were transfected into EC109 cells using Lipofectamine2000. The expression of exogenous p15 gene and P15 protein were detected by polymerase chain reaction (PCR) and western blot, respectively. The proliferation and apoptosis of the EC109 cells were examined by MTT, colony formation assay, flow cytometry and transmission electron microscope.
RESULTS: After transfection, p15 gene cDNA was expressed in the cells of p15 transfection group, and P15 protein was expressed at a high level. The cell growth was inhibited, and the colony formation was significantly decreased in EC109-p15 cells as compared with that in the cells of empty plasmid transfection or non-transfection group (20.8±1.3% vs 54.3±3.2%, 56.8±2.3%, P<0.01). EC109-p15 cells arrested at G1/S phase, and the population of the cells in G1 phase was significantly increased as compared with that in the cells of empty plasmid transfection group or Non-transfection group (62.45±7.08% vs 38.02±5.83%, 34.45±1.05%, P<0.01). However, the number of the cells in S phase was significantly decreased (21.12±1.31% vs 35.50±2.38%, 36.30±0.69%, P<0.01), and a Sub G1 peak (apoptosis peak) appeared. Under electron microscope, typical features of apoptosis were observed in EC109-p15 cells.
CONCLUSION: p15 gene transfection can not only inhibit the proliferation of EC109 cells, but also induce the apoptosis of the cells in vitro.
- Citation: Zhang XY, Liu TF, Yu Y, Liu W, Cui XW. Inhibitory effect of p15INK4B gene transfection on proliferation of human esophageal squamous cell carcinoma cell line EC109. Shijie Huaren Xiaohua Zazhi 2005; 13(16): 1945-1950
- URL: https://www.wjgnet.com/1009-3079/full/v13/i16/1945.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i16.1945
p15是近年来发现的细胞周期蛋白依赖性激酶抑制因子(cyclin-dependent kinase inhibitors, CKI)家族中的一个新成员.已经证实p15失活与食管癌发病有关, 他影响CKI级联反应和DNA错配修复过程[1].p15是食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)发生过程中经常失活的靶基因.为探讨恢复p15表达是否有抑制人食管鳞癌细胞增殖的作用, 我们采用脂质体介导的基因转染技术, 将p15转染到人食管鳞癌细胞系EC109中, 以研究其对食管鳞癌细胞生长的影响.
真核表达质粒pCMV5-p15由北京师范大学生命科学学院-教育部细胞增殖与调控重点实验室柳惠图教授惠赠.pCDNA3.1(+)空载体质粒由哈尔滨医科大学附属二院检验科任蕾硕士惠赠.EC109细胞株购自中国科学院上海细胞所.Trizol试剂盒是Gibco公司产品, Taq酶为上海生工公司产品, 逆转录试剂盒、限制性内切酶、转染级质粒中提试剂盒是Promega公司产品.p15小鼠抗人mAb是Neo Markers公司产品, 辣根酶标山羊抗小鼠IgG为北京中杉金桥公司产品.actin beta(ACTB)抗体和Western Blotting发光试剂是Santa Cruz公司产品.脂质体Lipofectamine2000购于Invitrogen公司.T4连接酶是MBI公司产品.凝胶回收试剂盒是上海博亚公司产品.引物由上海生工公司和捷倍思公司合成.上海博亚公司进行质粒测序.人食管癌EC109细胞系在37℃, 50 mL/L CO2饱和湿度条件下, 用含100 mL/L胎牛血清的DMEM高糖培养基培养传代, 取对数生长期细胞进行相关实验.因为pCMV5无真核筛选标志, 故将之克隆到有真核筛选标志新霉素抗性基因(neo)的pCDNA3.1(+)上.设计特异PCR引物序列如下: 上游: 5'-AGCAAGCTTATGCGCGAGGAGAACAA-3', 下游: 5'-AGAGTCTAGATCAGTCCCCCGTGGC-3'.用高保真Taq酶对pCMV-p15进行PCR扩增, PCR产物经琼脂糖凝胶电泳, 凝胶回收试剂盒回收.对此PCR产物和pCDNA3.1(+)空载体进行HindⅢ, XbaⅠ双酶切, 琼脂糖凝胶电泳, 回收酶切产物, 使用T4 DNA连接酶连接p15目的片段和pCDNA3.1(+)载体.将连接产物转化感受态大肠杆菌DH5α, 挑取单克隆, PCR鉴定后用PCDNA3.1(+)载体的测序引物T7测序.
1.2.1 RT-PCR检测EC109细胞p15mRNA表达: 用Trizol试剂盒提取细胞总RNA.逆转录cDNA第一链合成: 反应体系20 μL, 含随机引物0.5 μg, 逆转录酶200 U, RNA 1.0 μg, dNTP 0.5 mmol/L, RNasin 20 U, 37℃ 60 min, 95℃ 5 min.PCR反应: 反应体系25 μL, 含Mg2+ 2.5 mmol/L, dNTP 0.5 mmol/L, cDNA 2 μL, TaqDNA合成酶2 U, 上下游引物各0.4 μmol/L, p15引物(退火58℃, 产物753 bp): 上游5'-CCAGAAG CAATCCAGGCGCG-3', 下游: 5'-CGTTGGCAGCCTTCATCG-3'.β-actin引物(退火57℃, 产物301 bp): 上游5'-TCCTCCTGAGCGCAAGTAC-3', 下游5'-GTCACCT TCACCGTTCCAG-3'.反应35个循环.产物经12 g/L琼脂糖凝胶电泳, 照相.以表达p15的Hela细胞为阳性对照.
1.2.2 基因转染: 根据转染质粒的不同和是否进行质粒转染分为3组, 每组3个样本.p15转染组: 采用Lipofectamine2000脂质体介导转染, 将pCDNA3.1(+)-p15真核表达质粒导入EC109细胞; 空载体转染组: 用pCDNA3.1(+)-neo空载体以上述相同方法转染, 作为阴性对照; 未转染组: 不进行转染的同期培养的EC109细胞, 作为空白对照.转染方法按照Lipofectamine2000说明书进行.采用6孔板转染细胞, 每孔用2 mL无抗生素生长培养基含5×105个细胞制板, 每孔用5 μg DNA, 15 μL Lipofectamine2000.转染48 h后加入G418终浓度为400 mg/L的选择培养基.每2-4 d更换培养基, 4 wk后挑选阳性克隆扩大培养.转染细胞外源p15基因检测: (1)PCR检测外源p15基因.常规酚/氯仿法提取细胞总DNA为模板, 设计针对转染质粒p15基因引物, 序列如下: 上游: 5'-ATGCGCGAGGAGAACAAGG-3', 下游: 5'-TAGATC AGTCCCCCGTGGC-3'.进行PCR(退火59℃).(2)Western blot检测外源P15蛋白.提取细胞总蛋白, 用Bradford法定量.5%积层胶、120 g/L SDS-聚丙烯酰胺凝胶电泳, 转膜, 进行一抗、酶标二抗孵育和显色, 并照相.以表达P15蛋白的Hela细胞为阳性对照.
1.2.3 转染细胞生长特性: (1)取对数生长期细胞按3×106/L接种96孔板, 每孔加入MTT溶液(5 g/L)20 μL, 37℃温育4 h, 每孔加入二甲基亚砜180 μL, 振荡10 min, 选490 nm波长, 在酶标仪上测定吸光度值, 每隔24 h测定1次, 连续测定7 d, 绘制细胞生长曲线, 计算生长抑制率.生长抑制率 = (对照组A值-实验组A值)/对照组A值×100%.(2)取各组细胞按4 000个细胞/孔接种于含3 g/L软琼脂的DMEM培养基中, 每种细胞3个孔.37℃, 50 mL/L CO2饱和湿度条件下培养, 2 wk后在低倍镜下计数克隆数.集落形成率 = 细胞集落数/接种细胞数×100%.(3)取各组细胞, 每组1×106个细胞, 用磷酸缓冲液(PBS)洗2次, 加入700 mL/L冷乙醇4℃固定24 h, PBS洗2次, 用RNA酶(50 mg/L)于37℃处理30 min, 加碘化丙啶(100 mg/L)染色, 避光30 min, 进行流式细胞仪测定.(4)取各组细胞, 每组1×106个细胞, 用PBS洗2次, 1 500 r/min离心10 min, 加入30 g/L戊二醛固定1 wk, 按常规制备电镜标本, 送透射电镜检测.
统计学处理 数据以mean±SD表示, 应用SPSS-11.0统计软件, 采用单因素方差分析, 多个均数之间两两比较q检验.
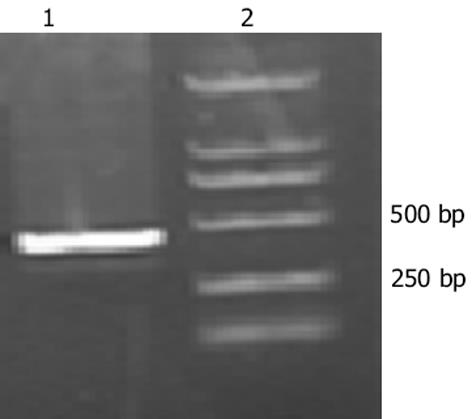
亚克隆得到pCDNA3.1(+)-p15重组质粒, PCR鉴定得到421目的片段(图1), 证明已将目的基因克隆入pCDNA3.1(+).双向测序鉴定证明pCDNA3.1(+)中插入片段与人p15mRNA(cDNA clone MGC: 23110 IMAGE: 4871014)编码序列100%同源, 无碱基序列突变(图2).
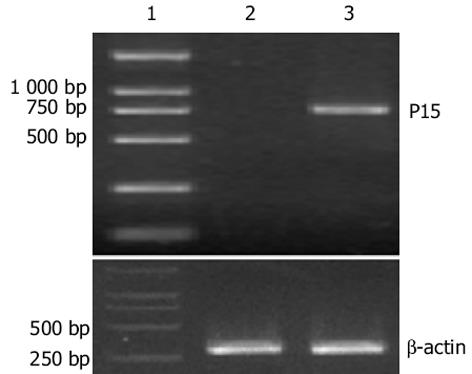
RT-PCR发现EC109细胞p15基因mRNA无表达, 而阳性对照Hela细胞有p15mRNA表达, 证明EC109细胞p15表达缺失, 可用于转染(图3).
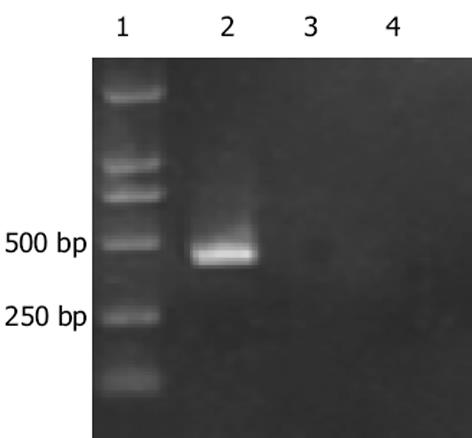
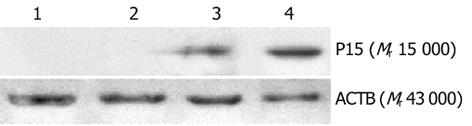
(1)外源性p15基因检测.在p15转染细胞中以目的基因检测引物PCR扩增得到421 bp片段, 空载体转染和未转染组无目的片段, 可证明p15已成功转染入受体癌细胞(图4).(2)外源性P15蛋白检测.Western blot证实p15转染组的EC109细胞和阳性对照Hela中有Mr 15 000目的条带, 空载体转染和未转染组无目的条带, 可证明转染的pCDNA3.1(+)-p15质粒后, P15蛋白在EC109细胞中高表达(图5).
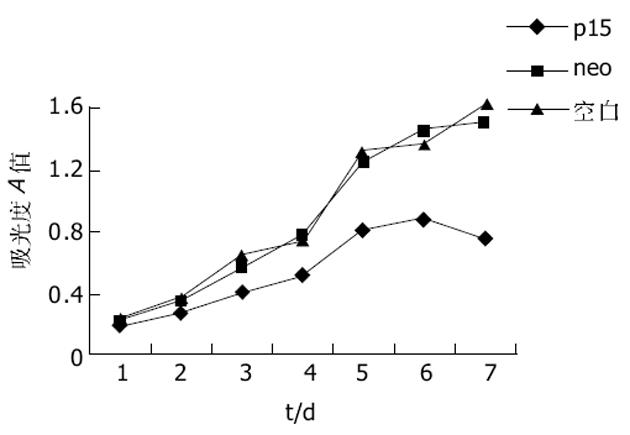
通过比较3种细胞的生长曲线, 可以看出空载体转染组和未转染组细胞的生长曲线较为接近, 而p15转染组细胞的生长曲线则位于前二者的下方, 说明neo转染后其增殖特性未受影响, 细胞在转染p15基因后其增殖特性受到抑制.2 d增殖开始被抑制, 生长抑制率为19.5%, 随时间延长抑制率逐渐升高, 至7 d生长抑制率达50.4%.p15转染组细胞的软琼脂集落形成能力与对照组细胞相比显著降低(20.8±1.3% vs 54.3±3.2%, 56.8±2.3%, q = 24.50, 26.32, P<0.01).与亲本细胞比较, P15蛋白高表达使EC109细胞发生G1/S阻滞, G1期细胞比例显著高于空载体组和未转染组(62.4±7.1% vs 38.0±5.8%, 34.4±1.0%, q = 7.94, 9.10, P<0.01), S期比例显著低于空载体组和未转染组(21.1±1.3% vs 35.5±2.4%, 36.3±0.7%, q = 15.39, 16.24, P<0.01), 并出现亚G1峰(凋亡峰)(图6).
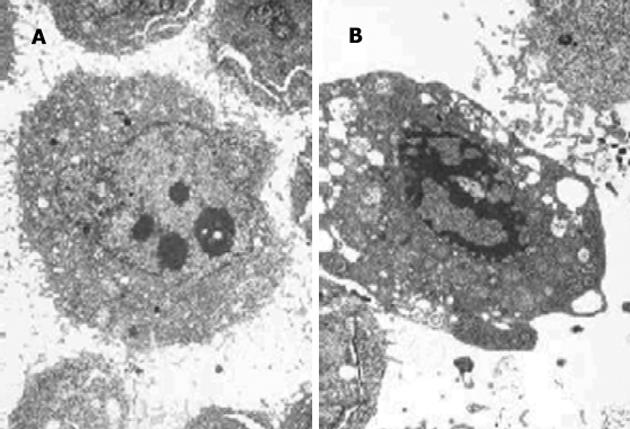
空载体转染细胞生长状态较好, 未见凋亡形态学改变, 核浆比例大, 圆形核仁多, 细胞表面绒毛密集排列, 双层核膜结构清晰, 胞质内有丰富的游离核蛋白体.p15转染可见部分细胞发生凋亡, 细胞体积变小, 表面绒毛消失, 核固缩, 染色质形成高密度斑块.细胞内有大量脂滴出现, 胞质内出现大量脂肪滴颗粒, 双层核膜结构清晰, 部分线粒体出现髓样变, 游离核糖体减少(图7A-B).
食管癌是最常见的消化系统恶性肿瘤之一[1-4], 我国是世界上食管癌发病率和死亡率高的国家.鳞癌是最多见的组织学类型[5], 占90%以上.基因治疗是当今攻克癌症的主要研究方向, 探寻食管鳞癌新的基因治疗方法具有重要意义.p15是近年来发现的一类CKI分子, 定位于9号染色体9p21区, 这一位点是易发生缺失、突变和甲基化, 从而导致恶性肿瘤发生.p15被认为是除了p53, Rb之外的CKI类重要抑癌基因[6].p15的抑癌机制与细胞周期调控密切相关, 能特异地通过直接作用于cyclinD1/CDK4复合物中的cyclinD1, 从而影响CDK4激酶的活性, 并导致pRb磷酸化水平下降, 使细胞被阻滞在G1期, 负调细胞周期过程.癌基因c-myc的产物Myc与Max结合形成一个转录因子, 具有促进细胞转化, 诱导肿瘤发生的作用, P15高表达能引起c-Myc蛋白表达水平下降.P15高表达同时可引起c-fos基因的蛋白表达水平的下降.c-fos也是一个重要的原癌基因, 参与形成转录因子AP-1.AP-1能激活生长类蛋白基因的转录, 对细胞周期起正调作用[7].上述机制可能是引起细胞增殖抑制的原因.
p15失活是引发ESCC的重要因素, p15失活在恶变中所起的重要作用可能与其引起cyclin-Rb通路失控和控制细胞增殖的作用丧失直接相关.此外, 他是细胞外刺激素源细胞周期控制途径的中介者.p15失活可能使细胞对胞外信号不敏感而导致癌的发生[8-9].p15似乎是TGF-β诱导产生细胞生长阻滞的关键[10].TGF-β对上皮细胞有生长抑制作用, 从TGF-β受体到Smads再到p15, 是一条肿瘤抑制通路.在很多肿瘤中p15基因缺失, 这样就丧失了TGF-β诱导的CDK抑制因子的抑制作用.Hitomi et al[11]认为p15是组蛋白去乙酰基(histone deacetylase, HDAC)抑制物的重要分子靶点, 而HDAC抑制物能将人肿瘤细胞阻滞于G1期, 并能激活细胞周期依赖激酶抑制物p21WAF1.p15基因在食管癌中有高频率的纯合缺失[12], 在ESCC细胞系中, 55%显示p16, p15和/或9p21相邻位点有纯合性缺失[13].Tanaka et al[14]报道其检测的30个细胞系中有16个(53%)有p15纯合缺失, 而没有发现点突变.Xing et al[15]发现其检测ESCC样本的50%发生了p15基因改变, 这表明p15是ESCC发生过程中经常失活的靶基因, p15纯合缺失是p15失活的主要机制, 少数为甲基化.
p15基因转染于黑色素瘤细胞、肝癌、胆管癌、神经胶质瘤及骨肉瘤细胞均有生长抑制作用[6-7,16-21].陈会松et al[12]认为p15基因有可能成为癌症基因治疗的新目的基因.有关p15转染对食管鳞癌乃至其他鳞癌细胞增殖是否有抑制作用尚无研究报道.为证实p15基因对人食管鳞癌细胞的抑制作用, 我们将p15转染到人食管鳞癌细胞系EC109细胞中, 以研究其对食管鳞癌细胞生长的影响.
我们发现EC109细胞在转染p15基因而产生P15蛋白高表达后, 其增殖特性明显受到抑制.在接种第2 d增殖开始被抑制, 随时间延长抑制率逐渐升高, 至第7 d与对照组比较生长抑制率达50.4%.细胞的软琼脂集落形成能力与对照组细胞相比显著降低.流式细胞仪检测发现有明显的G1/S, G2/M期阻滞, 出现凋亡特征性的亚G1峰, 透射电镜亦发现细胞凋亡发生.关于p15转染引起细胞凋亡报道较少, 仅覃扬 et al报道在肝癌细胞转染发现诱导细胞凋亡发生, 机制尚不清楚.推测原因可能是细胞凋亡多发生于细胞周期阻滞的细胞群体, 处于G1(或G2)期阻滞的细胞对细胞凋亡信号敏感性升高.本研究提示p15转染对食管鳞癌有明显的生长抑制作用并能诱导细胞凋亡, 这为食管鳞癌的基因治疗提供了一种新途径, p15转染的优点是其片段长度小, 克隆和转染操作比较方便, 是具有应用前景的基因治疗的很好的靶基因.
编辑: 潘伯荣 审读: 张海宁
| 5. | Metzger R, Schneider PM, Warnecke-Eberz U, Brabender J, Holscher AH. Molecular biology of esophageal cancer. Onkologie. 2004;27:200-206. [PubMed] [DOI] |
| 6. | 童 迎凯, 刘 军, 柳 惠图. CKIp15INK4B高表达对人黑色素瘤细胞cyclinD1和c-myc表达的影响及生长特性的改变. 中国生物化学与分子生物学报. 2000;16:514-519. |
| 8. | Xing EP, Nie Y, Song Y, Yang GY, Cai YC, Wang LD, Yang CS. Mechanisms of inactivation of p14ARF, p15INK4b, and p16INK4a genes in human esophageal squamous cell carcinoma. Clin Cancer Res. 1999;5:2704-2713. [PubMed] |
| 9. | Hannon CJ, Beach D. p15INK4B is a potential effector of TGF-b-induced cell cycle arrest. Nature. 1994;371:257-261. [PubMed] [DOI] |
| 10. | Feng XH, Lin X, Derynck R. Smad2, Smad3 and Smad4 cooperate with Sp1 to induce p15 (Ink4B) transcription in response to TGF-b. EMBO J. 2000;19:5178-5193. [PubMed] [DOI] |
| 11. | Hitomi T, Matsuzaki Y, Yokota T, Takaoka Y, Sakai T. p15 (INK4b) in HDAC inhibitor-induced growth arrest. FEBS Lett. 2003;554:347-350. [PubMed] [DOI] |
| 14. | Tanaka H, Shimada Y, Imamura M, Shibagaki I, Ishizaki K. Multiple types of aberrations in the p16 (INK4a) and the p15 (INK4b) genes in 30 esophageal squamous-cell-carcinoma cell lines. Int J Cancer. 1997;70:437-442. [PubMed] [DOI] |
| 15. | Xing EP, Nie Y, Wang LD, Yang GY, Yang CS. Aberrant methylation of p16INK4a and deletion of p15INK4b are frequent events in human esophageal cancer in Linxian, China. Carcinogenesis. 1999;20:77-84. [PubMed] [DOI] |
| 16. | 覃 扬, 刘 建余, 李 波, 彭 文珍, 傅 明德, 孙 芝琳, 孙 泽芳. p16INK4A和p15INK4B对人肝癌细胞增殖和凋亡影响的研究. 中华医学遗传学杂志. 2004;21:132-137. |
| 18. | Fuxe J, Akusjarvi G, Goike HM, Roos G, Collins VP, Pettersson RF. Adenovirus-mediated overexpression of p15INK4B inhibits human glioma cell growth, induces replicative senescence, and inhibits telomerase activity similarly to p16 INK4A. Cell Growth Differ. 2000;11:373-384. [PubMed] |
| 19. | Simon M, Koster G, Ludwig M, Mahlberg R, Rho S, Watzka M, Schramm J. Alternative splicing of the p15 cdk inhibitor in glioblastoma multiforme. Acta Neuropathol (Berl). 2001;102:167-174. [PubMed] |
| 20. | Fuxe J, Akusjarvi G, Goike HM, Roos G, Collins VP, Pettersson RF. Adenovirus-mediated overexpression of p15INK4B inhibits human glioma cell growth, induces replicative senescence, and inhibits telomerase activity similarly to p16INK4A. Cell Growth Differ. 2000;11:373-384. [PubMed] |