修回日期: 2005-03-22
接受日期: 2005-05-25
在线出版日期: 2005-08-15
目的: 研究乙型肝炎病毒(HBV)X蛋白(HBxAg)对前-X基因启动子的调节作用, 研究HBxAg在HBV致病的分子生物学机制中的作用.
方法: 应用聚合酶链反应(PCR)扩增HBV前X基因启动子, 以T-A克隆法, 将前-X基因启动子(promoter)的基因片段连入载体pGEM-T. 将获得的质粒pGEMT-前-X-promoter与报告质粒pCAT3-basic分别用KpnI和Bgl II 双酶切后构建前-X启动子报告基因表达载体pCAT3-前-X-promoter, 以重组表达质粒pCAT3-前-X-promoter分别与pcDNA3.1空载体和HBxAg表达载体pcDNA-HBxAg瞬时转染HepG2细胞, 以转染pCAT3 basic的HepG2细胞为阴性对照, 48 h后收获细胞. 用酶联免疫吸附法(ELISA)检测细胞中氯霉素乙酰转移酶(CAT)的表达活性, 以了解HBxAg对前X基因启动子的调节作用.
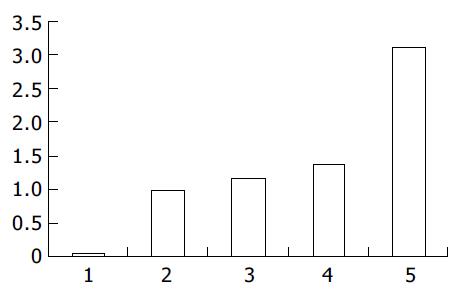
结果: 构建的报告载体pCAT3-前-X-promoter经过序列分析和酶切鉴定正确. 真核表达载体pcDNA3.1(-)-X和pCAT3-前-X-promoter共转染的HepG2细胞的CAT表达活性是CAT3启动子的3.12倍, 是pCAT3-前-X-promoter的2.65倍, 是pCAT3-3.1空载体和pCAT3-前-X-promoter共转染的2.28倍.
结论: HBxAg可以上调乙型肝炎病毒基因组中前-X基因启动子的活性.
引文著录: 白桂芹, 成军, 刘妍, 刘蔚, 张树林. 乙型肝炎病毒X蛋白上调前-X基因启动子表达活性. 世界华人消化杂志 2005; 13(15): 1904-1906
Revised: March 22, 2005
Accepted: May 25, 2005
Published online: August 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(15): 1904-1906
- URL: https://www.wjgnet.com/1009-3079/full/v13/i15/1904.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i15.1904
HBV基因组全长3 200个核苷酸(nt)左右, 为部分双链结构. 1979年最初的研究将HBV基因组划分为4个开放读码框架(ORF)[1], 分别命名为S、C、P、X区. 其中最小的ORF编码的X蛋白(HBxAg)是一种具有反式激活作用的病毒蛋白, 在HBV感染肝细胞的恶性转化中具有十分重要的作用[2-5].1990年克隆了一株adr亚型的HBV基因组, 发现了前-X区基因, 并初步认为是adr亚型特异性的一段序列. Gelibert et al[6]于1995年的初步研究认为前-X区变异与肝细胞癌(HCC)的形成有关, 之后在1998年发表的研究报告中发现来源于HCC患者的40个全HBV病毒基因序列中, 有18株具有前-X基因, 且均为adr亚型.
董菁et al[7]利用长距离精确聚合酶链反应(LR-PCR)扩增慢性乙型肝炎患者血清来源的5个全长HBV基因组DNA, 在分析不同克隆之间的序列变异程度时, 发现所获得的5个克隆在X区之前可能还存在一个ORF, 长度为168 bp, 编码56个氨基酸残基(aa), 并将其暂时命名为前-X(pre-X). 为了解前X编码区上游DNA序列是否具有启动子, 杨倩et al[8]选取其翻译起始密码子ATG上游225 bp的基因片断并设计引物, 将其克隆至报告基因表达载体pCAT3中, 构建pCAT3-前-X-promoter表达载体, 以该质粒转染HepG2细胞, 用ELISA法检测报告基因编码产物氯霉素乙酰转移酶(CAT)的表达活性. 结果提示pCAT3-前-X-promoter中插入的DNA序列具有启动子活性, 为界定前-X的ORF的存在提供了直接的依据.
我们为了研究HBxAg蛋白对前-X基因启动子的调节作用, 用基因重组技术构建pCAT3-前-X-promoter报告基因载体及HBxAg的真核表达载体pcDNA3.1(-)-X, 并共转染于人肿瘤细胞系HepG2细胞, 应用报告基因CAT共转染瞬时表达系统, 证明HBxAg可上调前-X基因启动子的转录活性.
人肝癌细胞系HepG2细胞及大肠杆菌JM109菌株为本室保存, pcDNA3.1(-)-X为本室构建[5].Tag DNA 聚合酶、T4 DNA连接酶及限制性内切酶均购自Takara公司. 质粒DNA提取试剂盒, 中间载体pGEM-T及报告质粒pCAT3-basic均购自Promega公司;CAT-ELISA检测试剂盒及质粒DNA转染试剂盒购自Roche公司. 其他生化试剂购自Sigma公司.
目的基因的扩增与纯化: 杨倩et al[8]选取了前-X-基因翻译起始密码子ATG上游225 bp, 设计并合成引物. 在上下游引物的5'-端分别引入KpnI和XhoI酶切位点. 上游引物P1:5'-GGTACCGATTGGAAAGTATGTCAGAG-3'.下游引物P2:5'-CTCGAGTTGCGTCAGCAAACACTTGG-3'.以HepG2细胞基因组DNA为模板, PCR扩增包含前-X基因启动子全序列的DNA片段, PCR产物经10 g/L琼脂糖凝胶电泳, 切胶, 回收纯化.
1.2.1 pCAT3报告载体的构建、纯化和DNA测序: 以T-A克隆法, 用T4 DNA连接酶将前-X-promoter基因片段连入载体pGEM-T. 将获得的质粒pGEMT-前-X-promoter和报告质粒pCAT3-basic分别用KpnI和Bgl II双酶切后用T4 DNA连接酶进行定向连接, 产物转化JM109宿主菌, 筛选抗氨苄青霉素阳性菌落; 提取质粒, 再次双酶切及PCR鉴定正向插入克隆, 命名为pCAT3-前-X-promoter.DNA测序由上海博亚公司完成.
1.2.2 细胞转染及前-X-promoter活性检测: 磁珠法提取质粒pCAT3-前-X-promoter以备转染, 以标准方案培养HepG2细胞. 具体转染方法参照转染说明书进行. 转染48 h后收集细胞, 收集细胞裂解液, 用于CAT活性检测.
1.2.3 共转染试验: pcDNA3.1(-)-X和pcDNA3.1(-)-空载体分别与pCAT3-前-X-promoter行共转染实验. 在35 mm培养皿中常规培养HepG2细胞, 细胞生长至对数期时分别将pcDNA3.1(-)-X+pCAT3-前-X-promoter、pcDNA3.1(-)-空载体+ pCAT3-前-X-promoter及pCAT3-pCAT3-前-X-promoter加入细胞培养液中, 同时以转染pCAT3-Basic的HepG2细胞作阴性对照. 转染24 h后, 收集细胞裂解液, 用于CAT活性检测. 所有实验严格平行操作.
1.2.4 CAT含量检测: 参照试剂盒说明书进行. 取1.0 ng/mL的CAT标准品(试剂盒提供)及细胞裂解液200 mL加入已包被抗体的96孔板中, 37 ℃温育2 h, 再依次加入第一抗体(地高辛标记的抗-CAT)、第二抗体(偶联有过氧化物酶的地高辛抗体anti-DIG-POD)200 mL 37 ℃温育1 h后, 加入过氧化物酶的底物室温显色10-30 min. 用酶标仪检测标本在415 nm波长的吸光度, 其数值反映细胞提取物中CAT的表达水平. 以未作转染的细胞裂解液平行实验作空白对照.
构建的中间载体pGEMT-前-X-promoter以KpnI和XhoI双酶切, 电泳图谱为两条带:225 bp(IL-18基因片段)和3 015 bp(pGEM-T空载体);DNA测序证实重组质粒含有225 bp的目的基因, 读码框架正确.
pCAT3-前-X-promoter分别以KpnI和Bgl II双酶切及PCR鉴定均显示225 bp正向插入条带. 说明重组质粒pCAT3-前-X-promoter构建正确.
重组质粒pCAT3-前-X-promoter分别与pcDNA3.1(-)-X和pcDNA3.1(-)-空载体共转染实验结果: 空载体对照组pCAT3 basic的CAT的吸光度值为0.062, pCAT3-promoter的吸光值为0.998, pCAT3-前-X-promoter的CAT的吸光度值为1.175, 共转染pCAT3-前-X-promoter/pcDNA3.1(-)-空载体和pCAT3-前-X-promoter/pcDNA3.1(-)-X的HepG2细胞CAT的吸光度值分别为1.365和3.115, 共转染pCAT3-前-X-promoter/pcDNA3.1(-)-X的CAT的表达明显增强, 是pCAT3空载体的3.12倍, 是pCAT3-前-X-promoter的2.65倍, 是共转染pCAT3-前-X-promoter/pcDNA3.1(-)-空载体的2.28倍(图1).
HBV编码的HBx是一种重要的转录激活因子, 与乙型肝炎的慢性化和促进肝细胞的恶性转化有密切关系. HBx的功能状态与其细胞定位有关, 核内HBx可通过与DNA结合蛋白作用, 激活转录因子或基本转录过程, 通过反式激活转录元件而促进病毒的复制. HBx还能在DNA水平激活转录. 而胞质中的HBx则主要通过刺激信号转导途径而引起一系列的反应, 激活AP-1、NF-κB等一批转录因子, 干扰细胞内信号转导通路反式激活转录, 导致细胞的转录、增生[9-11].HBx功能域的分析、研究认为, N-末端和C-末端对其反式激活都不重要, 转录活性区位于32-148 aa内[9,12]. 以HBx基因序列为靶区域, 研究HBV在慢性感染患者体内的存在状态时发现, HBx基因具有准种特点, 在其羧基末端存在相对的高变区. 进一步研究发现HBx基因的异质性和准种特点对于其反式激活作用具有显著的影响[13]. 这些研究结果的差异, 可能是HBx在不同细胞通过不同因子或途径起作用而导致所需的功能域不同所致.
研究发现HBx的反式激活作用呈现明显的广谱性, 能够反式激活多种同源或异源病毒或细胞转录调节基因区, 包括HBV增强子/核心启动子、S基因启动子, SV40的增强子及早期启动子, 单纯疱疹病毒胸腺嘧啶核苷激酶启动子(HSV-TK), 人T淋巴细胞I型病毒(HTLV-1)的长末端重复序列(LTR)、人免疫缺陷病毒I型(HIV-1)、罗氏肉瘤病毒(RSV)及b-干扰素等的启动子.
但是, HBxAg是否对HBV前X基因启动子的转录活性具有显著的反式调节作用, 一直没有相关的研究. 本文采用基因重组技术, 前-X基因上游自碱基ATG上推225个碱基, 以HBV DNA为模板, 设计引物, PCR扩增包含前X基因启动子全序列的DNA片段, 构建pCAT3-前-X-promoter报告基因载体, 应用报告基因CAT共转染瞬时表达系统, 与pcDNA3.1(-)-X共转染HepG2细胞, 共转染pCAT3-前-X-promoter/pcDNA3.1(-)-X的CAT的表达明显增强, 是CAT3空载体的3.12倍, 是pCAT3-前-X-promoter的2.65倍, 是共转染pCAT3-前-X-promoter/pcDNA3.1(-)-空载体的2.28倍. 说明乙型肝炎病毒X蛋白对前-X基因启动子有反式激活作用, 转录激活其下游基因的活性. 证明HBxAg蛋白可上调前-X启动子活性, 首次证实HBxAg反式激活HBV前-X基因启动子的转录活性, 从而为研究HBV致病的分子生物学机制提供依据.
编辑: 王谨晖 审读:张海宁
| 1. | 成 军, 杨 守纯. 现代肝炎病毒分子生物学. 北京: 人民军医出版社 1997; 79. |
| 5. | 成 军, 斯 崇文. HBV DNA转染细胞系的建立及其应用研究进展. 国外医学•流行病学传染病学分册. 1994;21:60. |
| 6. | Galibert F, Mandart E, Fitoussi F, Tiollais P, Charnay P. Nucleotide sequence of the hepatitis B virus genome (subtype ayw) cloned in E. coli. Nature. 1979;281:646-650. [PubMed] [DOI] |
| 9. | Murakami S. Hepatitis B virus X protein: structure, function and biology. Intervirology. 1999;42:81-99. [PubMed] [DOI] |
| 10. | Yu DY, Moon HB, Son JK, Jeong S, Yu SL, Yoon H, Han YM, Lee CS, Park JS, Lee CH. Incidence of hepatocellular carcinoma in transgenic mice expressing the hepatitis B virus X-protein. J Hepatol. 1999;31:123-132. [PubMed] [DOI] |
| 11. | Guo SP, Wang WL, Zhai YQ, Zhao YL. Expression of nuclear factor-kappa B in hepatocellular carcinoma and its relation with the X protein of hepatitis B virus. World J Gastroenterol. 2001;7:340-344. [PubMed] [DOI] |