修回日期: 2005-03-22
接受日期: 2005-05-25
在线出版日期: 2005-08-15
目的: 应用抑制性消减杂交(SSH)技术构建乙型肝炎病毒(HBV)全S蛋白反式激活蛋白1(CSTP1)的反式激活基因差异表达的cDNA消减文库, 克隆HBV CSTP1反式激活相关基因.
方法: 以HBV CSTP1表达质粒pcDNA3.1(-)-CSTP1转染HepG2细胞, 以空载体pcDNA3.1(-)为对照; 制备转染后的细胞裂解液, 从中提取mRNA并逆转录为cDNA, 经RsaI酶切后将实验组cDNA分成两组, 分别与两种不同的接头衔接, 再与对照组cDNA进行两次消减杂交及两次抑制性PCR, 将产物与T/A载体连接, 构建cDNA消减文库, 并转染大肠杆菌进行文库扩增, 随机挑选克隆PCR扩增后进行测序及同源性分析.
结果: 成功构建人HBV CSTP1反式激活基因差异表达的cDNA消减文库. 文库扩增后得到86个白色克隆, 进行菌落PCR分析, 均得到100-1 000 bp插入片段. 挑取25个含有插入片段的阳性克隆测序分析, 获得23个已知基因序列和2个未知基因. 未知基因的功能还正在研究中.
结论: 应用SSH技术成功构建了HBV CSTP1反式激活基因差异表达的cDNA消减文库. 该文库的建立为进一步阐明HBV CSTP1反式调节的靶基因及致肝病发生的分子生物学机制提供理论依据.
引文著录: 白桂芹, 成军, 张树林, 刘妍, 刘蔚, 张黎颖. 应用抑制性消减杂交技术克隆HBV全S蛋白反式激活蛋白1的反式激活基因. 世界华人消化杂志 2005; 13(15): 1897-1900
Revised: March 22, 2005
Accepted: May 25, 2005
Published online: August 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(15): 1897-1900
- URL: https://www.wjgnet.com/1009-3079/full/v13/i15/1897.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i15.1897
乙型肝炎病毒(HBV)为带包膜的肝DNA病毒属, 1979年Gelibert et al发表了HBV基因组的第一个全长核苷酸序列, 长度为3 182 nt, 血清型为ayw亚型, 并在HBV基因组中界定了4个开放读码框(ORF), 分别命名为S、C、P、X 区. 其中S区又因不同的起始密码子(ATG)而又人为的分为前-S1、前-S2和S三个区. 董菁et al[1]应用长距离精确PCR技术(long and accurate PCR, LA-PCR)研究了乙型肝炎患者血清中存在的HBV病毒子基因组发现在前-S1的ORF之前存在一融合编码的ORF, 该区长135 bp, 暂时命名为前-前-S区, 并且证实了在前-前-S基因上游277 bp核苷酸序列有启动子活性[2], 其功能可能为调控前-前-S区与HBV大蛋白的融合表达.
抑制性消减杂交(suppression subtractive hybr-idization, SSH)技术是近年发展起来的一项新的基因克隆技术, 与传统方法比较, 具有实验周期短、易操作、可靠性高、假阳性率低等特点, 能有效分离扩增低丰度特异表达的基因, 可以在较短的时间内获得较理想的实验结果[3-4]. 我们利用SSH技术成功构建人HBV全S蛋白反式激活基因差异表达的cDNA消减文库. 获得2个未知基因, 通过生物信息学分析获得其全长序列, 其中之一命名为全S蛋白反式激活基因1(CSTP1), 已在GenBank中注册, 注册号:AY553877. 本研究对HBV CSTP1反式激活作用进行研究, 为讨论HBV CSTP1在致病(癌)过程中的作用奠定基础.
HepG2细胞及感受态大肠杆菌DH5a为本室保存, pcDNA3.1(-)真核表达载体(Invitrogen), Lipofec-tamine PLUS转染试剂(Gibco), mRNA Purification试剂盒(Amersham Pharmacia Biotech), PCR-Select cDNA Subtraction试剂盒, 50×PCR Enzyme Mix、Advantage PCR Cloning试剂盒(Clontech), High Pure PCR Product Purification试剂盒(Boehringer Mannheim), T7、SP6通用引物及pGEM-Teasy载体(Promega).
HBV CSTP1的克隆分析和真核表达载体及细胞转染: 根据电子拼接的新基因序列(945 bp), 利用生物信息分析软件Vector NTI设计新基因序列的引物含有特异性核酸内切酶(EcoRI/BamHI), 利用HepG2细胞来源的mRNA, 经过RT-PCR扩增, 并与pGEM-T载体连接, 转化DH5a感受态细菌, 铺于含有氨苄青霉素的LB/X-gal/IPTG培养板上, 37 ℃培养18 h. 挑取阳性菌落, 增菌, 使用碱裂解法提取质粒后进行双酶切(EcoRI/BamHI)和菌落PCR鉴定, 证明目的基因约945 bp后测序, 进一步鉴定正确后获得阳性克隆.
1.2.1 HBV CSTP1真核表达质粒pcDNA3.1(-)-CSTP1由本室构建. 用Lipofectamine PLUS转染试剂将2 mg pcDNA3.1(-)-CSTP1及pcDNA3.1(-)空载体分别转染35 mm平皿HepG2细胞, 48 h后收获细胞.
1.2.2 细胞mRNA提取: 使用mRNA Purification试剂盒, 直接提取转染了CSTP1表达质粒及空载体的HepG2细胞mRNA, 经琼脂糖凝胶电泳及分光光度计进行定性、定量分析.
1.2.3 双链cDNA(dscDNA)合成: 用Clontech公司的PCR-SelectTM cDNA Subtraction Kit中的试剂, 以获得的mRNA为模板逆转录合成cDNA.
1.2.4 消减杂交文库的建立: 采用Clontech公司的PCR-SelectTM cDNA Subtraction Kit, 常规SSH方法按说明书进行: 转染了CSTP1表达质粒及空载体的HepG2细胞cDNA分别标记为Tester和Driver, 经RsaⅠ(一种识别4碱基序列的内切酶)消化, 产生相对较短的平端片段, 纯化酶切产物. 将Tester的cDNA分为两份, 分别连接试剂盒提供的特殊设计的寡核苷酸接头Adapter 1和Adapter 2, 然后与过量的Driver cDNA进行杂交; 合并两种杂交产物后再与Driver cDNA作第2次杂交; 然后将杂交产物做选择性PCR扩增, 使Tester cDNA中特异性表达或高表达的片段得到特异性扩增.
1.2.5 克隆鉴定分析: 扩增产物与pGEM-Teasy载体连接, 转化JM109感受态细菌, 在含氨苄青霉素的LB/X-gal/IPTG培养板上, 37 ℃培养18 h. 挑取白色菌落, 增菌, 以pGEM-Teasy载体多克隆位点两端T7/SP6引物进行菌落PCR扩增, 证明含有插入片段后(200-1 000 bp)测序(上海博亚生物技术有限公司). 应用生物信息学将测得序列与GenBank数据库进行同源性分析.
使用高质量的mRNA是保证cDNA高产量的前提. 紫外分光检测显示, 转染了HBV CSTP1表达质粒及空载体的HepG2细胞mRNA分别为4.06 mg和3.96 mg, A260/A280 = 2.01. 10 g/L琼脂糖凝胶电泳见mRNA为大于0.5 kb清晰慧尾片状条带.
dscDNA与接头连接效率的高低是决定SSH成败的最关键步骤. 将连接有Adaptor l和Adaptor 2的两组dscDNA分别用两个基因特异性引物[甘油三磷酸脱氢酶(G3PDH)3'和5']与一个基因特异性引物(G3PDH 3')和一个PCR引物1进行28个循环扩增, 产物用20 g/L琼脂糖凝胶电泳鉴定. 结果显示两组dscDNA扩增产物浓度相当, 说明dscDNA已与接头高效率连接.
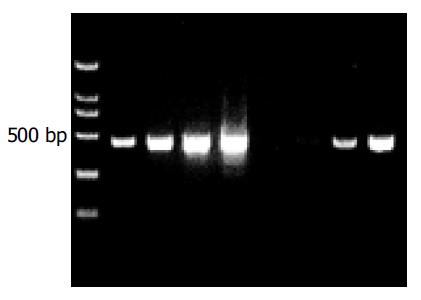
分别取l mL抑制性及非抑制性PCR产物为模板, 用看家基因G3PDH引物进行PCR扩增, 分别在18、23、28、33次循环结束时从体系中吸取5 mL进行电泳鉴定. 结果显示: 与非抑制性PCR产物相比, 抑制性PCR产物中G3PDH基因产物大大减少, 说明所构建的消减文库具有很高的消减效率(图1).
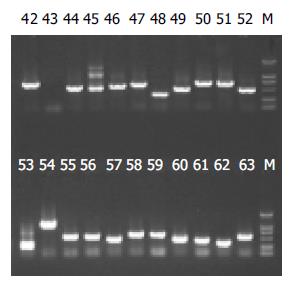
杂交产物经两轮PCR扩增后, 菌落PCR扩增结果显示为200-1 000 bp大小不等的插入片段, 所获得的86个克隆中几乎均含有插入片段, 这些条带可能代表差异表达的基因片段(图2).
挑选25个克隆测序, 与GenBank数据库进行初步比较. 2个克隆未检索到任何对应的相似序列, 可能代表了某些新基因. 应用生物信息学技术对他们进行克隆分析, 获得相应的全长编码基因, 新基因结构及功能分析正在进行中. 其余23个克隆均与已知基因的部分序列高度同源(96-100%, 表1).
| 已知的同源序列编码蛋白 | 相同克隆数 | 同源性(%) |
| 人类真核翻译延长因子1 | 2 | 100 |
| 人类热休克蛋白 | 3 | 99 |
| 人类丝氨酸/苏氨酸蛋白激酶 | 1 | 99 |
| 人类仅在胎盘绒毛表达的mRNA | 1 | 97 |
| 人类核糖体蛋白 | 5 | 98 |
| 人类NADH 脱氢酶 | 1 | 99 |
| 人类磷蛋白质 | 1 | 99 |
| 人类肌动蛋白相关蛋白 | 1 | 100 |
| 人类主要组织相容性复合物I(MHC-I) | 2 | 100 |
| 人类细胞色素氧化酶亚单位1 | 1 | 100 |
| 人类线粒体核糖体蛋白 | 1 | 100 |
| 人类磷脂酰肌醇聚糖3 | 1 | 100 |
| 人类肌动蛋白 | 1 | 100 |
| 人类微管蛋白2 | 1 | 100 |
| 人类Axin 2 | 1 | 100 |
HBV感染, 不仅引起急、慢性病毒性肝炎, 而且与肝纤维化、肝细胞癌(HCC)的发生、发展密切相关[5-6].HBV为包膜DNA病毒, 其包膜由四个相关的表面蛋白组成, 他们是主蛋白(S), 中蛋白(M, PreS2+S), 大蛋白(L, PreS1+PreS2+S), 还包括前-前-S区的全S蛋白. 由病毒基因组同一开放读码框编码, 但起始位点不同. 我们应用SSH技术研究包括前-前-S在内的全S蛋白的反式激活靶基因. 结果共获得2个差异表达的未知序列, 我们初步采用生物信息学方法获得了其全长基因序列, 其中之一命名为全S蛋白反式激活基因1(CSTP1), 已在GenBank中注册, 注册号: AY553877. 本研究对HBV CSTP1反式激活作用进行研究, 为讨论HBV CSTP1在致病(癌)过程中的作用奠定基础, 进一步明确了HBV全S蛋白在致病中的机制.
以下的基因序列值得我们注意: 第一是人类肌动蛋白(actin), 是一种具有收缩能力的微丝蛋白, 其抗原性较稳定, HBV核心蛋白与cDNA编码的人肌动蛋白结合蛋白C末端区存在相互作用, 这种相互作用在体外和体内均被确定. 他们相互作用的部位是C末端的199氨基酸残基. 在慢性HBV感染患者HBV的复制及其引起的病理变化与这二者之间的相互作用有潜在的联系[7]. 常吉庆et al[8]观察癌周正常乳腺小叶及不典型小叶增生, 其导管肌上皮完整, 肌动蛋白呈阳性表达, 而小叶原位癌及早期浸润性小叶癌肌动蛋白呈阴性反应, 阴性率100%(20/20). 当乳腺小叶末梢导管上皮细胞发生癌变成为癌细胞时, 便具有浸润力, 破坏周围肌上皮细胞, 随着病变程度的不断进展, 肌上皮逐渐消失. 因而肌动蛋白由正常阳性表达变弱, 直至转阴. 因此, 采用肌动蛋白标记乳腺肌上皮, 对区别良恶性肿瘤及判断早期癌变和早期浸润具有重要诊断价值. 可将其作为鉴别诊断指标之一. HBV CSTP1能上调肌动蛋白的表达, 在HBV的致病中到底起什么作用还需要进一步研究. 第二是人类丝氨酸/苏氨酸蛋白激酶, 丝氨酸/苏氨酸蛋白激酶对大量的细胞内、外刺激的转导起着中枢性调节作用, 从而控制细胞的生长、增生、凋亡, 如进入细胞周期、控制核苷酸的生物合成、G2/M期的转变、M期高尔基体的裂解和纺锤体的形成等[9]. 此系统由多组具有丝/苏氨酸特异性的, 脯氨酸指导的蛋白激酶组成, 可以被细胞外多种刺激所激活, 其主要功能为信息传递的中转站, 与细胞表面受体、特异性转录因子以及其他调控蛋白相互作用, 从而使细胞外信号来调节特异性基因的表达[10]. 丝氨酸/苏氨酸激酶的N末端的接触区域和C末端区域直接调节激酶活性, 这个作用区域是与死亡相关的蛋白激酶的区域, Sanjo et al[11]研究发现激酶的过度表达诱导NIH 3T3细胞凋亡的形态学改变, 也就是说此激酶涉及到细胞凋亡, 表明他在凋亡信号中有重要的作用. 大多数生长因子受体内部都具有酪氨酸激酶结构域, 因而细胞因子受体能够与细胞内酪氨酸激酶偶联, 通过一些递质和衔接于酪氨酸激酶能进一步激活一系列下游丝氨酸/苏氨酸激酶, 后者又能进一步刺激细胞核和细胞质中转录因子[12-14], 从而导致相应的病理变化. 此信号级联在HBV致癌机制中也有着重要的作用[15]. 因此, 我们了解肝炎病毒蛋白CSTP1对丝氨酸/苏氨酸激酶及其对信号通路的影响, 对于肝炎病毒慢性感染的形成, 甚至是肝炎病毒相关性HCC的发生机制的研究具有重要意义. 第三是人类主要组织相容性复合物I(MHC-I), 程宝泉et al[16]应用流式细胞仪对慢性乙肝、原发性肝癌组织中的MHC-I类抗原进行检测, 发现肝癌组织较慢性乙肝组织MHC-I抗原表达明显下降, 转移组较非转移组下降明显, 而且与血清AFP呈负相关, 提示肝癌的发生和转移可能与MHC-I类抗原表达下降有关. 以往研究表明, 细胞毒T淋巴细胞只识别和MHC-I结合的外来抗原, 肿瘤细胞异于正常细胞, 其抗原性物质只有经过MHC结合、处理后方能被T淋巴细胞所识别, 并杀灭之. MHC-I抗原下降, 使肿瘤细胞与之结合减少, 从而逃逸抗体免疫细胞的消灭, 这可能是肝癌发生和转移的重要机制[17].Zhou et al[18]研究发现正常肝细胞表达非常少量的MHC-I分子, 但是在HBV感染时MHC-I的表达明显升高. 瞬时转染分析表明HBV X蛋白通过MHC-I启动子反式激活转录并且证明顺式元件对反式激活的重要性. 第四是人类Axin2.Wnt蛋白是被糖蛋白分泌的, 并且在胚胎发育时期形成高度保守的信号分子家族. 其信号分子的成分发生突变就引起各种类型的癌. Axin是Wnt信号转导通路的一种成分, 而Axin2和Axin1有同样的功能. 启动子分析提示Axin2是Wnt通路的直接靶位, 而且认为Axin2参与能限制Wnt初始信号维持时间和强度的负反馈环[19].Miao et al[20]研究认为Wnt信号通路在胚胎发育和肿瘤形成过程中起非常重要的作用. 作为Wnt信号转导的一部分, Axin复合物的功能被抑制, 导致catenin的积累. 而catenin在肝脏肿瘤中显示免疫组织化学阳性更为常见, 提示Axin基因的突变可能在儿童HCC的致癌机制起一定的作用. Taniguchi et al[21]研究认为通过catenin突变的Wnt信号的激活导致HCC和肝细胞肿瘤的形成. Axin1和Axin2突变似乎在10% HCC的发生中很重要. 但是最近研究发现在HCC中仅检测出Axin2和Axin1突变而没有catenin基因的突变[22-23], 进一步提示Axin2在致癌中的重要作用. 身体的Axin1和Axin2突变已经正式与许多癌组织种类的形成有关, 如结肠癌和HCC[24]. 我们利用SSH技术对HBV CSTP1蛋白反式激活作用进行研究, 为讨论HBV全S蛋白和HBV CSTP1在致病(癌)过程中的作用提供有力的理论依据. 将对HBV感染的检测、疫苗设计、HBV进入肝细胞机制(受体学说)、表面抗原的表达过程及功能、宿主抗感染机制、HCC产生机制研究产生重大影响.
编辑: 王谨晖 审读:张海宁
| 3. | Kuang WW, Thompson DA, Hoch RV, Weigel RJ. Differential screening and suppression subtractive hybridization identified genes differentially expressed in an estrogen receptor-positive breast carcinoma cell line. Nucleic Acids Res. 1998;26:1116-1123. [PubMed] [DOI] |
| 6. | 李 克, 王 琳, 成 军, 张 玲霞, 段 惠娟, 陆 荫英, 杨 继珍, 刘 妍, 洪 源, 夏 小兵. 酵母双杂交技术筛选克隆HCV核心蛋白结合蛋白基因1. 世界华人消化杂志. 2001;9:1379-1383. [DOI] |
| 7. | Huang CJ, Chen YH, Ting LP. Hepatitis B virus core protein interacts with the C-terminal region of actin-binding protein. J Biomed Sci. 2000;7:160-168. [PubMed] [DOI] |
| 9. | Nishihama R, Ishikawa M, Araki S, Soyano T, Asada T, Machida Y. The NPK1 mitogen-activated protein kinase kinase kinase is a regulator of cell-plate formation in plant cytokinesis. Genes Dev. 2001;15:352-363. [PubMed] [DOI] |
| 10. | Su B, Karin M. Mitogen-activated protein kinase cascades and regulation of gene expression. Curr Opin Immunol. 1996;8:402-411. [PubMed] [DOI] |
| 11. | Sanjo H, Kawai T, Akira S. DRAKs, novel serine/threonine kinases related to death-associated protein kinase that trigger apoptosis. J Biol Chem. 1998;273:29066-29071. [PubMed] [DOI] |
| 13. | Karin M, Hunter T. Transcriptional control by protein phosphorylation: signal transmission from the cell surface to the nucleus. Curr Biol. 1995;5:747-757. [PubMed] [DOI] |
| 14. | Schindler C, Shuai K, Prezioso VR, Darnell JE Jr. Interferon-dependent tyrosine phosphorylation of a latent cytoplasmic transcription factor. Science. 1992;257:809-813. [PubMed] [DOI] |
| 15. | 纪 冬, 成 军, 王 建军, 刘 妍, 杨 倩, 党 晓燕, 王 春花. 乙型肝炎病毒和丙型肝炎病毒对MAPKKK蛋白信号转导的影响. 世界华人消化杂志. 2003;11:1959-1962. [DOI] |
| 17. | Cruz E, Vieira J, Gonçalves R, Alves H, Almeida S, Rodrigues P, Lacerda R, Porto G. Involvement of the major histocompatibility complex region in the genetic regulation of circulating CD8 T-cell numbers in humans. Tissue Antigens. 2004;64:25-34. [PubMed] [DOI] |
| 18. | Zhou DX, Taraboulos A, Ou JH, Yen TS. Activation of class I major histocompatibility complex gene expression by hepatitis B virus. J Virol. 1990;64:4025-4028. [PubMed] |
| 19. | Lyu J, Costantini F, Jho EH, Joo CK. Ectopic expression of Axin blocks neuronal differentiation of embryonic carcinoma P19 cells. J Biol Chem. 2003;278:13487-13495. [PubMed] |
| 20. | Miao J, Kusafuka T, Udatsu Y, Okada A. Sequence variants of the Axin gene in hepatoblastoma. Hepatol Res. 2003;25:174-179. [PubMed] [DOI] |
| 21. | Taniguchi K, Roberts LR, Aderca IN, Dong X, Qian C, Murphy LM, Nagorney DM, Burgart LJ, Roche PC, Smith DI. Mutational spectrum of beta-catenin, AXIN1, and AXIN2 in hepatocellular carcinomas and hepatoblastomas. Oncogene. 2002;21:4863-4871. [PubMed] [DOI] |
| 22. | de La Coste A, Romagnolo B, Billuart P, Renard CA, Buendia MA, Soubrane O, Fabre M, Chelly J, Beldjord C, Kahn A. Somatic mutations of the beta-catenin gene are frequent in mouse and human hepatocellular carcinomas. Proc Natl Acad Sci USA. 1998;95:8847-8851. [PubMed] [DOI] |