修回日期: 2005-06-02
接受日期: 2005-06-13
在线出版日期: 2005-08-15
目的: 探索小鼠胚胎干细胞(ES)体外分步诱导为肝细胞的培养方法.
方法: 在小鼠胚胎成纤维细胞MEF饲养层上培养ES细胞, 培养液中含白血病抑制因子(LIF), 然后分阶段加入含acid-FGF、肝细胞生长因子(HGF)、致瘤素(OSM)、胰岛素、微量硒酸等诱导因子. 采用免疫组化方法检测白蛋白(Albumin)、细胞角蛋白CK18, 用硝基四氮唑蓝/5-溴-4-氯-3-吲哚基磷酸(NBT/BCIP)显色检测碱性磷酸酶(ALP).
结果: ES细胞克隆ALP染色阳性, 未分化. 培养4 d后, 形成拟胚体. 在分步加入诱导因子24 d后, ES细胞分化出的细胞形态比较单一, 类似上皮样细胞. 诱导分化的细胞可见白蛋白、CK18阳性细胞.
结论: 分步诱导培养有利于ES细胞向肝细胞分化.
引文著录: 江海洪, 向德栋, 刘国栋, 王宇明. 小鼠胚胎干细胞体外分步诱导为肝细胞的实验研究. 世界华人消化杂志 2005; 13(15): 1849-1851
Revised: June 2, 2005
Accepted: June 13, 2005
Published online: August 15, 2005
AIM: To explore a method for the differentiation of embryonic stem (ES) cells into hepatocytes in vitro.
METHODS: ES cells were cultured on the feeder layer of mouse embryonic fibroblasts (MEF) in the medium containing leukemia inhibitory factor (LIF). The inductive factors, such as acid-fibroblast growth factor (acid-FGF), HGF, oncostatin M (OSM), Dex and ITS mixture (5 g/L insulin, 5 g/L transferring, 5 mg/L selenic acid), were added at day 9, 12, 12, 15 of induction. The activity of alkaline phosphatase (ALP) was detected by cytochemical method and visualized by NBT/BCIP. Albumin (ALB) and CK18 were examined by immunohistochemistry and DAB staining.
RESULTS: ALP was positive in the undifferentiated ES cells. Four days after induction, embryonid bodies came into formation. After the inductive factors were added, ES cells were differentiated into single morphological cells like epithelium. ALB and CK18 were positive in some differentiated cells.
CONCLUSION: Embryonic stem cells can be selectively differentiated into hepatocytes in vitro.
- Citation: Jiang HH, Xiang DD, Liu GD, Wang YM. Differentiation of mouse embryonic stem cells into hepatocytes in vitro. Shijie Huaren Xiaohua Zazhi 2005; 13(15): 1849-1851
- URL: https://www.wjgnet.com/1009-3079/full/v13/i15/1849.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i15.1849
胚胎干细胞(Embryonic stem cells, ES cells)是从小鼠的胚胎内细胞团(inner cell mass, ICM)或桑葚胚中分离并建立起来的具有自我更新、高度增殖和多向分化潜能的细胞. 在特定的体外培养条件下, ES细胞能分化成心肌、造血细胞、神经细胞以及肝细胞、胆管细胞等各种类型的细胞[1-3]. 随着人ES细胞系的建立[4], 在体外大量生产人肝细胞有可能成为肝细胞移植、生物人工肝等肝细胞材料的新来源. 目前所报道的诱导胚胎干细胞为肝细胞主要有3条途径: 细胞因子干预、细胞共培养和转基因. 我们采用以小鼠胚胎成纤维细胞(MEF)作为饲养层, 观察ES细胞生长情况, 并用细胞因子分步干预法诱导ES细胞分化为肝细胞, 探讨诱导ES细胞为肝细胞的可行性并探索其诱导条件, 为肝病的临床治疗及其研究提供理论基础.
小鼠ES细胞株MESPU13由闵峰博士提供. DMEM, DMEM/F12, 胎牛血清(fetal calf serum, FCS)均购自Hyclone公司, 重组人白血病抑制因子(leukemia inhibitory factor, LIF)为PeproTech产品. 胰岛素, 转铁蛋白, 硒化钠, 胶原蛋白Ⅰ型, b-巯基乙醇, 胰蛋白酶, 丝裂霉素C均购自Sigma. 白蛋白抗体, CK18抗体购自PharMingen公司, 二抗和三抗、褐色DAB显色试剂盒以及硝基四氮唑蓝(NBT)、5-溴-4-氯-3-吲哚基磷酸(BCIP)购自武汉博士德, 其余试剂均为国产分析纯试剂.
小鼠胚胎成纤维细胞(MEF)在含FCS 100 mL/L的DMEM培养液中培养, 细胞铺满培养瓶底壁后用含10 mg/L丝裂霉素C的培养液处理1 h, PBS洗5次后, 用于ES细胞的培养. ES细胞在MEF饲养层上培养, 培养液成分为DMEM, 含150 mL/L FCS的LIF(1×106 IU/L), b-巯基乙醇(100 mmoL/L). 培养时每天更换培养液, 2-3 d传代1次. 碱性磷酸酶(ALP)染色是将盖玻片置于培养板的底壁, 待MEF和ES细胞长好后取出. 40 g/L多聚甲醛固定30 min, PBS漂洗5 min×3, TSM1、TSM2中各漂洗5 min×2, (TSM1:0.1 mol/L NaCl, 0.1 mol/L Tris, 10 mmol/L MgCl2, 0.1 mmol/L HCl调pH到8.0;TSM2:0.1 mmol/L NaCl, 0.1 mmol/L Tris, 50 mmol/L MgCl2, 0.1 mol/L HCl调pH到9.5), 用NBT/BCIP显色(NBT 45 mL, BCIP 35mL, TSM2 1 mL), 室温避光显色10-15 min. 胚胎干细胞向肝细胞诱导的具体方法如下, 不用MEF饲养层和LIF, ES细胞在含100mmol/L b-巯基乙醇、150 mL/L FCS的DMEM中利用细菌培养皿悬滴方法悬浮培养2 d. 在每一液滴中细胞形成聚集物, 并形成一个拟胚体EBs(embryonid bodies, EBs). 用递质5 mL小心冲洗细菌培养盖, 然后转移到60 mm细菌培养皿中, 并加入分化递质5 mL. 持续悬浮培养3 d. 将单个的EBs转移到1 g/L胶原蛋白Ⅰ型包被的微孔板中进行形态学分析, 或转移5-10个EBs到直径为60 mm细菌培养皿作免疫组化实验. 在诱导递质中按照以下不同时间加入肝细胞诱导分化的启动因子和成熟因子, 以ES细胞悬浮培养开始时为第1 d: 作为早期诱导因子的Acidic FGF(10 mg/L)在第9 d加入, 作为中期因子HGF(2×10-5 g/L)在第12 d加入, 作为晚期因子OSM(1×10-5 g/L)、Dex(10-7 mol/L)、ITS混合物(5 g/L胰岛素, 5 g/L转铁蛋白、5 mg/L硒酸)在第15 d加入. 诱导递质用含150 mL/L FCS的DMEM低糖, 每天换液1次. 用40 g/L多聚甲醛固定细胞30 min, 2 ml/L Triton X-100处理10 min, 正常小鼠血清封闭10 min, 用3 mL/L H2O2封闭内源性过氧化物酶10 min, 加入白蛋白、CK18一抗(1:100), 然后4 ℃过夜. 用PBS漂洗后, 其余步骤按传统ABC方法操作.
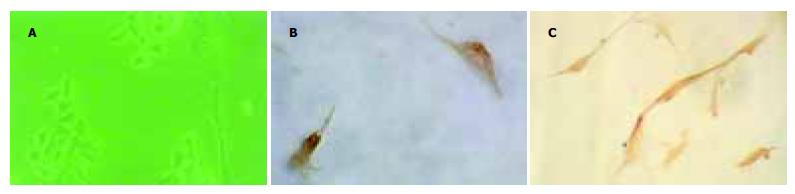
小鼠ES细胞在含LIF的DMEM高糖培养基中形成细胞克隆. 细胞表面的ALP是ES细胞未分化特性的标志, ALP染色阳性, 表明ES细胞处于未分化状态(图1A).ES细胞在含b-巯基乙醇(100 mmol/L)的DMEM低糖、150 mL/L FCS中悬浮培养4 d后, 形成拟胚体EBs(图1B);ES细胞在分步加入诱导因子24 d后, ES细胞分化出的细胞形态比较单一, 类似上皮样细胞(图2A). 诱导培养递质中按不同的时间分步加入HGF、acid-FGF等细胞因子干预后, 部分分化细胞白蛋白、CK18表达阳性. 本实验中不加一抗的对照完全不着色(图2B、2C).
有关ES细胞的研究是目前生物领域研究的热点, 将ES细胞诱导为神经细胞、心肌细胞和血细胞的研究较多, 但将ES细胞诱导为内胚层细胞如胰岛细胞、肝细胞等文献报道较少. 我们根据肝发育的过程拟定的诱导培养条件. 肝发育的第一个形态学标志是在小鼠性交后8.5 d, 由前肠内胚层的腹侧底部增厚形成, 即所谓的肝憩室; 然后由肝憩室迁移到横隔而形成肝脏的雏形. 在早期未分化的前肠内胚层, 转录因子Gata-4和Hnf-3b能结合到肝脏特定的白蛋白增强子部位[5], 从而开始诱导肝脏特定基因的表达. 随后, 来源于临近中胚层心脏FGFs, 诱导前肠内胚层定向形成原始的肝胚, 组织移植研究也已显示从心脏中胚层来源的细胞信号能诱导内胚层向肝脏分化[6]. 国内丛笑倩et al采用ES与鼠胎肝细胞共培养, 将小鼠胚胎干细胞成功诱导为肝细胞, 并且有肝细胞特异性标志物表达, 国外Jung et al[7]应用组织外植体系证实了FGF1和FGF2能替代心脏中胚层的诱导效应. 因此, 在向肝细胞分化中, FGFs可能是向肝细胞诱导的重要启动因子. 在E8.5以后的2 d, 肝脏的胚芽增殖并迁移到周围由含有胶原质的疏松结缔组织构成的横膈膜. 肝脏的前体直接和结缔组织基质接触, 并且其周围环绕的实质细胞能分泌HGF并支持胎肝细胞的生长; 在HGF遗传缺陷小鼠, 会导致胚胎肝脏在容量上缩小, 并显示实质细胞的广泛丢失. 现已研究表明, HGF的不同生物效应是通过激活酪氨酸激酶受体c-Met蛋白来介导的. 当HGF结合到c-Met受体, 在c-Met的C-末端区域的两个酪氨酸残基磷酸化, 然后各种结合蛋白和信号转导分子如Grb2/Sos/Ras、细胞外信号调节激酶(ERK)、p38、MAPK、P70s6k和AKT等被激活, 从而产生生物效应. 近来, 磷酸肌醇-3-羟基激酶(PI3K)/AKT信号转导途径已经应用到各种HGF依赖系统的生物效应, 包括犬肾细胞的迁移、主要肝细胞中的抗凋亡保护和胰腺细胞的增殖等方面[8]. 在临床上, 从治疗的观点来考虑, 主要应发展一种HGF转移到严重肝损伤患者的再生肝脏中来增强肝细胞活力. 在E12到E16期间, 胎肝是造血的主要场所. 造血细胞能产生OSM, 并与ITS(转铁蛋白、胰岛素与硒酸)一同诱导小鼠胎肝细胞的成熟.
目前, 虽然有关内胚层肝脏发育特别是肝细胞成熟过程中的分子作用机制仍未完全阐明, 但ES细胞向肝细胞诱导应该有FGFs、HGF、OSM和ITS等得到了广泛的学者支持[9]. 我们根据肝脏的发育生物学特点, 在培养液中分步加入上述物质, 探索了ES诱导分化为肝细胞的体外培养条件. 白蛋白主要由肝细胞合成, 并且被普遍认为是肝细胞的标志, CK18主要存在于肝细胞、胆管上皮细胞以及卵圆细胞等. 我们检测了白蛋白、CK18, 且均为阳性, 因而认为分化细胞中有肝细胞的存在, 表明我们使用的ES诱导递质和分步诱导方法, 具有诱导ES细胞向肝细胞分化的潜能. 并且诱导分化的肝细胞样细胞, 既具有增殖分化潜能, 又没有ES细胞生成畸胎瘤的危险(移植部分的实验资料待发表), 故是较好的肝细胞移植材料, 其将可为肝细胞移植、生物人工肝等提供新的细胞来源.
编辑: 潘伯荣 审读:张海宁
| 1. | Yamada T, Yoshikawa M, Kanda S, Kato Y, Nakajima Y, Ishizaka S, Tsunoda Y. In vitro differentiation of embryonic stem cells into hepatocyte-like cells identified by cellular uptake of indocyanine green. Stem Cells. 2002;20:146-154. [PubMed] [DOI] |
| 2. | Tabei I, Hashimoto H, Ishiwata I, Tachibana T, Akahori M, Ohi S, Kubo H, Satou K, Yamazaki Y, Yanaga K. Characteristics of hepatocytes derived from early ES cells and treatment of surgically induced liver failure rats by transplantation. Transplant Proc. 2005;37:262-264. [PubMed] [DOI] |
| 3. | Kumashiro Y, Asahina K, Ozeki R, Shimizu-Saito K, Tanaka Y, Kida Y, Inoue K, Kaneko M, Sato T, Teramoto K. Enrichment of hepatocytes differentiated from mouse embryonic stem cells as a transplantable source. Transplantation. 2005;79:550-557. [PubMed] [DOI] |
| 4. | Carpenter MK, Rosler E, Rao MS. Characterization and differentiation of human embryonic stem cells. Cloning Stem Cells. 2003;5:79-88. [PubMed] [DOI] |
| 5. | Kanda S, Shiroi A, Ouji Y, Birumachi J, Ueda S, Fukui H, Tatsumi K, Ishizaka S, Takahashi Y, Yoshikawa M. In vitro differentiation of hepatocyte-like cells from embryonic stem cells promoted by gene transfer of hepatocyte nuclear factor 3 beta. Hepatol Res. 2003;26:225-231. [PubMed] [DOI] |
| 6. | Fair JH, Cairns BA, Lapaglia M, Wang J, Meyer AA, Kim H, Hatada S, Smithies O, Pevny L. Induction of hepatic differentiation in embryonic stem cells by co-culture with embryonic cardiac mesoderm. Surgery. 2003;134:189-196. [PubMed] [DOI] |
| 7. | Jung J, Zheng M, Goldfarb M, Zaret KS. Initiation of mammalian liver development from endoderm by fibroblast growth factors. Science. 1999;18:1998-2003. [PubMed] [DOI] |
| 8. | Okano J, Shiota G, Matsumoto K, Yasui S, Kurimasa A, Hisatome I, Steinberg P, Murawaki Y. Hepatocyte growth factor exerts a proliferative effect on oval cells through the PI3K/AKT signaling pathway. Biochem Biophys Res Commun. 2003;309:298-304. [PubMed] [DOI] |
| 9. | Jones EA, Tosh D, Wilson DI, Lindsay S, Forrester LM. Hepatic differentiation of murine embryonic stem cells. Exp Cell Res. 2002;272:15-22. [PubMed] [DOI] |