修回日期: 2005-04-05
接受日期: 2005-04-09
在线出版日期: 2005-07-15
目的: 探讨直肠癌临床病理特征和生物学因素与预后的关系.
方法: 143例直肠癌患者, 青年组31例, 中年组60例, 老年组52例, 中高分化腺癌101例, 其他42例, 低于C期的67例, 淋巴结转移31例, 应用EnVision法分析切片P16ink4a、P53、PCNA和PKC-α的表达, 单因素和多因素分析其对预后的影响.
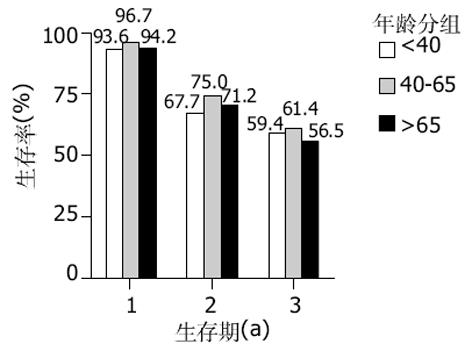
结果: 各年龄组5 a生存率分别为56.5%, 61.4%和59.4%.单因素分析, 预后与病理类型(χ2 = 18.994, P = 0.002)、淋巴结转移情况(χ2 = 13.311, P = 0.021)、临床病理分期(χ2 = 17.075, P = 0.004)及年龄(χ2 = 11.249, P = 0.047)均有显著相关; 与P16ink4a的表达缺失(χ2 = 15.179, P = 0.01)、突变型P53的过度表达(χ2 = 28.185, P<0.001)显著相关.COX模型分析显示, 临床病理类型、病理分期、P16ink4a的表达缺失、突变型P53的过度表达是独立预后因素, P值分别为0.029, 0.028, <0.001和<0.001, 风险比分别为1.982, 2.049, 0.219和4.175.
结论: 直肠癌病理类型、病理分期和P16ink4a、P53是重要的预后指标, 可以指导直肠癌患者术后个体化治疗.
引文著录: 顾军, 王梅, 李永梅, 王雅杰, 薛春燕, 高伟. 直肠癌病理和分子生物特征与预后的多因素分析. 世界华人消化杂志 2005; 13(13): 1602-1606
Revised: April 5, 2005
Accepted: April 9, 2005
Published online: July 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(13): 1602-1606
- URL: https://www.wjgnet.com/1009-3079/full/v13/i13/1602.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i13.1602
结直肠癌是最常见的恶性肿瘤之一.据报道, 1990年全世界约有43 700例患者死于结直肠癌, 其好发年龄为50.5-68.4岁, 通常将发病年龄大于65岁者称为老年人直肠癌.目前, 结直肠癌的治疗较前有了很大的进步, 5 a生存率达到60%左右, 但直肠癌的预后相对差.有关直肠癌预后的临床病理因素已经有较多的研究, 但结果还不一致, 对分子生物标记物在预后中的影响报道的尚少[1-2].我们选取我院手术治疗的143例直肠癌的临床病理资料和分子生物学标记与预后的关系进行回顾性分析, 为预后的判断提供综合性指标, 以利于临床选择术后辅助治疗措施.
我院1997-06/2000-06手术治疗并经病理检查证实的直肠癌患者共223例, 选取完整临床病理资料和随访资料的143例, 按年龄分组, 青年组(<40岁)31例(21.7%, 平均年龄35±4.3岁), 41-65岁组60例(41.9%, 平均年龄56±5.4岁), >65岁组52例(36.4%, 平均年龄71±4.7岁), 其中男95例, 女48例.随访1997-06/2004-04, 共82 mo, 平均52 mo, 中位随访时间61 mo.全部患者术后第1 a内3 mo随访一次, 以后每6 mo随访一次, 建立随访病历档案, 所有临床病理资料指标编码后输入计算机系统, 建立SPSS数据文件, 生存时间从手术后至发生死亡事件(排除与肿瘤无关的死亡).随访方式采取门诊随访、人访、电话或信件, 随访率100%.
143例患者石蜡切片进行回顾性免疫组化分析, 所有病例术前均未经放疗和化疗.抗蛋白激酶c-α(PKC-α)、突变型P53蛋白、增殖细胞核抗原(PCNA)及ink4a编码蛋白P16ink4a单抗购自晶美生物公司, EnVision反应液购自Dako公司.存档蜡块制备4 μm连续切片, 二甲苯脱蜡、梯度酒精水化后置于pH6.0的枸橼酸盐缓冲液中, 微波法修复抗原: 95℃, 5 min×4次, EnVisionTM免疫组化法染色, DAB显色, 按试剂盒说明书常规操作, 各抗体工作浓度按试剂盒说明, 阴性对照用PBS代替一抗, 阳性对照由试剂盒提供.P53及PCNA的表达以胞核出现棕黄色颗粒为阳性; P16为瘤细胞浆和/或核着黄褐色, PKC-α为胞质着色, 阳性细胞>5%为阳性, 阳性细胞<5%为阴性.P16阳性细胞数>25%为阳性, 否则记为阴性.P53和PCNA标记指数(PCNA LI)为每500个细胞的阳性百分比, 切片组织中无阳性细胞为-, 阳性细胞<25%为+, 阳性细胞达25-50%为++, 阳性细胞达>50%为+++.
统计学处理 应用SPSS 11.5软件包进行统计分析, 非参数的Kruskal-Wallis检验, 生存率计算采用Kaplan-Meier法, Log-rank比较各组间生存率, 用Cox回归模型进行多因素分析.
| 65岁以上 | 40-65岁 | 40岁以下 | |||||
| n | % | n | % | n | % | ||
| 性别 | 男 | 36 | 69.2 | 42 | 70 | 17 | 54.8 |
| 女 | 16 | 30.8 | 18 | 30 | 14 | 45.2 | |
| 手术方式 | dixon | 30 | 57.7 | 26 | 43.3 | 21 | 67.7 |
| miles | 16 | 30.8 | 27 | 45 | 9 | 29 | |
| 其他 | 6 | 11.5 | 7 | 11.7 | 1 | 3.2 | |
| 肛门距离 | ≤7 cm | 29 | 55.8 | 36 | 60 | 19 | 61.3 |
| >7 cm | 23 | 44.2 | 24 | 40 | 12 | 38.7 | |
| 肿瘤大小 | ≤5 cm | 48 | 92.3 | 49 | 81.7 | 24 | 77.4 |
| >5 cm | 4 | 7.7 | 11 | 18.3 | 7 | 22.6 | |
| 病理类型 | 高中分化腺癌 | 41 | 78.8 | 40 | 66.7 | 20 | 64.5 |
| 低分化腺癌,黏液腺癌和印戎细胞癌 | 11 | 21.2 | 20 | 33.3 | 11 | 35.5 | |
| 分期 | AB期 | 30 | 57.7 | 26 | 43.3 | 11 | 35.5 |
| C期, 包括部分可切除肝转移的D | 22 | 42.3 | 34 | 56.7 | 20 | 64.5 | |
| 淋巴结转移 | 无淋巴结转移 | 31 | 59.6 | 32 | 53.3 | 14 | 45.2 |
| 黏膜外淋巴结转移 | 10 | 19.2 | 13 | 21.7 | 8 | 25.8 | |
| 肠系膜淋巴结转移 | 11 | 21.2 | 15 | 25 | 9 | 29 | |
| PKC-a | (-) | 22 | 42.3 | 27 | 45 | 13 | 41.9 |
| (+) | 30 | 57.7 | 33 | 585 | 18 | 58.1 | |
| P16 | (-) | 28 | 53.8 | 31 | 51.7 | 13 | 41.9 |
| (+) | 24 | 46.2 | 29 | 48.3 | 18 | 58.1 | |
| P53 | --+ | 27 | 51.9 | 35 | 58.3 | 16 | 51.6 |
| ++-+++ | 25 | 48.1 | 25 | 41.7 | 15 | 48.4 | |
| PCNA | --+ | 24 | 46.2 | 16 | 26.7 | 7 | 22.6 |
| ++-+++ | 28 | 53.8 | 44 | 73.3 | 24 | 77.4a | |
各组在手术方式, 肿瘤至肛门距离, 肿瘤大小方面无明显差异, 青年组比老年组的淋巴结转移比率高(P = 0.573), 但相差不显著; 青年组分化差的低分化腺癌和黏液腺癌、印戒细胞癌的比例较高(P = 0.259), 相差亦无统计学意义; 老年组A、B病例多, 占57.7%, 青年组C期和可切除肝转移的D期病例占64.5%, 但两组相差无统计学差异.
全组PKC阳性表达各组间无显著差异, P16、P53和CA19-9的表达也无显著差异; 青年组和40-65岁组PCNA表达强度比老年组明显高, 强阳性的分别为77.4%、73.3%和53.8%(χ2 = 6.693, P = 0.035).老年组和40-65岁组相差无统计学差异(P = 0.10).
生存时间和病理类型、淋巴结转移情况、临床分期及年龄有显著相关, 和肿瘤大小、肿瘤到肛门距离及性别无明显相关; 抑癌基因P16ink4a的表达缺失、突变型P53的过度表达显著相关, 和PKC-α及PCNA的表达无显著相关性(表2).
| PKC-α | P16 | P53 | PCNA | 分组 | 性别 | 手术方式 | 肛门距离 | 肿瘤大小 | 病理类型 | 淋巴结转移 | 分期 | |
| 卡方值 | 3.945 | 15.18 | 28.19 | 4.675 | 11.25 | 3.450 | 1.710 | 4.857 | 6.556 | 18.99 | 13.31 | 17.08 |
| 自由度 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 |
| P值 | 0.557 | 0.010 | 0.000 | 0.457 | 0.047 | 0.631 | 0.888 | 0.434 | 0.256 | 0.002 | 0.021 | 0.004 |
经Kaplan-Meier法计算各组5 a生存率分别为老年组56.5%, 中年组61.4%, 青年组59.4%, 各年龄组累积生存率见图1, 经Log-rank检验差异无统计学意义(P = 0.8 212).Cox回归模型分析认为生存时间与病理类型、临床病理分期和P16、P53的表达显著相关, P16阳性表达患者成活期长, 野生型P53蛋白表达成活期短(表3).
| 回归系数 | 标准误 | Wald卡方值 | g | P值 | 相对危险度 | 相对危险度95.0%可信区间 | |||
| Lower | Upper | ||||||||
| Step 1 | P53 | 1.288 | 0.287 | 20.086 | 1 | 0.000 | 3.626 | 2.064 | 6.369 |
| Step 2 | P16 | -1.177 | 0.292 | 16.295 | 1 | 0.000 | 0.308 | 0.174 | 0.546 |
| P53 | 1.670 | 0.302 | 30.505 | 1 | 0.000 | 5.314 | 2.938 | 9.613 | |
| Step 3 | 病理类型 | 0.924 | 0.295 | 9.804 | 1 | 0.002 | 2.519 | 1.413 | 4.493 |
| P16 | -1.468 | 0.316 | 21.636 | 1 | 0.000 | 0.230 | 0.124 | 0.428 | |
| P53 | 1.613 | 0.308 | 27.379 | 1 | 0.000 | 5.017 | 2.742 | 9.180 | |
| Step 4 | 病理类型 | 0.684 | 0.313 | 4.788 | 1 | 0.029 | 1.982 | 1.074 | 3.656 |
| 分期 | 0.717 | 0.326 | 4.845 | 1 | 0.028 | 2.049 | 1.082 | 3.880 | |
| P16 | -1.519 | 0.316 | 23.059 | 1 | 0.000 | 0.219 | 0.118 | 0.407 | |
| P53 | 1.429 | 0.316 | 20.458 | 1 | 0.000 | 4.175 | 2.248 | 7.755 | |
近几年直肠癌治疗取得了一些进展, 但是患者的总体生存率仍不能令人满意, 且不同患者临床预后差别很大, 如果能够找到明确的预后因子, 提早鉴别哪类患者需要更积极的治疗和密切随访, 将为提高直肠癌的长期生存、减少复发和肿瘤相关死亡带来较好的益处[2].我们就临床病理因素和分子生物因素对预后的影响进行探索.
文献报道结直肠癌总的存活率韩国为62%, 美国为61%, 维多利亚和澳大利亚为76%.而局限的直肠腺癌的5 a生存率为53-56%, 区域转移性腺癌为39-42%, 有远处转移的腺癌为9-11%.本组病例各年龄组5 a生存率在56.5-61.4%, 与国外报道的一致[3-5].在直肠癌的预后因素中, 多数认为与肿瘤的细胞分化程度、病理分期、肠壁浸润程度, 淋巴结转移和远处转移等显著相关, 而与年龄、性别、肿瘤距肛门的距离及手术方式无明显相关, 但还存在差异.Di Fabio et al[6]研究认为T4病变、年龄大于70岁、淋巴管浸润和神经浸润与生存期减低显著相关, 其中T4(风险比率12.75, P<0.001)和年龄大于70岁(风险比率3.08, P = 0.04)是独立预后因素.Alici et al[7]比较了小于40岁(80例)与大于40岁(382例)的结直肠癌的预后因素, 认为年龄、肿瘤分期、直肠癌位置、淋巴结浸润及血清LDH、CEA水平与预后相关, 肿瘤部位和TNM分期是独立的预后因素.本组资料显示青年组肿瘤大于5 cm的占22.6%, 高于老年组的7.7%, C、D期占64.5%, 而老年组占42.3%, 低分化腺癌、黏液腺癌和印戒细胞癌各组分别是21.2%、33.3%和35.5%, 但均无统计学差异.生存分析中, 各年龄组生存期Kruskal-Wallis检验差异有统计学意义(P = 0.047), 但Log-rank检验并无显著差异, Cox回归分析年龄不是影响生存的独立危险因素, 与文献[7-8]报道不同.其原因可能是年龄分组的差异, 多数报道把青年组定为小于40岁, 老年组定为大于65岁; 同时本研究青年组病例较少, 为便于统计, 将C期和伴可切除肝转移的D期病例合并, 预后差的低分化腺癌和黏液腺癌、印戒细胞癌合并, 这是否影响统计效率, 有待进一步扩大病例数验证.在单因素分析中病理类型、淋巴结转移情况和病理分期与生存时间差异有统计学意义(P = 0.002, 0.021, 0.004), Cox模型的多因素分析也认为病理类型和疾病分期是影响生存期的独立危险因素, 与文献[1,7-8]报道一致.
每种肿瘤发生都有其基因谱系.结直肠癌的基因研究比较多, 但单独研究直肠癌发生的基因谱系研究尚少.p53基因是迄今发现的与人类肿瘤相关性最强的基因, 与p14ARF基因通过mdm2基因相互作用, 三者构成P53-mdm2-p14细胞周期调控分子通路.P53蛋白在DNA损伤应答反应中引起DNA合成抑制基因的表达或诱导凋亡[9].研究表明突变P53可能直接地参与肿瘤的扩散, 肿瘤细胞从基因突变中获得转移潜能, 或从原发肿瘤分离出来后有较强的成活能力[10].本组突变型P53强阳性比率分别为48.1%、41.7%和48.4%, 各组间无显著差异, 但单因素和多因素分析均与预后显著相关(P<0.001), 与文献[11-12]报道一致.Cimoli et al[13]用Meta分析认为野生型P53增加细胞对细胞毒药物的敏感性, 而突变型P53对药物的耐受性增加.这也是表达突变型P53蛋白预后差的原因之一.
P16ink4a是细胞周期蛋白依赖激酶(cyclin-dependent kinase, CDK)抑制因子, 妨碍pRb蛋白磷酸化, 将细胞周期阻断在G1期, 是Rb细胞周期控制通路(P16-Rb-p21ras)中关键分子之一, 在大多数人类肿瘤细胞下调, 其调控失常的机制多为基因缺失、突变、启动子甲基化、其产物被癌基因蛋白所结合及转录后修饰.文献报道P16在结直肠癌中的缺失频率在50-67%之间, 本研究各组的P16表达缺失频率分别为53.6%、51.7%和41.9%, 其表达缺失与年龄无明显相关, 但与生存期显著相关, Cox回归分析P16阴性直肠癌预后差[14-15].
蛋白激酶C(protein kinase C, PKC)是一类Ca2+、磷脂依赖性的蛋白激酶, 在跨膜信号传递过程中起着重要作用.肿瘤PKC-α活性增加引起抗凋亡分子数量增加, 增强多药耐药, 抑制凋亡, 增强细胞渗透能力和浸润能力, 促进肿瘤生长.而在尚未知的状态下, PKC-α活性增加也呈现低浸润性的表型[16].PKC-α过度表达与结肠癌的多药耐药(MDR)相关, 其耐药性与mdr基因无关, 在PKC-α表达的细胞系中, doxorubicin和vincristine摄入减少, 而5-氟脲嘧啶的摄入不受影响, 阻断PKC-α后耐药表型被逆转, 细胞对丝裂霉素、5-氟脲嘧啶和vincristine更敏感[16].本组PKC-α阳性表达率在55.0-58.1%之间, 与患者的长期生存无关(P = 0.557).可能PKC-α使肿瘤浸润和抗肿瘤的双重性取消其对生存期的影响[16].进一步研究PKC-α同工酶在直肠癌中的表达谱, 可以为临床应用PKC-α的抑制剂提供佐证.
PCNA是DNA聚合酶的辅助蛋白, 是细胞增殖周期中的一种核蛋白, 其表达在细胞增殖周期G1后期开始升高, G2/S期交界时达到高峰, G2、M期明显下降, 因此PCNA的阳性表达率可直接反映肿瘤细胞的功能状态和增殖活性.这种增殖活性的升高与预后的关系存在相当的差异, 尚无一致的结论[12,17].本组PCNA增殖指数大于25%的表达在53.8-77.4%, 青年组表达强度比老年组明显高(P = 0.035), 但这种表达强度的差异并未表现出对生存的影响(P = 0.457), 与多数文献结论相同[12].
总之, 直肠癌的病理类型、淋巴结转移情况、病理分期和生物学标记P53、P16ink4a是影响预后的危险因素, 其中病理类型、病理分期和P16ink4a、P53是重要的独立变量, 而年龄、肿瘤大小、肿瘤距肛门的部位、手术方式及PKC-α、PCNA的表达不是影响预后的独立变量.结合临床病理资料和直肠癌相关基因谱分析可能是评估预后的一条良好途径.进一步分析直肠癌的基因表达谱及对预后的意义可能是今后研究的方向, 以便更准确判断预后, 指导制定个体化治疗和随访方案.
编辑: 张海宁
| 2. | Renehan AG, O'Dwyer ST, Whynes DK. Cost effectiveness analysis of intensive versus conventional follow up after curative resection for colorectal cancer. Br Med J. 2004;328:81. [PubMed] [DOI] |
| 3. | Park YJ, Park KJ, Park JG, Lee KU, Choe KJ, Kim JP. Prognostic factors in 2230 korean colorectal cancer patients: analysis of consecutively operated cases. World J Surg. 1999;23:721-726. [PubMed] [DOI] |
| 4. | Gatta G, Ciccolallo L, Capocaccia R, Coleman MP, Hakulinen T, Moller H, Berrino F; EUROCARE Working Group. Differences in colorectal cancer survival between Europe and U. S. populations: the importance of sub-site and morphology. Eur J Cancer. 2003;39:2214-2222. [PubMed] [DOI] |
| 5. | McLeish JA, Thursfield VJ, Giles GG. Survival from colorectal cancer in victoria: 10-year follow-up of the 1987 management survey. ANZ J Surg. 2002;72:352-356. [PubMed] [DOI] |
| 6. | Di Fabio F, Nascimbeni R, Villanacci V, Baronchelli C, Bianchi D, Fabbretti G, Casella C, Salerni B. Prognostic variables for cancer-related survival in node-negative colorectal carcinomas. Dig Surg. 2004;21:128-133. [PubMed] [DOI] |
| 7. | Alici S, Aykan NF, Sakar B, Bulutlar G, Kaytan E, Topuz E. Colorectal cancer in young patients: characteristics and outcome. Tohoku J Exp Med. 2003;199:85-93. [PubMed] [DOI] |
| 9. | Halaschek-Wiener J, Wacheck V, Kloog Y, Jansen B. Ras inhibition leads to transcriptional activation of p53 and down-regulation of Mdm2: two mechanisms that cooperatively increase p53 function in colon cancer cells. Cell Signal. 2004;16:1319-1327. [PubMed] [DOI] |
| 10. | McKay JA, Douglas JJ, Ross VG, Curran S, Loane JF, Ahmed FY, Cassidy J, McLeod HL, Murray GI. Analysis of key cell-cycle checkpoint proteins in colorectal tumours. J Pathol. 2002;196:386-393. [PubMed] [DOI] |
| 11. | Tang R, Wang JY, Fan CW, Tsao KC, Chen HH, Wu CM, Chen JS, Changchien CR, Hsieh LL. P53 is an independent pre-treatment markers for long-term survival in stage II and III colorectal cancers: an analysis of interaction between genetic markers and fluorouracil-based adjuvant therapy. Cancer Lett. 2004;201:101-109. [PubMed] [DOI] |
| 12. | 阎 晓初, 柳 凤轩, 贺 光友, 于 冬梅, 王 宗梅. 大肠肿瘤cyclin D1, p21WAF1/CIP1, P53和增殖细胞核抗原的免疫组化研究. 癌症. 2000;19:974-977. |
| 13. | Cimoli G, Malacarne D, Ponassi R, Valenti M, Alberti S, Parodi S. Meta-analysis of the role of p53 status in isogenic systems tested for sensitivity to cytotoxic antineoplastic drugs. Biochim Biophys Acta. 2004;1705:103-120. [PubMed] |
| 14. | Esteller M, Gonzalez S, Risques RA, Marcuello E, Mangues R, Germa JR, Herman JG, Capella G, Peinado MA. K-ras and P16 aberrations confer poor prognosis in human colorectal cancer. J Clin Oncol. 2001;19:299-304. [PubMed] [DOI] |
| 15. | Cui X, Shirai Y, Wakai T, Yokoyama N, Hirano S, Hatakeyama K. Aberrant expression of pRb and p16INK4a, alone or in combination, indicates poor outcome after resection in patients with colorectal carcinoma. Hum Pathol. 2004;35:1189-1195. [PubMed] [DOI] |
| 16. | Lahn M, Paterson BM, Sundell K, Ma D. The role of protein kinase C-alpha (PKC-a) in malignancies of the gastrointestinal tract. Eur J Cancer. 2004;40:10-20. [PubMed] [DOI] |