修回日期: 2004-11-20
接受日期: 2004-11-25
在线出版日期: 2005-01-01
目的: 检测TNF-α存在条件下HBV体外感染人绒毛膜癌细胞的情况, 为HBV宫内传播机制的研究提供细胞学基础.
方法: 在TNF-α存在条件下, 绒毛膜癌JEGIII细胞与HBV阳性血清(2×1012 HBV DNA/L)共同孵育. 感染后24 h, 胰酶常规消化细胞, PBS充分洗涤, 直至最后一遍洗液ELISA检测HBsAg阴性, 重新接种细胞, 加新鲜培养液继续培养, 每隔12 h, 收集培养标本, 分别用Western blotting, 免疫细胞化学方法, 透射电镜检测培养物中HBV标志物.
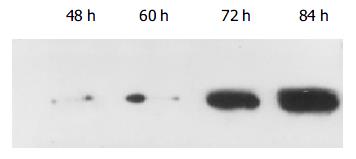
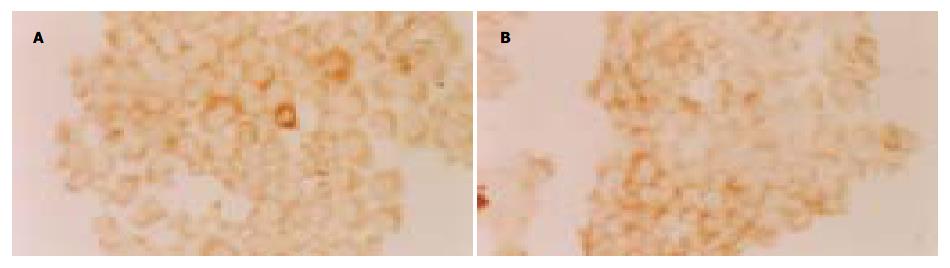
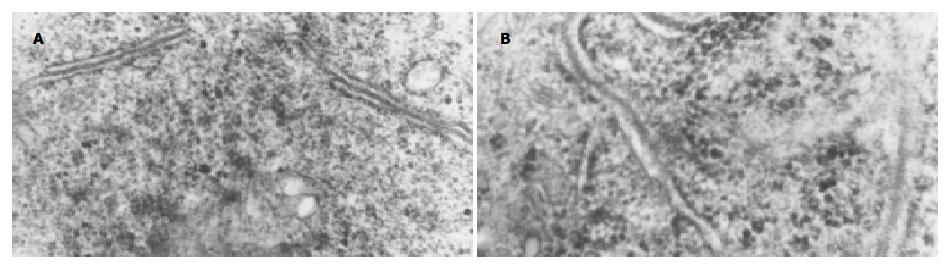
结果: HBV阳性血清感染JEGIII细胞36 h后, 各时间点收集的细胞上清标本中Western blotting均检测到阳性的HBsAg条带, 免疫细胞化学方法检测细胞铺片发现, 在TNF-α存在的感染环境下, HBsAg呈阳性或强阳性表达, 与TNF-α不存在的感染环境下相比有显著性差别(20.40±4016 vs 7.40±1.82, P<0.01), 而且HbsAg主要位于胞膜和/或胞质, 透射电镜下, 细胞扩张的粗面内质网腔内发现有杆状HBsAg颗粒.
结论: HBV体外可以成功感染人绒毛膜癌细胞. 本体外细胞感染模型是深入研究HBV宫内传播机制的关键.
引文著录: 李富军, 王雪萍, 徐德忠, 闫永平, 门可, 张景霞. TNFα对HBV体外感染人绒毛膜癌JEGIII细胞的促进作用. 世界华人消化杂志 2005; 13(1): 31-34
Revised: November 20, 2004
Accepted: November 25, 2004
Published online: January 1, 2005
AIM: To study the in vitro infection of human choriocarcinoma JEGIII cells by hepatitis B virus (HBV) in the presence of TNF-α, and to provide some clues for the mechanism responsible for HBV intrauterine transmission.
METHODS: Human choriocarcinoma-derived JEGIII cells were exposed to HBV (2×1012 HBV DNA/L) in the presence of TNF-α. After an overnight incubation, the cells were then trypsinized, extensively washed with PBS till the last washings were negative for HbsAg as identified by ELISA. The cells were re-inoculated and kept on subculturing with fresh medium. Then the specimens were collected at an interval of 12 hours. HBsAg in supernatants and cells was detected by Western blotting, immunohistochemistry and transmission electron microscopy.
RESULTS: After JEGIII cells were infected with HBV for 36 hours, HBsAg was positive in supernatants collected at different time points. The level of HBsAg was significantly higher in JEGIII cells infected by HBV in the presence of TNF-α than that in the absence of TNF-α(20.40±4016 vs 7.40±1.82, P < 0.01). HBsAg was mainly located in the cytolemma and/or the cytoplasm. Under electron microscope, HBsAg particles were observed in the dilated cisterns of rough surfaced endoplasmic reticulum of the cells.
CONCLUSION: Human choriocarcinoma JEGIII cells can be susceptibly infected by HBV in the presence of TNF-α in vitro, and this may provide some clues for further studying HBV intrauterine transmission.
- Citation: Li FJ, Wang XP, Xu DZ, Yan YP, Men K, Zhang JX. Enhancement effect of TNFα on hepatitis B virus in vitro infection of human choriocarcinoma JEGIII cells. Shijie Huaren Xiaohua Zazhi 2005; 13(1): 31-34
- URL: https://www.wjgnet.com/1009-3079/full/v13/i1/31.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i1.31
HBV感染是一个世界性的公共卫生问题. 乙肝疫苗可以有效地预防乙肝, 对控制HBV产中和产后母婴传播亦取得了令人满意的效果, 但对于母亲宫内HBV传播, 包括乙肝疫苗在内的现有措施却难以发挥作用. 因此, 随着乙肝疫苗的普遍使用, HBV宫内感染的研究已成为控制乙肝流行的关键问题. HBV必须穿过胎盘屏障才能到达胎儿循环和感染胎儿. 其中, 滋养层细胞将母血与胎儿血分开, 并控制二者的物质交换, 是HBV侵入胎盘的关键部位. 因此, 既往研究多以此为重点进行在体研究和流行病学研究[1-9], 现已证实胎盘滋养层细胞HBV呈阳性表达, 然而, 滋养层细胞不是HBV的靶细胞, 细胞表面HBV受体表达量极低. 因此, 滋养层细胞体外到底能否被HBV感染, 依然是有争议的. 我们拟在离体条件下观察HBV感染人绒毛膜滋养层细胞的情况, 为进一步研究其胞内转运过程和胎盘内细胞间传递过程奠定关键基础.
绒毛膜癌细胞株JEGIII购自中国科学研究院动物研究所生殖中心. Ham's F12、DMEM培养基和HEPES购自Gibco公司. 胰蛋白酶和超级小牛血清购自杭州四季青公司. TNFα购自Promega公司. ELISA试剂盒、ABC免疫组化试剂盒、Anti-HBs、兔抗鼠IgG均购自华美生物工程公司. HBV阳性血清采自乙型肝炎患者, 应用HBV核酸扩增荧光定量检测法检测HBV DNA 3次, 试剂盒购自深圳达尔安生物工程有限公司, 得血清浓度为2×1012 HBV DNA/L, 将HBV阳性血清过滤分装并于-80 ℃冻存备用.
1.2.1 JEGIII细胞的培养: 用含100 mL/L灭活小牛血清的FD培养液(含10 g/L的谷氨酰胺和10 g/L的丙酮酸钠)在37 ℃, 50 mL/L CO2孵箱中培养, 每2 d换液1次, 每天于相差显微镜下观察, 当细胞铺满85-90%时进行传代, 等状态稳定后, 液氮冻存4支, 1 wk后复苏检测, 确保冻存成功后, 进行后续实验.
1.2.2 HBV感染JEGIII细胞: 当细胞50-80%铺满时, 加入TNFα, 终浓度为10 mg/L, 2 h后, 再加入HBV阳性血清, 使其终浓度为100 DNA/cell. 孵育24 h后, 弃掉培养液, 用PBS晃动洗涤2遍, 0.125 g/L胰酶消化, 800 r/min离心10 min, PBS洗涤数遍, 直至最后一遍洗液ELISA检测HBsAg阴性为止. 接种细胞于铺有盖玻片的培养板和/或培养瓶中继续培养, 每隔12 h收集细胞和培养上清标本以备后续检测. 同时设HBV阳性血清和TNFα均不加的空白对照组和不加TNFα的对照培养组.
1.2.3 Western blotting: 每隔12 h收集细胞培养上清, 行SDS-变性聚丙烯酰胺凝胶电泳, 电转移至NC膜上. 含5 g/L Tween-20的PBST洗膜5 min. 含50 g/L BSA的封闭液于37 ℃封闭1 h. PBST洗膜15 min×1次, 5 min×2次. 加入PBST稀释好的一抗anti-HBs(1:500), 4 ℃过夜. PBST洗膜15 min×1次, 5 min×2. 加入PBST稀释好的二抗液(1:3000), 37 ℃孵育1 h. PBST洗膜15 min×1次, 5 min×4次. ECL底物发光, X-光片观察照相.
1.2.4 免疫组织化学法检测HBsAg: 每隔12 h收集细胞铺片, PBS洗涤3遍, 纯丙酮固定, 空气中干燥后置于-80 ℃保存待用. 染色时按试剂盒说明书操作. 染色完成后显微镜下观察并照相. 并设立不加HBV阳性血清的空白对照细胞铺片, 以及用PBS代替一抗的替代对照进行质量控制. 在高倍镜下, 共测5个视野, 再取其平均值. 染色结果判定标准: 阴性(-), 无阳性细胞; 弱阳性(+), 阳性细胞数1-25%, 染色较浅; 阳性(++), 阳性细胞数26-75%, 染色中等; 强阳性(+++), 阳性细胞数>75%, 染色较深.
1.2.5 HBV感染JEGIII细胞的透射电镜观察: 待细胞数≥5×106时, 常规将细胞消化, 800 r/min离心10 min, PBS洗涤2遍, 收细胞团块, 加入40 g/L戊二醛前固定, 4 ℃过夜, 0.1 mol/L PB漂洗3次, 10 min/次, 10 g/L锇酸后固定2 h, 500-1000 mL/L梯度乙醇脱水, Epon 812环氧树脂包埋, 60 ℃聚合48 h. LK13-NoVa型超薄切片机切片, 饱和醋酸铀染色10 min, 枸橼酸铅染色10 min, JEM-2000EX型透射电镜观察.
统计学处理 检测数据以mean±SD表示, 组间差异应用单因素方差分析, SPSS12.0软件进行分析. P<0.05为具有显著性差异.
blotting检测 培养混合物经过充分洗涤, 最后一遍洗液HBsAg阴性. 在TNFα存在的感染环境下, HBV感染后36 h, 上清中即可检测到HBsAg, 以后各时间点收集的培养上清中也均检测到阳性HBsAg条带(图1).
在TNFα存在的感染环境下, HBsAg染色呈阳性或强阳性(图2), HBsAg主要位于胞膜和/或胞质, 各时间点之间染色强度差异不显著(P>0.05). 而在TNFα不存在的感染环境下, HBsAg染色呈阴性或弱阳性, 二者差异显著(20.40±4.16 vs 7.40±1.82, P<0.01).
在TNF存在的感染环境下, 细胞扩张的粗面内质网腔内, 发现有杆状HBsAg颗粒(图3).
HBV从感染的母亲传给胎儿必须通过由绒毛滋养层、绒毛内薄层结缔组织、和绒毛内毛细血管内皮组成的胎盘屏障. 绒毛表面的滋养层在母胎之间形成一连续的物理屏障, 具有选择性通透作用, 避免了母胎之间免疫活性细胞的直接接触, 对病原微生物也有一定的阻挡作用. 但某些病毒却会以某种方式通过胎盘屏障到达胎儿血循环[10-11]. 病毒通过胎盘屏障的机制目前尚不清楚. 由于胎盘屏障的第一层细胞是滋养层细胞, 该层细胞直接与母亲血液接触, 因此, 滋养层细胞在病毒宫内传播中的作用不容忽视[12-16]. 多位学者对滋养层细胞进行体外培养, 然后用病毒进行感染, 发现在离体状态下, 某些病毒可感染合体滋养层细胞[17-21]. 这些结果说明, 滋养层细胞在离体情况下可以被某些病毒感染, 从而为病毒宫内感染机制的研究指明了方向.
我们曾经报道了HBV可以感染体外培养的人绒毛膜滋养层细胞, 但感染效率很低[22,23]. 对结果进行分析, 认为体外单纯地将滋养层细胞和HBV混合孵育, 或许不能更好地模拟体内细胞被病毒感染情况, 因此, 有必要摸索更接近怀孕期间滋养层细胞体内生存环境的体外感染方法. 怀孕期间人体的生理活动是复杂而又有其自身特征的, 其中一大特征是由孕体和/或子宫的逐步调节方式产生一系列细胞因子, 这些因子在孕期发挥着重要作用[24-26]. 孕期胎盘微环境中特异的细胞因子在调控细胞活性的同时, 可能也促进病毒的感染. 肿瘤坏死因子α在HIV宫内传播中的作用已引起了研究人员的注意[27-29].首先, HIV感染胎盘组织中滋养层细胞上TNFα呈高表达, 而且表达量与滋养层细胞中HIV Gag转录体的数量呈现显著正相关[27]. 第二, TNFα预处理的滋养层细胞与淋巴细胞的黏附力增强[28]. 第三, 巨噬细胞与滋养层细胞间的黏附可以上调由巨噬细胞分泌的TNFα调节的HIV的表达[29]. 而且, 有趣的是TNFα发挥作用主要在怀孕初期和分娩时. 该时间点与HIV宫内传播高危时间段相一致[30]. 本研究结果也表明, 在TNFα不存在的感染系统中, 滋养层细胞HBV感染标志物呈阴性或弱阳性, 而在TNFα存在的感染系统中, 滋养层细胞HBV感染标志物呈阳性或强阳性. 提示HBV感染滋养层细胞在孕期可能也主要集中在两个时间点: 怀孕初期, 此阶段滋养层细胞高度增生和侵袭性移行; 足月分娩时. 本研究结果与我们的预期结果基本一致, 初步证实了HBV体外可以感染培养的滋养层细胞, TNFα的存在, 可以更好地模拟孕期体内滋养层细胞生存微环境, 对其感染有促进作用. 总而言之, 我们建立的体外模型是进一步研究HBV宫内传播分子基础的有用工具.
感谢中科院动物所生殖中心庄临之、王雁玲教授在细胞培养方面给予的指导和帮助. 感谢第四军医大学张伟博士在实验操作方面的帮助.
编辑: 潘伯荣 审读: 张海宁
| 1. | Yan Y, Xu D, Wang W. The role of placenta in hepatitis B virus intrauterine transmission. Zhonghua Fuchanke Zazhi. 1999;34:392-395. [PubMed] |
| 2. | Xu DZ, Yan YP, Zou S, Choi BC, Wang S, Liu P, Bai G, Wang X, Shi M, Wang X. Role of placental tissues in the intrauterine transmission of hepatitis B virus. Am J Obstet Gynecol. 2001;185:981-987. [PubMed] |
| 3. | Xu DZ, Yan YP, Choi BC, Xu JQ, Men K, Zhang JX, Liu ZH, Wang FS. Risk factors and mechanism of transplacental transmission of hepatitis B virus: a case-control study. J Med Virol. 2002;67:20-26. [PubMed] |
| 4. | Xu D, Yan Y, Xu J. A molecular epidemiology study on risk factors and mechanism of HBV intrauterine transmission. Zhonghua Yixue Zazhi. 1999;79:24-27. [PubMed] |
| 5. | Zhang SL, Yue YF, Bai GQ, Shi L, Jiang H. Mechanism of intrauterine infection of hepatitis B virus. World J Gastroenterol. 2004;10:437-438. [PubMed] |
| 6. | Yue YF, Jiang H, Shi L, Li LF, Xi BS, Yu YL, Chen GF. Study on the mechanism of intrauterine infection of hepatitis B virus. Zhonghua Fuchanke Zazhi. 2004;39:224-226. [PubMed] |
| 7. | Liu Y, Kuang J, Zhang R, Lin S, Ding H, Liu X. Analysis about clinical data of intrauterine infection of hepatitis B virus. Zhonghua Fuchanke Zazhi. 2002;37:465-468. [PubMed] |
| 8. | Guo PF, Zhong M, Hou JL. Genotyping study of hepatitis B virus in its intrauterine transmission. Diyi Junyi Daxue Xuebao. 2002;22:303-305. [PubMed] |
| 9. | Yue Y, Yang X, Zhang S. Prevention of intrauterine infection by hepatitis B virus with hepatitis B immune globulin: efficacy and mechanism. Chin Med J (Engl). 1999;112:37-39. [PubMed] |
| 10. | Oliveira LH, Fonseca ME, de-Bonis M. Echovirus type 19 and herpes simplex type 2 infection in human placenta tissue explants. Braz J Med Biol Res. 1993;26:703-717. [PubMed] |
| 11. | Douglas GC, Thirkill TL, LaSalle J. Automated quantitation of cell-mediated HIV type 1 infection of human syncytiotrophoblast cells by fluorescence in situ hybridization and laser scanning cytometry. AIDS Res Hum Retroviruses. 2001;17:507-516. [PubMed] |
| 12. | Hemmings DG, Kilani R, Nykiforuk C, Preikstaitis J, Guilbert LJ. Permissive cytomegalovirus infection of primary villous term and first trimester trophoblasts. J Virol. 1998;72:4970-4979. |
| 13. | Arechavaleta-Velasco F, Koi H, Strauss JF, Parry S. Viral infection of the trophoblast: time to take a serious look at its role in abnormal implantation and placentation? J Reprod Immunol. 2002;55:113-121. [PubMed] |
| 14. | Lagaye S, Derrien M, Menu E, Coïto C, Tresoldi E, Mauclère P, Scarlatti G, Chaouat G, Barré-Sinoussi F, Bomsel M. Cell-to-cell contact results in a selective translocation of maternal human immunodeficiency virus type 1 quasispecies across a trophoblastic barrier by both transcytosis and infection. J Virol. 2001;75:4780-4791. [PubMed] |
| 15. | Schwartz DH, Sharma UK, Perlman EJ, Blakemore K. Adherence of human immunodeficiency virus-infected lymphocytes to fetal placental cells: a model of maternal --> fetal transmission. Proc Natl Acad Sci USA. 1995;92:978-982. [PubMed] |
| 16. | Koi H, Zhang J, Parry S. The mechanisms of placental viral infection. Ann N Y Acad Sci. 2001;943:148-156. [PubMed] |
| 17. | Bácsi A, Ebbesen P, Szabó J, Beck Z, Andirkó I, Csoma E, Tóth FD. Pseudotypes of vesicular stomatitis virus-bearing envelope antigens of certain HIV-1 strains permissively infect human syncytiotrophoblasts cultured in vitro: implications for in vivo infection of syncytiotrophoblasts by cell-free HIV-1. J Med Virol. 2001;64:387-397. [PubMed] |
| 18. | Rüth J, Conesa C, Dieci G, Lefebvre O, Düsterhöft A, Ottonello S, Sentenac A. A suppressor of mutations in the class III transcription system encodes a component of yeast TFIIIB. EMBO J. 1996;15:1941-1949. [PubMed] |
| 19. | Gabrielli L, Losi L, Varani S, Lazzarotto T, Eusebi V, Landini MP. Complete replication of human cytomegalovirus in explants of first trimester human placenta. J Med Virol. 2001;64:499-504. [PubMed] |
| 20. | Fisher S, Genbacev O, Maidji E, Pereira L. Human cytomegalovirus infection of placental cytotrophoblasts in vitro and in utero: implications for transmission and pathogenesis. J Virol. 2000;74:6808-6820. [PubMed] |
| 21. | Tóth FD, Aboagye-Mathiesen G, Nemes J, Liu X, Andirkó I, Hager H, Zdravkovic M, Szabó J, Kiss J, Aranyosi J. Epstein-Barr virus permissively infects human syncytiotrophoblasts in vitro and induces replication of human T cell leukemia-lymphoma virus type I in dually infected cells. Virology. 1997;229:400-414. [PubMed] |
| 22. | Wang XP, Xu DZ, Li YG, Yan YP, Men K, Zhang JX. HBsAg uptake into human trophoblasts cultured in vitro. Diyi Junyi Dayue Xuebao. 2003;23:16-20. [PubMed] |
| 23. | Wang XP, Xu DZ, Li YG, Yan YP, Zhang JX, Huang J. In vitro culture of human trophoblasts [in English]. J Fourth Mil Med Univ. 2002;23:2023-2026. |
| 24. | Guilbert L, Robertson SA, Wegmann TG. The trophoblast as an integral component of a macrophage-cytokine network. Immunol Cell Biol. 1993;71:49-57. [PubMed] |
| 25. | Douglas GC, Thirkill TL. Chemokine receptor expression by human syncytiotrophoblast--a review. Placenta. 2001;22 Suppl A:S24-S28. [PubMed] |
| 26. | Mognetti B, Moussa M, Croitoru J, Menu E, Dormont D, Roques P, Chaouat G. HIV-1 co-receptor expression on trophoblastic cells from early placentas and permissivity to infection by several HIV-1 primary isolates. Clin Exp Immunol. 2000;119:486-492. [PubMed] |
| 27. | Vidricaire G, Tardif MR, Tremblay MJ. The low viral production in trophoblastic cells is due to a high endocytic internalization of the human immunodeficiency virus type 1 and can be overcome by the pro-inflammatory cytokines tumor necrosis factor-alpha and interleukin-1. J Biol Chem. 2003;278:15832-15841. [PubMed] |
| 28. | Lee BN, Ordonez N, Popek EJ, Lu JG, Helfgott A, Eriksen N, Hammill H, Kozinetz C, Doyle M, Kline M. Inflammatory cytokine expression is correlated with the level of human immunodeficiency virus (HIV) transcripts in HIV-infected placental trophoblastic cells. J Virol. 1997;71:3628-3635. [PubMed] |
| 29. | Zachar V, Fink T, Koppelhus U, Ebbesen P. Role of placental cytokines in transcriptional modulation of HIV type 1 in the isolated villous trophoblast. AIDS Res Hum Retroviruses. 2002;18:839-847. [PubMed] |