修回日期: 2004-07-09
接受日期: 2004-07-22
在线出版日期: 2004-09-15
目的: 通过内毒素联合精氨酸诱导自分泌的一氧化氮(No)及其限速酶的表达, 观察人肝癌细胞Bel-7402自分泌的一氧化氮的改变对其增生及凋亡的影响.
方法: Bel-7402细胞中NO产生的限速酶为诱生型合酶(iNOS), 其底物为精氨酸(L-Arg). 采用MTT法观察不同浓度的L-Arg及内毒素(LPS)对细胞增生的影响. 采用细胞免疫组化的方法对iNOS在细胞中的表达进行观察. Tunel法观察NO对细胞凋亡的影响.
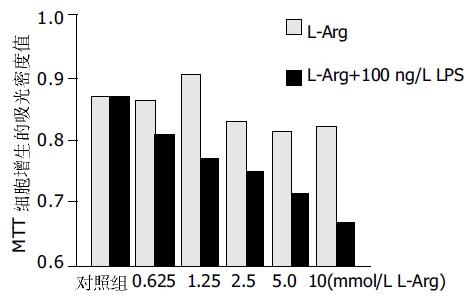
结果: 在iNOS的表达不受影响的情况下, 0.625 mmol/L的L-Arg产生低浓度的NO, 对细胞的增生有促进作用(对照组0.86±0.01, 处理组0.87±0.02 P >0.05), 2.5 mmol/L-Arg产生高浓度的NO, 对细胞的增生有抑制作用(对照组0.86±0.01, 0.83±0.01 P <0.05). 100 ng/L LPS使iNOS的表达增强, 使单位时间内NO的生成增多, 细胞增生受抑. 与L-Arg有协同作用. 高浓度的NO能够促进细胞的凋亡.
结论: LPS可能通过促进iNOS的产生, 在精氨酸的协同作用下, 促进细胞凋亡, 抑制细胞增生.
引文著录: 孟玫, 姜军梅, 尹晓燕, 朱菊人. 内毒素联合精氨酸对人肝癌细胞Bel-7402增生及凋亡的影响. 世界华人消化杂志 2004; 12(9): 2053-2056
Revised: July 9, 2004
Accepted: July 22, 2004
Published online: September 15, 2004
AIM: To study the effect of endogenous nitric oxide (NO) on the proliferation and apoptosis in human liver carcinoma cell line 7402 through regulation of the speed limit enzyme and the concentration of substrate in the process of No production.
METHODS: The speed limit enzyme in the process of NO production in 7402 cell is inducible nitric oxide synthase (iNOS), and its substrate is L-arginine (L-Arg).The cells were cultured in the Dulbecco's modified Eagle medium, which was without L-Arg. Different concentration of L-Arg was added into the culture medium and lipopolysaccharide (LPS) of 100 ng/L was added at the same time. MTT method was adopted to describe the proliferation of the cells. Immunohistochemical method was performed to determine the expression of iNOS. The TUNEL method was used to detect the apoptosis in situ.
RESULTS: Without change of the expression and activity of iNOS, L-Arg of 0.625 mmol/L produced NO with low concentration, it could promote the proliferation of the cells. On the contrary, L-Arg of 2.5 mmol/L inhibited the proliferation of the cells and improved the apoptotic rate of the cells. LPS of 100 ng/L could promote the expression and activity of iNOS in the cells. The production of NO in unit time was increased if the substrate was enough.
CONCLUSION: Low concentration of NO promotes the proliferation of the cells. High concentration of NO can inhibit the proliferation and promote the apoptosis of the cells. Increasing the production of endogenous NO by stimulating the expression and activity of its own iNOS is an effective way to inhibit the cells proliferation and promote its apoptosis.
- Citation: Meng M, Jiang JM, Yin XY, Zhu JR. Effects of lipopolysaccharide with L-arginine on proliferation and apoptosis of human hepatocellular carcinomacell line Bel-7402. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2053-2056
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2053.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2053
一氧化氮(NO)在人体内具有广泛的生物学活性[1-5], 目前对于与肿瘤关系的研究表明, 不论是巨噬细胞、自然杀伤细胞、内皮细胞分泌的NO, 还是化学反应提供的外源性NO, 都能通过内分泌或旁分泌的方式诱导肿瘤细胞凋亡和/或细胞毒作用抑制肿瘤细胞的增生[6-12]. 但对于诱导表达iNOS的肝癌细胞自身NO的生成对其增生和凋亡的影响尚未见报道, 我们通过在不含反应底物L-Arg的肝癌细胞株培养基中补充L-Arg, 在L-Arg充足的情况下用内毒素诱导肝癌细胞株iNOS的表达, 提高NO的产生, 从而对NO在肝癌细胞中的自分泌作用进行了探讨.
兔抗人iNOS一抗, SABC试剂盒和TUNEL细胞凋亡试剂盒均购自武汉博士德生物工程公司; 无L-精氨酸培养基DMEM和新生牛血清购自美国Hyclone公司; L-精氨酸及其拮抗剂L-NAME(Nω-nitro-L-Arginine methyl ester)购自美国Sigma公司; 内毒素由上海第二军医大学微生物教研室王路先生惠赠; 胰蛋白酶购于上海华美生物工程公司; 人肝癌细胞株Bel-7402由山东省立医院中心实验室王春霞老师惠赠. 细胞置于37 ℃, 50 mL/L CO2孵育箱内, 以含100 mL/L新生牛血清的无L-精氨酸的DMEM培养液培养, 培养液中因小牛血清中含有的L-Arg<10 mmol/L, 在细胞培养生长1 d后, 已基本消耗, 可忽略不计(Blood 1996;87:5136) , 传代数次以耗尽Bel-7402细胞内的L-Arg库. 然后取对数生长期的细胞, 实验时以2.5 g/L的胰蛋白酶消化, 制成单细胞悬液, 按实验所需进行处理.
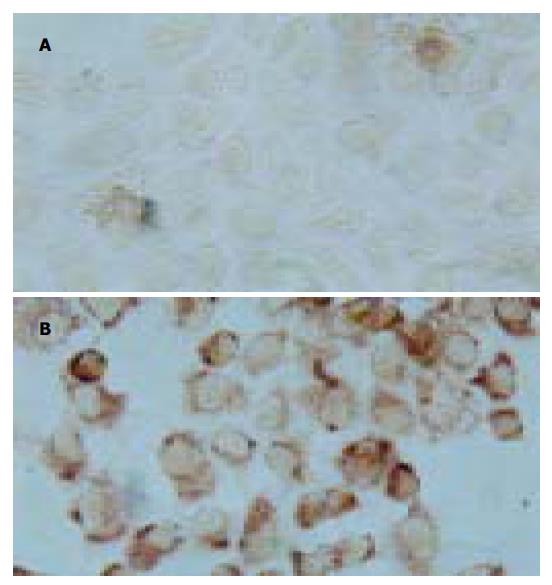
实验孔分别加入终浓度为10, 5, 2.5, 1.25, 0.625 mmol/L的L-Arg处理, 观察不同浓度的L-Arg 对Bel-7402增生的影响, 诱导人肝癌细胞Bel-7402中iNOS的表达对人肝癌细胞7402增生的影响. 由 LPS诱导iNOS的表达, 研究NO对细胞增生的影响, 根据肝硬化患者体内门静脉的LPS浓度范围是88±35 ng/L, 故本研究取LPS的浓度为100 ng/L. LPS组加入LPS100 ng/L. LPS(100 ng/L)加L-Arg组, L-Arg所设的5组浓度同上. 同时设置对照孔, 不加任何干扰因素. 每组设6个复孔, 作用24 h后观察细胞的形态学改变. 采用四甲基偶氮唑兰盐(MTT)法向已无培养液的孔中加入1 g/L MTT 200 mL, 作用4 h后, 甩掉培养液, 加入20 g/L DMSO 200 mL, 孵育10 min, 在酶标仪(Denley Drangon Wellscan MK2 )570nm处测吸光度A值. 免疫组织化学按试剂盒说明ABC法操作, 检测iNOS在胞质中的表达. DNA末端原位标记染色法(TUNEL)检测细胞凋亡. iNOS的免疫组化结果以胞质中出现棕褐色颗粒为阳性结果, Tunel结果以胞核中出现蓝色着色为阳性结果. 凋亡指数(apoptosis index, AI)计算方法: 数5个高倍镜视野>1 000个细胞, 分别计算凋亡细胞数和总细胞数. AI=细胞凋亡/总细胞数×100%.
统计学处理 MTT的吸光密度值及生化测定结果采用One-way ANOVA、Two-way ANOVA法进行分析, 免疫组化的着色程度经高清晰度彩色病理图文分析仪(HIPA1000)进行光密度分析, 进行t检验.
在未加L-Arg的培养基中生长的细胞形态肿胀, 体积增大, 分裂相较少, 细胞密度减少, 细胞之间的连接较疏松, 培养液的颜色变化较慢, 培养液中悬浮的细胞较多; 在低浓度L-Arg的培养基中生长的细胞形态正常, 体积较小, 增生较快, 分裂相较多, 细胞的分布密度较大, 细胞之间的连接较紧密, 培养液的颜色变化较快, 上清液中悬浮的细胞较少; 而高浓度的L-Arg对细胞的增生有抑制作用, 细胞形态明显肿胀, 体积增大, 增生缓慢, 贴壁细胞明显减少, 细胞间的连接最为疏松, 培养液中悬浮的细胞明显增多, 培养液的颜色变化较慢. L-Arg和内毒素对细胞增生的抑制具有协同作用, 使细胞增生明显受抑.
细胞中的棕褐色颗粒明显高于对照组, 两组A: 0.028±0.02和0.25±0.05 (P <0.05, 图1).
以只加L-Arg的实验组为对照组, 在内毒素诱导iNOS表达并加L-Arg组, 细胞凋亡率明显增加, 两组凋亡率: 9.3±5.2%, 18.6±4.6%, P <0.05 MTT法测细胞增生无诱导iNOS表达变化的因素存在时, 0.625 mmol/L L-Arg处理过的肝细胞的增生(0.86±0.01)与对照组(0.87±0.02)无明显差异, 而较低浓度(0.625<L-Arg浓度≤1.25 mmol/L)的L-Arg (0.91±0.01)对细胞的增生有促进作用. 高浓度(≥2.5 mmol/L)的L-Arg(0.83±0.01, 0.82±0.03, 0.82±0.02) 对细胞的增生有抑制作用. 并且在达到一定的浓度(5 mmol/L)以后, 对细胞增生的抑制处于平台期, 差异无显著性. L-Arg和内毒素抑制细胞增生具有协同作用, 可提高L-Arg的有效浓度(图2).
我们将肝癌细胞株Bel-7402培养在无L-Arg的培养基中, 使其处于基本无NO的环境中, 然后在培养基中加入由低至高的不同浓度的L-Arg, 镜下观察到在无NO的培养条件下Bel-7402细胞形态肿胀, 分裂相较少, 细胞密度较底, 细胞之间的连接松散, 培养液的颜色变化较慢, 提示在无NO的条件下细胞的代谢较缓慢生长受抑制. 在培养基中加入0.625 mmol/L的L-Arg继续培养细胞, 我们观察到 Bel-7402细胞呈现特征性的多角形, 细胞核分裂相明显增加, 细胞密度较大, 细胞间的连接紧密, 培养液的颜色变化较快, 提示细胞的生长代谢旺盛, 低浓度的L-Arg对Bel-7402有促进增生的作用. 而2.5 mmol/L以上的L-Arg培养组我们观察到贴壁细胞减少, 悬浮细胞增多, 提示高浓度L-Arg对细胞增生起抑制作用. 在L-Arg联合LPS(100 ng/L)的各培养组观察到细胞的增生呈抑制状态. 免疫组化显示LPS诱导了细胞中iNOS的表达. DNA末端原位标记染色法(TUNEL)证实L-Arg联合LPS培养组细胞凋亡率明显增加.
低浓度的L-Arg则可能被优先作为细胞的营养成分被利用, 从而促进了细胞的生长. 用LPS刺激肝癌细胞, 使肝癌细胞中iNOS的表达及活性增强, 发现各种L-Arg浓度对肝癌的增生的抑制作用明显增强, 低浓度的L-Arg对细胞的增生亦呈抑制作用. 原因可能是在无L-Arg培养基中培养的肝癌细胞表达较弱且低活性的iNOS, 加入大于2.5 mmol/L的L-Arg可满足iNOS对底物的需要, 使细胞内NO的单位时间生成量达到最大, 部分细胞因此而发生凋亡或死亡.
细胞中iNOS的表达受许多因素的影响[13-14], LPS是确定因素之一, 还能增强其活性[15] .所以在用LPS刺激以后iNOS的表达增强, 对底物量的要求增高, 故在2.5 mmol/L以上浓度组单位时间NO的生成因底物的增加而增加, 而低浓度的L-Arg联合LPS后对细胞的增生亦呈抑制作用, 可能是因为LPS刺激iNOS的活性增强, 在单位时间内产生的NO增多, 浓度增大使细胞死亡的缘故. 有研究证实NO对细胞的作用决定于其单位时间内的生成量, 即NO在达到一定的浓度后才可以发挥细胞毒作用或促进细胞凋亡的作用, 低浓度的NO在体参与正常的细胞信息传递和生长代谢[16-19]. 本研究的结果与之相符. LPS诱导Bel-7402中iNOS的表达, 在培养基中有充分的底物的前提下, 迅速合成大量的NO分泌至培养基中, 对自身的增生与凋亡发生影响. 有研究证实内毒素血症时, 选择性抑制iNOS对内毒素肝损伤有保护作用, 提示iNOS 及其合成的NO对肝细胞具有损伤作用[20], 这可能因为L-Arg为非必需氨基酸, 可在体内合成, 能够在限速酶充足的情况下, 产生大量的NO, 对肝脏造成损伤. 本结果内毒素与L-Arg的协同作用相符合.
调节NO在肿瘤细胞中的代谢可能有一定的治疗潜能[21-27]. 本实验结果提示在诱导iNOS的表达及活性的同时补充适当的L-Arg, 对肝癌的治疗可能有一定的辅助作用. 除内毒素外可考虑其他能够刺激iNOS表达的药物如5-氟尿嘧啶、g-干扰素等并补充其底物L-Arg, 对原发性肝细胞癌进行辅助治疗.
| 1. | Oktem G, Karabulut B, Selvi N, Sezgin C, Sanli UA, Uslu R, Yurtseven ME, Omay SB. Differential effects of doxorubicin and docetaxel on nitric oxide production and inducible nitric oxide synthase expression in MCF-7 human breast cancer cells. Oncol Res. 2004;14:381-386. [PubMed] |
| 2. | Caron MH, Alling C. Role of nitric oxide in ethanol-induced up-regulation of muscarinic acetylcholine receptors in SH-SY5Y cells. Alcohol Clin Exp Res. 2001;25:1107-1113. [PubMed] [DOI] |
| 4. | Vijh AK. High infectious burden, low cancer incidence, and early malignancy in developing countries: a molecular hypothesis in term of the role of nitric oxide. Med Hypotheses. 2004;63:208-210. [PubMed] [DOI] |
| 5. | Ji C, Kaplowitz N. Hyperhomocysteinemia, endoplasmic reticulum stress, and alcoholic liver injury. World J Gastroenterol. 2004;10:1699-1708. [PubMed] [DOI] |
| 7. | Xia HH, Wong BC. Nitric oxide in Helicobacter pylori-induced apoptosis and its significance in gastric carcinogenesis. J Gastroenterol Hepatol. 2003;18:1227-1230. [PubMed] [DOI] |
| 8. | Vekemans K, Braet F, Muyllaert D, Wisse E. Nitric oxide from rat liver sinusoidal endothelial cells induces apoptosis in IFN gamma-sensitized CC531s colon carcinoma cells. J Hepatol. 2004;41:11-18. [PubMed] [DOI] |
| 9. | Kumamoto H, Suzuki T, Ooya K. Immunohistochemical analysis of inducible nitric oxide synthase (iNOS) and heat shock proteins (HSPs) in ameloblastomas. J Oral Pathol Med. 2002;31:605-611. [PubMed] [DOI] |
| 10. | Broholm H, Rubin I, Kruse A, Braendstrup O, Schmidt K, Skriver EB, Lauritzen M. Nitric oxide synthase expression and enzymatic activity in human brain tumors. Clin Neuropathol. 2003;22:273-281. [PubMed] |
| 12. | Kasper HU, Wolf H, Drebber U, Wolf HK, Kern MA. Expression of inducible nitric oxide synthase and cyclooxygenase-2 in pancreatic adenocarcinoma: correlation with microvessel density. World J Gastroenterol. 2004;10:1918-1922. [PubMed] [DOI] |
| 13. | Shen ZY, Shen WY, Chen MH, Shen J, Cai WJ, Yi Z. Nitric oxide and calcium ions in apoptotic esophageal carcinoma cells induced by arsenite. World J Gastroenterol. 2002;8:40-43. [PubMed] [DOI] |
| 14. | Oshima T, Imada T, Nagashima Y, Cho H, Shiozawa M, Rino Y, Takanashi Y. Role of nitric oxide in human gastric cancer cells treated with 5-fluorouracil. Oncol Rep. 2001;8:847-849. [PubMed] [DOI] |
| 15. | Ikezoe T, Yang Y, Heber D, Taguchi H, Koeffler HP. PC-SPES: a potent inhibitor of nuclear factor-kappa B rescues mice from lipopolysaccharide-induced septic shock. Mol Pharmacol. 2003;64:1521-1529. [PubMed] [DOI] |
| 16. | Liu J, Li C, Qu W, Leslie E, Bonifant CL, Buzard GS, Saavedra JE, Keefer LK, Waalkes MP. Nitric oxide prodrugs and metallochemotherapeutics: JS-K and CB-3-100 enhance arsenic and cisplatin cytolethality by increasing cellular accumulation. Mol Cancer Ther. 2004;3:709-714. [PubMed] |
| 17. | Tomita R, Tanjoh K, Fujisaki S, Fukuzawa M. The role of nitric oxide (NO) in the human internal anal sphincter. J Gastroenterol. 2001;36:386-391. [PubMed] [DOI] |
| 20. | Wang H, Chen XP, Qiu FZ. Increased hepatic expression of nitric oxide synthase type II in cirrhotic rats. World J Gastroenterol. 2004;10:1923-1927. [PubMed] [DOI] |
| 21. | Song ZJ, Gong P, Wu YE. Relationship between the expression of iNOS,VEGF,tumor angiogenesis and gastric cancer. World J Gastroenterol. 2002;8:591-595. [PubMed] [DOI] |
| 22. | Lim SY, Jang JH, Surh YJ. Induction of cyclooxygenase-2 and peroxisome proliferator-activated receptor-gamma during nitric oxide-induced apoptotic PC12 cell death. Ann N Y Acad Sci. 2003;1010:648-658. [PubMed] [DOI] |
| 23. | Xu MH, Deng CS, Zhu YQ, Lin J. Role of inducible nitric oxide synthase expression in aberrant crypt foci-adenoma-carcinoma sequence. World J Gastroenterol. 2003;9:1246-1250. [PubMed] [DOI] |
| 24. | Inano H, Onoda M. Role of nitric oxide in radiation-induced initiation of mammary tumorigenesis in rats. Nitric Oxide. 2003;8:144-148. [PubMed] [DOI] |
| 25. | Li HL, Sun BZ, Ma FC. Expression of COX-2, iNOS, p53 and Ki-67 in gastric mucosa-associated lymphoid tissue lymphoma. World J Gastroenterol. 2004;10:1862-1866. [PubMed] [DOI] |
| 26. | Song ZY, Wen SQ, Peng JP, Huang X, Qian KD. Significance of vascular endothelial growth factor expression and its correlation with inducible nitric oxide synthase in gastric cancer. World J Gastroenterol. 2004;10:1250-1255. [PubMed] |
| 27. | Wang Z, Cook T, Alber S, Liu K, Kovesdi I, Watkins SK, Vodovotz Y, Billiar TR, Blumberg D. Adenoviral gene transfer of the human inducible nitric oxide synthase gene enhances the radiation response of human colorectal cancer associated with alterations in tumor vascularity. Cancer Res. 2004;64:1386-1395. [PubMed] [DOI] |