修回日期: 2004-04-09
接受日期: 2004-04-29
在线出版日期: 2004-09-15
目的: p27kip1 氨基端第10号位置的丝氨酸(Ser10)磷酸化位点是该蛋白分子中最重要的磷酸化位点, 探讨人工诱变该位点丝氨酸为丙氨酸(S10A)后对肝癌细胞株HepG2细胞周期以及细胞增生的影响. 同时比较野生型p27kip1和Ser10突变型p27kip1基因转染对肝癌细胞株HepG2细胞周期和增生的影响.
方法: 应用脂质体转染法将含人野生型和突变型p27kip1质粒DNA瞬时转染HepG2细胞, 免疫细胞化学检测p27kip1蛋白的表达和细胞内分布, 流式细胞计数仪分析细胞周期变化.
结果: 野生型和突变p27kip1 蛋白转基因后HepG2细胞均可以G0期阻滞, 且突变型的阻滞作用强于野生型(P <0.05), 细胞生长受到抑制. 无血清培养96 h同步化于G0期, 野生型和突变型p27kip1均分布于细胞核; 而在20 mL/L血清继续培养8 h后野生型向细胞质转运而主要分布于细胞质, 突变型仍然滞留于细胞核.
结论: p27kip1 的过度表达可明显抑制HepG2细胞的增生, p27kip1Ser10磷酸化可能介导其细胞核外转运的重要分子机制.
引文著录: 管晓翔, 陈龙邦, 张爱华, 王靖华, 德伟. 抑癌基因p27Kip1及其 Ser10突变体对HepG2细胞周期和增生的影响. 世界华人消化杂志 2004; 12(9): 2041-2044
Revised: April 9, 2004
Accepted: April 29, 2004
Published online: September 15, 2004
AIM: To investigate the influence of over-expression of exogenous p27kip1 gene on cell cycle and proliferation in HepG2 cell line, and to elucicate the role of phosphorylation of ser10 of p27kip1 protein in its subcellular localization.
METHODS: Both plasmids containing the wild type and S10A p27kip1 were transfected into HepG2 cell lines with Lipofectamine separately. The exogenous p27kip1 protein expression and subcellular localization was monitored with immunoflurescence under laser confocal microscope. Its biological effects on cell cycle and proliferation were determined by FACS and growth curves.
RESULTS: Over-expression of p27kip1 protein was observed in transfected cells. As a result, the proliferation of HepG2 cells was greatly inhibited and cell cycle was arrested in G1 phase after exogenous p27kip1 expression. Both the wild type and S10A p27kip1 protein were distributed in the nucleus when synchronized at G0 phase by serum deprivation for 96 hours. The wild type p27kip1 protein was translocated from nucleus to cytoplasm when the cell was restimulated by exposure to 20% serum for 8 h, whereas the S10A p27kip1 still presented in the nucleus.
CONCLUSION: The overexpression of p27kip1 can inhibit the proliferation of HepG2, and phosphorylation of p27kip1 on serine10is required for its nuclear export.
- Citation: Guan XX, Chen LB, Zhang AH, Wang JH, De W. Role of phosphorylation of ser10 of p27Kip1 in its subcellular localization in HepG2 cell lines. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2041-2044
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2041.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2041
肝细胞癌是人类常见的一种恶性肿瘤, 其发病机制则是目前人们研究的重点. 肝细胞癌的生物学特征就是多种原癌基因的激活、抑癌基因的失活及一系列复杂的调控机制失常所导致的失控性生长[1-8]. 失控性生长的主要分子机制是细胞周期紊乱导致细胞增生过多和凋亡过少, 而p27kip1作是一种重要的细胞周期素依赖性激酶的抑制因子, 是最有效的G1阻断剂[9]. p27kip1的蛋白表达水平及活性的改变与肿瘤的形成有关, 在肝细胞肝癌等多种肿瘤组织中表达降低[10]. 因此, 调节p27kip1蛋白可能成为肿瘤生物治疗一个值得探讨的新靶点. 我们探讨p27kip1及其突变体S10A过度表达对肝癌细胞周期的改变及其凋亡的影响, 并进一步分析其分子机制.
野生型和S10A突变型人p27kip1全长序列的cDNA由日本Kyushu大学Keiichi Nakayama 教授馈赠, 该载体在p27kip1基因上游包含了FLAG蛋白, 从而形成p27kip1/FLAG融合蛋白. 鼠源性的抗FLAG蛋白的抗体(M2)购自美国Sigma公司, FITC标记的羊抗鼠IgG 购自美国Santa Cruz公司. 质粒纯化试剂盒购自美国罗氏公司, Lipofectamine (LF2000) 购自美国Gibco 公司. 将日本Kyushu(九州大学)分子和细胞生物学中心Keiichi Nakayama教授国外馈赠的含有p27kip1全长序列的cDNA转化到DH5a大肠杆菌感受态菌中, 氨苄青抗生素筛选后, 挑取单个克隆在含100 mg/L的Amp的LB培养基内37 ℃, 200 r/min过夜培养, 质粒抽提试剂盒抽提后用7 g/L的琼脂糖凝较电泳2 h鉴定Mr . 基因测序证明开放性阅读框架及氨基酸序列正确无误.
HepG2细胞培养用含100 mL/L小牛血清DMEM培养37 ℃、50 mL/L CO2标准条件下培养. 转化前24 h, 以1.25 g/L 胰酶消化细胞, 2×105每孔浓度接种6孔板. 转化采用采用脂质体(Lipofectamine 2000)法, 将5 mg质粒DNA和脂质体10 mL分别加入无FCS的DMEM培养剂100 mL中, 再将以上两种液体轻轻混匀, 室温静置20 min, 摇匀后, 滴加至6孔板的每1孔, 标准条件下培养4-6 h后更换新鲜完全培养液继续培养. 细胞分两组, 一组在培养48 h后, 用流式细胞仪分析细胞周期. 另外一组在转染24 h后以1 mL/L血清培养基培养96 h使其同步化G0期, 然后再以含200 mL/L小牛血清培养基培养8 h, 使细胞进入S期, 激光共具焦显微镜观察以上两期p27kip1分布改变. 细胞基因转染后在标准条件下培养48 h, 用1 g/L胰蛋白酶消化后收集细胞, 将细胞用PBS制成2×108/L的单细胞悬液, 7 001 mL/L乙醇固定16 h, 加少量RNA酶和10 g/L碘化丙啶孵育30 min, 应用流式细胞仪FACS(美国Becton-Dickinson公司)进行细胞周期分析. 转化细胞以3×105/孔的密度种于6孔板, 按实验设计的要求处理细胞后, 丙酮固定, 加入1:300稀释的抗FLAG mAb, 37 ℃结合1 h, 0.1 mol/L的PBS洗3次, 每次10 min, 再与FITC标记的羊抗鼠IgG(1:1 000) 37 ℃孵育30 min, 再以0.1 M的PBS洗三次后封片. 激光共聚焦显微镜下观选择488 nm观察p27kip1蛋白的分布. 1×105沉淀细胞中用1ul/ml的Hoechst33258染色, 37 ℃染色10 min, 荧光显微镜下观察, 蓝色荧光均匀者为正常细胞, 而核染色质浓集或成团者为凋亡细胞[11]. 以细胞动态计数来分析细胞增生状况, 每组设3复孔, 分别在基因转染后24, 48及72 h收集细胞计数并描绘生长曲线. 每组试验结果采用SPSS10.0统计软件分析. 所得数据以mean±SD表示, P <0.05为差异有显著性.
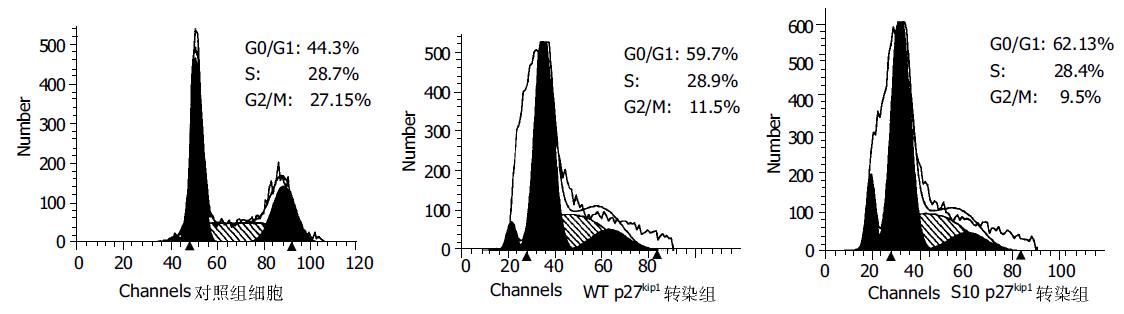
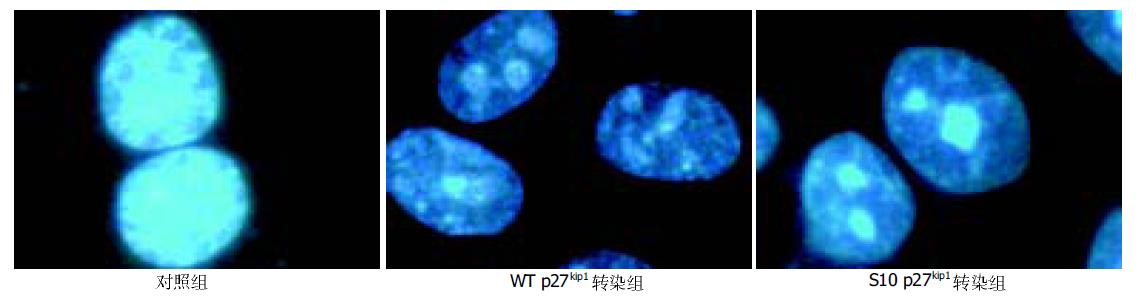
流式细胞仪分析显示, 野生型和S10A突变型人p27kip1基因转染的HepG2 48 h后, 44.3%的未转化细胞处于G0/G1期, 而野生型和S10A突变型转细胞处于G0/G1期分别为59.7%和62.1%. 表明野生型和S10A突变型外源性p27kip1蛋白在HepG2细胞高表达可抑制细胞由G1期向S期过度. 组间差异非常显著(P <0.01), 而两转化组间差异亦显著(P <0.05). 此外两组转染p27kip1基因后的HepG2出现凋亡峰(图1). Hoechst33258染色荧光显微镜下可见部分凋亡细胞核染色质浓集或成团者分布(图2). 提示过度表达p27kip1蛋白可能促进HepG2细胞凋亡.
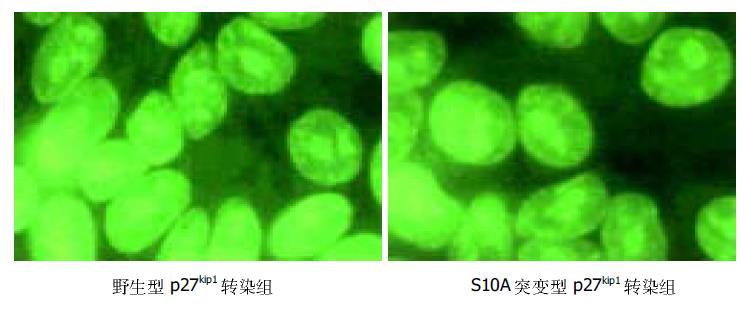
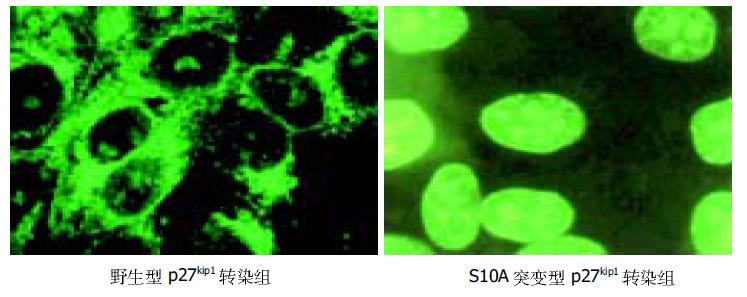
应用激光共聚焦显微镜观察发现转染细胞内有, 无血清培养基孵育96 h细胞阻滞G0期, 野生型和突变型p27kip1蛋白均主要分布细胞核(图3), 而在200 mL/L血清刺激后野生型p27kip1分布细胞质, S10A突变型p27kip1仍然分布于细胞核(图4).
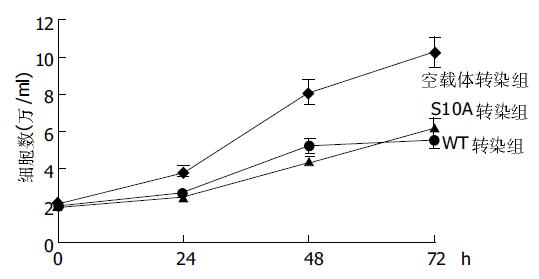
对照组细胞增生旺盛, 镜下可见较多核分裂相, 倍增快; 而实验组细胞的增生停滞, 镜下看不出分裂的迹象, 细胞形态变大, 核浆比减小. 随着培养时间的延长, p27kip1转化组细胞增生明显慢于空载体对照组(P <0.01, 图5)
p27kip1蛋白是一种细胞周期调控的抑制因子, 与多种肿瘤发生、发展和预后密切相关[12-13]. 在肿瘤细胞p27kip1蛋白通常地表达或无表达, 而过度表达则抑制肿瘤细胞过度增生. 我们也证实p27kip1转染肝癌细胞株HepG2后生长明显抑制, 流式细胞仪也出现凋亡峰, 提示p27kip1转染后过度表达可能诱导细胞的凋亡, 在乳腺癌细胞株MDA-MB-231[14]和食管癌裸鼠模型的研究也发现p27kip1过度表达可以促使细胞凋亡.
p27kip1基因是高度保守的抑癌基因, 其与其他抑癌基因如p53的高突变率不同, p27kip1基因少有或没有突变[15]. 关于S10A突变型p27kip1蛋白对细胞周期调控的影响目前尚未有报道. 本文首次发现S10A突变型p27kip1同样可以促进细胞周期阻滞于G0, 而且强于野生型. 该研究似乎提示S10A突变是一个无义突变, 该突变对p27kip1蛋白本身功能影响意义不明显. 然而, Ser10的磷酸化占总蛋白几乎70%, 可能是最主要的功能调节机制[15]. p27kip1蛋白细胞周期G0/G1阻滞的主要分子[9], 而p27kip1蛋白发挥其生物学功能除了依赖其表达水平还与其在细胞内分布密切相关[16], 细胞周期G0/G1阻滞时p27kip1蛋白主要分布于细胞核, 而在M和S期开始时, 则由胞核穿过核膜进入细胞质. 我们发现S10A突变型p27kip1不能由细胞核向细胞质转运, 提示p27kip1蛋白主要分布细胞核, 而丧失了向胞质转运的功能. 而S10A突变型p27kip1在细胞核滞留似乎更有利于其发挥细胞周期G0/G1阻滞, p27kip1蛋白在细胞核的分布是其发挥细胞G1期阻滞的分子基础.
细胞周期的不同时相, p27kip1存在精确的细胞内亚定位调控机制, 但确切的分子机制并没有阐明. 我们发现S10A突变型p27kip1丧失了由细胞核向细胞质转运功能, 说明Ser10磷酸化可能是介导其细胞核外转运的重要分子基础. 国外最新研究也证实p27kip1蛋白可以和CRM1蛋白相互作用, 并且这种作用是依赖Ser10磷酸化[17], 而CRM1是一种广谱的核外运蛋白(exportin), 可以介导p27kip1蛋白的细胞核外转运[18].
阐明p27 kip1分子的生物学特性及其在肝癌细胞周期调控中的作用, 在理论可以为进一步认识肝癌细胞增生失控的分子机制, 并为临床治疗提供新的思路.
| 1. | Lin GY, Chen ZL, Lu CM, Li Y, Ping XJ, Huang R. Immunohistochemical study on p53, H-rasp21, c-erbB-2 protein and PCNA expression in HCC tissues of Han and minority ethnic patients. World J Gastroenterol. 2000;6:234-238. [PubMed] |
| 2. | Feng DY, Zheng H, Tan Y, Cheng RX. Effect of phosphorylation of MAPK and Stat3 and expression of c-fos and c-jun proteins on hepatocarcinogenesis and their clinical significance. World J Gastroenterol. 2001;7:33-36. [PubMed] [DOI] |
| 3. | Guo XZ, Shao XD, Liu MP, Xu JH, Ren LN, Zhao JJ, Li HY, Wang D. Effect of bax, bcl-2 and bcl-xL on regulating apoptosis in tissues of normal liver and hepatocellular carcinoma. World J Gastroenterol. 2002;8:1059-1062. [PubMed] [DOI] |
| 4. | Liu LH, Xiao WH, Liu WW. Effect of 5-Aza-2'-deoxycytidine on the P16 tumor suppressor gene in hepatocellular carcinoma cell line HepG2. World J Gastroenterol. 2001;7:131-135. [PubMed] [DOI] |
| 5. | Cui J, Yang DH, Bi XJ, Fan ZR. Methylation status of c-fms oncogene in HCC and its relationship with clinical pathology. World J Gastroenterol. 2001;7:136-139. [PubMed] [DOI] |
| 6. | Jiang Y, Zhou XD, Liu YK, Wu X, Huang XW. Association of hTcf-4 gene expression and mutation with clinicopathological characteristics of hepatocellular carcinoma. World J Gastroenterol. 2002;8:804-807. [PubMed] [DOI] |
| 7. | Qin LL, Su JJ, Li Y, Yang C, Ban KC, Yian RQ. Expression of IGF- II, p53, p21 and HBxAg in precancerous events of hepatocarcinogenesis induced by AFB1 and/or HBV in tree shrews. World J Gastroenterol. 2000;6:138-139. [PubMed] [DOI] |
| 8. | Sun BH, Zhang J, Wang BJ, Zhao XP, Wang YK, Yu ZQ, Yang DL, Hao LJ. Analysis of in vivo patterns of caspase 3 gene expression in primary hepatocellular carcinoma and its relationship to p21(WAF1) expression and hepatic apoptosis. World J Gastroenterol. 2000;6:356-360. [PubMed] [DOI] |
| 9. | Polyak K, Lee MH, Erdjument-Bromage H, Koff A, Roberts JM, Tempst P, Massagué J. Cloning of p27Kip1, a cyclin-dependent kinase inhibitor and a potential mediator of extracellular antimitogenic signals. Cell. 1994;78:59-66. [PubMed] [DOI] |
| 10. | Ito Y, Matsuura N, Sakon M, Miyoshi E, Noda K, Takeda T, Umeshita K, Nagano H, Nakamori S, Dono K. Expression and prognostic roles of the G1-S modulators in hepatocellular carcinoma: p27 independently predicts the recurrence. Hepatology. 1999;30:90-99. [PubMed] [DOI] |
| 11. | Negri C, Donzelli M, Bernardi R, Rossi L, Bürkle A, Scovassi AI. Multiparametric staining to identify apoptotic human cells. Exp Cell Res. 1997;234:174-177. [PubMed] [DOI] |
| 12. | Rahman A, Maitra A, Ashfaq R, Yeo CJ, Cameron JL, Hansel DE. Loss of p27 nuclear expression in a prognostically favorable subset of well-differentiated pancreatic endocrine neoplasms. Am J Clin Pathol. 2003;120:685-690. [PubMed] [DOI] |
| 13. | Barnes A, Pinder SE, Bell JA, Paish EC, Wencyk PM, Robertson JF, Elston CW, Ellis IO. Expression of p27kip1 in breast cancer and its prognostic significance. J Pathol. 2003;201:451-459. [PubMed] [DOI] |
| 14. | Katayose Y, Kim M, Rakkar AN, Li Z, Cowan KH, Seth P. Promoting apoptosis: a novel activity associated with the cyclin-dependent kinase inhibitor p27. Cancer Res. 1997;57:5441-5445. [PubMed] |
| 15. | Ponce-Castañeda MV, Lee MH, Latres E, Polyak K, Lacombe L, Montgomery K, Mathew S, Krauter K, Sheinfeld J, Massague J. p27Kip1: chromosomal mapping to 12p12-12p13.1 and absence of mutations in human tumors. Cancer Res. 1995;55:1211-1214. [PubMed] |
| 16. | Ishida N, Kitagawa M, Hatakeyama S, Nakayama K. Phosphorylation at serine 10, a major phosphorylation site of p27(Kip1), increases its protein stability. J Biol Chem. 2000;275:25146-25154. [PubMed] [DOI] |
| 17. | Connor MK, Kotchetkov R, Cariou S, Resch A, Lupetti R, Beniston RG, Melchior F, Hengst L, Slingerland JM. CRM1/Ran-mediated nuclear export of p27(Kip1) involves a nuclear export signal and links p27 export and proteolysis. Mol Biol Cell. 2003;14:201-213. [PubMed] [DOI] |
| 18. | Kudo N, Khochbin S, Nishi K, Kitano K, Yanagida M, Yoshida M, Horinouchi S. Molecular cloning and cell cycle-dependent expression of mammalian CRM1, a protein involved in nuclear export of proteins. J Biol Chem. 1997;272:29742-29751. [PubMed] [DOI] |