修回日期: 2004-06-02
接受日期: 2004-06-24
在线出版日期: 2004-08-15
死亡受体DR5(TRAILR2)是TRAILR中的一员, 属于肿瘤坏死因子受体超家族. 当他与相关配体结合时, 能选择性地杀伤多种肿瘤细胞而对正常细胞没有毒性. 他的作用机制是通过DR5受体上的FADD形成DISC和caspase-8, 然后启动非线粒体依赖途径和线粒体依赖途径来介导细胞的凋亡信号. TRAIL是最先发现的DR5配体, 曾被誉为最有发展前途的抗肿瘤药物. 然而随后发现不同形式的TRAIL对于正常人的不同的细胞有毒性, 尤其是肝细胞. 于是, 人们研制出TRA-8-针对人DR5受体的特异性mAb. 发现他不仅杀瘤效应比TRAIL强出数倍, 而且对正常人的肝细胞及其他细胞均没有毒副作用. 目前正被考虑为最安全最有效的抗癌药物. 人们对DR5受体和配体的不断探索, 为进一步了解肿瘤细胞的凋亡和抗癌药物的研制, 开创了新的途径.
引文著录: 朱冉旭, 林菊生. 死亡受体DR5与肿瘤细胞凋亡. 世界华人消化杂志 2004; 12(8): 1909-1912
Revised: June 2, 2004
Accepted: June 24, 2004
Published online: August 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1909-1912
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1909.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1909
目前研究得最多最清楚的是死亡受体介导的凋亡. 某些细胞表面存在着特殊的感受器-死亡受体(death receptor, DR), 他能识别外来的死亡信号, 并迅速启动细胞凋亡机制. 死亡受体DR5与目前已知的其他死亡受体CD95(又称Fas/Apol), TNFR1, DR3(又称Wsl-1/Apo3/TRAMP), DR4一样, 都属于肿瘤坏死因子受体(tumor necrosis factor receptor TNFR)超家族, 都是I型跨膜蛋白, 他们之间有很高的同源性. 然而死亡受体DR5的独特之处就在于当外来的配体与之相结合时, 他仅选择性地杀伤肿瘤细胞或转化细胞, 而对机体的正常组织不具有明显的毒性. 这是CD95, TNFR1, DR3, DR4所无法比拟的. 针对这一特性, 促使人们对DR5展开了深入地研究. 研究显示死亡受体DR5也是TRAIL或TRA-8诱导许多肿瘤细胞凋亡的主要死亡受体[1]. 现将对死亡受体DR5及其相应配体的结构、功能和他们在肿瘤细胞凋亡中作用的研究进展作一综述.
死亡受体DR5是1997年Pan et al[2]在克隆出DR4的全长基因后, 发现在某些细胞表面上存在着另外一种分子. 他与DR4具有高度同源性, 遂命名为死亡受体DR5. 他是由411个氨基酸组成, 1-55氨基酸是信号肽, 84-179氨基酸残基含有2个富含半胱氨酸的重复功能区的链状结合区, 184-206氨基酸为跨膜区, 胞内区含死亡结构域, 与DR4的同源性为58%, 与TNFR1死亡受体结构的同源性达64%. 研究表明, DR5受体的独特性就在于他高水平地广泛表达于许多肿瘤组织, 如肝癌、肺癌、乳腺癌、睾丸癌、卵巢癌、胰腺癌、直肠癌、宫颈癌、子宫癌、甲状腺癌、咽喉癌、前列腺癌等; 而不表达或较少表达于正常的组织细胞中[3]. 这也成为了他不同于DR4的优越之处, 因为DR4不仅不能普遍地高表达于这些肿瘤细胞, 且在较多的正常组织中也有表达, 如脾脏、外周血白细胞、小肠、胸腺、活化的T细胞[4-5].
1.2.1 TRAIL: 1995年Wiley et al克隆并发现了肿瘤坏死因子相关诱导配体(tumor necrosis factor related apoptosis-inducing ligand, TRAIL)基因, 第2 a由Pitti et al证实并又命名为Apo-2L. TRAIL广泛表达于正常人的各种组织如外周淋巴细胞、肺、肾、脾、胸腺、前列腺、卵巢、小肠、心脏、胎盘、骨胳肌等中, 而在脑、肝和睾丸中未检测到表达[6]. TRAIL为TNF超家族成员, 其基因定位于染色体3q26, 编码281个氨基酸, Mr为32 500, 等电点为7.63, 属于Ⅱ型跨膜蛋白, N 端15-40 氨基酸为疏水区域并形成跨膜结构, 胞内区很短, 胞外区与 FasL的同源性最高, 为28%. 1个TRAIL单体包括4个反向平行的"β"折叠, 形成1个"β"三明治夹心结构, 3个单体头尾相接形成钟形三聚体, 而这种三聚体的形式则是TRAIL和受体相结合时, 发挥活性的功能模式. TRAIL同 TNF家族其他成员最独特的区别是在137-152位形成一个12-16氨基酸的插入环A'loop, 此结构可插入受体的TRAIL结合位点, 保证受体与TRAIL的特异性结合. 研究证实, 这个插入结构在传递同型受体识别特异性方面有关键作用[2]. 目前已知TRAIL有两种形式: 膜结合型TRAIL(全长的TRAIL)和可溶型TRAIL(胞外区C端的168个氨基酸), 他们在体外均能诱导多种肿瘤细胞的凋亡, 作用范围很广.
1.2.2 TRA-8: 人DR5特异的竞争性mAb(agonistic monoclonal antibody specific for human DR5, TRA-8)是特异性针对人细胞膜表面的死亡受体DR5而合成的mAb, 他与一般的抗人DR5的mAb(monoclonal antibody against human DR5)不同, 他能特异性地与死亡受体DR5相结合, 发挥配体的作用, 从而诱导细胞凋亡. 2001年, Kimihisa et al 将人DR5的细胞外区和人IgG1(DR5-Ig)的Fc段组成融合蛋白来免疫BALB/c的♀小鼠[1], 从而合成了TRA-8这种mAb. 实验证明TRA-8能诱导许多表达DR5受体的肿瘤细胞的凋亡, 而对正常组织细胞无毒性. 并且用Western-blot法分析, TRA-8不会与其他的死亡受体发生交叉反应.
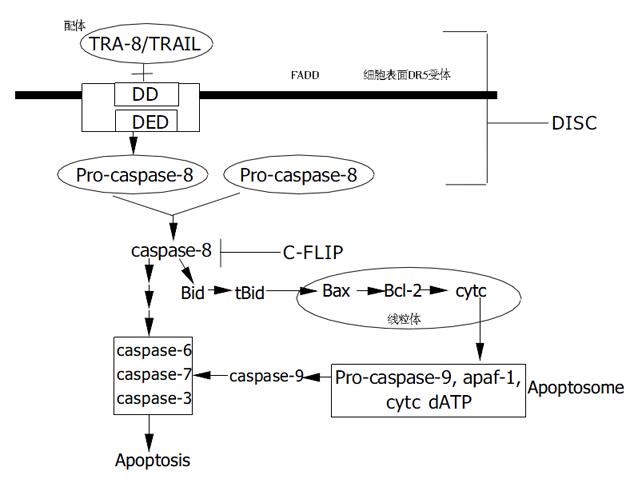
当配体与死亡受体DR5以前联合(pre-associa ted)受体的三聚体形式相结合时, 被激活的死亡受体是通过募集着一个被称之为Fas相关死亡结构域(fas-associated death domain, FADD)的接头器来诱导凋亡的. FADD包含有两个相互作用的结构域蛋白, 即死亡结构域 (death domain, DD)和死亡效应器(death effector domain, DED). 目前的研究结果认为接头器FADD是通过两个DD之间的相互作用来结合受体, 并同时通过DED之间的相互作用来结合凋亡信号的起始因子胱冬酶原(pro-caspase-8). 这样, 人们把由"死亡配体- 死亡受体- FADD- 胱冬酶原分子"以串联形式组合而成的复合物称之为死亡诱导信号复合体 (death-inducing signal complex, DISC). 在DISC中的被激活的两个pro-caspase-8发生分子内水解, 随后二聚化成胱冬酶caspase-8(又称为 FADD-like interleukin-1βconverting enzyme, FLICE)[7], 从而引发了细胞凋亡的流程. 于是, 被激活的caspase-8启动了非线粒体依赖途径和线粒体依赖的两种细胞凋亡途径(如图1)[8]. (1)非线粒体依赖途径: 通过激活的caspase8自动裂解和活化, 经过一系列的级联效应(cascade), 最终激活效应酶(如 caspase3), 从而介导细胞的凋亡. (2)线粒体依赖途径: 通过激活的caspase8作用于Bid (Bcl-2inhibitory BH3-domain-containing protein)形成有活性的tBid (truncated BID), tBid 迁移到线粒体内, 促使包括 cytochrome c在内的线粒体蛋白的释放. 被释放的cytochrome c 再与apaf-1, pro-caspase9和dATP形成一种被称之为 apoptosome的复合体[9]. 这种复合体二聚化以后再激活 caspase9, 进而通过caspase3, caspase7诱导肿瘤细胞的凋亡; 其他被释放的线粒体蛋白包括了AIF(apoptosis inducing factor)[10], Smac/Diabo(second mitochondria -derived activator of caspase)[11-12], 核酸内切酶G. 然而这些线粒体蛋白在配体单独作用下释放得并不明显.
有报道称死亡受体DR5诱导细胞凋亡需要依赖于FADD和caspase-8[13]. 通过一种内生的抑制因子C-FLIP (celluar FLICE-like inhibitor protein), 可以调控DR5受体的死亡信号转导途径. C-FLIP与caspase-8相关, 但他没有蛋白水解酶的活性, 他通过与caspase-8竞争性结合DISC[14], 从而阻断由caspase-8引发的细胞死亡信号途径.
许多化疗药物能协同由死亡受体DR5介导的体内外肿瘤细胞的凋亡, 如阿霉素和顺铂, 这些能够诱导细胞DNA损伤的化疗药物, 他们主要是通过激活JNK/P38和线粒体死亡信号途径来诱导细胞凋亡[15-16]. 由TRA-8配体和化疗药物联合作用所诱发的凋亡是通过MKK4(mitogen-activated protein kinase kinase)这种酶激活JNK/P38途径的. 在乳腺癌(MDA-MB-231 -KS, MDA-MB-231-PO细胞)、星型细胞瘤(132INI细胞)、宫颈癌(HeLa细胞)、结肠癌(Widr细胞)以及卵巢癌(UL-3B, UL-3C细胞)中单独使用化疗药物时, 药物本身就可以在肿瘤中引发微弱的JNK/P38的途径, 但不足以促使细胞凋亡. 而在与配体联合作用时, 他则是通过提高JNK/P38的活性以及caspase的活性(即促进caspase9, caspase3的裂解), 从而得以发挥协同作用, 促使细胞凋亡. Ohtsuka et al[16]用一种caspase抑制剂Z-VAD-FMK证明了JNK/P38的途径对caspase的依赖性. 而在线粒体途径中, 线粒体膜电位的丧失以及cytochrome c和Smac/Diabo的释放则是促使该途径的重要因素.
肿瘤坏死因子受体CD95, TNFR等因其在死亡信号传递过程中同时激活细胞因子NF-κB而被限制. 激活的NF-κB能够调控多种免疫基因的表达, 诱导巨噬细胞和内皮细胞的前炎症基因活化, 引起全身严重的炎性反应, 同时他也会促使肿瘤细胞对凋亡产生抵抗性. 然而, 受体DR5在与配体(TRAIL或TRA-8)结合时, 虽然也产生NF-κB, 但只是暂时性的, 不能起到拮抗肿瘤细胞凋亡的作用. 原因是NF-κB效应的发挥取决于他的动力学特性[17]. 因而, DR5受体相关配体选择性的细胞毒性决定了他们特有的安全性.
TRAIL具有相应的五种受体: (1)死亡受体TRAILR1(DR4)[4-5]; (2)死亡受体TRAILR2(DR5)[2,18-19]; (3)诱捕受体TRAILR3(decoy receptor-1, DcR1)[20]; (4)诱捕受体TRAILR4(decoy receptor-2, DcR2)[21]; (5)OPG受体(osteoprotegerin receptor, OPGR)[22]. 由于DcR1没有胞内区, DcR2的胞内区仅有一段不完整的DD. 因此二者都不能传递TRAIL介导的死亡信号. 但是他们都有与DR4和DR5高度同源的富含半胱氨酸的伪重复序列, 能够与TRAIL结合, 从而与死亡受体DR4、DR5竞相结合TRAIL. 研究表明DcR1和(或)DcR2普遍地表达于正常细胞, 其中DcR1在外周血淋巴细胞与脾脏组织表达尤为丰富, DcR2在胎肝组织和成人睾丸组织表达较为丰富; 而肿瘤细胞或转化细胞则较多的含有DR4和(或)DR5, 且较少或不含DcR1、DcR2, 故而正常细胞由于诱捕受体的保护, 而免于TRAIL诱导的凋亡, 而肿瘤细胞则可受到TRAIL应有的攻击. 而OPG则是另一种与TRAIL相结合的可溶性受体, 但是当他与配体结合时, 他能抑制破骨细胞的生长, 增加骨密度, 在调节骨密度的代谢方面起着重要的作用. 因而OPG受体不能诱导细胞凋亡, 而是作为诱捕受体来拮抗TRAIL诱导的凋亡. 由此, 因为这种选择性杀伤肿瘤的效应, 近年来一直被誉为最有前景的抗癌药物. 但是, 随着深入地研究, 发现TRAIL的某种形式, 能诱发正常人某些细胞的凋亡, 特别是肝细胞的凋亡显得尤为突出. 如膜结合型TRAIL(全长的TRAIL)可以在体内诱发正常的肝细胞凋亡, 引发严重的肝炎[1]. 经过分析, TRAIL的作用机制可能是通过复合受体-即不单单是通过DR5还有其他受体, 从而发生交叉反应. 而可溶型TRAIL的各种融合寡肽对人的正常细胞也有促凋亡作用: 即融合寡聚组氨酸的可溶型TRAIL. his (114-281 氨基酸) 对正常人的肝脏细胞有明显的诱导凋亡作用[23], 对正常人的红细胞生成有负调控作用, 对淋巴细胞具有诱导凋亡作用; 融合亮氨酸拉链的可溶型TRAIL. leuzip(95-281 氨基酸) 对人的角质细胞具有损伤作用[24]; FLAG-TRAIL 对人的脑细胞具有诱导凋亡作用[25]. 这种对不同细胞的毒性差异可能是由于融合TRAIL 在化学及空间结构方面的改变所造成的. 由此人们对于TRAIL抗肿瘤治疗的安全性产生了疑虑.
面对这一难题, 人们在小鼠身上制成了针对人死亡受体DR5的mAb-TRA-8. 在研究中人们发现, 虽然DR5的mRNA广泛地表达于人的正常组织, 但是在许多正常组织如肝脏、肺、乳腺、肾、脾、睾丸、卵巢、心脏、胰腺等却未能用TRA-8检测出DR5受体蛋白; 而在其相应的肿瘤组织和其他的癌组织却可检测出DR5受体蛋白的高表达, 并可对TRA-8有很高的敏感性[1,26]. 与此同时, 人们虽然在正常的星形胶质细胞和外周血T, B淋巴细胞中可检测出DR5受体的表达, 但其蛋白水平不高, 不足以对TRA-8产生敏感, 不会被诱导凋亡. 而在其相应的神经胶质瘤(SH687, U87细胞)和淋巴瘤组织(Jukat, CEM-6细胞)中, DR5受体蛋白的水平却明显增高, 能够被TRA-8诱导凋亡[1,27-28]. 这充分说明了DR5受体蛋白表达水平的高低与TRA-8的敏感性成正相关; 同时也意味着DR5受体蛋白水平的高表达和对TRA-8的敏感性的增高是转化细胞和肿瘤细胞的特性之一. 随后在实验中, 人们发现DR5的mAb(TRA-8)在肝癌、乳腺癌, 纤维肉瘤, 胶质细胞瘤等癌细胞上的特异性杀瘤效应比TRAIL高出数倍, 而且对正常组织包括人正常肝细胞均无毒副作用[1,26-28]. 这也显示了TRA-8比TRAIL更有效更具安全性. 随着研究的深入, 人们已将放射疗法和(或)化学治疗与TRA-8相结合, 协同运用于治疗肿瘤的方案上, 并取得了备受瞩目的成效[15,26]. 因此, TRA-8这种高效能选择性杀伤肿瘤细胞以及对机体的正常组织细胞无毒性的优越性引起了人们极大的兴趣. 2003年北京生物工程课题组首席科学家孟路教授申请了TRAIL-R2/DR5这种mAb的中国专利. 不久, 人们将进一步深入研究TRA-8在人体内确实可行的效果. TRA-8有望成为新一代的最有前景的抗癌药物之一.
由于死亡受体DR5在细胞分布及作用机制的独特性, 已为人们在研究肿瘤细胞凋亡的方向上提供了良好的前景. 随着对死亡受体DR5及其配体的深入研究, 人们发现在抗癌治疗上也存在着某些问题, 如TRAIL对肝癌的耐药性, 及他对肝细胞的毒性等, 目前已成为人们着力探讨的课题. 而TRA-8也正处于研制当中. 但是对DR5受体的新配体的不断探索, 加深了人们对DR5受体在肿瘤细胞凋亡的发生发展及治疗方面的认识, 并为全新的肿瘤治疗方案提供了广阔的理论依据.
编辑: N/A
| 1. | Ichikawa K, Liu W, Zhao L, Wang Z, Liu D, Ohtsuka T, Zhang H, Mountz JD, Koopman WJ, Kimberly RP. Tumoricidal activity of a novel anti-human DR5 monoclonal antibody without hepatocyte cytotoxicity. Nat Med. 2001;7:954-960. [PubMed] [DOI] |
| 2. | Pan G, Ni J, Wei YF, Yu G, Gentz R, Dixit VM. An antagonist decoy receptor and a death domain-containing receptor for TRAIL. Science. 1997;277:815-818. [PubMed] [DOI] |
| 3. | Cha SS, Sung BJ, Kim YA, Song YL, Kim HJ, Kim S, Lee MS, Oh BH. Crystal structure of TRAIL-DR5 complex identifies a critical role of the unique frame insertion in conferring recognition specificity. J Biol Chem. 2000;275:31171-31177. [PubMed] [DOI] |
| 4. | Griffith TS, Lynch DH. TRAIL: a molecule with multiple receptors and control mechanisms. Curr Opin Immunol. 1998;10:559-563. [PubMed] [DOI] |
| 5. | Pan G, O'Rourke K, Chinnaiyan AM, Gentz R, Ebner R, Ni J, Dixit VM. The receptor for the cytotoxic ligand TRAIL. Science. 1997;276:111-113. [PubMed] [DOI] |
| 7. | Chen M, Orozco A, Spencer DM, Wang J. Activation of initiator caspases through a stable dimeric intermediate. J Biol Chem. 2002;277:50761-50767. [PubMed] [DOI] |
| 8. | Kim K, Fisher MJ, Xu SQ, el-Deiry WS. Molecular determinants of response to TRAIL in killing of normal and cancer cells. Clin Cancer Res. 2000;6:335-346. [PubMed] |
| 9. | Li P, Nijhawan D, Budihardjo I, Srinivasula SM, Ahmad M, Alnemri ES, Wang X. Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates an apoptotic protease cascade. Cell. 1997;91:479-489. [PubMed] [DOI] |
| 10. | Susin SA, Lorenzo HK, Zamzami N, Marzo I, Snow BE, Brothers GM, Mangion J, Jacotot E, Costantini P, Loeffler M. Molecular characterization of mitochondrial apoptosis-inducing factor. Nature. 1999;397:441-446. [PubMed] [DOI] |
| 11. | Du C, Fang M, Li Y, Li L, Wang X. Smac, a mitochondrial protein that promotes cytochrome c-dependent caspase activation by eliminating IAP inhibition. Cell. 2000;102:33-42. [PubMed] [DOI] |
| 12. | Verhagen AM, Ekert PG, Pakusch M, Silke J, Connolly LM, Reid GE, Moritz RL, Simpson RJ, Vaux DL. Identification of DIABLO, a mammalian protein that promotes apoptosis by binding to and antagonizing IAP proteins. Cell. 2000;102:43-53. [PubMed] [DOI] |
| 13. | Bodmer JL, Holler N, Reynard S, Vinciguerra P, Schneider P, Juo P, Blenis J, Tschopp J. TRAIL receptor-2 signals apoptosis through FADD and caspase-8. Nat Cell Biol. 2000;2:241-243. [PubMed] [DOI] |
| 14. | Tschopp J, Irmler M, Thome M. Inhibition of fas death signals by FLIPs. Curr Opin Immunol. 1998;10:552-558. [PubMed] [DOI] |
| 15. | Mühlenbeck F, Haas E, Schwenzer R, Schubert G, Grell M, Smith C, Scheurich P, Wajant H. TRAIL/Apo2L activates c-Jun NH2-terminal kinase (JNK) via caspase-dependent and caspase-independent pathways. J Biol Chem. 1998;273:33091-33098. [PubMed] [DOI] |
| 16. | Ohtsuka T, Buchsbaum D, Oliver P, Makhija S, Kimberly R, Zhou T. Synergistic induction of tumor cell apoptosis by death receptor antibody and chemotherapy agent through JNK/p38 and mitochondrial death pathway. Oncogene. 2003;22:2034-2044. [PubMed] [DOI] |
| 17. | Zwacka RM, Stark L, Dunlop MG. NF-kappaB kinetics predetermine TNF-alpha sensitivity of colorectal cancer cells. J Gene Med. 2000;2:334-343. [PubMed] [DOI] |
| 18. | Sheridan JP, Marsters SA, Pitti RM, Gurney A, Skubatch M, Baldwin D, Ramakrishnan L, Gray CL, Baker K, Wood WI. Control of TRAIL-induced apoptosis by a family of signaling and decoy receptors. Science. 1997;277:818-821. [PubMed] [DOI] |
| 19. | Walczak H, Degli-Esposti MA, Johnson RS, Smolak PJ, Waugh JY, Boiani N, Timour MS, Gerhart MJ, Schooley KA, Smith CA. TRAIL-R2: a novel apoptosis-mediating receptor for TRAIL. EMBO J. 1997;16:5386-5397. [PubMed] [DOI] |
| 20. | Degli-Esposti MA, Smolak PJ, Walczak H, Waugh J, Huang CP, DuBose RF, Goodwin RG, Smith CA. Cloning and characterization of TRAIL-R3, a novel member of the emerging TRAIL receptor family. J Exp Med. 1997;186:1165-1170. [PubMed] [DOI] |
| 21. | Marsters SA, Sheridan JP, Pitti RM, Huang A, Skubatch M, Baldwin D, Yuan J, Gurney A, Goddard AD, Godowski P. A novel receptor for Apo2L/TRAIL contains a truncated death domain. Curr Biol. 1997;7:1003-1006. [PubMed] [DOI] |
| 22. | Emery JG, McDonnell P, Burke MB, Deen KC, Lyn S, Silverman C, Dul E, Appelbaum ER, Eichman C, DiPrinzio R. Osteoprotegerin is a receptor for the cytotoxic ligand TRAIL. J Biol Chem. 1998;273:14363-14367. [PubMed] [DOI] |
| 23. | Jo M, Kim TH, Seol DW, Esplen JE, Dorko K, Billiar TR, Strom SC. Apoptosis induced in normal human hepatocytes by tumor necrosis factor-related apoptosis-inducing ligand. Nat Med. 2000;6:564-567. [PubMed] [DOI] |
| 24. | Qin J, Chaturvedi V, Bonish B, Nickoloff BJ. Avoiding premature apoptosis of normal epidermal cells. Nat Med. 2001;7:385-386. [PubMed] [DOI] |
| 25. | Nitsch R, Bechmann I, Deisz RA, Haas D, Lehmann TN, Wendling U, Zipp F. Human brain-cell death induced by tumour-necrosis-factor-related apoptosis-inducing ligand (TRAIL). Lancet. 2000;356:827-828. [PubMed] [DOI] |
| 26. | Buchsbaum DJ, Zhou T, Grizzle WE, Oliver PG, Hammond CJ, Zhang S, Carpenter M, LoBuglio AF. Antitumor efficacy of TRA-8 anti-DR5 monoclonal antibody alone or in combination with chemotherapy and/or radiation therapy in a human breast cancer model. Clin Cancer Res. 2003;9:3731-3741. [PubMed] |
| 27. | Kaliberov S, Stackhouse MA, Kaliberova L, Zhou T, Buchsbaum DJ. Enhanced apoptosis following treatment with TRA-8 anti-human DR5 monoclonal antibody and overexpression of exogenous Bax in human glioma cells. Gene Ther. 2004;11:658-667. [PubMed] [DOI] |
| 28. | Choi C, Kutsch O, Park J, Zhou T, Seol DW, Benveniste EN. Tumor necrosis factor-related apoptosis-inducing ligand induces caspase-dependent interleukin-8 expression and apoptosis in human astroglioma cells. Mol Cell Biol. 2002;22:724-736. [PubMed] [DOI] |