修回日期: 2004-03-13
接受日期: 2004-03-18
在线出版日期: 2004-06-15
目的: 克隆人HMGB1中的A box (1-85 aa)和B box (88-162 aa)的cDNA, 构建重组原核表达载体并对其诱导表达, 为检测其生物学活性做准备.
方法: 提取人新鲜扁桃体组织总RNA, 经RT-PCR扩增出人 HMGB1 A box和B box 的 cDNA 序列, 并分别克隆至载体pUC19进行序列测定, 随后分别构建于高效原核表达载体pQE-80L/DHFR中, 经IPTG诱导 4 h后, 可表达Mr 约 35 000, 34 000的融合蛋白. Western Blotting鉴定所表达的目的蛋白.
结果: 经RT-PCR扩增得到了255 bp和225 bp的DNA片段, 经序列分析与GenBank中报道的已知序列完全一致, 构建了含融合蛋白的重组表达质粒, 诱导表达了目的蛋白, 经Western Blotting证实, 在Mr分别约为35 000和34 000处有两条清楚的蛋白带.
结论: HMGB1 A box和B box cDNA的克隆, 原核表达载体的构建及目的蛋白的表达鉴定, 为进一步研究HMGB1 A box和B box的生物学功能奠定了基础.
引文著录: 张艳, 何凤田, 李蓉芬, 连继勤, 杨朝辉, 高会广. 人HMGB1 A box和B box cDNA的克隆与表达. 世界华人消化杂志 2004; 12(6): 1365-1368
Revised: March 13, 2004
Accepted: March 18, 2004
Published online: June 15, 2004
AIM: To clone human HMGB1 A box and B box cDNA, to construct their prokaryotic expression vectors and to express their products for examining their activity.
METHODS: The total RNA was extracted from human tonsil and the human HMGB1 A box and B box cDNA sequence were amplified using RT-PCR, and inserted into pUC19 for sequence analysis. Then the identified cDNAs were inserted into the new type of prokaryotic expression vector pQE-80 L/DHFR. Having induced by IPTG for 4 h, we confirmed the confusion protein by SDS-PAGE, then identified the expressed confusion protein by Western blotting.
RESULTS: The target DNA fragments by RT-PCR were completely same as the sequence reported in GenBank. The recombinant prokaryotic expression vector was constructed and the fusion protein expressed, which was then identified by Western blotting.
CONCLUSION: Cloning of HMGB1 A box and B box cDNA, construction of their prokaryotic expression vectors and expression of fusion protein have provided the fundamental proof for examining their biological activity.
- Citation: Zhang Y, Hen FT, Li RF, Lian JQ, Yang ZH, Gao HG. Cloning and expression of HMGB1 A box and B box cDNAs. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1365-1368
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1365.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1365
高迁移率族蛋白B1(high-mobility group box-1, HMGB1), 是根据其在聚丙烯酰胺凝胶电泳中有很高的迁移率而得名. 他是一个重要的晚期致炎因子, 与全身性炎症及其并发症毒性综合征(sepsis syndrome)的发生与发展密切相关.巨噬/单核细胞、垂体细胞受内毒素、IL-1a、TNF 刺激后均能释放HMGB1, HMGB1也可刺激巨噬/单核细胞释放致炎因子, 如TNF, IL-1a , IL-1b等[1]. 因此, HMGB1成为抗炎治疗新靶点[2-4]. 目前发现HMGB1还与肿瘤的生长和侵袭(如乳腺癌, 胃肠道肿瘤等)[5-6]以及类风湿关节炎有关[7]. 经结构功能分析HMGB1的致炎活性位于B box, 而另一个结合DNA 的功能结构域HMGB1 A box却能竞争性抑制HMGB1的活性, 但其作用机制尚不清楚. 因此, 我们以人新鲜扁桃体组织总RNA为材料, 经RT-PCR扩增出人 HMGB1 A box和B box 的cDNA 序列, 并将其克隆于载体pUC19进行测序, 随后构建于高效原核表达载体pQE-80L/DHFR, 进一步诱导该蛋白的表达, 从而为今后的深入研究其生物学功能及作用机制打下基础.
人新鲜扁桃体组织取自临床手术切除的扁桃体; 质粒pUC19购自华美公司; 原核表达载体pQE-80L/DHFR由本室保存; 大肠杆菌JM109、DH5a由本室保存; Tripure RNA提取试剂为Roche公司产品; PCR引物由上海生工公司合成; RT-PCR及PCR纯化试剂盒为 Promega公司产品; 限制性内切酶、T4 DNA连接酶购自Promega公司; 小鼠抗人His抗体购自德国Qiagen公司; HRP标记的山羊抗小鼠IgG购自华美公司; 浓缩DAB显色液购自北京中同生物技术有限公司; 硝酸纤维素膜为Roche公司产品.
取人新鲜扁桃体组织, 按Tripure试剂盒说明提取细胞总RNA, 经甲醛变性琼脂糖凝胶电泳鉴定其完整性, 经紫外分光光度计测定其浓度. RT-PCR扩增人HMGB1 A box 和B box cDNA. 根据GenBank中编码人HMGB1 A box (1-85 aa), HMGB1 B box (88-162 aa)的cDNA序列, 分别设计一对特异性引物. HMGB1 A box上游引物: 5'- GC GGT ACC ATG GGC AAA GGA GAT CCT A-3'(划线部分为KpnⅠ 酶切位点), 下游引物: 5'- GC AAG CTT TCA TGT CTC CCC TTT GGG A-3'(划线部分为HindⅢ 酶切位点); HMGB1 B box上游引物: 5'- CC GGT ACC AAG TTC AAG GAT CCC AAT -3'(划线部分为KpnⅠ 酶切位点); 下游引物: 5'- CC AAG CTT TCA ATA TGC AGC AAT ATC C -3' (划线部分为Hind ℃ 酶切位点). RT-PCR按试剂盒说明进行: RNA 5 mL(约1 mg), 5×反应buffer 10 mL, 上、下游引物各2 mL, dNTP 1mL, 25 mmoL/L MgSO4 2 mL, AMV反转录酶1 mL(5U), Tfl DNA聚合酶1mL(5U), ddH2O 26 mL, 总体积为50 mL; 反应程序为48 ℃ 45 min; 94 ℃预变性2 min; 然后(94 ℃ 30 s; 60 ℃ 1 min; 68 ℃ 2 min)×40个循环; 最后68 ℃ 7 min. 分别取5 mL RT-PCR产物于20 g/L琼脂糖凝胶中电泳, 凝胶扫描仪下观察并记录结果. 将RT-PCR产物及载体pUC19经HindⅢ+KpnⅠ酶切后, 分别用纯化试剂盒进行回收, 按常规条件于16 ℃连接12 h, 将连接产物转化至大肠杆菌JM109感受态细胞, 经蓝白筛选获得阳性重组子, 提取质粒, 经HindⅢ+KpnⅠ酶切鉴定获得重组质粒(命名为pUC19/HMGB1 A box, pUC19/HMGB1 B box). 然后由上海生工公司进行序列测定. 行DNA测序后, 以HindⅢ+KpnⅠ酶切pUC19/HMGB1 A box, pUC19/HMGB1 B box质粒, 回收目的片段并连接于原核表达载体pQE-80L/DHFR.将重组原核表达载体转化至大肠杆菌DH5a, 经质粒提取和酶切鉴定得到重组原核表达载体pQE-80L/DHFR/HMGB1 A box, pQE-80L/DHFR/HMGB1 B box. 挑取含重组原核表达载体的单个菌落接种于LB培养基 (含 50 mg/L 氨苄青霉素), 37 ℃培养过夜后, 按10 g/L接种于新鲜LB培养基, 37 ℃培养至A600 nm约为0.7, 加入IPTG至终浓度为 1 mmoL/L, 诱导 4h后, 离心收菌, 行SDS-PAGE(分离胶120 g/L, 积层胶50 g/L), 再经灰度扫描确定菌体总蛋白中目的蛋白的比例. 以所表达目的蛋白上的His标签肽为标志, 经Western blot行进一步鉴定, 其简要步骤是: 将诱导表达的产物先行SDS-PAGE, 然后以半干法电转移至硝酸纤维素膜(NC膜)上, 取下NC膜短暂漂洗后用丽春红染膜, 待蛋白marker条带显色后用滤纸将膜轻轻吸干, 用记号笔标记蛋白marker各条带, 继而经漂洗去除用丽春红, 然后依次经50 g/L脱脂奶粉室温封闭1 h, 与抗-His单抗孵育1 h, 与HRP标记的山羊抗小鼠IgG孵育1 h, 每步完成后均严格洗膜, 最后加DAB避光显色.
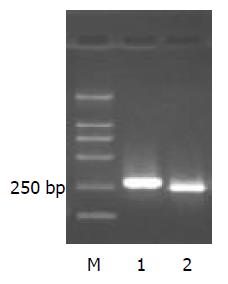
扩增产物行电泳后, 可见清晰条带, 片段大小分别约为255 bp和225 bp(图1).
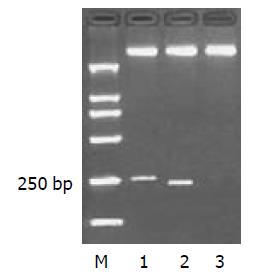
阳性重组子pUC19/HMGB1 A box, pUC19/HMGB1 B box经酶切后, 分别可见约为255bp和225bp大小的目的片段(图2).
人HMGB1 A box cDNA 序列
ATGGGCAAAG GAGATCCTAA GAAGCCGAGA GGCAAAATGT CATCATATGC
ATTTTTTGTG CAAACTTGTC GGGAGGAGCA TAAGAAGAAG CACCCAGATG
CTTCAGTCAA CTTCTCAGAG TTTTCTAAGA AGTGCTCAGA GAGGTGGAAG
ACCATGTCTG CTAAAGAGAA AGGAAAATTT GAAGATATGG CAAAAGCGGA
CAAGGCCCGT TATGAAAGAG AAATGAAAAC CTATATCCCT CCCAAAGGGG
AGACA
人HMGB1 B box cDNA 序列
AAGTTCAAGG ATCCCAATGC ACCCAAGAGG CCTCCTTCGG CCTTCTTCCT
CTTCTGCTCT GAGTATCGCC CAAAAATCAA AGGAGAACAT CCTGGCCTGT
CCATTGGTGA TGTTGCGAAG AAACTGGGAG AGATGTGGAA TAACACTGCT
GCAGATGACA AGCAGCCTTA TGAAAAGAAG GCTGCGAAGC TGAAGGAAAA
ATACGAAAA G GATATTGCTG CATAT
将序列正确的HMGB1 A box, B box cDNA分别克隆于原核表达载体pQE-80L/DHFR得到重组原核表达载体pQE-80L/DHFR/HMGB1A box, pQE-80L/DHFR/HMGB1B box, 经酶切后分别见约为255 bp和225 bp大小的目的片段(图3).
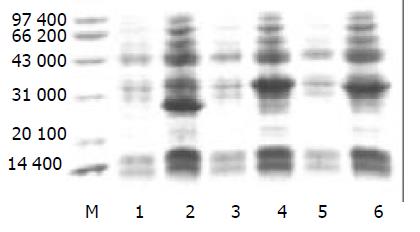
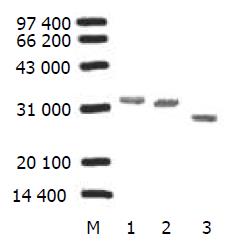
重组原核表达载体转化至大肠杆菌DH5a后, 以IPTG诱导表达, 对细胞裂解液进行SDS-PAGE, 结果显示重组目的蛋白在Mr35 000, Mr34 000处分别有一清晰条带, 与预期结果一致, 而含融合蛋白DHFR的空载体 pQE-80L/DHFR的菌株在Mr 26 000处有一清晰条带(图4). 灰度扫描显示目的蛋白表达量占菌体总蛋白的40%, 这表明目的蛋白在大肠杆菌中获得了高效表达. 以His标签肽为标志的Western blot分析显示, 经IPTG诱导的含重组原核表达载体pQE-80L/DHFR/HMGB1A box, pQE-80L/DHFR/HMGB1 B box的菌体裂解物能与抗-His单抗特异性反应, 在约Mr 35 000 与Mr 34 000处呈现一条带, 而经同样诱导的含融合蛋白DHFR的空载体 pQE-80L/DHFR在约Mr 26 000有一清晰条带, 说明所表达的融合蛋白的确是目的蛋白(图5).
HMGB1是高迁移率族蛋白超家族的成员, 根据结构特点高迁移率族蛋白超家族可分为HMGB、HMGN、HMGA三类家族, 而HMGB1属于HMGB家族, 真核细胞染色质中含有丰富的HMGB1, 人HMGB1含215个氨基酸残基, 基因定位于染色体13q12. N 端富含赖氨酸, 而氨基酸序列高度保守的C 端(又称产酸尾端, "acidic tail", 富含天冬氨酸和谷氨酸. HMGB1含有2 个约80aa组成的"L"型的HMG box, 分别是A box(1-85 aa) 和B box (88-162 aa) 是结合DNA的功能结构域.其中B box 是HMGB1发挥致炎功能的主要区域[8], 而A box却能竞争性抑制HMGB1的致炎功能. 膜相关的HMGB1结合的受体是RAGE (receptor for advanced glycation end products). 内皮细胞、血管平滑肌细胞、神经元、单核/巨噬细胞均表达RAGE[9]. HMGB1与RAGE高亲和力结合, 较其他的RAGE配体高7倍. HMGB1与RAGE结合能诱导大鼠平滑肌细胞的迁移[10]和促进轴突生长[11], 而且能抑制肿瘤的生长和转移[12]. 目前的研究发现细胞表面可能还存在着其他的HMGB1受体[13]. 目前, 发现HMGB1可作为晚期致炎因子, 密切参与炎症的发生发展. 动物实验表明, 大鼠经致死量脂多糖 (LPS)处理后, TNF、IL-1b等早期致炎因子一般都在6 h内达到高峰, 然后很快回到基础水平, 而大鼠仍在攻击后数日内死亡, 故提示内毒素血症致死亡的过程中, 存在一种迟发递质即HMGB1起着重要的作用. TNF基因敲除小鼠在注射高剂量的内毒素后数小时至数天内也发生死亡. 同时, Wang et al用LPS刺激大鼠RAW264.7细胞, 并用SDS-PAGE法分析此条件培养基, 发现LPS刺激后18h即可诱发一种Mr 30 000的蛋白质出现, 而在早期此种蛋白质并不突出, 经氨基酸序列分析证实这种迟发递质为大鼠HMGB1. 巨噬细胞、单核细胞、垂体细胞受内毒素、IL-1、TNF 刺激后在胞内形成丰含HMGB1的囊泡, 再以胞吐的方式释放HMGB1[14], 同时, HMGB1也可刺激单核细胞、巨噬细胞释放致炎因子, 如TNF, IL-1a, IL-1b, IL-6, IL-8, MIP-1a, MIP-1b等. 因此, 我们选用了手术切除的人新鲜扁桃体组织来提取总RNA, 最终获得了与已知序列完全一致的目的片段. 由于HMGB1A box、 HMGB1 B box的分子量分别只有10 000和9 000, 难以在细菌体内形成正确的折叠和稳定表达, 容易被降解, 因此我们从pQE-40L质粒上截取了表达二氢叶酸还原酶(DHFR)的基因片段, 与目的基因片断一起连接于表达载体pQE-80L上, 从而获得了HMGB1A box, HMGB1 B box融合蛋白稳定的表达.另外, 我们所采用的原核表达载pQE-80L是一种高效表达载体, 该载体表达的目的蛋白量可达到细胞蛋白总量的50%, 表达蛋白的N端带有6×His-tag, 便于纯化和检测.
| 1. | Andersson U, Wang H, Palmblad K, Aveberger AC, Bloom O, Erlandsson-Harris H, Janson A, Kokkola R, Zhang M, Yang H. High mobility group 1 protein (HMG-1) stimulates proinflammatory cytokine synthesis in human monocytes. J Exp Med. 2000;192:565-570. [PubMed] [DOI] |
| 2. | Czura CJ, Tracey KJ. Targeting high mobility group box 1 as a late-acting mediator of inflammation. Crit Care Med. 2003;31:S46-S50. [PubMed] [DOI] |
| 3. | Yang H, Wang H, Czura CJ, Tracey KJ. HMGB1 as a cytokine and therapeutic target. J Endotoxin Res. 2002;8:469-472. [PubMed] [DOI] |
| 4. | Andersson U, Erlandsson-Harris H, Yang H, Tracey KJ. HMGB1 as a DNA-binding cytokine. J Leukoc Biol. 2002;72:1084-1091. [PubMed] |
| 5. | Lotze MT, DeMarco RA. Dealing with death: HMGB1 as a novel target for cancer therapy. Curr Opin Investig Drugs. 2003;4:1405-1409. [PubMed] |
| 6. | Palumbo R, Sampaolesi M, De Marchis F, Tonlorenzi R, Colombetti S, Mondino A, Cossu G, Bianchi ME. Extracellular HMGB1, a signal of tissue damage, induces mesoangioblast migration and proliferation. J Cell Biol. 2004;164:441-449. [PubMed] [DOI] |
| 7. | Andersson U, Erlandsson-Harris H. HMGB1 is a potent trigger of arthritis. J Intern Med. 2004;255:344-350. [PubMed] [DOI] |
| 8. | Li J, Kokkola R, Tabibzadeh S, Yang R, Ochani M, Qiang X, Harris HE, Czura CJ, Wang H, Ulloa L. Structural basis for the proinflammatory cytokine activity of high mobility group box 1. Mol Med. 2003;9:37-45. [PubMed] |
| 9. | Schmidt AM, Stern DM. RAGE: a new target for the prevention and treatment of the vascular and inflammatory complications of diabetes. Trends Endocrinol Metab. 2000;11:368-375. [PubMed] [DOI] |
| 10. | Degryse B, Bonaldi T, Scaffidi P, Müller S, Resnati M, Sanvito F, Arrigoni G, Bianchi ME. The high mobility group (HMG) boxes of the nuclear protein HMG1 induce chemotaxis and cytoskeleton reorganization in rat smooth muscle cells. J Cell Biol. 2001;152:1197-1206. [PubMed] [DOI] |
| 11. | Srikrishna G, Huttunen HJ, Johansson L, Weigle B, Yamaguchi Y, Rauvala H, Freeze HH. N -Glycans on the receptor for advanced glycation end products influence amphoterin binding and neurite outgrowth. J Neurochem. 2002;80:998-1008. [PubMed] [DOI] |
| 12. | Taguchi A, Blood DC, del Toro G, Canet A, Lee DC, Qu W, Tanji N, Lu Y, Lalla E, Fu C. Blockade of RAGE-amphoterin signalling suppresses tumour growth and metastases. Nature. 2000;405:354-360. [PubMed] [DOI] |
| 13. | Sparatore B, Pedrazzi M, Passalacqua M, Gaggero D, Patrone M, Pontremoli S, Melloni E. Stimulation of erythroleukaemia cell differentiation by extracellular high-mobility group-box protein 1 is independent of the receptor for advanced glycation end-products. Biochem J. 2002;363:529-535. [PubMed] [DOI] |