修回日期: 2003-12-09
接受日期: 2003-12-22
在线出版日期: 2004-05-15
目的: 探讨三维动态对比增强磁共振门脉血管造影(3D DCE MRP)诊断原发性肝细胞癌门脉血管并发症的影像表现及其诊断价值.
方法: 对33例原发性肝细胞癌患者行3D DCE MRP检查, 之后10 d内, 25例进行了数字减影血管成像(DSA)检查, 8例进行了外科手术治疗.以手术所见或DSA结果为标准, 对3D DCE MRP诊断门脉血管并发症的结果进行评价.
结果: 3D DCE MRP共诊断41条门脉主干或分支癌栓形成, 表现为梗阻端呈结节状24例, 不规则状17例, 伴有受累管腔扩张23例以及管壁的不连续光滑11例, 其诊断敏感性、特异性及诊断符合率分别为91.9%、88.7%及89.8%. 同时检出12例门静脉海绵样变性, 表现为正常门静脉血管消失或中断, 代之以与门脉主干并行、迂曲扩张成蛇形的静脉网; 并提示6例肝动脉-门静脉瘘形成, 表现为"双轨征"(2例)或三级以上门静脉早显(4例).
结论: 3D DCE MRP是诊断门脉癌栓、门脉海绵样变及肝动脉-门静脉瘘的有效方法, 可为临床采取正确的治疗方案提供必要依据.
引文著录: 张水兴, 张雪林, 张玉娴, 张玉忠. 增强磁共振血管造影诊断肝细胞癌门静脉并发症. 世界华人消化杂志 2004; 12(5): 1251-1253
Revised: December 9, 2003
Accepted: December 22, 2003
Published online: May 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1251-1253
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1251.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1251
原发性肝细胞癌(hepatocellular carcinomas, HCC)常易引起门脉分支或主干的癌栓, 继而可引起门静脉海绵样变性及肝动脉-门静脉瘘等血管并发症的形成. 三维动态对比增强磁共振门脉血管造影(the three-dimensional dynamic contrast-enhanced magnetic resonance portography, 3D DCE MRP)是一种非损伤性血管成像检查方法, 已逐步应用于临床[1]. 本研究通过与外科手术所见或DSA结果相对照, 进一步探讨3D DCE MRP诊断HCC门脉血管并发症的影像表现及其应用价值.
HCC诊断明确, 所有病例均经过临床综合检查(包括病史、体检、AFP、超声、CT、MRI、 DSA或经皮肝穿), 符合1999年第四届全国肝癌会议制定的原发性肝癌诊断标准, 并经超声、CT或常规MRI诊为可疑门脉癌栓形成者. 33例HCC患者, 其中男27例, 女6例, 年龄30-72岁, 平均43.3岁. 有慢性乙型肝炎史17例, 合并肝硬化20例. 巨块型15例, 多结节型9例, 弥漫型6例, 巨块+多结节型3例. 所有病例均于3D DCE MRP检查后1-10 d(平均3 d)进行手术治疗, 其中行DSA并栓塞化疗25例, 外科手术治疗8例.
采用仪器: SIEMENS公司1.5T magneton vision plus VB33A超导型全身磁共振扫描仪, 相阵控体部线圈, SBP200型spectris MR专用压力注射器. 扫描序列: 快速成像稳态进动序列(3D FISP). 扫描参数: TR/TE/FA/FOV/matrix分别为2 ms/5 ms/20/35-40 cm/192×256, 3D块厚度70-90 mm, 有效层厚2 mm, 脂肪抑制, 采集时间18-21 s. 对比剂: 选用Gd-DTPA, 剂量为0.4 mmoL/kg, 速度2-3 mL/s, 注射完毕后20 mL生理盐水冲管. 扫描前采用团注实验技术(bolus test)确定扫描延迟时间, 扫描均取冠状位, 范围包括门脉主干和肝内左右分支, 尽量同时包括肝静脉和下腔静脉, 扫描完毕后, 采用最大强度信号投影(maximum intensity projection, MIP)对原始图像进行三维重建.
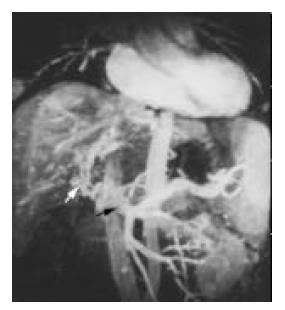
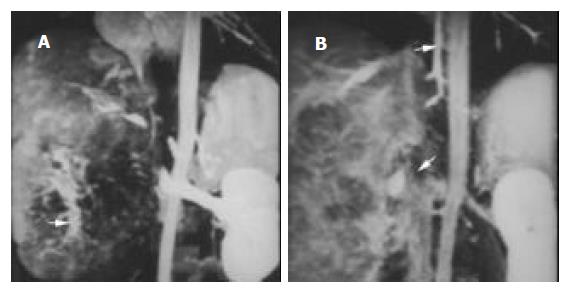
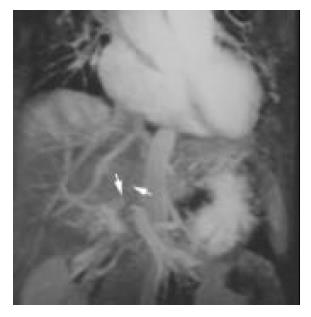
(1)门脉癌栓: 33例患者共可见41支门脉主干/一级分支内有癌栓形成. 主要表现为门静脉主干和/或肝内分支突然中断或完全消失, 梗阻远端不显影. 其中梗阻端呈不规则状17例(图1), 结节状24例(图3); 伴有受累管腔扩张23例以及受累管壁不连续光滑11例. (2)门脉海绵样变12例(图1), 其中发生于门静脉主干8例, 发生于门静脉左右分支4例. 主要表现为正常门静脉血管消失或中断, 代之以与门脉主干并行、迂曲扩张成蛇形的静脉网, 这些扩张静脉多位于有瘤栓的门静脉旁, 沿着门脉系统分布, 且无肝动脉或胆管伴行. (3)肝动脉-门静脉瘘6例(图2), 其典型表现为在动脉期癌肿内或其周围可见多发小草样门脉小分支显影或于肝外周出现与动脉平行的门静脉影称为"双轨征", 此为周围型, 可见2例; 或表现为动脉期肝动脉未显示, 而三级以上门静脉早显, 此为中央型, 共见4例.
外科手术探查或DSA证实有30例共37支门脉主干/一级分支内有癌栓形成, DSA同时检出14例门脉海绵样变及10例肝动脉-门静脉瘘(中央型4例, 周围型6例 ). 将33例HCC患者手术病理或DSA检查结果与3D DCE MRP检查所见进行比较, 经统计学方法处理, 可得出3D DCE MRP对门脉主干及一级分支内癌栓诊断的敏感性、特异性及诊断符合率分别为91.9%、88.7%及89.8%; 对门脉海绵样变的诊断敏感性为85.7%; MRP对肝动脉-门静脉瘘中央型的诊断与DSA基本符合, 远优于其对周围型的检出(表1).
| 检查方法 | 门脉癌栓 | 门脉海绵样变 | 肝动脉-门静脉瘘 | |||||
| PV | RPV | LPV | PV+RPV | PV+LPV | 中央型 | 周围型 | ||
| 3D DCE MRP | 14 | 6 | 5 | 4 | 4 | 12 | 4 | 2 |
| 手术病理或DSA | 15 | 6 | 2 | 5 | 2 | 14 | 4 | 6 |
根据尸检及影像学检查, 约20-70%的HCC伴有门静脉癌栓[2]. 正确认识门脉癌栓及其所致的门脉血管继发性改变对于HCC患者的预后及治疗方案的选择具有重要意义[3-4]. 3D DCE MRP采集时间短且血管成像不依赖于血液流动效应, 无造影剂过敏反应和肾毒性, 具有很高的敏感性和特异性, 使门静脉血管成像技术发生了质的飞跃, 已逐渐成为门静脉血管造影的主流方法[1].
在组织学上80-91.8%的肝癌患者可发现门静脉癌栓. 门脉癌栓在MRP上表现为门静脉突然中断不显影, 梗阻端见结节状或不规则形状, 并可见邻近门静脉分支增粗或增多, 常伴有受累管腔扩张以及管壁的不连续光滑. 林江et al[5]认为3D DCE MRP显示门脉癌栓的准确性高于超声. 陈立波et al[6]研究认为3D DCE MRP对门静脉癌栓诊断的敏感性、特异性分别为94.3%、84.2%, 远远优于常规MRI. 本研究3D DCE MRP可见33例患者共有41支门静脉主干/一级分支癌栓形成, 对门脉主干及一级分支内癌栓诊断的敏感性、特异性及诊断符合率分别为91.9%、88.7%及89.8%, 进一步验证了3D DCE MRP对门静脉癌栓的诊断具有极高的价值.结合常规MRI还可对门脉癌栓及血栓进行有效鉴别(新鲜血栓表现为典型短T1长T2信号), 此点亦是3D DCE MRP较DSA更具优势之处. 对本组病例进一步统计得出, MRP对门静脉右支及左支癌栓的诊断符合率分别为96.9%、84.8%, 3D DCE MRP在判定门静脉左支有无受累与侵犯时出现明显的假阳性结果, 这可能与门脉左支较细长、快速注射造影剂易引起湍流等有关. 癌栓所致的门脉栓塞中, 血管往往因为癌栓的膨胀性生长而扩张[7]; 并且由于血管壁受侵或血管内癌栓膨胀性生长对管壁造成的压迫, 栓塞的血管壁可以不连续光滑, 甚至形成外突性结节, 本组可见此征象11例, 为本研究首次报道.
Triger[8]通过血管造影和病理检查发现门脉海绵样变是门静脉阻塞后形成的向肝性静脉侧支循环. 由于这些血管的大体标本切面观呈海绵状血管瘤样改变, 故被称为"门脉海绵变性".门脉海绵样变在3D DCE MRP上表现为正常门静脉血管消失或中断, 代之以与门脉主干并行、迂曲扩张成蛇形的静脉网, 在静脉期显影最为清晰, 这些扩张静脉多位于有瘤栓的门静脉旁, 沿着门脉系统分布, 且无肝动脉或胆管伴行. 本组病例共可见12例门脉海绵样变, 发生于门脉主干8例, 左右分支各见1例和3例, 与DSA所见相比, 其敏感性为85.7%, 远优于CT或常规MRI, 且3D DCE MRP能三维动态显示侧支血管网, 其诊断价值较超声亦更具优势.每例患者MRP图像上均可见相应部位门脉癌栓形成, 因此, 笔者认为, HCC患者如出现门脉海绵样变可强烈提示门脉癌栓形成.
肝动脉-门静脉瘘在肝癌中的发生率较高[9], 最高可达肝癌患者的50%。本组3D DCE MRP共检出肝动脉-门静脉瘘6例. 其中中央型4例, 表现为门脉主干及一、二级大分支于动脉期早显, 周围型2例, 典型表现为在动脉期癌肿内或其周围可见多发小草样门脉小分支显影或于肝外周出现与动脉平行的门静脉影像称为"双轨征". 本组研究结果表明, 3D DCE MRP对肝动脉-门静脉瘘中央型检出率与DSA相当, 但对周围型其检出结果明显低于DSA, 笔者认为其原因可能与3D DCE MRP显示门脉四级或以下分支能力有限有关.
3D DCE MRP具有扫描时间短、图像分辨率高、实用性强等特点, 可得到任何角度观察的门脉血管图像, 准确率非常高[10];并且可以比超声、CT提供更多有关侧支循环的信息[11-12]. 总之, 3D DCE MRP所提供的信息对中晚期肝癌患者的治疗及预后极具价值.
| 1. | Suto Y, Kimura T, Kamba M, Sugihara S, Yoshida K, Takizawa O. Use of three-dimensional segmented FLASH sequence with magnetization transfer contrast to improve Gd-DTPA-enhanced intrahepatic MR portography. J Magn Reson Imaging. 1997;7:286-291. [PubMed] [DOI] |
| 2. | Cedrone A, Rapaccini GL, Pompili M, Aliotta A, Trombino C, De Luca F, Caturelli E, Caputo S, Gasbarrini G. Portal vein thrombosis complicating hepatocellular carcinoma. Value of ultrasound-guided fine-needle biopsy of the thrombus in the therapeutic management. Liver. 1996;16:94-98. [PubMed] [DOI] |
| 3. | Tanaka A, Morimoto T, Yamaoka Y. Implications of surgical treatment for advanced hepatocellular carcinoma with tumor thrombi in the portal vein. Hepatogastroenterology. 1996;43:637-643. [PubMed] |
| 4. | Saddik D, Frazer C, Robins P, Reed W, Davis S. Gadolinium-enhanced three-dimensional MR portal venography. AJR Am J Roentgenol. 1999;172:413-417. [PubMed] [DOI] |
| 5. | 林 江, 陈 祖望, 周 康荣, 王 建华, 颜 志平, 程 洁敏, 龚 高全, 沈 继章, 陈 财忠, 施 伟斌. 三维动态 增强磁共振血管成像诊断肝癌患者门脉受侵的价值. 中华放射学杂志. 1999;33:511-514. |
| 7. | Tublin ME, Dodd GD 3rd, Baron RL. Benign and malignant portal vein thrombosis: differentiation by CT characteristics. AJR Am J Roentgenol. 1997;168:719-723. [PubMed] [DOI] |
| 9. | Wu ZQ, Fan J, Qiu SJ, Zhou J, Tang ZY. The value of postoperative hepatic regional chemotherapy in prevention of recurrence after radical resection of primary liver cancer. World J Gastroenterol. 2000;6:131-133. [PubMed] [DOI] |
| 10. | Stafford-Johnson DB, Hamilton BH, Dong Q, Cho KJ, Turcotte JG, Fontana RJ, Prince MR. Vascular complications of liver transplantation: evaluation with gadolinium-enhanced MR angiography. Radiology. 1998;207:153-160. [PubMed] [DOI] |
| 11. | Okumura A, Watanabe Y, Dohke M, Ishimori T, Amoh Y, Oda K, Dodo Y. Contrast-enhanced three-dimensional MR portography. Radiographics. 1999;19:973-987. [PubMed] [DOI] |
| 12. | Erden A, Erden I, Yağmurlu B, Karayalçin S, Yurdaydin C, Karayalçin K. Portal venous system: evaluation with contrast-enhanced 3D MR portography. Clin Imaging. 2003;27:101-105. [PubMed] [DOI] |