修回日期: 2004-01-09
接受日期: 2004-02-01
在线出版日期: 2004-05-15
目的: 探讨分裂原激活的蛋白激酶家族(MAPK)信号转导通路与脂质体生存素(survivin)反义寡核苷酸转染诱导人胃癌细胞系HS-746T凋亡的关系.
方法: 设计合成survivin反义寡核苷酸(ASODN)转染胃癌HS-746T细胞, 分空白对照组, 脂质体和正义链转染组, 100, 200, 400 nmoL/L反义链转染组及P38MAPK、ERK1/2抑制剂组. 用流质细胞仪检测转染后2, 4, 8, 12, 24 and 48 h各组细胞增生和凋亡指数. 逆转录聚合酶链反应(RT-PCR)、免疫细胞化学染色法、Western blot蛋白免疫印迹法、免疫沉淀法及激酶活性测定法检测各对照组及ASODN组转染后survivin mRNA和P38MAPK, ERK1/2, survivin蛋白表达和活性的变化.
结果: 不同时间空白组、脂质体和正义链转染组ERK1/2 , P38MAPK表达均无明显差异, 各浓度survivin ASODN转染组凋亡细胞增多, 凋亡指数高于其他对照组. P38MAPK抑制剂组凋亡细胞减少, ERK1/2抑制剂组增多. Survivin mRNA和蛋白表达随着转染浓度的增加而降低. 磷酸化和非磷酸化细胞外信号调节激酶(extracellular signal-regulated kinasel/2, ERKl/2)的表达随药物浓度增加而减弱. P38MAPK的表达在各组均相同, 但ASODN转染组活性增高.
结论: Survivin基因反义寡核苷酸在体外可能通过MAPK信号转导通路激活凋亡相关的信号途径P38MAPK, 阻断与细胞增生相关的信号途径ERK1/2来诱导胃癌细胞凋亡, 抑制人胃癌细胞的增生.
引文著录: 付广, 王国斌, 卢晓明, 黄庆先, 郑海. MAPK信号转导通路与生存素反义寡核苷酸诱导人胃癌细胞凋亡的关系. 世界华人消化杂志 2004; 12(5): 1034-1039
Revised: January 9, 2004
Accepted: February 1, 2004
Published online: May 15, 2004
AIM: To study the relation of mitogen-activated protein kinase (MAPK) signal transduction and apoptosis of human gastric carcinoma cells HS-746T induced by liposomes of survivin antisense oligonucleotide (ASODN).
METHODS: Survivin ASODN was designed and synthesised to transfect human gastric carcinoma cells HS-746T. The cultured cells were divided into 6 groups: vacuity control group, liposome and sense oligonucleotide (SODN) group, 100, 200 and 400 nmoL/L ASODN group and P38MAPK, extracellular signal-regulated kinase 1/2 (ERK1/2) inhibitor groups. Apoptotic index (AI) and proliferative index (PI) were examined by flow cytometry after transfection 2, 4, 8, 12, 24 and 48 h. RT-PCR, immunocytochemical stain, Western blot, immuno-precipitation and kinase activity assay were used to detect protein expression and activity of P38MAPK, ERK1/2, survivin and survivin mRNA after transfection.
RESULTS: Expression of ERK1/2 and P38MAPK has not significantly different among vacuity control group, liposomes group and SODN group. The apoptotic cells increased in anisoconcentration survivin ASODN groups and AI was higher than that of other control group. Apoptotic cells decreased in P38MAPK inhibitor group while increased in ERK1/2. The protein and mRNA expression of survivin decreased when transfection concentration was increased. The phosphorylated and nonphosphorylated ERK1/ 2 showed a dose-and time-dependent decrease whereas protein level of p38MAPK remained unchanged, but activity increased.
CONCLUSION: Survivin ASODN can induce apoptosis of human gastric carcinoma cells in vitro though MAPK signal transduction including activating apoptosis-related signal P38MAPK and suppressing proliferation-related signal ERK1/2.
- Citation: Fu G, Wang GB, Lu XM, Huang QX, Zheng H. MAPK signal transduction and apoptosis of human gastric carcinoma cells induced by liposomes of survivin antisense oligonucleotide. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1034-1039
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1034.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1034
生存素(survivin)是细胞内凋亡抑制蛋白家族(inhibitor of apoptosis family of protein, IAPs)的一个新成员, 他可以通过有丝分裂促进细胞增生, 抑制细胞凋亡. 研究表明, 应用反义策略阻断survivin表达在体外可明显抑制胃癌细胞的生长. 分裂原激活的蛋白激酶家族(mitogen-activated protein kinase , MAPK) 通过三级酶促级联反应激活并调节特定的基因表达, 他所介导的信号转导通路是将细胞外丝裂原信号传递给细胞核并产生反应的重要通路, 在细胞增生和凋亡的调节中起重要作用. 我们在观察了survivin反义寡核苷酸(ASODN)诱导胃癌细胞HS-746T凋亡的基础上, 进一步探讨其与MAPK信号转导通路的关系.
脂质体Lipofectin购自LifeTechnologies公司;人胃癌细胞系HS-746T购自武汉大学培养物保存中心;RPMI1640购自GIBCO公司; ECL显色试剂盒购自武汉亚法生物工程公司. 抗磷酸化ERK1/2和磷酸化p38MAPK的抗体, 抗总ERK1/2和总p38MAPK蛋白的抗体及PD98059, SB203580购自美国Sigma公司. 根据生存素的基因序列(Genbank Accession Number: U75285), 应用primer 5.0软件设计互补于生存素mRNA的232-251序列的20个碱基组成的ASODN链, 序列为5'-CCCAGCCTTCCAGCTCCTTG-3', 同时合成正义链, 序列为5'-CAAGGAGCTGGAAGGCTGGG-3', 两序列在合成时均用巯基取代寡核苷酸片段磷上的羟基修饰. 在Genbank中行Blastn证实ASODN及SODN与任何已知哺乳动物基因无匹配. ASODN 5'端以绿色荧光蛋白标记, 由上海生工生物公司合成.
水浴复苏人胃癌细胞系HS-746T后接种于30 mL培养瓶及铺有无菌盖玻片的6孔培养板上, 在37 ℃、50 mL/L CO2饱和湿度培养箱中用含100 mL/L小牛血清的RPMI 1640培养液常规培养, 胰蛋白酶消化细胞并记数, 培养至80%融合后取对数生长期细胞进行转染. 实验共分6组, 为空白对照组, 脂质体转染对照组, SODN转染对照组和100, 200, 400 nmoL/L三种浓度的ASODN转染组, 每组设3个复孔. 另设置6组转染时分别加入ERK1/2和p38MAPK特异性抑制剂10 mmol/L PD98059, SB203580, 转染结束后再根据转染进行2, 4, 8, 12, 24, 48 h分为6组, 收集不同时间的细胞进行检测. 采用阳离子脂质体Lipofectin进行转染, 将接种于6孔板培养至80%汇片的HS-746T细胞去除培养基, 用温热无血清的RPMI 1640漂洗细胞2次. 分别将寡核苷酸及Lipofectin 10 mL溶于预暖的无血清RPMI 1640100和90 mL, 室温下静置30 min后轻柔混合二者, 孵育15 min, 不加抗生素, 用800 mL无血清RPMI 1640稀释后轻铺于细胞上, 在37 ℃, 50 mL/L CO2培养箱内孵育. 8 h后去除转染液, 继续以含100 mL/L小牛血清的RPMI 1640培养. 培养过程中常规用台盼蓝染色法检测各组细胞死亡率均小于或等于5%.
1.2.1 免疫细胞化学染色: 按SP法操作, 制作培养的各组胃癌细胞爬片用冷丙酮固定, 加3 mL/L甲醇于室温封闭30 min, 室温振荡3次, 用含100 mL/L山羊血清的PBS室温封闭30 min. 分别加入一抗, 湿盒中4 ℃过夜, 再加入通用型生物素化二抗37 ℃孵育30 min, 最后加入辣根酶标记的链霉孵白素, 37 ℃孵育30 min. DAB显色, 苏木素复染, 常规脱水, 透明, 中性树脂胶封片, 设置PBS代替一抗作为阴性对照. 稀释度为: 抗ERK1/2:1:200; 抗p38:1:200; 抗 p-ERK1/2:1:100; 抗p-p38:1:100.
1.2.2 分析细胞凋亡比率及细胞周期: 收集1.0×106个细胞, 70 mL/L冷乙醇 4 ℃固定, 加 RNase A 37 ℃孵育1 h, 碘化丙啶(PI) 避光冰浴染色1 h. 采用Beckon/Dickinson Facssort型流式细胞仪, 在488 nm波长处进行检测, 用multicycle软件分析凋亡指数, DNA含量及细胞周期, 细胞凋亡指数(AI) = 亚二倍峰细胞数/总细胞数×100%, 细胞增生指数(PI) = (S+G2/M)/(G0/G1+S+G2/M)×100%.
1.2.3 检测胃癌细胞: Survivin, ERK1/2及P38MAPK蛋白表达 将转染后继续培养4, 12, 24 h的胃癌细胞用PBS液漂洗3次后加入预冷至4 ℃的50 mL裂解缓冲液, 冰上作用20 min, 4 ℃, 12 000 r/min离心20 min, 上清液保存于-20 ℃. 采用BCA法测定蛋白质浓度, 用40 mg/孔上样, 120 g/L SDS PAGE凝胶电泳分离, 通过电转移法将蛋白质从SDS PAGE凝胶转移至硝酸纤维素膜后在含50 g/L脱脂奶粉的TTBS中37 ℃封闭90 min, 加入一抗, 4 ℃孵育过夜, TTBS漂洗后(10min×3次), 加入二抗, 7 ℃作用40 min, TTBS充分漂洗(10 min×3次), 洗膜后加入增强化学发光底物ECL试剂. X线片暗室曝光, 常规显影定影. 图像以Bio Rad图像分析系统分析, 用蛋白条带的平均光强度值表示survivin, ERK1/2及P38MAPK 蛋白表达的相对强度.
1.2.4 检测胃癌细胞survivin mRNA表达: 取转染后继续培养24 h的1×106个胃癌细胞用PBS液漂洗2次, 以Trizol试剂提取总RNA, 用紫外分光光度计检验纯度并定量. 在1%甲醛变性凝胶上电泳验证RNA完整性后逆转录为cDNA, 产物进行PCR, 设GAPDH为内参照, 对样品模板用量标准化, Survivin和GAPDH分管扩增, 引物由上海生工公司合成. Survivin引物(扩增产物727 bp)序列:上游5'-GGGACCCGTTGGCAGAG-3', 下游5'- AAAATGAGCCCCCAAAAAAGA-3'; GAPDH引物(扩增产物372 bp) 序列:上游5'-CACCATCTTCCAGGAGCGAG-3', 下游5'-TCACGCCACAGTTTCCCGGA-3'. RT-PCR条件: 50 ℃逆转录30 min, 94 ℃变性2 min, 60 ℃退火1 min, 72 ℃延伸1 min, 35(survivin)或26(GAPDH)个循环, 72 ℃充分延伸10 min. PCR扩增产物行1.5%琼脂糖凝胶上电泳, 以Fluor S多功能成像系统扫描拍照分析, 用以下公式计算其相对抑制率. 抑制率 = [1-(实验样品/实验内参) /(空白对照样品/空白对照内参)]×100%.
1.2.5 ERK1/2, p38 MAPK活性分析: 参照李田昌et al(基础医学与临床1996;16:78-80)的方法, 将提取的各组胃癌细胞质蛋白稀释至1.3 g/ L, 分别与浓度为0.5 g/L的抗ERK1/2, p38MAPK抗体4 ℃共同孵育4 h, 加入激酶缓冲液25 mL, 在25 ℃水浴孵育30 min, 加入20 mmoL/L ATP, 1.85 MBq [g-32P]ATP启动磷酸化反应, 然后进行放射自显影, b液闪测定仪上测 cpm值计数, 测定32P的放射活性, 以每克蛋白质32P的掺入量[pkat/g]表示ERK1/2, p38MAPK活性.
统计学处理 各组实验数据以平均值±标准差(mean±SD)表示, 采用SPSS10.0统计软件进行分析, 多个样本间比较行单因素方差分析, 组间两两比较用q检验. P<0.05, 差异在统计学上有显著性意义.
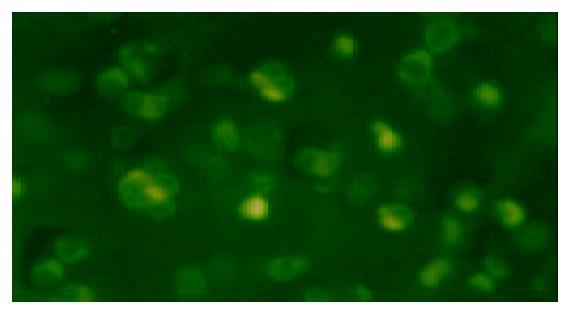
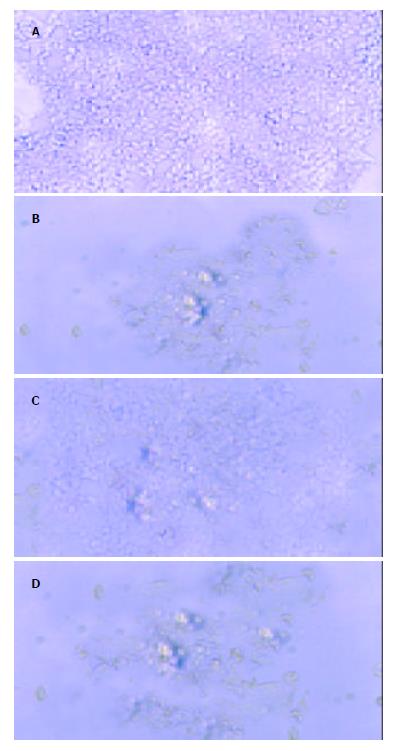
倒置荧光显微镜下观察各组胃癌细胞的变化, 不同浓度的ASODN转染组细胞可见清晰的绿色荧光, 空白对照组, 脂质体转染对照组, SODN转染对照组则未见到(图1). 光镜下见ASODN转染组2 h后有部分细胞贴壁性降低, 细胞变圆漂起, 突起收缩, 形成凋亡小体, 24 h后达到高峰, 有大量坏死细胞漂浮(图2 A, B). 加入p38MAPK, ERK抑制剂SB203580, PD98059后, ERK组坏死细胞增多, 贴壁细胞减少; 而p38MAPK组效应则相反(图2 C, D).
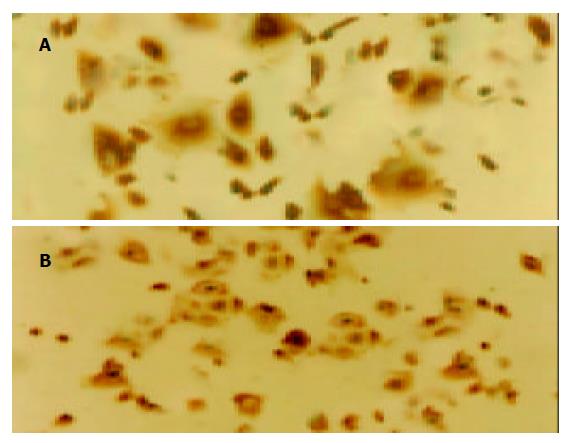
免疫组化染色后见未加抑制剂的对照组p38MAPK, ERK蛋白主要位于胃癌细胞核周区, 染色较弱, 呈淡黄色颗粒. ASODN实验组中p38MAPK与其无明显差别, 而ERK蛋白则分布于胞核及胞质内, 黄染减弱(图3 A, B). 加抑制剂的对照组和实验组中, 二者表达均减低.
用流式细胞仪定量检测发现各对照组不同时间人胃癌细胞凋亡指数(AI)无显著性差异, 不同浓度ASODN转染组DNA直方图可见二倍体峰减少, G1峰左侧出现明显的亚二倍体凋亡峰, 转染24 h后测空白对照组, 脂质体转染组, SODN转染组, 100, 200, 400 nmoL/L ASODN转染组细胞凋亡率分别为0.8%, 1.0%, 1.3%, 14.8%, 19.4%及53.8%. 400 nmoL/L ASODN转染组诱导凋亡最为明显, 各ASODN转染组细胞AI明显高于各对照组, 差异在统计学上有显著意义(P<0.05). 400 nmoL/L组AI明显高于100, 200 nmoL/L组, 差异在统计学上也有显著意义(P<0.05).
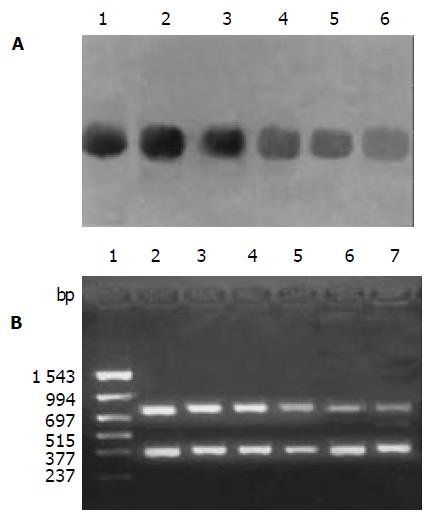
Westernblot印迹法显示各对照组不同时间人胃癌细胞内survivin蛋白表达无明显差异, 不同浓度ASODN转染组survivin蛋白表达均较各对照组低. 应用计算机对条带净密度进行分析发现, ASODN转染对survivin蛋白的抑制作用有明显的剂量依赖性, survivin蛋白表达随着转染浓度的增加而降低, 转染24 h后400 nmoL/L转染组蛋白表达仅为空白对照组的30.5%(图4 A). RT-PCR产物电泳结果显示出372 bp的GAPDH DNA片段和727 bp的survivin基因片段, 不同时间对照组人胃癌细胞内survivin mRNA表达量差异无显著意义. 与各对照组相比较, 各浓度ASODN转染组survivin mRNA表达量均显著降低, 而且随着ASODN浓度增加, Survivin mRNA表达量逐渐下降, 对mRNA表达相对抑制率逐渐升高, 转染24 h后400 nmoL/L转染组相对抑制率可达68.3%, ASODN的抑制作用具有明显的剂量依赖性, 它可有效抑制人胃癌细胞内survivin mRNA表达(图4 B).
流式细胞术定量检测发现转染survivin ASODN 24 h后, 在用p38MAPK抑制剂SB203580组中, 空白对照组, 脂质体转染组, SODN转染组, 100, 200, 400 nmoL/L ASODN转染组细胞凋亡率分别为0.7%, 0.9%, 1.1%, 11.3%, 13.2%及31.5%, 均比未用抑制剂者减低. 而在用ERK1/2抑制剂PD98059组中, 各组细胞凋亡率分别为0.9%, 1.2%, 1.4%, 17.3%, 23.4%及63.5%, 均比未用抑制剂者增高. 各ASODN转染组之间的差异在统计学上有显著意义(P<0.05).
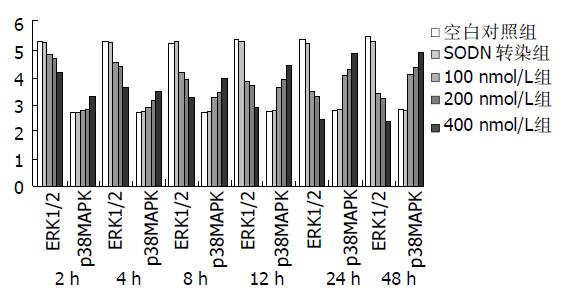
Westernblot法检测细胞转染后4, 12, 24 h的ERK1/2及P38MAPK活性(磷酸化水平), 同时检测非磷酸化的ERK1/2及P38MAPK蛋白表达情况作为对照. 结果显示, 各对照组不同时间人胃癌细胞内磷酸化和非磷酸化的ERK1/2, P38MAPK蛋白表达无明显差异, 不同浓度ASODN转染组p-ERK1/2及ERK1/2表达均较各对照组低, 且随着时间延长和浓度增高而降低; 而P38MAPK蛋白在不同时间表达均相同, 但p-P38MAPK较各对照组高.应用计算机对条带净密度进行分析发现, p-ERK1/2, ERK1/2, p-P38MAPK蛋白表达对ASODN转染浓度有明显的剂量依赖性, 转染24 h后400 nmoL/L转染组p-ERK1/2, ERK1/2, p-P38MAPK表达为空白对照组的50.5%, 45.6%, 180.7%(图5).
激酶活性检测结果显示, 转染survivin ASODN后P38MAPK活性随时间延长逐渐增高, 24 h后增势减缓; 而ERK1/2活性则具有与P38MAPK活性变化相反的趋势. 各对照组ERK1/2及P38MAPK活性变化不大, 与各实验组相比较, 差异有有显著性意义(P<0.05, 图6).
近年研究显示, 利用反义技术, 抑制或封闭基因的表达, 干扰致病蛋白质的产生, 对肿瘤具有良好的治疗作用[1-4]. Survivin基因是细胞内凋亡抑制蛋白家族的一个新成员, 他与胃癌的形成和发展有着较大的关系[5-9]. 我们以survivin为靶分子, 利用脂质体反义寡核苷酸在体外能够通过下调survivin mRNA和蛋白的表达, 诱导胃癌细胞凋亡, 抑制人胃癌细胞的增生能力. 由于survivin基因表达的蛋白定位于细胞有丝分裂的纺锤体, 而分裂原激活的蛋白激酶家族(MAPK)活性的异常又与肿瘤的发生和细胞凋亡的信号转导关系密切[10-13], 所以推测MAPK通路可能参与了反义寡核苷酸诱导胃癌细胞凋亡的过程. 实验结果显示, 在ASODN实验组中加入p38MAPK, ERK抑制剂能够影响胃癌细胞凋亡率的改变, 且磷酸化和非磷酸化的p38MAPK, ERK1/2蛋白表达及二者的活性在实验组和对照组中均有不同, 这提示了MAPK通路中的p38MAPK、ERK1/2途径与survivin ASODN诱导胃癌细胞凋亡的过程有很大关系.
MAPK信号转导通路是介导细胞反应的重要信号系统[14-23], MAPK的活化能将细胞生长因子等丝裂原信号传递到细胞核内诱导大多数真核细胞增生分化. 现在已经确定哺乳动物细胞中MAPKs途径大致分为4种: ERK1/2途径, ERK5途径, JNK途径, p38途径. 其中p38MAPK通路被称为应激激活的MAPK通路, 其被激活的磷酸化级联反应是: MLK(DLK)/TAK/ASK-MEK3/6-p38 MAPK, 主要增强细胞对应激原的抵抗力并介导细胞凋亡的信号转导;而细胞外信号调节激酶(ERK1/2) 为分裂原激活的MAPK通路, 其级联反应是: Raf mos/TPL-1/2-ERKl/2, 主要介导细胞增生和分化的信号转导. MAPK级联反应非常复杂, 这些通路可被不同的细胞外信号所激活, 然后将特异的细胞外刺激信号诱发的蛋白激酶酪氨酸磷酸化转变为蛋白激酶丝氨酸/苏氨酸磷酸化, 从而使信号向下游传导. 因此他位于许多细胞因子信号传导途径中的汇聚点. ERK1/2主要与细胞的增生通路有关, 而p38主要在诱导细胞凋亡的信号传导途径中起作用, 两种途径可以独立或同时被激活. 在我们的研究中发现, ASODN实验组中加入p38MAPK抑制剂SB203580后, 胃癌细胞凋亡减少; 而加入ERK抑制剂PD98059后, 细胞凋亡增多, 二者呈现相反的效应. 对转染survivin ASODN后不同时间胃癌细胞ERK1/2及P38MAPK蛋白表达及活性分析显示, 不同浓度ASODN转染组p-ERK1/2, ERK1/2蛋白表达及激酶活性均较各对照组低, 且呈时间和剂量依赖性. 而P38MAPK的表达情况则与ERK1/2明显不同, 非磷酸化的P38MAPK蛋白无论在各对照组还是ASODN实验组, 表达均差异不大, 统计学上无显著性意义; 但磷酸化的P38MAPK蛋白及激酶活性却明显增高, 也呈时间和剂量依赖性. 这些结果说明了P38MAPK蛋白在胃癌细胞中表达较稳定, 虽然survivin ASODN转染不能引起它的变化, 但它可致P38MAPK活性的增高, ERK1/2蛋白表达及激酶活性的降低. Survivin ASODN转染诱导胃癌细胞凋亡可能是通过促进P38MAPK活性, 抑制ERK1/2蛋白表达及活性, 产生相互协同效应来实现.
MAPK通路的激活导致细胞增生主要是通过激活raf1, 然后依次使MEK磷酸化, 激活ERK1/2, 抑制P38MAPK, 诱导细胞周期素, 激活细胞周期素依赖激酶, 促使Rb蛋白磷酸化, 从而导致细胞增生. Survivin反义寡核苷酸抑制胃癌细胞的增生能力可能是通过抑制survivin mRNA及蛋白的产生, 使有丝分裂原形成减少, 从而抑制上述的过程, 提高P38MAPK的活性, 导致胃癌细胞增生减少, 凋亡增加. 总之, 胃癌在我国常见[24-35], 利用反义技术诱导癌细胞凋亡的信号转导是一个复杂的过程, 其确切机制还有待进一步研究.
| 1. | Abaza MS, Al-Attiyah RJ, Al-Saffar AM, Al-Sawan SM, Moussa NM. Antisense oligodeoxynucleotide directed against c-myb has anticancer activity and potentiates the antiproliferative effect of conventional anticancer drugs acting by different mechanisms in human colorectal cancer cells. Tumour Biol. 2003;24:241-257. [PubMed] [DOI] |
| 2. | Zang XP, Lerner MR, Dunn ST, Brackett DJ, Pento JT. Antisense KGFR oligonucleotide inhibition of KGF-induced motility in breast cancer cells. Anticancer Res. 2003;23:4913-4919. [PubMed] |
| 3. | Du QY, Wang XB, Chen XJ, Zheng W, Wang SQ. Antitumor mechanism of antisense cantide targeting human telomerase reverse transcriptase. World J Gastroenterol. 2003;9:2030-2035. [PubMed] [DOI] |
| 4. | Gu ZP, Wang YJ, Li JG, Zhou YA. VEGF165 antisense RNA suppresses oncogenic properties of human esophageal squamous cell carcinoma. World J Gastroenterol. 2002;8:44-48. [PubMed] [DOI] |
| 5. | Yang XY, Wang MW, Wang GS, You WD. Expression of human anti-apoptotic gene survivin and its splice in normal human gastric tissue and gastric cancer. Yixue Yichuanxue Zazhi. 2003;20:75-76. [PubMed] |
| 6. | Wakana Y, Kasuya K, Katayanagi S, Tsuchida A, Aoki T, Koyanagi Y, Ishii H, Ebihara Y. Effect of survivin on cell proliferation and apoptosis in gastric cancer. Oncol Rep. 2002;9:1213-1218. [PubMed] [DOI] |
| 7. | Yu J, Leung WK, Ebert MP, Ng EK, Go MY, Wang HB, Chung SC, Malfertheiner P, Sung JJ. Increased expression of survivin in gastric cancer patients and in first degree relatives. Br J Cancer. 2002;87:91-97. [PubMed] [DOI] |
| 8. | Krieg A, Mahotka C, Krieg T, Grabsch H, Müller W, Takeno S, Suschek CV, Heydthausen M, Gabbert HE, Gerharz CD. Expression of different survivin variants in gastric carcinomas: first clues to a role of survivin-2B in tumour progression. Br J Cancer. 2002;86:737-743. [PubMed] [DOI] |
| 9. | Okada E, Murai Y, Matsui K, Isizawa S, Cheng C, Masuda M, Takano Y. Survivin expression in tumor cell nuclei is predictive of a favorable prognosis in gastric cancer patients. Cancer Lett. 2001;163:109-116. [PubMed] [DOI] |
| 10. | Zhao Y, Wu K, Yu Y, Li G. Roles of ERK1/2 MAPK in vitamin E succinate-induced apoptosis in human gastric cancer SGC-7901 cells. Weisheng Yanjiu. 2003;32:573-575. [PubMed] |
| 11. | Feng DY, Zheng H, Tan Y, Cheng RX. Effect of phosphorylation of MAPK and Stat3 and expression of c-fos and c-jun proteins on hepatocarcinogenesis and their clinical significance. World J Gastroenterol. 2001;7:33-36. [PubMed] [DOI] |
| 12. | Park MT, Choi JA, Kim MJ, Um HD, Bae S, Kang CM, Cho CK, Kang S, Chung HY, Lee YS. Suppression of extracellular signal-related kinase and activation of p38 MAPK are two critical events leading to caspase-8- and mitochondria-mediated cell death in phytosphingosine-treated human cancer cells. J Biol Chem. 2003;278:50624-50634. [PubMed] [DOI] |
| 13. | Ling MT, Wang X, Ouyang XS, Lee TK, Fan TY, Xu K, Tsao SW, Wong YC. Activation of MAPK signaling pathway is essential for Id-1 induced serum independent prostate cancer cell growth. Oncogene. 2002;21:8498-8505. [PubMed] [DOI] |
| 14. | Sawafuji K, Miyakawa Y, Weisberg E, Griffin JD, Ikeda Y, Kizaki M. Aminopeptidase inhibitors inhibit proliferation and induce apoptosis of K562 and STI571-resistant K562 cell lines through the MAPK and GSK-3beta pathways. Leuk Lymphoma. 2003;44:1987-1996. [PubMed] [DOI] |
| 15. | Wu J, Haugk K, Plymate SR. Activation of pro-apoptotic p38-MAPK pathway in the prostate cancer cell line M12 expressing a truncated IGF-IR. Horm Metab Res. 2003;35:751-757. [PubMed] [DOI] |
| 16. | Levy-Nissenbaum O, Sagi-Assif O, Raanani P, Avigdor A, Ben-Bassat I, Witz IP. cDNA microarray analysis reveals an overexpression of the dual-specificity MAPK phosphatase PYST2 in acute leukemia. Methods Enzymol. 2003;366:103-113. [PubMed] [DOI] |
| 17. | Zhu KQ, Zhang SJ. Involvement of ATM/ATR-p38 MAPK cascade in MNNG induced G1-S arrest. World J Gastroenterol. 2003;9:2073-2077. [PubMed] [DOI] |
| 18. | Liu HS, Pan CE, Liu QG, Yang W, Liu XM. Effect of NF-kappaB and p38 MAPK in activated monocytes/macrophages on pro-inflammatory cytokines of rats with acute pancreatitis. World J Gastroenterol. 2003;9:2513-2518. [PubMed] |
| 19. | Wang CH, Tang CW, Liu CL, Tang LP. Inhibitory effect of octreotide on gastric cancer growth via MAPK pathway. World J Gastroenterol. 2003;9:1904-1908. [PubMed] [DOI] |
| 20. | Németh ZH, Leibovich SJ, Deitch EA, Sperlágh B, Virág L, Vizi ES, Szabó C, Haskó G. Adenosine stimulates CREB activation in macrophages via a p38 MAPK-mediated mechanism. Biochem Biophys Res Commun. 2003;312:883-888. [PubMed] [DOI] |
| 21. | Fujikawa K, Miletic AV, Alt FW, Faccio R, Brown T, Hoog J, Fredericks J, Nishi S, Mildiner S, Moores SL. Vav1/2/3-null mice define an essential role for Vav family proteins in lymphocyte development and activation but a differential requirement in MAPK signaling in T and B cells. J Exp Med. 2003;198:1595-1608. [PubMed] [DOI] |
| 22. | Lee KH, Hyun MS, Kim JR. Growth factor-dependent activation of the MAPK pathway in human pancreatic cancer: MEK/ERK and p38 MAP kinase interaction in uPA synthesis. Clin Exp Metastasis. 2003;20:499-505. [PubMed] [DOI] |
| 23. | Kundu AK, Nagaoka M, Chowdhury EH, Hirose S, Sasagawa T, Akaike T. IGF-1 induces growth, survival and morphological change of primary hepatocytes on a galactose-bared polymer through both MAPK and beta-catenin pathways. Cell Struct Funct. 2003;28:255-263. [PubMed] [DOI] |
| 24. | Lu JB, Sun XB, Dai DX, Zhu SK, Chang QL, Liu SZ, Duan WJ. Epidemiology of gastroenterologic cancer in Henan Province, China. World J Gastroenterol. 2003;9:2400-2403. [PubMed] |
| 25. | Zhang C, Liu ZK. Gene therapy for gastric cancer: a review. World J Gastroenterol. 2003;9:2390-2394. [PubMed] |
| 26. | Zhu XD, Lin GJ, Qian LP, Chen ZQ. Expression of survivin in human gastric carcinoma and gastric carcinoma model of rats. World J Gastroenterol. 2003;9:1435-1438. [PubMed] [DOI] |
| 27. | Wang LD, Zheng S, Zheng ZY, Casson AG. Primary adenocarcinomas of lower esophagus, esophagogastric junction and gastric cardia: in special reference to China. World J Gastroenterol. 2003;9:1156-1164. [PubMed] [DOI] |
| 28. | Yin GY, Zhang WN, Shen XJ, Chen Y, He XF. Ultrastructure and molecular biological changes of chronic gastritis, gastric cancer and gastric precancerous lesions: a comparative study. World J Gastroenterol. 2003;9:851-857. [PubMed] [DOI] |
| 29. | Guo HQ, Guan P, Shi HL, Zhang X, Zhou BS, Yuan Y. Prospective cohort study of comprehensive prevention to gastric cancer. World J Gastroenterol. 2003;9:432-436. [PubMed] [DOI] |
| 30. | Xi WD, Zhao C, Ren GS. Endoscopic ultrasonography in preoperative staging of gastric cancer: determination of tumor invasion depth, nodal involvement and surgical resectability. World J Gastroenterol. 2003;9:254-257. [PubMed] [DOI] |
| 31. | Chen C, Liu FK, Qi XP, Li JS. The study of chemiluminescence in gastric and colonic carcinoma cell lines treated by anti-tumor drugs. World J Gastroenterol. 2003;9:242-245. [PubMed] [DOI] |
| 32. | Cai L, Zheng ZL, Zhang ZF. Risk factors for the gastric cardia cancer: a case-control study in Fujian Province. World J Gastroenterol. 2003;9:214-218. [PubMed] [DOI] |
| 33. | Hu JK, Chen ZX, Zhou ZG, Zhang B, Tian J, Chen JP, Wang L, Wang CH, Chen HY, Li YP. Intravenous chemotherapy for resected gastric cancer: meta-analysis of randomized controlled trials. World J Gastroenterol. 2002;8:1023-1028. [PubMed] [DOI] |
| 34. | Niu WX, Qin XY, Liu H, Wang CP. Clinicopathological analysis of patients with gastric cancer in 1200 cases. World J Gastroenterol. 2001;7:281-284. [PubMed] [DOI] |
| 35. | Xue FB, Xu YY, Wan Y, Pan BR, Ren J, Fan DM. Association of H. pylori infection with gastric carcinoma: a Meta analysis. World J Gastroenterol. 2001;7:801-804. [PubMed] [DOI] |