修回日期: 2003-12-25
接受日期: 2004-01-12
在线出版日期: 2004-04-15
目的: 探讨线粒体DNA体细胞性突变和种系性变异在食管癌的发生情况及其可能的作用.
方法: 利用时相温度梯度电泳方法分析了食管癌的线粒体基因体细胞性突变. 采用32对重叠引物扩增了来自20例食管癌患者的肿瘤组织和配对正常组织的线粒体全长基因, 在肿瘤和正常组织中不同的电泳条带类型的DNA片段被测序以辩明其突变类型.
结果: 在20例肿瘤中11例(55%)至少发现一个体细胞性突变, 总共发现14个体细胞性突变, 其中1个位于rRNA (7.1%), 4个位于mRNA(28.5%), 另外9个位于高变D环区(64.3%). 4个新的体细胞性突变中2个为错义突变. 在测序片段中共发现187个种系性变异, 其中14个为新发现的变异, 173个为已被报道并记录在线粒体基因数据库中.
结论: 食管癌患者线粒体DNA存在高发生频率的体细胞性突变提示线粒体DNA的变异可能与食管癌的发生发展有关.
引文著录: 谭端军, 刘玲玲, 刘鹏, 文毅, JuliaChang, Kun-TuYeh, Lee-Jun CWong. 食管癌线粒体DNA体细胞性突变与种系性变异. 世界华人消化杂志 2004; 12(4): 892-896
Revised: December 25, 2003
Accepted: January 12, 2004
Published online: April 15, 2004
AIM: To detect somatic mutations in the complete mitochondrial genome and to investigate the role of mtDNA in the tumorigenesis of esophageal cancer.
METHODS: A temporal temperature gradient gel electrophoresis (TTGE) method was used to analyze the somatic mitochondrial DNA (mtDNA) mutations in esophageal cancer. The entire mitochondrial genomes in 20 tumor samples and paired normal tissues were amplified by using 32 pairs of overlapping primers. DNA fragments showing different banding patterns between normal and tumor mtDNA were sequenced to identify the somatic mutations and germline variations.
RESULTS: Eleven out of the 20 tumors (55%) displayed at least one somatic mtDNA mutation. Total fourteen somatic mutations were found. Among them, one was in tRNA (7.1%), 4 in mRNA (28.5%), and 9 in the hypervariable D loop region (64.3%). There were two missense mutations in four novel somatic mutations. A total of 187 distinct germline variations were identified. Fourteen of these variations were novel, and 173 of them had been recorded in the Mitomap database.
CONCLUSION: The high incidence of mtDNA mutations presents in patients with esophageal cancer. mtDNA alterations may play an important role in tumorigenesis of esophageal cancer.
- Citation: Tan DJ, Liu LL, Liu P, Wen Y, Chang J, Yeh KT, Wong LJC. Mitochondrial DNA somatic mutations and germline variations in patients with esophageal cancer. Shijie Huaren Xiaohua Zazhi 2004; 12(4): 892-896
- URL: https://www.wjgnet.com/1009-3079/full/v12/i4/892.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i4.892
线粒体是细胞质内的重要细胞器, 他通过氧化磷酸化以ATP形式产生能量, 线粒体DNA(mitochondrial DNA, mtDNA)缺失性突变已在众多的神经肌肉疾病中被报道[1-5]. 线粒体DNA的突变率较核基因增高至少10倍, 线粒体DNA具有高突变率, 对于与肿瘤有关的氧化性DNA损伤极为敏感[6-8]. 线粒体在能量代谢、活性氧的产生、衰老和细胞凋亡的起始过程中的重要角色提示线粒体是细胞死亡和非正常生长的关键点, 因此而在肿瘤的发生过程中可能起着重要作用. 体细胞性线粒体DNA突变已经在乳腺癌、结直肠癌、膀胱癌、头颈部肿瘤、白血病、肺癌和口腔癌被报道[9-17]. 是否在食管癌组织中同样具有线粒体基因的体细胞性突变? 如果有突变那么他们与食管癌发生发展具有何种和关系? 他们与其他肿瘤中报道的突变率是否具有差异? 为了阐明上述问题, 我们对食管癌组织线粒体基因体细胞性突变和肿瘤特征的相关性进行了探讨.
食管癌组织和匹配的正常组织共20例, 使用蛋白酶K和酚/氯仿抽提总DNA, 荧光Hoechst染料H33258于DYNA QUANT200系统上测定含量, DNA被稀释至5 mg/L供PCR反应使用.
首先使用32对重叠引物扩增线粒体16.6 kb全长基因, 所得片段长度为306-805 bp, 平均594 bp, 扩增片段全长18 953 bp. 由于部分扩增区域重叠, 因此较线粒体基因16 569 bp长出14%. 利用时相温度梯度凝胶电泳筛选线粒体基因体细胞性突变, 对来自于正常组织和肿瘤组织的片段进行配对分析[18-19]. 在TTGE分析中, 单一条带的迁移变化代表着同质性的DNA改变, 出现多条带则代表异质性的突变. 对任何显示肿瘤和正常组织电泳条带类型的不同的DNA片段进行测序分析, 以辩明确切的突变. DNA测序采用荧光染料链终止测序试剂盒(Perkin Elmer )于ABI377(applied biosystem)自动测序仪上进行. DNA测序结果利用MacVectorTM 7.0 [20] (Oxford Molecular Ltd, Oxford, England)软件与MitoMap的剑桥修正序列[21]进行比对分析, 在肿瘤和正常组织线粒体基因中均发现的变异被认为是种系性突变, 如在二者间出现不同则筛选为体细胞性突变.
在20例食管癌中有11例(55%)具有体细胞性线粒体基因突变, 其中9例在高变D环区具有突变. 8例具有1个突变, 剩余3例具有多个突变, 突变总数达14个. 除核酸303-309位点多聚C的插入与缺失外, 每种突变仅发生1次. 在全部14个突变中, 1个位于rRNA(7.1%), 4个位于mRNA(28.5%), 另外9个位于高变D环区(64.3%), 且均位于核酸303-315区域. 肿瘤组织中5个突变为同质状态, 其中有3个在其周围正常组织为异质状态. 异质性产生可能是由于包含肿瘤周围正常组织所致, 或者形态学正常的组织在分子水平已经发生了改变. 剩余的9个突变在肿瘤组织中为异质状态, 其中6个是由周围正常组织同质状态向肿瘤的异质状态发生转变, 3个在肿瘤和周围正常组织中均为异质状态, 但突变线粒体DNA在定量上的所占百分率不同(表1).
| 病例 | 基因1 | 体细胞性突变 | 类型2 | 核酸编码 | 氨基酸改变3 | 已报道情况 |
| E02 | D环 | T310C | HT→HT | 多态性 | ||
| E05 | D环 | 303→309 缺失C (C8→C7/8) | HM→HT | 多态性 | ||
| E05 | 12S | A1544T | HM→HT | 新突变 | ||
| E09 | D环 | 303→309 缺失C (C9/8→C8/9) | HT→HT | 多态性 | ||
| E10 | D环 | 303→309 插入C (C8→C8/9) | HM→HT | 多态性 | ||
| E12 | ND4L | G10500A | HM→HT | GCA→ACA | A11T | 新突变 |
| E14 | D环 | 303→309 插入CC (C7→C9) | HM→HT | 多态性 | ||
| E14 | COX III | G9377A | HM→HM | TGG→TGA | W57W | 多态性 |
| E15 | D环 | 303→309 缺失C (C8/9→C8) | HT→HM | 多态性 | ||
| E15 | ATPase 6 | A9182G | HT→HM | AAC→AGC | N219S | 新突变 |
| E16 | D环 | 303→309 插入C (C7/8→C7/8/9) | HT→HT | 多态性 | ||
| E17 | D环 | 303→309 插入C (C8→C9) | HM→HM | 多态性 | ||
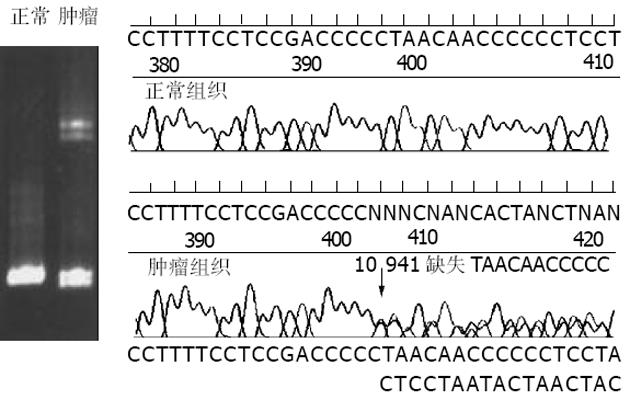
| E18 | ND4 | 10941缺失TAACAACCCCC | HM→HT | 新突变 | ||
| E19 | D环 | 303→309 缺失CC (C9/10→C7) | HT→HM | 多态性 |
在所有的14个突变中有4个突变是出现在新发现的突变位点上, 这些位点的变异在以前的研究中和MitoMap中未见记载(见表1), 其中2个错义突变分别发生在ND4L和ATPase 6基因区, G10500A造成了11号位点氨基酸由丙氨酸向苏氨酸转变, 动物进化保留情况分析显示该位点在脊椎动脉是属于保守序列, 该患者的正常组织已发生变异, 但在肿瘤组织中又发生回复性突变见图1. A9182G造成了氨基酸219号位点的天冬酰胺向丝氨酸转变, 同样该区域在脊椎动脉也属于相对保守的序列见图1, 这种突变有可能造成ATP合成酶功能的不良.
我们发现1例位于NADH氧化还原酶亚单位4基因的11个碱基缺失(起始于10 941位点、终止于10 946位点), 自61号氨基酸位点开始, 其后续的编码发生移位, 在移位154个氨基酸后遭遇链终止密码子UAA而氨基酸链合成终止. NADH氧化还原酶亚单位4基因共包含459个氨基酸, 而本例肿瘤由于移码突变而导致编码合成了215个氨基酸后即终止了合成. TTGE和测序图像均显示该突变为异质性改变(图2).
我们对TTGE上显示出在正常和肿瘤组织电泳条带不同的DNA片段进行了测序, 以辩明可能的体细胞性突变, 当将正常组织的序列与已报道的剑桥序列进行比较时, 我们也检测到187个种系性变异, 其中173个已被记录在MitoMap数据库中, 发生频率在25%以上的变异包括248-249缺失A、303-309插入或缺失C、311-315插入C、T489C、514-523缺失CA. A8860G、T9540C、C12705T、T16189C、C16223T、T16304C和T16519C. 此外, 本研究也发现14个在其他文献和线粒体文库中未见报道的、新的种系性变异, 除2个位于D环区外, 其余12个位于基因编码区. 其中7个位于呼吸链氧化磷酸化复合物I、4个位于复合物IV、1个位于复合物V, 7个错义变异造成了氨基酸的改变, 但所有的新变异均仅发生一次见表2 .
| 病例 | 基因 | 核酸改变 | 类型 | 编码 | 氨基酸改变1 |
| E13 | D环 | G251A | HM | ||
| E3 | D环 | C481T | HM | ||
| E19 | COII | T7711C | HM | CTT→CTC | L42L |
| E16 | COII | G7910C | HM | GAG→CAG | E109Q |
| E16 | COII | G7912C | HM | GAG→GAC | E109D |
| E15 | ATPase 6 | G9182A | HT | AGC→AAC | S219N |
| E1 | COIII | A9545G | HM | GGA→GGG | G113G |
| E14 | ND3 | T10282A | HT | CTA→CAA | L75Q |
| E13 | ND4L | T10609C | HM | ATA→ACA | M47T |
| E2 | ND4 | A11976C | HT | TAC→TCC | Y406S |
| E8 | ND5 | G12561A | HM | CAG→CAA | Q75Q |
| E5 | ND5 | C12882T | HM | TTC→TTT | F182F |
| E1 | ND5 | T12957C | HM | AAT→AAC | N207N |
| E13 | ND5 | G13928C | HM | AGC→ACC | S513T |
线粒体是体内重要的细胞器, 存在于胞质内. 每个人类细胞中含有数以百计的线粒体, 每个线粒体内含有2-10个拷贝的mtDNA分子. mtDNA位于线粒体基质中, 是目前发现的惟一存在于人细胞质中的DNA分子, 他是独立于细胞核染色体外的基因组, 具有自我复制、转录和编码功能. 线粒体既有自己的一套遗传控制系统, 同时也受细胞核DNA的控制. 许多生物化学反应都在线粒体内进行, 其中尤为重要的是通过氧化磷酸化作用产生ATP, 供生命活动需要. 我们报道了人类食管癌的体细胞性突变的全面研究, 在14个独立的体细胞性突变中, 10个已经在其他肿瘤中被报道, 4个为首次被观察到. 最近报道的研究结果显示, 大部分针对肿瘤的体细胞性线粒体基因突变的研究都集中在D环区和包含有微卫星的区域, 但对全线粒体基因进行突变检测的较少, 约7%-80%的线粒体基因已被采用不同的方法进行研究, 包括单链构象多态性检测、二维基因扫描和手动测序等[9-10,13]. 最具有对比性的研究是通过全线粒体基因测序调查了10例卵巢癌的体细胞性突变, 其中发现60% (6/10)卵巢癌具有体细胞性突变, 33%的突变位于D环区[9]. 在本研究中我们对全线粒体基因突变进行了扫描, 发现55%的食管癌具有线粒体基因体细胞性突变, 64.3%的突变位于D环区, 其突变发生率与上述卵巢癌研究基本相同, D环区突变发生率略高, 但全部位于核酸303-315区域. 既往的研究表明该区域是一个高度多态的区域, 胞嘧啶(C)的数目在不同个体的正常组织是非常多变的, 在核酸310位点为胸腺嘧啶(T), 其前后分别为单核苷酸C的重复, 其中303-309的长度从7C到10C不等, 最常见的野生型为7-8C, 311-315绝大部分为6C[22]. 在我们的另一项研究中发现, 在149个不同类型的肿瘤中43例(占28.86%)具有该区域的体细胞性突变, 最常见的表现形式是插入和缺失, 说明这是一个基因不稳定区域[23].
另外, 我们还发现部分突变位于线粒体结构与功能的重要区域, 但在肿瘤发生学过程中每种突变所扮演的作用尚不清楚, 但在基因编码区、进化保留区、复制起始区、转录推动子和转录因子结合位点的突变可能影响整个线粒体的转录量和成熟蛋白, 最后, 氧化磷酸化活性将受到影响. 例如, NADH氧化还原酶亚单位4基因异质性的移码缺失突变导致了氨基酸合成链的终止; 此外, 二个保留的错义突变也可能具有一定的意义, 如ATP6合成酶亚单位6的219号位点天冬酰胺向丝氨酸转变, 这个位点在脊椎动物是属于保守序列, 这种改变将可能导致NADH氧化还原酶功能的改变. 此外NADH氧化还原酶亚单位4L的11号氨基酸位点丙氨酸向苏氨酸转变, 此位点同属脊椎动物保守序列, 但正常组织中发生突变, 而在肿瘤组织中又回复为原保留序列, 在肿瘤组织这种返祖现象的原因不明, 但我们认为在肿瘤组织中的体细胞性突变可能是乘客突变(passenger mutation)或一过性突变, 或者在肿瘤发生学上并不扮演起因角色.
我们发现许多的种系性突变, 值得提及的是在14个新的种系性变异中7个为错义变异, 导致了氨基酸的变化. 剩余的均为同质性变异, 尽管通常认为这种同质、多态性突变的生物化学作用很弱, 不足以引起氧化磷酸化的改变, 但长时间、轻微的氧化磷酸化改变最终可导致氧化应激, 尤其在肿瘤等疾病出现时, 他们可能因影响肿瘤发生的危险因素而在肿瘤的发生发展过程中发挥潜在的作用. 通过对全mtDNA突变检测表明食管癌组织中存在高频率的体细胞突变, 他们在线粒体基因中的分布是散在的, 在食管癌发病中的作用目前尚难以判断, 但可以明确的是mtDNA的编码和非编码区的突变会影响mtDNA的正常表达, 影响线粒体蛋白质的合成与功能, 这些突变是否参与了肿瘤的发生与发展尚有待进一步的生物化学研究加以证实. 薛凌霄et al[24-25]通过恶性肿瘤报告分析了消化系恶性肿瘤的发病状况, 在1 691例恶性肿瘤中统计分析结果显示消化系恶性肿瘤1 160例占68.60%, 其中食管癌552例占47.59%, 是发生率最高的肿瘤, 而且容易发生区域淋巴结转移, 手术后5年生存率约10%. 在多种肿瘤中等位基因异常被证明是肿瘤发生早期事件, 食管癌中常见的染色体缺失区及其相关基因有17号染色体短臂(p53基因)、13号染色体长臂(Rb基因)等[26]. 林军 et al[27]从基因水平探讨湖北地区汉族人食管癌HLA-DQB1等位基因的遗传易感性, 结果发现湖北汉族人食管癌患者与正常人比较, HLA-DQB1.0301基因频率显著增高. 汪栋 et al[28]的研究发现有53.8%的食管癌具有抑癌基因p16基因第2外显子缺失, 而癌旁正常食管组织均无缺失. 其他多项研究也证实食管癌的发生与遗传具有一定的相关性[29-32], 本研究中发现的线粒体基因突变可能对食管癌发生的研究具有重要意义, 首先本研究明确了食管癌的发生发展过程中具有高发生频率的线粒体基因的突变; 其次, 这些突变引起了基因编码的氨基酸发生改变, 导致了基因功能的不良; 第三, 这些变异可能反映食管癌的遗传风险特征或有可能作为潜在的肿瘤生物学标志之一, 进一步对这些突变所造成的线粒体功能变化进行研究可望为彻底阐明食管癌的发生发展提供基础研究依据.
编辑: N/A
| 1. | Lane H, Bermingham N, Farrell MA, Redmond J, Connolly S, Brett FM. Mitochondrial disorder with a common 4977-bp deletion presenting as a novel multisystem neurodegenerative disorder. Ir Med J. 2003;96:249-250. [PubMed] |
| 2. | Ro LS, Lai SL, Chen CM, Chen ST. Deleted 4977-bp mitochondrial DNA mutation is associated with sporadic amyotrophic lateral sclerosis: a hospital-based case-control study. Muscle Nerve. 2003;28:737-743. [PubMed] [DOI] |
| 3. | Jacobs LJ, Jongbloed RJ, Wijburg FA, de Klerk JB, Geraedts JP, Nijland JG, Scholte HR, de Coo IF, Smeets HJ. Pearson syndrome and the role of deletion dimers and duplications in the mtDNA. J Inherit Metab Dis. 2004;27:47-55. [PubMed] [DOI] |
| 4. | Nádasi EA, Melegh B, Seress L, Kosztolányi G. Mitochondrial DNA4977 deletion in brain of newborns died after intensive care. Acta Biol Hung. 2003;54:253-262. [PubMed] [DOI] |
| 5. | Carod-Artal FJ, Solano-Palacios A, Playán-Ariso A, Viana-Brandi I, López-Gallardo E, Andreu A, López-Pérez M, Montoya J. [A single deletion of mitochondrial DNA in a Brazilian patient with chronic progressive external ophthalmoplegia]. Rev Neurol. 2003;37:1029-1031. [PubMed] |
| 7. | Liu CS, Tsai CS, Kuo CL, Chen HW, Lii CK, Ma YS, Wei YH. Oxidative stress-related alteration of the copy number of mitochondrial DNA in human leukocytes. Free Radic Res. 2003;37:1307-1317. [PubMed] [DOI] |
| 8. | Brown MD, Hosseini S, Steiner I, Wallace DC, Korn-Lubetzki I. Complete mitochondrial DNA sequence analysis in a family with early-onset dystonia and optic atrophy. Mov Disord. 2004;19:235-237. [PubMed] [DOI] |
| 9. | Liu VW, Shi HH, Cheung AN, Chiu PM, Leung TW, Nagley P, Wong LC, Ngan HY. High incidence of somatic mitochondrial DNA mutations in human ovarian carcinomas. Cancer Res. 2001;61:5998-6001. [PubMed] |
| 11. | Tan DJ, Bai RK, Wong LJ. Comprehensive scanning of somatic mitochondrial DNA mutations in breast cancer. Cancer Res. 2002;62:972-976. [PubMed] |
| 12. | Tan DJ, Chang J, Chen WL, Agress LJ, Yeh KT, Wang B, Wong LJ. Novel heteroplasmic frameshift and missense somatic mitochondrial DNA mutations in oral cancer of betel quid chewers. Genes Chromosomes Cancer. 2003;37:186-194. [PubMed] [DOI] |
| 13. | Kumimoto H, Yamane Y, Nishimoto Y, Fukami H, Shinoda M, Hatooka S, Ishizaki K. Frequent somatic mutations of mitochondrial DNA in esophageal squamous cell carcinoma. Int J Cancer. 2004;108:228-231. [PubMed] [DOI] |
| 14. | Hiyama T, Tanaka S, Shima H, Kose K, Tuncel H, Ito M, Kitadai Y, Sumii M, Yoshihara M, Shimamoto F. Somatic mutation in mitochondrial DNA and nuclear microsatellite instability in gastric cancer. Oncol Rep. 2003;10:1837-1841. [PubMed] [DOI] |
| 15. | He L, Luo L, Proctor SJ, Middleton PG, Blakely EL, Taylor RW, Turnbull DM. Somatic mitochondrial DNA mutations in adult-onset leukaemia. Leukemia. 2003;17:2487-2491. [PubMed] [DOI] |
| 16. | Liu VW, Yang HJ, Wang Y, Tsang PC, Cheung AN, Chiu PM, Ng TY, Wong LC, Nagley P, Ngan HY. High frequency of mitochondrial genome instability in human endometrial carcinomas. Br J Cancer. 2003;89:697-701. [PubMed] [DOI] |
| 17. | Carew JS, Zhou Y, Albitar M, Carew JD, Keating MJ, Huang P. Mitochondrial DNA mutations in primary leukemia cells after chemotherapy: clinical significance and therapeutic implications. Leukemia. 2003;17:1437-1447. [PubMed] [DOI] |
| 18. | Wong LJ, Liang MH, Kwon H, Park J, Bai RK, Tan DJ. Comprehensive scanning of the entire mitochondrial genome for mutations. Clin Chem. 2002;48:1901-1912. [PubMed] |
| 19. | Chen TJ, Boles RG, Wong LJ. Detection of mitochondrial DNA mutations by temporal temperature gradient gel electrophoresis. Clin Chem. 1999;45:1162-1167. [PubMed] |
| 20. | Rastogi PA. MacVector. Integrated sequence analysis for the Macintosh. Methods Mol Biol. 2000;132:47-69. [PubMed] |
| 21. | Kogelnik AM, Lott MT, Brown MD, Navathe SB, Wallace DC. MITOMAP: a human mitochondrial genome database--1998 update. Nucleic Acids Res. 1998;26:112-115. [PubMed] [DOI] |
| 22. | Tang M, Baez S, Pruyas M, Diaz A, Calvo A, Riquelme E, Wistuba II. Mitochondrial DNA mutation at the D310 (displacement loop) mononucleotide sequence in the pathogenesis of gallbladder carcinoma. Clin Cancer Res. 2004;10:1041-1046. [PubMed] [DOI] |