修回日期: 2003-08-25
接受日期: 2003-09-24
在线出版日期: 2004-03-15
目的: 探讨在HGF、FGF4诱导下人骨髓CD45-CD117-细胞能否向肝细胞分化, 并探讨两种生长因子在诱导分化中可能的作用机制.
方法: 骨髓来自4名4-40岁健康志愿者的胸骨或髂骨. 用两步磁式分离法分离出CD45-CD 117-细胞, 分别用含有FGF4, HGF, HGF+FGF4或不加生长因子的DMEM培养基进行培养, 相应地分为A, B, C, D四组. 分别于新分离时和培养7 d, 14 d, 21 d, 28 d时留细胞. 备作免疫细胞化学检测AFP, CK18, 白蛋白, PAS染色检测糖原等肝系细胞的特征型标志, RT- PCR检测C、D组细胞c-met (HGF受体)和FGFR2(FGF4R) mRNA 表达情况.
结果: A, B, C三组加生长因子诱导培养后的细胞均可检测到肝系细胞的标志, D组细胞不加生长因子培养后没有检测到肝系细胞的标志. c-met和FGFR2mRNA在新分离的和D组培养7 d, 14 d时的细胞均有较弱的表达, 而在C组细胞诱导培养7 d, 14 d时表达升高.
结论: HGF和FGF4可诱导人骨髓CD45-CD117-细胞向肝细胞样细胞分化. 生长因子诱导分化的作用可能通过与其受体之间的正反馈调节.
引文著录: 李文晰, 段芳龄, 马军, 陈香宇. HGF和FGF4体外诱导人骨髓CD45-CD117-细胞向肝细胞分化的研究. 世界华人消化杂志 2004; 12(3): 697-701
Revised: August 25, 2003
Accepted: September 24, 2003
Published online: March 15, 2004
AIM: To observe whether the CD117-CD45- bone marrow cell can differentiate into the cells with characters of hepatocyte by the stimulation of hepatocyte growth factor (HGF)and fibroblast growth factor-4 (FGF4), and to explore the acting mechanism of the growth factors.
METHODS: Bone marrow cells were from the stern or ilium of 4 healthy volunteers between 4-40 years old. CD117-CD45- bone marrow cells separated by magnetic cell sorting method, cultured in DMEM medium with FGF4, HGF, FGF4+ HGF or no growth factor were divided into four groups: groups A, B, C, and D accordingly. Cells were collected on d 0, 7, 14, 21, and 28 for detecting the hepatocyte markers: AFP, CK18, albumin by immunocytochemistry, glycogen by PAS staining and c-met, FGFR2 mRNA by RT-PCR.
RESULTS: The specific markers of hepatocyte were positive in groups A, B and C but not in group D. C-met and FGFR2 mRNA expressed at a low level in the cells newly isolated or cultured in the medium without growth factor, but at increasing level after cutured with growth factor.
CONCLUSION: HGF and FGF4 can induce CD45-CD117- differentiate into hepatocyte-like cells. The effect of growth factor on cell differentiation is probably by the positive regulation between the growth factor and its receptor.
- Citation: Li WX, Duan FL, Ma J, Chen XY. Differentiation of adult bone marrow CD45-CD117- stem cells into hepatocyte in vitro. Shijie Huaren Xiaohua Zazhi 2004; 12(3): 697-701
- URL: https://www.wjgnet.com/1009-3079/full/v12/i3/697.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i3.697
骨髓干细胞向肝细胞分化潜能的发现, 给肝病的治疗带了新思路和新的前景. 但目前向肝细胞分化的具体的骨髓亚型来源及调控骨髓干细胞定向分化的机制尚不清楚. 我们选用了 CD45-CD117-细胞, 用HGF和FGF4诱导其向肝细胞分化, 为了进一步探讨肝细胞的骨髓源问题. 还检测了所用生长因子的受体诱导前后表达情况, 以探讨骨髓干细胞向肝细胞可能的分化机制.为骨髓干细胞应用于临床奠定理论基础.
抗人CD45 Microbead、抗PE Microbead购自德国Miltenyi公司, 抗人PE-CD117抗体、HGF、FGF4购自BD公司, 淋巴分离液购自TBD公司, DMEM、ITS购自GIBCO, 胎牛血清购自天津血研所, RNA抽提试剂盒购自QIAGEN公司, Revertaid First Strand cDNA synthesis kit购自MBI公司, Probest Taq酶购自Takara公司, DAPI购自Roche公司, GeneRulerTM 100 bp DNA ladder购自MBI公司, 抗人CK18抗体、兔、鼠SP试剂盒购自福州迈新生物公司, 抗人白蛋白抗体、抗人AFP抗体购自DAKO公司, DAB试剂盒购自北京中山生物公司, 鼠尾胶原, Schiff试剂自制.
骨髓源于4名健康志愿者, 年龄4-40岁, 从胸骨或髂骨抽取8 mL骨髓, 先用淋巴分离液初步分离出骨髓单个核细胞.再用磁式分离法分离出CD45-CD117-细胞. 具体步骤: (1)密度梯度离心法分离出骨髓单个核细胞, 再将其过Pre-separation filter柱. (2)加10 L PE标记的抗人CD117(c-kit)于细胞悬液中(10 L抗体/ 107个细胞), 混匀后4 ℃避光反应5-10 min. (3)洗细胞后, 重悬细胞, 并加抗PE微磁珠20 L, 混匀后6-12 ℃孵育15 min (20 L磁珠/ 107个细胞). (4)用2 mL除气Buffer润湿LD柱, 将3)的细胞悬液加于柱子上, 让其流到一新备的收集管中, 既得CD117-细胞. (5)重悬细胞并加抗人CD45磁珠混匀, 4 ℃孵育15 min. (6)洗细胞后, 将其重悬, 加到一新的LD柱. (7)收集流下的细胞, 得到的即为CD117-CD45-细胞. 留部分作细胞计数, 并分别通过台盼兰染色和DAPI复染细胞核计算细胞活率和纯度, 余用Hank's洗1遍后加培养基. 分离好的细胞以4×104个细胞/cm2的密度接种于铺有鼠尾胶原的24孔培养板上, 加低糖型DMEM(GIBCO), 含20 mL/L FBS, 1×ITS, 青霉素100 ku/L, 链霉素100 ku/L, 1 g/L BSA, 10-8mol/L地塞米松, 10-4 mol/L抗坏血酸, 分为单独HGF, 单独FGF4, HGF与FGF4、无生长因子4个组, 分别计为A, B, C, D组, 每组6个复孔, 以后每周换液2次, 分别于培养7, 14, 21, 28 d时留取细胞以备检测.
免疫细胞化学SP法检测CK18、AFP、白蛋白, 步骤: 留取的细胞用Carnoy固定液固定10 min, 用PBS冲洗干净后, 加过氧化物酶阻断剂反应10 min, 0.1 mol/L PBS冲洗干净, 非免疫血清封闭10 min, 甩弃多余封闭液, 加一抗: CK18工作液, AFP用PBS 1: 200稀释, 白蛋白1: 300稀释, 50 L/片, 室温反应2 h, PBS代替一抗作阴性对照.PBS冲洗, 3 min×3. 加生物标记的二抗10 min. 过氧化物酶标记的卵白素10 min冲洗, DAB镜下显色, 冲洗, 苏木素复染或不复染, 梯度酒精脱水, 二甲苯透明, 中性树胶封片, 镜下观察, 选数个高倍视野进行细胞计数(每个指标源于4标本), 共计500个细胞.
PAS染色检测糖原: 留取细胞, 用950 mL/L酒精固定10 min, 冲洗干净, 10 g/L过碘酸水溶液反应10 min, 冲洗, 晾干, 加Schiff试剂30 min, 亚硫酸水洗3遍, 自来水冲洗, 晾干, 加2%甲绿反应15 min, 自来水冲洗、脱水、透明、中性树胶封片.
RT-PCR检测c-met和FGFR2 mRNA: 分别取新鲜分离出的CD117-CD45-细胞及C组、D组诱导培养7、14 d的细胞, 各5×106个, 抽提RNA(按试剂盒说明书进行), 加600 L RLT制成细胞悬液, 用自动匀浆器匀浆30 s.加700 mL/L乙醇600 L到匀浆液中, 抽吸均匀后将其加于柱子上, 离心15 s. 加700 L RW1于柱子, 离心15 s. 加500 L RPE于Rneasy柱, 离心15 s, 并重复. 将柱子放入1个1.5 mL收集管中, 加30-50 L无RNA酶水于柱子中, 大于或等于8 000 g离心1 min. 用紫外光分光光度计测A260和A280值, 按公式计算出RNA的浓度和纯度. 逆转录参照试剂盒说明书, 冰上加: 总RNA 10 L (0.2 mg), oligo (dT)18 引物 1 L; 水1 L, 混匀3-5 s.70 ℃反应5min, 冰上速冷. 按如下顺序在冰上加: 5×buffer 4 L; 核酶抑制剂 1 L; 10 mmol/L dNTP×2 L , 混匀并离心片刻. 37 ℃反应5min.ReverAid M-Mulv 逆转录酶(200u/ L) 1 L, 混匀. 42 ℃反应60 min. 之后在70 ℃反应10min, 冰上冷却结束反应.PCR所用引物C-met1, 5 - cattctgaagccgttttatgc-3'; C-met2, 5'-atgccctctcctatgatct-3', 产物长度601 bp. FGFR2U, 5'-aacaccacggacaaagagat-3'; FGFR2L5'-tcttggtcgtgttcttcattcg-3', 产物长度265 bp. β-actin1, 5'-ccaaggccaaccgcgagaagatga-3'; β-actin2, 5'-agggtacatggtggtgccgccaga-3' , 产物长度587 bp.
以肝癌组织cDNA为模板, 进行PCR扩增, 作为阳性对照, 以鉴定引物设计及合成质量, 以β-actin 作内参. PCR反应体系: 10×buffer 5 L; Taq酶 0.125 L; dNTPs (2.5 mmol/L), 2.5 L; 引物mix (100 pmol/L) 1 L; 模板(100 ng/ L) 1 L; 灭菌水 17.875 L; 总体积25 L.循环条件: 94 ℃, 预变性5 min; 94 ℃变性30 s, 55 ℃ (c-met, FGFR2)/ 62 ℃ (β-actin)退火30 s, 72 ℃延伸30 s, 30个循环; 72 ℃后延伸3 min. 分别取PCR产物5 L, DNA ladder 6 L, 用1 g/L琼脂糖凝胶电泳, 紫外投射仪下观察并照像, 用Quantity one软件分析. 以DNA ladder的表达值为标准, 用各个待测条带的灰度值与标准参照相比得到校正值, 再分别将各标本的c-met, FGFR2的校正值与其相应的β-actin的校正值相比, 得出一个比值, 即二次校正值, 然后进行各组间比较.
统计学处理 阳性率在各组之间, 各时间点之间的比较用x2检验, P<0.05为有显著性差异.
在倒置相差显微镜下观察, 细胞大小均匀, 透光度良好, DAPI染核后, 在荧光显微镜下观察, PE标记的细胞占细胞总数的百分率小于1%. 台盼蓝染色, 细胞活率大于95%. 细胞均呈克隆性生长, 单个不形成克隆的细胞容易死亡. 24 h起开始有贴壁生长, 之后逐渐增多, 贴壁的细胞呈卵圆形或梭形. 诱导至28 d时, 细胞形态呈上皮样细胞. C组细胞生长速度快于A、B两组细胞. 细胞达对数生长期的时间, 在不同的细胞供应者之间有差异, 在7-20 d之间.
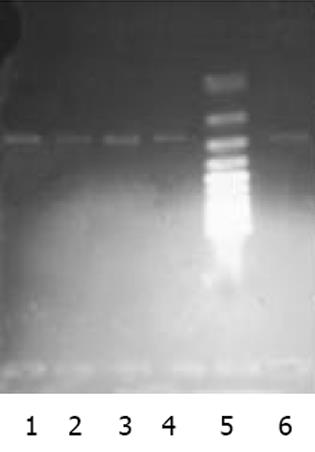
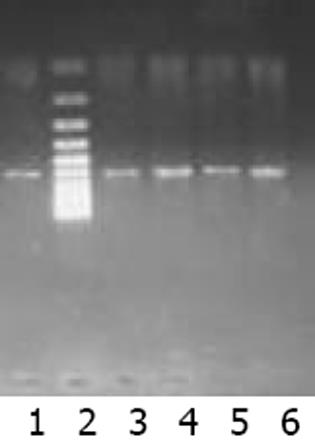
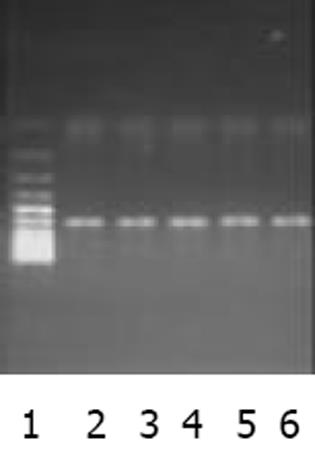
以肝癌cDNA为模板扩增, c-met, FGFR2均有很亮的条带(图1). 以新鲜分离骨髓干细胞或诱导培养后细胞的cDNA 为模板的RT-PCR产物, 其电泳结果经肉眼观察, 并用Quantity One分析的结果均表明: c-met与FGFR2 mRNA在新鲜分离的骨髓CD117-CD45-细胞有表达, 在C组细胞诱导培养7, 14 d时表达均升高, 而D组培养7, 14 d时表达量变化不明显(图2, 3). 其内参对照 β-actin 在各组, 各时间点无明显差异(图4), 均有较亮的条带. Quantity one软件分析结果见表1.
| 分组 | β-actin | c-met | FGFR2 | |||
| 表达值 | 校正值 | 表达值 | 校正值 | 表达值 | 校正值 | |
| 新分离的细胞 | 75.26 | 0.57 | 59.17 | 0.47 | 36.60 | 0.18 |
| C组7 d | 77.78 | 0.59 | 85.49 | 0.68 | 64.53 | 0.32 |
| D组7 d | 80.91 | 0.61 | 59.74 | 0.48 | 36.70 | 0.18 |
| C组14 d | 74.02 | 0.56 | 89.42 | 0.72 | 62.15 | 0.31 |
| D组14 d | 73.90 | 0.56 | 57.39 | 0.46 | 30.65 | 0.15 |
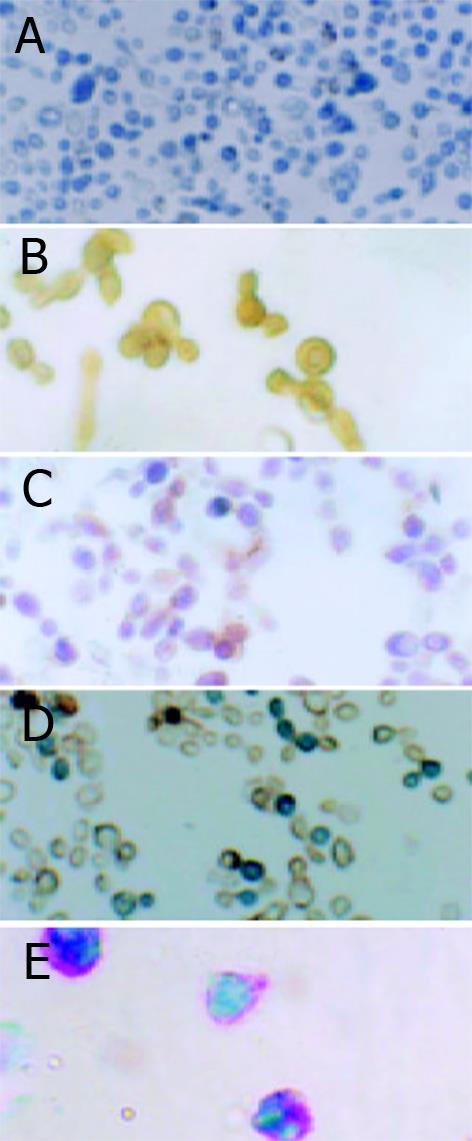
AFP在新分离的细胞有少数细胞表达, 阳性率在2%左右. 在加生长因子诱导培养7 d, 14 d时表达较高. 诱导培养21, 28 d时较低. 经统计学分析AFP表达从7-28 d呈下降趋势(P<0.01, 表2, 图5B). 但在3个组之间无明显差异(P>0.05).不加生长因子培养的7-28 d细胞和无一抗对照均未见染色(见图5A). 白蛋白在新分离的细胞有少数的细胞呈阳性, 加生长因子诱导的3组细胞, 阳性率随着诱导培养时间的延长有逐渐升高的趋势(P<0.01, 表2, 图5C), 在3组间白蛋白的表达无明显差异(P>0.05). 不加生长因子组在7-28 d均未见白蛋白表达, 无一抗对照未见染色. CK18表达随着加生长因子诱导培养时间的延长, 有逐渐升高的趋势(P<0.01, 表2, 图5D.), 在3组间未见明显差异. 不加生长因子组和无一抗对照均未见阳性染色. 随细胞培养时间的延长, 加生长因子诱导培养的3组细胞, 糖原染色的阳性率逐渐升高(P<0.01, 见表2, 图5E), 在3组间无明显差异(P>0.05). 而不加生长因子培养的细胞, 各个时间点均未见糖原阳性染色, 阴性对照未见染色.
| 指标 | 组别 | 7 d | 14 d | 21 d | 28 d | x2 | P值 |
| AFP | A | 80.0 | 42.0 | 8.8 | 2.0 | 804.42 | 0.000 |
| B | 79.0 | 41.6 | 7.6 | 1.8 | 803.51 | 0.000 | |
| C | 78.4 | 40.0 | 9.2 | 2.0 | 771.22 | 0.000 | |
| 白蛋白 | A | 19.0 | 76.4 | 94.0 | 96.0 | 774.06 | 0.000 |
| B | 210 | 75.6 | 92.2 | 97.4 | 759.865 | 0.000 | |
| C | 19.4 | 76.0 | 95.2 | 98.0 | 808.6 | 0.000 | |
| CK18 | A | 17.4 | 65.0 | 89.8 | 92.8 | 672.496 | 0.000 |
| B | 18.0 | 63.0 | 90.0 | 91.8 | 759.865 | 0.000 | |
| C | 18.4 | 64.8 | 90.4 | 92.6 | 808.6 | 0.000 | |
| 糖原 | A | 1.2 | 8.0 | 61.0 | 88.0 | 1026.5 | 0.000 |
| B | 1.4 | 8.4 | 60.4 | 87.0 | 998.8 | 0.000 | |
| C | 1.0 | 7.8 | 62.0 | 89.0 | 1054.6 | 0.000 |
体内外试验证实肝细胞可来源于骨髓干细胞[1-6], 这为肝脏疾病的治疗提供了新思路, 因而人们对这方面的研究倾注了极大的热情, 但目前向肝细胞分化的骨髓来源问题还没搞清. CD117, 也叫c-kit, 是干细胞因子(SCF)的受体, 表达于未分化的造血前体细胞, 是最常用的造血干细胞标志之一[7-9]. CD45表达于除红细胞和血小板以及他们的前体以外的所有造血源性细胞[10-12], 因而我们分离的CD117-CD45-细胞为骨髓非造血干细胞的一个亚型. 这种亚性的骨髓干细胞向肝细胞的分化情况目前尚无人研究.本试验选择了CD117-CD45-细胞, 诱导他们向肝细胞分化, 旨在探讨肝细胞的骨髓来源问题.
磁式分离法可以利用细胞的表面标志分离出造血干细胞或非造血干细胞, 能更精确的将细胞分类. 我们用磁式分离得到的细胞, 透亮度好, 台盼蓝染色发现活细胞比率大于95%, 这说明本实验分离的细胞活力尚可, 适合用于细胞培养. 用荧光染料DAPI染核检测纯度, 荧光显微镜观察发现PE标记的细胞占总数的99%, 这说明此法分离出的细胞具有很高的纯度.
AFP是一种胞质蛋白, 由肝前体细胞分泌, 随着细胞逐渐成熟而消失[13-15]. 我们实验中加生长因子诱导培养后, AFP符合一个规律: 7, 14 d时表达均处于较高水平, 21, 28 d时表达较低, 总体上呈下降趋势. 这一规律与肝系细胞从幼稚到成熟这一过程中AFP变化规律相一致.
CK18 , 白蛋白, 糖原均是成熟肝细胞的标志. CK18在幼稚的肝前体细胞不表达, 当肝细胞趋于成熟或已成熟时表达[16-18]. 白蛋白是肝细胞功能的一个标志物, 在体内他主要由成熟肝细胞分泌[19-21]. 糖原合成和储存是正常肝细胞特有的功能[22-24], 因而联合检测这三个指标能较准确的反应肝系细胞的特征.
我们的试验结果显示这些标志物在细胞诱导培养过程中的表达符合肝细胞逐渐趋于成熟过程中的表达规律.
目前对骨髓干细胞分化潜能的研究已比较多, 且骨髓干细胞的多向分化潜能已成定论. 但骨髓干细胞分化的机制及其定向分化的控制因素还是困扰研究者的一大难题, 这在骨髓干细胞应用于临床方面设置了巨大障碍. 生长因子是调控分化的众多因素中的一个重要元素. 我们试验中运用了2种生长因子: HGF和FGF4. HGF也叫肝细胞生长因子, 在胚肝发育成熟过程中发挥着重要作用, 并能促进未活化的肝细胞分化[25-27]. 因其在体内的作用, 使其成为了目前体外诱导骨髓干细胞向肝细胞分化的研究中应用最多且效果比较肯定的一个生长因子. 本实验将其作为FGF4, FGF4与HGF联合的对照以观察他们诱导向肝细胞分化的作用. FGF4在内胚层的形成时是一重要的因子, 对保持内胚层的特异性起重要作用[28-30]. 我们的结果显示不管单独HGF, 单独FGF4或二者联合刺激组均检测到了肝细胞表型和功能信号. 这说明了HGF, FGF4, 这两个生长因子均具有诱导骨髓干细胞向肝细胞分化的功能. 当FGF4与HGF联合应用时, 虽肝细胞特异性标志阳性的细胞比率与单独HGF、单独FGF4无明显差异, 但细胞生长速度要快于后二者, 因而HGF与FGF4还是起到了一定的协同作用.
RT-PCR作为鉴定引物质量和操作问题的阳性对照和内参对照均有较亮的条带, 这说明引物设计合成质量及PCR各项反应条件均合适. 对骨髓细胞的检测发现在新鲜分离的细胞有微弱的条带, 这提示了二者在CD117-CD45-干细胞中的低表达状态, 也间接提示了这种亚型骨髓干细胞均有可能受HGF与FGF4的诱导, 这种假设在细胞培养过程中得到了验证. 动态观察诱导培养7 d, 14 d时c-met、FGFR2表达的情况, 发现加生长因子的一组细胞, 其c-met、FGFR2 mRNA表达均升高, 而不加生长因子时则未见c-met、FGFR2 mRNA表达变化. 这提示HGF与FGF4对其相应的受体可能有诱导其活化或诱导性表达的作用.提示HGF, FGF4发挥作用时可能存在正反馈机制.
既然新鲜分离的骨髓干细胞表面就存在一些生长因子受体, 我们可以考虑从这些受体入手, 找出与之相应的配体, 然后再通过细胞培养或动物试验等方法检测这些配体的作用效果. 沿此路线去寻找调控分化的因素, 或许也是值得考虑的路径. 另外从检测骨髓干细胞与肝细胞表面共同存在的受体入手, 可能也是找出骨髓干细胞向肝细胞分化的调控因素的一种途径.
编辑: N/A
| 1. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] [DOI] |
| 2. | Avital I, Inderbitzin D, Aoki T, Tyan DB, Cohen AH, Ferraresso C, Rozga J, Arnaout WS, Demetriou AA. Isolation, characterization and transplantation of bone marrow-derived hepatocyte stem cells. Biochem Biophy Res Commu. 2001;288:156-164. [DOI] |
| 3. | Avital I, Inderbitzin D, Aoki T, Tyan DB, Cohen AH, Ferraresso C, Rozga J, Arnaout WS, Demetriou AA. Isolation, characterization, and transplantation of bone marrow-derived hepatocyte stem cells. Biochem Biophys Res Commun. 2001;288:156-164. [PubMed] [DOI] |
| 4. | 李 文晰, 段 芳龄, 马 军, 朱 武凌, 高 天慧, 陈 香宇, 颜 伏归, 李 蔚, 韩 娜, 王 晓. 人骨髓单个核细胞向肝细胞诱导分化的体外研究. 胃肠病学和肝病学杂志. 2003;12:144-147. |
| 5. | 马 军, 段 芳龄, 李 文晰, 颜 伏归, 王 晓, 王 智卿, 朱 武凌, 陈 香宇, 高 天慧. 大鼠移植骨髓细胞向肝细胞转化的实验研究. 胃肠病学和肝病学杂志. 2003;12:138-143. |
| 7. | Jordan JH, Walchshofer S, Jurecka W, Mosberger I, Sperr WR, Wolff K, Chott A, Bühring HJ, Lechner K, Horny HP. Immunohistochemical properties of bone marrow mast cells in systemic mastocytosis: evidence for expression of CD2, CD117/Kit, and bcl-x(L). Hum Pathol. 2001;32:545-552. [PubMed] [DOI] |
| 8. | Niemeyer GP, Hudson J, Bridgman R, Spano J, Nash RA, Lothrop CD. Isolation and characterization of canine hematopoietic progenitor cells. Exp Hematol. 2001;29:686-693. [PubMed] [DOI] |
| 9. | Nadin BM, Goodell MA, Hirschi KK. Phenotype and hematopoietic potential of side population cells throughout embryonic development. Blood. 2003;102:2436-2443. [PubMed] [DOI] |
| 10. | Ohmura K, Kawamoto H, Lu M, Ikawa T, Ozaki S, Nakao K, Katsura Y. Immature multipotent hemopoietic progenitors lacking long-term bone marrow-reconstituting activity in the aorta-gonad-mesonephros region of murine day 10 fetuses. J Immunol. 2001;166:3290-3296. [PubMed] [DOI] |
| 11. | Niemeyer GP, Hudson J, Bridgman R, Spano J, Nash RA, Lothrop CD. Isolation and characterization of canine hematopoietic progenitor cells. Exp Hematol. 2001;29:686-693. |
| 12. | McKinney-Freeman SL, Majka SM, Jackson KA, Norwood K, Hirschi KK, Goodell MA. Altered phenotype and reduced function of muscle-derived hematopoietic stem cells. Exp Hematol. 2003;31:806-814. [PubMed] [DOI] |
| 13. | Fiegel HC, Kluth J, Lioznov MV, Holzhüter S, Fehse B, Zander AR, Kluth D. Hepatic lineages isolated from developing rat liver show different ways of maturation. Biochem Biophys Res Commun. 2003;305:46-53. [PubMed] [DOI] |
| 14. | Okumura K, Nakamura K, Hisatomi Y, Nagano K, Tanaka Y, Terada K, Sugiyama T, Umeyama K, Matsumoto K, Yamamoto T. Salivary gland progenitor cells induced by duct ligation differentiate into hepatic and pancreatic lineages. Hepatology. 2003;38:104-113. [PubMed] [DOI] |
| 15. | Azuma H, Hirose T, Fujii H, Oe S, Yasuchika K, Fujikawa T, Yamaoka Y. Enrichment of hepatic progenitor cells from adult mouse liver. Hepatology. 2003;37:1385-1394. [PubMed] [DOI] |
| 16. | Libbrecht L, Desmet V, Van Damme B, Roskams T. Deep intralobular extension of human hepatic 'progenitor cells' correlates with parenchymal inflammation in chronic viral hepatitis: can 'progenitor cells' migrate? J Pathol. 2000;192:373-378. [PubMed] [DOI] |
| 17. | Libbrecht L, Desmet V, Van Damme B, Roskams T. The immunohistochemical phenotype of dysplastic foci in human liver: correlation with putative progenitor cells. J Hepatol. 2000;33:76-84. [PubMed] [DOI] |
| 18. | Ruhnke M, Ungefroren H, Zehle G, Bader M, Kremer B, Fändrich F. Long-term culture and differentiation of rat embryonic stem cell-like cells into neuronal, glial, endothelial, and hepatic lineages. Stem Cells. 2003;21:428-436. [PubMed] [DOI] |
| 19. | Miyazaki M, Akiyama I, Sakaguchi M, Nakashima E, Okada M, Kataoka K, Huh NH. Improved conditions to induce hepatocytes from rat bone marrow cells in culture. Biochem Biophys Res Commun. 2002;298:24-30. [PubMed] [DOI] |
| 20. | Kollet O, Shivtiel S, Chen YQ, Suriawinata J, Thung SN, Dabeva MD, Kahn J, Spiegel A, Dar A, Samira S. HGF, SDF-1, and MMP-9 are involved in stress-induced human CD34+ stem cell recruitment to the liver. J Clin Invest. 2003;112:160-169. [PubMed] [DOI] |
| 21. | Yamamoto H, Quinn G, Asari A, Yamanokuchi H, Teratani T, Terada M, Ochiya T. Differentiation of embryonic stem cells into hepatocytes: biological functions and therapeutic application. Hepatology. 2003;37:983-993. [PubMed] [DOI] |
| 22. | Schwartz RE, Reyes M, Koodie L, Jiang Y, Blackstad M, Lund T, Lenvik T, Johnson S, Hu WS, Verfaillie CM. Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells. J Clin Invest. 2002;109:1291-1302. [PubMed] [DOI] |
| 23. | Honda M, Yamada T, Nomura T, Miki Y, Kanda S, Seki A, Sasaki J. Differential, histochemical and immunohistochemical changes in rat hepatocytes after isoflurane or sevoflurane exposure. Acta Med Okayama. 2003;57:1-12. [PubMed] |
| 24. | Ishizaka S, Shiroi A, Kanda S, Yoshikawa M, Tsujinoue H, Kuriyama S, Hasuma T, Nakatani K, Takahashi K. Development of hepatocytes from ES cells after transfection with the HNF-3beta gene. FASEB J. 2002;16:1444-1446. [PubMed] |
| 25. | Hamamoto R, Kamihira M, Iijima S. Growth and differentiation of cultured fetal hepatocytes isolated various developmental stages. Biosci Biotechnol Biochem. 1999;63:395-401. [PubMed] [DOI] |
| 26. | Okano J, Shiota G, Matsumoto K, Yasui S, Kurimasa A, Hisatome I, Steinberg P, Murawaki Y. Hepatocyte growth factor exerts a proliferative effect on oval cells through the PI3K/AKT signaling pathway. Biochem Biophys Res Commun. 2003;309:298-304. [PubMed] [DOI] |
| 27. | Enomoto H, Yoshida K, Kishima Y, Okuda Y, Nakamura H. Participation of hepatoma-derived growth factor in the regulation of fetal hepatocyte proliferation. J Gastroenterol. 2002;37 Suppl 14:158-161. [PubMed] [DOI] |
| 28. | Wells JM, Melton DA. Early mouse endoderm is patterned by soluble factors from adjacent germ layers. Development. 2000;127:1563-1572. [PubMed] |
| 29. | Isfort RJ, Cody DB, Kerckaert GA, LeBoeuf RA. Analysis of the Transforming Potential of Growth and Differentiation Factors in Syrian Hamster Embryo Cells: Reversible and Irreversible Transformation. In Vitr Mol Toxicol. 1999;12:133-148. [PubMed] |
| 30. | Henderson JK, Draper JS, Baillie HS, Fishel S, Thomson JA, Moore H, Andrews PW. Preimplantation human embryos and embryonic stem cells show comparable expression of stage-specific embryonic antigens. Stem Cells. 2002;20:329-337. [PubMed] [DOI] |