修回日期: 2003-09-25
接受日期: 2003-10-27
在线出版日期: 2004-03-15
目的: 研究核因子-kappa B(NF-κB)在胃癌长春新碱耐药细胞中的活化情况, 及其对细胞膜P-糖蛋白(P-gp)表达的调控作用.
方法: 以胃癌细胞SGC7901及其长春新碱(VCR)耐药株SGC7901/VCR为研究对象. 采用凝胶电泳迁移率分析检测NF-κB DNA 结合活性, 细胞-ELISA法检测细胞内IB-蛋白和细胞膜P-糖蛋白(P-gp)的表达, 免疫细胞化学法观测细胞内P65核转位.
结果: SGC7901/VCR耐药细胞中NF-kB的基础活性比敏感细胞高1.4倍. 不同浓度VCR(5, 10, 20, 50 g/L)均可引起耐药细胞NF-κB DNA 结合活性增强、IB-蛋白表达下降和P-gp表达增强, 而亲本敏感细胞产生的上述效应均不及耐药细胞明显; SGC7901/VCR耐药细胞中, NF-κB活性与P-gp的表达呈正相关(r = 0.977, P<0.01), 且NF-κB活化的同时伴有P65核转位. NF-κB抑制剂MG-132可抑制VCR诱导的NF-κB活化及IB-降解, 同时还能抑制P-gp高表达.
结论: 胃癌长春新碱耐药细胞中NF-κB 活性增强, 可能参与调控VCR诱导的细胞膜P-gp高表达.
引文著录: 王维, 罗和生. 长春新碱诱导人胃癌耐药细胞表达P-糖蛋白由核因子-B活化调控. 世界华人消化杂志 2004; 12(3): 537-541
Revised: September 25, 2003
Accepted: October 27, 2003
Published online: March 15, 2004
AIM: To investigate the effect of vincristine on activation of nuclear factor-kappa B (NF-κB) and expression of p-glycoprotein (P-gp) in vincristine-resistant human gastric cancer SGC7901 cells (SGC7901/VCR) and the parent sensitive clone (SGC7901).
METHODS: NF-κB-DNA binding activity was determined by electrophoretic mobility shift assay (EMSA). Levels of inhibitory B (IB-) and P-gp were measured by cellular-ELISA. And immunocytochemistry was used to detect the translocation of P65.
RESULTS: IN comparison with the parent SGC7901 cells, the basal and vincristine-induced NF-κB-DNA binding activity at various concentrations were all higher in the SGC7901/VCR cells. Concurrent with the NF-κB activation, vincristine-induced IB- degradation and P-gp upregulation were also found to be highly enhanced in the SGC7901/VCR cells than that in the sensitive SGC7901 cells. In the SGC7901/VCR cells, the activation of NF-κB induced by vincristine showed a positive relation with the level of P-gp expression (r = 0.977, P < 0.01). And nuclear translocation of P65 occurred concomitantly with NF-κB activation. Furthermore, the inhibition of NF-κB by MG-132, a proteasome inhibitor, could reduce NF-κB activation, IB- degradation and P-gp upregulation.
CONCLUSION: The enhancement of NF-κB activation correlates with vincristine resistance and NF-κB may play an important role in the regulation of the P-gp expression.
- Citation: Wang W, Luo HS. Involvement of NF-kappa B activation in P-glycoprotein expression in vincristine-resistant human gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2004; 12(3): 537-541
- URL: https://www.wjgnet.com/1009-3079/full/v12/i3/537.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i3.537
肿瘤细胞耐药的形成与细胞膜P-糖蛋白(P-gp)过度表达、DNA修复系统异常、凋亡信息抑制等有关. 核因子-B (NF-κB)成员可调控免疫和炎症基因的表达, 在机体防御中发挥重要作用[1-3], 而且, 在多种肿瘤中有NF-κB组成性活化[4-7], 他还参与细胞增生、凋亡、恶性转化和血管形成[8-11]. NF-κB信号转导途径在保护细胞免受抗癌药物诱导的凋亡中发挥关键作用[12]. 另外, 人mdr1基因(编码P-gp)上存在NF-κB结合位点[13], 提示NF-κB还可通过调节P-gp的表达参与形成耐药. 目前NF-κB和耐药相关性的研究多集中于淋巴造血组织肿瘤, 而实体瘤, 特别是胃癌耐药与NF-κB关系的研究极少. 我们通过研究长春新碱(vincristine, VCR)对人胃癌细胞SGC7901及相应多药耐药细胞(SGC7901/VCR)NF-κB DNA 结合活性的影响和P-gp上调的核转录机制, 探讨NF-κB在胃癌耐药形成中的作用.
人胃癌细胞株SGC7901购自中国科学院上海细胞生物学研究所, 相应多药耐药细胞株SGC7901/VCR由第四军医大学全军消化病研究所惠赠. VCR购自上海华联制药有限公司; MG-132购自Alexis公司; 二甲基亚枫(DMSO)和多聚甲醛(PFA)购自Sigma公司; Gel Shift Assay System 试剂盒、NF-κB双链寡核苷酸探针和G-25层析柱购自Promega公司; [-32P]ATP(111PBq/mol)购自北京亚辉生物医学工程公司; 小鼠抗人NF-κBP65单抗和兔IB-多抗购自Santa Cruz公司; 小鼠抗人P-gp单抗购自NeoMarkers公司, HRP标记的山羊抗兔和山羊抗小鼠二抗购自Vector公司; SP染色试剂盒购自北京中山技术有限公司.
两种细胞常规培养于含100 mol/L新生牛血清的RPMI1640培养液中, 其中耐药细胞培养液中加入VCR 0.7 mg/L以维持耐药表型, 并在无药条件下培养7 d后进行各项检测. 细胞接种培养36-40 h后加药, VCR组以不同浓度VCR(5, 10, 20, 50 g/L)作用细胞6 h; 抑制剂组以 MG-132 (2.5 mol/L, 溶于DMSO)预处理细胞30 min, 再加10 g/L VCR共同作用6 h; 同时设立不加药物的空白对照组和DMSO溶剂组. 凝胶电泳迁移率分析(electrophoretic mobility shift assay, EMSA). 收集5×106细胞, 参照文献[Nucleic Acids Res 1989; 17: 6419]的方法, 用碱性低渗裂解液A和B分别裂解细胞膜和核, 低温高速离心(14 000 g), 含核蛋白的上清保存于-80℃, 由紫外分光光度仪定其浓度; EMSA检测NF-κB 的DNA 结合活性参照试剂盒内说明书进行. 用[-32P]ATP以T4寡核苷酸激酶法对NF-κB探针末端标记. 未标记探针经G-25层析柱离心除去. 蛋白-DNA结合反应体系含有8 g核蛋白, 5×凝胶结合缓冲液和无核酶水, 总体积9 L, 室温下孵育10 min后加入标记探针1 L, 继续孵育20 min. 反应产物经60 g/L非变性聚丙烯酰胺凝胶电泳1 h, -70℃曝光24 h, 常规方法显影. 显影带通过激光扫描仪(Typhoon9200型, 瑞典安玛西亚公司)扫描成像后用Imagequant软件分析各带的相对放射性强度; 凝胶迁移率特异性竞争抑制实验, EMSA中设两组竞争性对照, 分别为特异性和非特异性竞争抑制实验, 前者在反应体系之中加入100倍未标记的特异性NF-κB探针, 后者加入100倍未标记的非特异性AP-2探针, 室温孵育10 min后加入标记探针, 以后步骤同2; 超迁移分析(super shift assay)的结合反应体系中加入NF-κBP65单抗0.8 g, 室温孵育30 min后加入标记探针, 以后步骤同2. 细胞酶联免疫黏附法(Celluar-ELISA)测定IB-蛋白和P-糖蛋白: 接种细胞于96孔培养板, 实验组和对照组条件同EMSA, 每个时相点设3个复孔, 按Parnas et al (Brain Res Protoc 1998; 2: 333)的方法测定. 简言之, 细胞经40 g/L PFA固定后, 封闭液(含50 ml/L山羊血清和10 ml/L牛血清白蛋白)孵育30 min, 依次加入一抗(37℃作用2 h)、酶标二抗(37℃作用1 h)、底物(四甲基联苯胺+H2O2, 室温暗处作用1 h), 2 mol/L硫酸中止反应, 490 nm处测吸光度A值. 实验结束后在倒置显微镜下计数各孔细胞数, 以校正A值. 免疫细胞化学检测NF-κB P65核转位: 细胞接种于无菌盖玻片, 干预结束后40 g/L PFA固定3 min, 冷PBS漂洗两次, 染色步骤参照SP试剂盒说明书, 其中P65单抗稀释度为1: 50, 4℃过夜, 最后DAB显色, 苏木素复染. 染成棕黄色为阳性, 观察阳性着色部位.
统计学处理 由SPSS统计软件处理, 用均数±标准差表示, 组间比较用t检验.
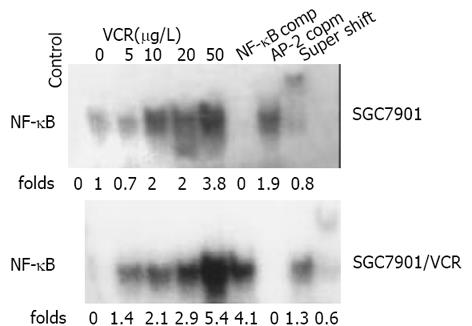
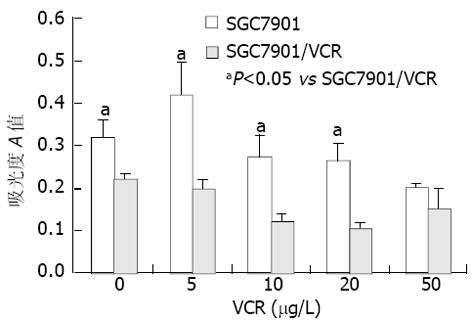
VCR处理前, SGC7901和SGC7901/VCR均存在一定NF-κB 基础活性, 且耐药细胞比敏感细胞高1.4倍; 以5, 10, 20, 50 g/L VCR 作用两种细胞各6 h, 均可引起NF-κB 的DNA 结合活性增强, 且在一定范围内呈剂量依赖性. 与敏感细胞未加药组相比, VCR诱导敏感细胞B活性上升0.7-3.8倍, 而耐药细胞上升2.1-5.4倍, 且相同浓度VCR作用下, 耐药细胞B的活化程度均较敏感细胞高. 耐药细胞在20 g/L VCR时B活性最强, 敏感细胞的B活性在50 g/L时才达到高峰. 竞争性抑制实验中, 100倍未标记的NF-κB探针能抑制滞后带的产生, 而无关探针AP-2对滞后带无明显影响, 证实EMSA检测的特异性. 超迁移试验中, 加入0.8 g抗P65单抗后, 电泳滞后带变淡且更为滞后, 证实转位入核的NF-κB至少含有P65亚单位(图1).不同浓度VCR作用6 h时, 两种细胞的IB-蛋白表达基本呈浓度依赖性递减, 且敏感细胞中的表达程度较耐药细胞高(图2), 其中0, 5, 10, 20 g/L VCR作用下两种细胞IB-蛋白的表达差异有统计学意义(P<0.05).
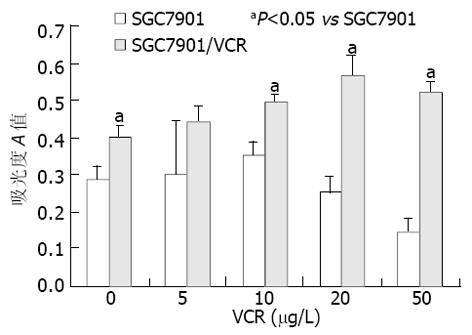
无 VCR刺激时, SGC7901和SGC7901/VCR细胞均存在一定程度的P-gp基础表达, 且耐药细胞比敏感细胞高1.41倍; 不同浓度VCR作用24 h时, 耐药细胞P-gp表达水平均较亲本敏感细胞高, 其中0, 10, 20, 50 g/L时两种细胞P-gp的表达差异有统计学意义(P<0.05, 图3).
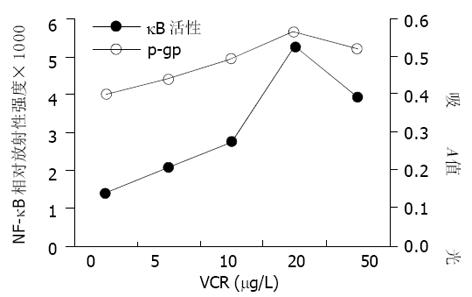
不同浓度VCR作用6 h时, SGC7901/VCR耐药细胞中NF-κB活性与P-gp的表达呈正相关(r = 0.977, P<0.01), 20 g/L VCR时, 二者的表达均达峰值(图4).
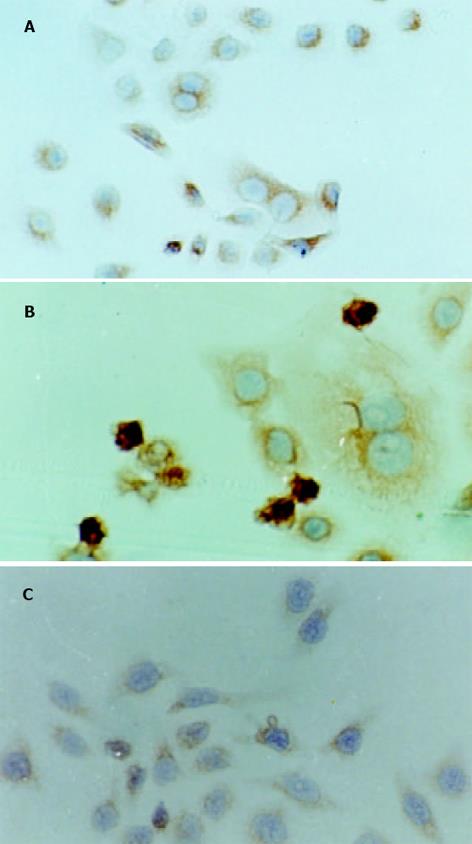
无VCR刺激时, SGC7901/VCR细胞内P65集中于胞质, 细胞核未见着色(图5A); 10 g/L VCR作用6 h时, 细胞核着色明显(图5B). 说明 VCR刺激后可引起耐药细胞内P65由胞质向胞核转位.
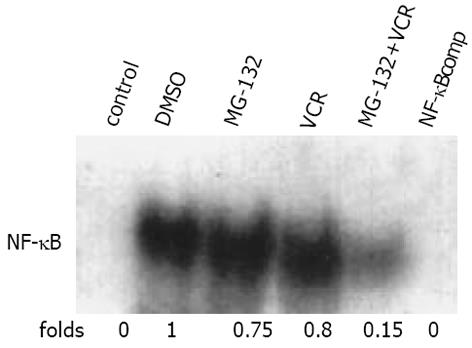
NF-κB抑制剂MG-132 (2.5 mol/L)预作用30 min能明显抑制10 g/L VCR诱导的NF-κB活性增强, 而溶剂DMSO和MG-132单独使用时, 均不能抑制B活化(图6). MG-132对于VCR引起的耐药细胞IB-低表达(作用6 h)和P-gp高表达(作用24 h)也有明显抑制作用(表1). MG-132还可抑制VCR引起的耐药细胞P65核转位(图5C).
NF-κB (通常指p50/P65异源二聚体)是一种重要的核转录调节因子. 静息状态时, 他与细胞内抑制物IB结合, 以非活性形式存在于胞质中. 多种因素刺激下, IB磷酸化、泛素化并在胞质中降解, 然后NF-κB转位入核, 与靶基因调控区结合, 调节靶基因的合成[14-15]. NF-κB具有广泛的调节作用, 参与炎症反应、免疫反应、细胞分化和凋亡[1], 最近有研究认为NF-κB还参与调控肿瘤细胞对抗癌治疗的敏感性[12]. Manna et al[16]发现表达NF-κB的细胞系HuT-78对TNF, 紫杉醇和okadaic acid耐药, 而不表达NF-κB的Jurket细胞对上述药物均敏感. 这可能与NF-κB在转录水平上上调抗凋亡基因的表达(如Bcl-2, IEX-1等)有关[17-19]. Arlt et al[20]进一步发现胰腺癌敏感细胞中NF-κB活性很低, 而耐药细胞中活性明显增高, 且使用NF-κB拮抗剂可显著提高耐药细胞对鬼臼乙叉甙和阿霉素的敏感性. 本实验以胃癌细胞SGC7901及其长春新碱耐药株为研究对象, 发现VCR可诱导两种细胞NF-κB DNA 结合活性增强, 但与亲本敏感细胞相比, 耐药细胞的NF-κB基础活性更高, 且不同浓度VCR作用时, 耐药细胞的B活化程度均较敏感细胞高. 这些差异与NF-κB主要表现为抗凋亡、维持细胞存活的作用一致, 提示两种细胞NF-κB对VCR刺激的反应不同可能参与胃癌耐药.
目前还不清楚VCR最初是通过什么靶点和/或产生何种损伤来激活NF-κB. 有报道微管解聚类药物可活化NF-κB[21-22], Rosettc et al[21]还发现微管稳定类药物能抑制这种活化, 故认为细胞骨架的不稳定是NF-κB活化信号之一. 但随后有研究发现紫杉醇(稳定细胞内微管解构)[23-24]、VCR和长春花碱(使细胞内微管解聚)[23], 均可某些肿瘤细胞的NF-κB活化. 我们还发现VCR诱导NF-κB活化的同时伴有IB-蛋白降解和P65核转位, 且NF-κB抑制剂MG-132可明显抑制VCR引起的耐药细胞IB-蛋白低表达、P65核转位和B活化, 进一步证实SGC7901/VCR耐药细胞中存在NF-κB信号通路.
除凋亡信息受抑, 肿瘤细胞获得耐药还与细胞膜上P-gp过度表达有关, 该蛋白由耐药基因Mdr1编码, 具有结合药物和ATP的位点, 可将化疗药从细胞内泵出细胞外, 是多种耐药细胞产生耐药性的重要机制, 而且拮抗P-gp 的功能可在一定程度上逆转耐药[25-26]. 本实验中也发现, SGC7901/VCR耐药细胞的P-gp的基础表达及VCR诱导后的表达均较亲本敏感细胞高, 可能是细胞对 VCR耐药的重要原因. 有研究显示P-gp的表达可能受NF-κB调控 [27-28], Deng et al[29]进一步发现在大鼠肝癌细胞系中2-乙酰氨芴诱导mdr1b基因过表达由NF-κB介导, 且Mdr1b基因5'端 -167至-158区域为NF-κB结合位点, Bentires-Alj et al[13]也发现人Mdr1基因的第一个启动子上存在NF-κB结合位点, 提示NF-κB可转录激活Mdr1, 使细胞膜表面 P-gp表达增高. Um et al[30]的实验证实, P-gp高表达的耐药细胞中NF-κB DNA 结合活性和P65的表达均高于敏感亲本细胞, 提出NF-κB活化可能是P-gp高表达细胞耐药的重要机制; 本实验也观测到耐药细胞NF-κB活性与P-gp表达的变化呈正相关, 且MG-132 在抑制NF-κB活化的同时也抑制P-gp表达, 提示NF-κB途径参与调节VCR诱导的P-gp表达.
樊代明教授惠赠SGC7901/VCR耐药细胞株, 张翼教授、包鹏辉硕士在实验技术上大力支持.
编辑: N/A
| 1. | Liou HC. Regulation of the immune system by NF-kappaB and IkappaB. J Biochem Mol Biol. 2002;35:537-546. [PubMed] |
| 2. | Jia CK, Zheng SS, Li QY, Zhang AB. Immunotolerance of liver allotransplantation induced by intrathymic inoculation of donor soluble liver specific antigen. World J Gastroenterol. 2003;9:759-764. [PubMed] [DOI] |
| 3. | Gong JP, Liu CA, Wu CX, Li SW, Shi YJ, Li XH. Nuclear factor B activity in patients with acute severe cholangitis. World J Gastroenterol. 2002;8:346-349. [PubMed] |
| 4. | Zhu JW, Yu BM, Ji YB, Zheng MH, Li DH. Upregulation of vascular endothelial growth factor by hydrogen peroxide in human colon cancer. World J Gastroenterol. 2002;8:153-157. [PubMed] [DOI] |
| 5. | Chen CD, Sawyers CL. NF-kappa B activates prostate-specific antigen expression and is upregulated in androgen-independent prostate cancer. Mol Cell Biol. 2002;22:2862-2870. [PubMed] [DOI] |
| 6. | Lind DS, Hochwald SN, Malaty J, Rekkas S, Hebig P, Mishra G, Moldawer LL, Copeland EM 3rd, Mackay S. Nuclear factor-kappa B is upregulated in colorectal cancer. Surgery. 2001;130:363-369. [PubMed] [DOI] |
| 7. | Guo SP, Wang WL, Zhai YQ, Zhao YL. Expression of nuclear factor-kappa B in hepatocellular carcinoma and its relation with the X protein of hepatitis B virus. World J Gastroenterol. 2001;7:340-344. [PubMed] [DOI] |
| 8. | Orlowski RZ, Baldwin AS Jr. NF-kappaB as a therapeutic target in cancer. Trends Mol Med. 2002;8:385-389. [PubMed] [DOI] |
| 9. | Lin A, Karin M. NF-kappaB in cancer: a marked target. Semin Cancer Biol. 2003;13:107-114. [PubMed] [DOI] |
| 10. | Kim DW, Sovak MA, Zanieski G, Nonet G, Romieu-Mourez R, Lau AW, Hafer LJ, Yaswen P, Stampfer M, Rogers AE. Activation of NF-kappaB/Rel occurs early during neoplastic transformation of mammary cells. Carcinogenesis. 2000;21:871-879. [PubMed] [DOI] |
| 11. | Li HL, Chen DD, Li XH, Zhang HW, Lu YQ, Ye CL, Ren XD. Changes of NF-κB, p53, Bcl-2 and caspase in apoptosis induced by JTE-522 in human gastric adenocarcinoma cell line AGS cells: role of reactive oxygen species. World J Gastroenterol. 2002;8:431-435. [PubMed] [DOI] |
| 12. | Mayo MW, Baldwin AS. The transcription factor NF-kappaB: control of oncogenesis and cancer therapy resistance. Biochim Biophys Acta. 2000;1470:M55-62. [PubMed] |
| 13. | Bentires-Alj M, Barbu V, Fillet M, Chariot A, Relic B, Jacobs N, Gielen J, Merville MP, Bours V. NF-kappaB transcription factor induces drug resistance through MDR1 expression in cancer cells. Oncogene. 2003;22:90-97. [PubMed] [DOI] |
| 14. | Jobin C, Sartor RB. The I kappa B/NF-kappa B system: a key determinant of mucosalinflammation and protection. Am J Physiol Cell Physiol. 2000;278:C451-462. [PubMed] |
| 15. | Wang T, Zhang X, Li JJ. The role of NF-kappaB in the regulation of cell stress responses. Int Immunopharmacol. 2002;2:1509-1520. [PubMed] [DOI] |
| 16. | Manna SK, Aggarwal BB. Lipopolysaccharide inhibits TNF-induced apoptosis: role of nuclear factor-kappaB activation and reactive oxygen intermediates. J Immunol. 1999;162:1510-1518. [PubMed] |
| 17. | Baldwin AS. Control of oncogenesis and cancer therapy resistance by the transcription factor NF-kappaB. J Clin Invest. 2001;107:241-246. [PubMed] [DOI] |
| 18. | Yamamoto Y, Gaynor RB. Therapeutic potential of inhibition of the NF-kappaB pathway in the treatment of inflammation and cancer. J Clin Invest. 2001;107:135-142. [PubMed] [DOI] |
| 19. | Schoemaker MH, Ros JE, Homan M, Trautwein C, Liston P, Poelstra K, van Goor H, Jansen PL, Moshage H. Cytokine regulation of pro- and anti-apoptotic genes in rat hepatocytes: NF-kappaB-regulated inhibitor of apoptosis protein 2 (cIAP2) prevents apoptosis. J Hepatol. 2002;36:742-750. [PubMed] [DOI] |
| 20. | Arlt A, Vorndamm J, Breitenbroich M, Folsch UR, Kalthoff H, Schmidt WE, Schafer H. Inhibition of NF-kappaB sensitizes human pancreatic carcinoma cells to apoptosis induced by etoposide (VP16) or doxorubicin. Oncogene. 2001;20:859-868. [PubMed] [DOI] |
| 21. | Rosette C, Karin M. Cytoskeletal control of gene expression: depolymerization of microtubules activates NF-kappa B. J Cell Biol. 1995;128:1111-1119. [PubMed] [DOI] |
| 22. | Mistry P, Deacon K, Mistry S, Blank J, Patel R. NF-kappa B promotes survival during mitotic cell cycle arrest. J Biol Chem. 2003; [Epub ahead of print]. [PubMed] |
| 23. | Das KC, White CW. Activation of NF-kappaB by antineoplastic agents. Role of protein kinase C. J Biol Chem. 1997;272:14914-14920. [PubMed] [DOI] |
| 24. | Huang Y, Johnson KR, Norris JS, Fan W. Nuclear factor-kappaB/IkappaB signaling pathway may contribute to the mediation of paclitaxel-induced apoptosis in solid tumor cells. Cancer Res. 2000;60:4426-4432. [PubMed] |
| 25. | Wang H, Chen XP, Qiu FZ. Overcoming multi-drug resistance by anti-MDR1 ribozyme. World J Gastroenterol. 2003;9:1444-1449. [PubMed] |
| 26. | Yin F, Shi YQ, Zhao WP, Xiao B, Miao JY, Fan DM. Suppression of P-gp induced multiple drug resistance in a drug resistant gastric cancer cell line by overexpression of Fas. World J Gastroenterol. 2000;6:664-670. [PubMed] [DOI] |
| 27. | Ros JE, Schuetz JD, Geuken M, Streetz K, Moshage H, Kuipers F, Manns MP, Jansen PL, Trautwein C, Muller M. Induction of Mdr1b expression by tumor necrosis factor-alpha in rat liver cells is independent of p53 but requires NF-kappaB signaling. Hepatology. 2001;33:1425-1431. [PubMed] [DOI] |
| 28. | Thevenod F, Friedmann JM, Katsen AD, Hauser IA. Up-regulation of multidrug resistance P-glycoprotein via nuclear factor-kappaB activation protects kidney proximal tubule cells from cadmium-and reactive oxygen species-induced apoptosis. J Biol Chem. 2000;275:1887-1896. [PubMed] [DOI] |
| 29. | Deng L, Lin-Lee YC, Claret FX, Kuo MT. 2-acetylaminofluorene up-regulates rat mdr1b expression through generating reactive oxygen species that activate NF-kappa B pathway. J Biol Chem. 2001;276:413-420. [PubMed] [DOI] |