修回日期: 2004-09-13
接受日期: 2004-09-19
在线出版日期: 2004-11-15
目的: 探讨胆汁酸肠肝循环对消化间期胃肠移行性复合运动(MMC)的影响.
方法: 建立狗胆汁酸体外循环模型(n = 12), 观察在胆汁酸肠肝循环完整、胆汁体外引流及自体胆汁回输时MMC及血浆胃动素(MTL)浓度的变化.
结果: 正常狗小肠MMC有3个不同的时相; Ⅲ相时MTL水平较Ⅰ相明显增高(433.8±46.3 ng/L vs 112.6±21.7 ng/L, P = 0.000<0.01). 胆汁体外引流时, MMC周期明显延长(110.2±13.6 min vs 99.1±14.4 min, P = 0.001<0.01), 无Ⅲ相活动, Ⅰ相缩短(31.0±6.6 min vs 53.2±9.2 min, P = 0.002<0.01), Ⅱ相延长(79.2±11.8 min vs 41.3±9.9 min, P = 0.001<0.01), Ⅱ相末30 min的动力指数较正常时降低(41.3±6.8 mV/s vs 69.1±9.2 mV/s vs, P = 0.001<0.01); 而MTL在各监测点间无明显变化. 自体胆汁回输后, 仍无明显的MMCⅢ相活动, 与灌输前比较, MMC周期缩短(101.9±14.0 min vs 110.2±13.6 min, P = 0.03<0.05), Ⅰ相延长(44.1±6.3 min vs 31.0±6.6 min, P = 0.002<0.01), Ⅱ相缩短(57.9±10.7 min vs 79.2±11.8 min, P = 0.002<0.01), Ⅱ相末30 min的动力指数较引流前明显增高(59.4±7.6 mV/s vs 41.3±6.8 mV/s, P = 0.002<0.01), 接近正常的MMC特征; 而血浆MTL水平仍无明显变化.
结论: 胆汁酸肠肝循环对维持MMC有重要意义, MTL可能发挥着重要的中介作用.
引文著录: 张珍妮, 董蕾, 刘欣, 李毅. 胆汁酸肠肝循环对消化间期移行性复合运动的作用. 世界华人消化杂志 2004; 12(11): 2610-2613
Revised: September 13, 2004
Accepted: September 19, 2004
Published online: November 15, 2004
AIM: To investigate the effects of enterohepatic circulation of bile acid on interdigestive migrating motor complex (MMC).
METHODS: The dog models of extracorporeal circulation of bile acid were established firstly (n = 12). Then the records of MMC were observed with bile flow intact, during total external biliary diversion and after re-infusion of the bile into the dogs duodenum respectively. At the same time, the concentration of plasma motilin (MTL) was measured under different conditions.
RESULTS: The interdigestive MMC with bile flow intact included 3 phases. The concentration of plasma MTL cycled with MMC. The level of MTL in phase Ⅲ was much higher than that in phaseⅠ(433.8 ± 46.3 ng/L vs 112.6 ± 21.7 ng/L, P = 0.000 < 0.01). During total external biliary diversion, phase Ⅲ was not obvious. Compared with the normal period of MMC, the one during total external biliary divevsion was much longer (110.2 ± 13.6 min vs 99.1 ± 14.4 min, P = 0.001 < 0.01); the duration of phaseⅠwas shorter (31.0 ± 6.6 min vs 53.2 ± 9.2 min, P = 0.002 < 0.01) and that of phase Ⅱ was longer (79.2 ± 11.8 min vs 41.3 ± 9.9 min, P = 0.001 < 0.01). The dynamic index of last 30 min of phase Ⅱwas lower than that of normal (41.3 ± 6.8 mV/s vs 69.1 ± 9.2 mV/s, P = 0.001 < 0.01). At the same time, the concentrations of plasma MTL did not show significant differences with the changing of MMC. Phase Ⅲ was also not obvious after re-infusion of the bile. However, compared with pre-infusion, the characteristics of MMC changed and were more similar to normal MMC.
CONCLUSION: Enterohepatic circulation of bile acid plays an important role in the maintenance of interdigestive MMC. MTL is an important factor in the initiation of phase Ⅲ of MMC.
- Citation: Zhang ZN, Dong L, Liu X, Li Y. Effect of bile acid enterohepatic circulation on interdigestive migrating motor complex. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2610-2613
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2610.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2610
在消化间期(禁食期)人和哺乳动物的胃肠道呈现一种独特的周期性的运动形式, 称为移行性复合运动(MMC), 表现为静息期与收缩期交替、规律性出现. MMC具有重要的生理功能, 起着胃肠道"清道夫"的作用, 可促进胃与幽门、小肠和胆道的协调性, 并能防止肠道感染. 胃动素(MTL)是一种重要的胃肠激素[1-3], 与MMC关系密切[4-7]. 有关MMC的研究国内外报道较多[8-11], 但其发生和调节机制还不清楚[12-14], 目前研究较多有争议的是胆汁酸的肠肝循环调节理论[15-17]. 我们通过建立狗胆汁酸体外循环模型, 来观察胆汁酸肠肝循环对MMC的影响, 并对血浆MTL浓度进行动态监测, 以探讨MMC的发生和调节机制.
健康成年犬12只, 体质量15-20 kg, 雌雄不限, 由西安交通大学第二医院动物实验中心提供; RM6280C多道生理信号记录仪购自成都仪器厂; 银丝电极购自上海市信息产业部电子23研究所特种线缆部; MTL放免试剂盒购自中国人民解放军总医院放免研究所; CCK放免试剂盒购自第二军医大学神经生物学教研室; NO试剂盒购自南京建成生物工程研究所.
实验犬硫喷妥钠股静脉麻醉后, 无菌条件下右上腹旁正中切口打开腹腔, 与胆总管十二指肠连接处上方2-3 cm处作一小切口, 在两个断段各插一硅胶管, 近端导管用以引流胆汁, 远端导管用以回输自体胆汁. 切断远近端硅胶管之间的胆总管以防胆流再通. 随后, 分别于胃窦、距幽门5 cm处十二指肠浆肌层缝置银丝电极, 走皮下隧道引出体外. 关腹后, 用一连接硅胶管将2个引流硅胶管体外端连接起来, 形成胆汁的体外循环, 保证胆流通畅. 将此硅胶管置于动物帆布背心中以防狗咬损坏. 术后8 d进行第1次MMC的测定. 实验前禁食12 min, 实验时动物在清醒状态下悬爬于自制的测试台上, 记录1个或1个以上完整的MMC周期后结束. 同时在MMCⅠ, Ⅱ, Ⅲ相通过静脉留置针各采集静脉血2 mL以检测血浆MTL浓度. 之后去掉连接硅胶管, 将近端引流硅胶管与一引流袋相连接, 以收集胆汁, 造成胆汁体外引流模型, 引流袋置于动物帆布背心的小袋中以防狗咬损坏. 术后第10 d再次进行测定, 连续记录胃肠道运动3 h, 观察胃肠MMC波形的变化, 然后在MMCⅡ相开始后10 min以1 mL/min的速率沿远端硅胶管注入狗自体胆汁10 min, 再次记录胃肠道运动3 h. 胆汁体外引流后在自体胆汁回输前后分别采血3次, 每次2 mL, 每次间隔1 h, 以检测血浆MTL水平. 测量MMC总体特征, MMC周期时间, MMC各时相时程, MMCⅢ相的峰电频率与平均波幅以及动力指数[18]等指标, 采用放免法检测血浆MTL浓度.
统计学处理 数据以mean±SD表示, 使用SPSS10.0统计软件, 运用配对t检验对结果进行统计和分析. 认为P<0.05有统计学意义.
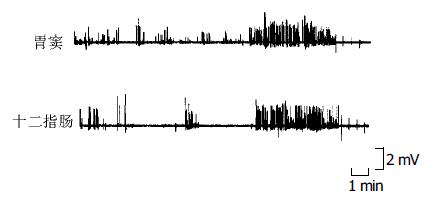
胆汁酸肠肝循环完整时, 犬胃肠MMC周期为99.1±14.4 min, 呈明显的3个时相, 其中Ⅰ相无收缩波, 时程53.2±9.2 min; Ⅱ相有间断收缩, 时程41.3±9.9 min; Ⅲ相出现强烈收缩, 时程4.9±1.2 min(表1). 胃窦部位MMCⅢ相峰电频率为4.2±1.5次/min, 十二指肠处为9.5±3.3次/min, 后者明显高于前者(P<0.01). 胃窦部位MMCⅢ相峰电波幅为2.0±0.3 mV, 十二指肠部位MMCⅢ相峰电波幅平均为1.4±0.2 mV, 前者明显高于后者(P<0.01, 图1).
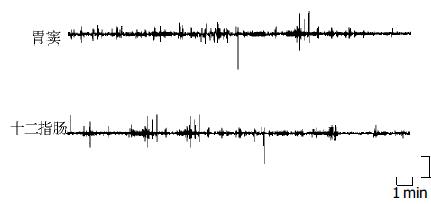
胆汁体外引流后, 未记录到MMCⅢ相活动, 与正常MMC相比, MMC周期明显延长(P<0.01), 主要表现为Ⅱ相延长(P<0.01), Ⅰ相缩短(P<0.01), Ⅱ相末30 min动力指数较正常时降低(P<0.01, 图2, 表1).
胆汁体外引流自体胆汁回输后, 仍未记录到MMCⅢ相活动, 但与自体胆汁回输前相比较, MMC周期缩短(P<0.05), 主要表现为Ⅱ相缩短(P<0.01), Ⅰ相延长(P<0.01), Ⅱ相末30 min动力指数较引流前明显增高(P<0.01, 表1).
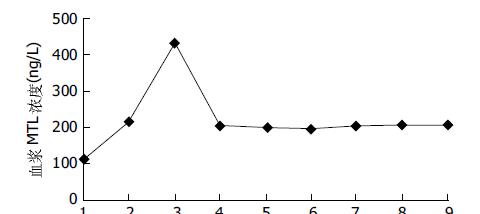
胆汁酸肠肝循环完整时, 血浆MTL水平随MMC发生周期性波动, 血浆MTL浓度在MMCⅠ, Ⅱ, Ⅲ相分别为112.6±21.7, 215.0±34.4, 433.8±46.3 ng/L, MMCⅢ相时血浆MLT水平明显高于MMCⅠ, Ⅱ相(P<0.01), 而MMCⅡ相时MTL水平明显高于Ⅰ相(P<0.01, 图3).
胆汁体外引流后血浆MTL水平在各监测点间无明显差异(P>0.05), 平均值为201.0±21.0 ng/L, 比胆汁体外引流前Ⅰ相MTL水平增高(P<0.01), 而低于引流前Ⅲ相MTL水平(P<0.01, 图3). 胆汁体外引流自体胆汁回输后, 各检测点之间血浆MTL水平无明显差异(P>0.05), 平均值为206.1±21.4 ng/L, 与自体胆汁灌输前相比较稍有增高, 但无显著性差异(P>0.05, 图3).
关于MMC的研究最早开始于20世纪初, 至今已经经历了100年的历史. MMC的发生及调节机制比较复杂, 可能有多种因素参与, 但其具体机制尚未完全阐明. 胆汁酸的肠肝循环调节理论越来越引起人们的重视. 胆汁酸是胆汁的主要成分, 约占胆汁中固体成分的85%. 肝脏分泌的胆汁酸大部分储存在胆囊, 在消化间期, 胆汁酸随胆囊收缩呈周期性排出. 胆汁酸随胆汁通过胆道进入十二指肠后, 绝大部分(约95%)由小肠黏膜重吸收入血, 通过门静脉返回肝脏. 经过肝细胞加工转化后, 连同新合成的胆汁酸一起又分泌入小肠, 绝大部分又被重吸收入血回肝. 胆汁酸如此在肠和肝之间循环往复的过程, 称为胆汁酸的肠肝循环.
有关胆汁酸肠肝循环对MMC的作用及其机制的研究目前还存在很多争论. 部分研究者认为胆汁酸的肠肝循环在胃肠道MMC的启动及调节方面发挥着至关重要的作用, 若胆汁酸的肠肝循环被破坏, 则胃肠道MMC的周期性运动消失[19-22], 并认为MTL在此过程中发挥着桥梁作用[23-26]; 另有部分学者则认为胆汁酸的肠肝循环和血浆MTL浓度的周期性波动对胃肠道MMC的启动和调节没有特殊作用, 肠肝循环的破坏不能改变MMC的周期性运动, 他们仅仅可能只是胃肠MMC周期性运动产生的一个结果[27-28]. 我们发现, 在正常状态下, 消化间期胃肠MMC呈现明显的规律性运动, 表现为静止期和收缩期交替出现. 一个完整的MMC周期包括波幅和持续时间明显不同的3个连续的时相. 当胆汁酸的肠肝循环被破坏后, 小肠原有的MMC特征发生了明显的改变, MMCⅢ相消失, 同时, 血浆MTL水平的周期性波动消失, 保持在一个较为平稳的状态. 因此我们认为维持胆汁酸肠肝循环的完整性对于小肠MMC具有重要意义. 这种现象发生的机制目前还不清楚, 可能与神经、激素调节以及肠内内容物的生化成分对肠道平滑肌的作用有关, 但是我们可以肯定的是MTL在此过程中发挥着不容忽视的作用, 他是调节MMC的一种重要的胃肠激素. 但是也有很多的研究报道不同于我们实验所得到的结果, 分析原因可能是由于他们所使用的胆汁体外引流的方法不能保证完全阻断了胆流, 而且不能避免发生了胆总管自发性再通的可能性. 我们的实验在设计时避免了这方面的因素, 胆总管插管的同时被横断以保证胆流完全阻断.
有关胆汁酸回输对胃肠MMC的影响的研究, 目前亦无定论. 有学者认为胆汁回输可以诱发十二指肠MMC[20-21,29]; 而Scottet al[27]认为胆汁回输对胃肠MMC的特征和起源位点没有影响, Luiking et al[30]研究发现健康人十二指肠内合成胆汁灌注对MMC也没有影响; 另有理论认为胆汁酸对MMC非但没有启动和调节作用, 相反, 胆汁排入十二指肠可以破坏胃肠MMC[31]. 我们在胆汁体外引流期间将狗自体胆汁回输入十二指肠并不能恢复正常MMC的特征, 也不能恢复血浆MTL的周期性波动, 但是与自体胆汁回输前相比较, 胆汁回输后的十二指肠MMC更为接近正常的MMC. 因此, 我们不能否认胆汁酸肠肝循环对MMC的重要性. 那么, 为什么自体胆汁回输后不能恢复正常的MMC呢? 分析其原因, 可能有以下几种: 我们所采用的胆汁回输方式, 并没有恢复正常的胆汁酸的肠肝循环. 我们以1 mL/min的速率回输自体胆汁10 min, 此量接近于狗正常体内胆汁酸池的40%[27,32], 由于胆汁引流期间, 肠道内的胆汁酸已经被完全代谢和排泄, 缺乏了正常肠道内胆汁酸浓度的铺垫, 10 mL的胆汁回输或许并没有达到胆汁酸发挥其作用的生理浓度, 所以不能诱发正常的十二指肠MMCⅢ相. 我们同时观察到胆汁酸回输后改变了胃肠MMC的特征, 使其更为接近正常MMC的特征, 所以我们认为胆汁酸对胃肠MMC的作用是肯定的, 只是存在一个从量变到质变的问题; 我们所采用的回输方式有别于Ozeki et al[20], 他们采用的是长时间(6 h)连续灌输胆汁, 或许在胆汁引流的情况下, 这种方式的灌输更有利于胆汁酸发挥作用; 记录时间不足. Ozeki et al[20]观察到胆汁回输后需要2 h左右来诱发十二指肠MMC, 而Kajiyama et al[33]报道将熊去氧胆酸注入静脉来诱发十二指肠MMC所需要的时间为4-8 h. 因为实验条件所限制, 我们在狗自体胆汁回输后对其胃肠MMC监测了3 h, 这或许也是我们没有记录到胆汁酸所诱发的MMCⅢ相的一个原因.
编辑: N/A
| 1. | Luiking YC, Akkermans LM, Peeters TL, Cnossen PJ, Nieuwenhuijs VB, Vanberge -Henegouwen GP. Effects of motilin on human interdigestive gastrointestinal and gallbladder motility, and involvement of 5HT3 receptors. Neurogastroenterol Motil. 2002;14:151-159. [DOI] |
| 2. | Qvist N, Oster-Jørgensen E, Pedersen SA, Rasmussen L, Hovendal C, Holst JJ. Increases in plasma motilin follow each episode of gallbladder emptying during the interdigestive period, and changes in serum bile acid concentration correlate to plasma motilin. Scand J Gastroenterol. 1995;30:122-127. [PubMed] [DOI] |
| 3. | Stolk MF, van Erpecum KJ, Smout AJ, Akkermans LM, Jansen JB, Lamers CB, Peeters TL, vanBerge-Henegouwen GP. Motor cycles with phase III in antrum are associated with high motilin levels and prolonged gallbladder emptying. Am J Physiol. 1993;264:G596-G600. [PubMed] |
| 8. | Thomas EA, Sjövall H, Bornstein JC. Computational model of the migrating motor complex of the small intestine. Am J Physiol Gastrointest Liver Physiol. 2004;286:G564-G572. [PubMed] [DOI] |
| 9. | Spencer NJ, Bywater RA. Enteric nerve stimulation evokes a premature colonic migrating motor complex in mouse. Neurogastroenterol Motil. 2002;14:657-665. [PubMed] [DOI] |
| 10. | Powell AK, O'brien SD, Fida R, Bywater RA. Neural integrity is essential for the propagation of colonic migrating motor complexes in the mouse. Neurogastroenterol Motil. 2002;14:495-504. [DOI] |
| 11. | Andrews JM, O'donovan DG, Hebbard GS, Malbert CH, Doran SM, Dent J. Human duodenal phase III migrating motor complex activity is predominantly antegrade, as revealed by high-resolution manometry and colour pressure plots. Neurogastroenterol Motil. 2002;14:331-338. [PubMed] [DOI] |
| 12. | Tanaka T, VanKlompenberg LH, Sarr MG. Selective role of vagal and nonvagal innervation in initiation and coordination of gastric and small bowel patterns of interdigestive and postprandial motility. J Gastrointest Surg. 2001;5:418-433. [PubMed] [DOI] |
| 13. | Wang L, Zhou L, Tian R. Role of the area postrema of medulla oblongata in the regulation of canine interdigestive migrating motor complex. Chin Med J (Engl). 2002;115:384-388. |
| 14. | Friis ML, Johansen B, Djurhuus JC, Gregersen H. Distension-induced duodenal contractions vary with the phases of the canine interdigestive migrating motility complex. Int J Surg Investig. 1999;1:39-45. [PubMed] |
| 15. | Plaza MA. 5-hydroxytryptamine and the gastrointestinal migrating motor complex. Curr Opin Investig Drugs. 2001;2:539-544. [PubMed] |
| 16. | Tanaka T, Kendrick ML, Zyromski NJ, Meile T, Sarr MG. Vagal innervation modulates motor pattern but not initiation of canine gastric migrating motor complex. Am J Physiol Gastrointest Liver Physiol. 2001;281:G283-G292. [PubMed] |
| 17. | Stolk MF, Van Erpecum KJ, Peeters TL, Samsom M, Smout AJ, Akkermans LM, Vanberge-Henegouwen GP. Interdigestive gallbladder emptying, antroduodenal motility, and motilin release patterns are altered in cholesterol gallstone patients. Dig Dis Sci. 2001;46:1328-1334. [PubMed] [DOI] |
| 18. | Simrén M, Castedal M, Svedlund J, Abrahamsson H, Björnsson E. Abnormal propagation pattern of duodenal pressure waves in the irritable bowel syndrome (IBS) [correction of (IBD)]. Dig Dis Sci. 2000;45:2151-2161. [PubMed] [DOI] |
| 19. | Scott RB, Strasberg SM, El-Sharkawy TY, Diamant NE. Regulation of the fasting enterohepatic circulation of bile acids by the migrating myoelectric complex in dogs. J Clin Invest. 1983;71:644-654. [PubMed] [DOI] |
| 20. | Ozeki K, Sarna SK, Condon RE, Chey WY, Koch TR. Enterohepatic circulation is essential for regular cycling of duodenal migrating motor complexes in dogs. Gastroenterology. 1992;103:759-767. [DOI] |
| 21. | Owyang C, Funakoshi A, Vinik AI. Evidence for modulation of motilin secretion by pancreatico-biliary juice in health and in chronic pancreatitis. J Clin Endocrinol Metab. 1983;57:1015-1020. [PubMed] [DOI] |
| 22. | Malfertheiner P, Sarr MG, DiMagno EP. Role of the pancreas in the control of interdigestive gastrointestinal motility. Gastroenterology. 1989;96:200-205. [DOI] |
| 23. | Hellström PM, Nilsson I, Svenberg T. Role of bile in regulation of gut motility. J Intern Med. 1995;237:395-402. [PubMed] [DOI] |
| 24. | Nieuwenhuijs VB, Luiking YC, Verheem A, vanBerge-Henegouwen GP, Gooszen HG, Akkermans LM. Disrupted bile flow affects interdigestive small bowel motility in rats. Surgery. 1997;122:600-608. [DOI] |
| 25. | Portincasa P, Peeters TL, van Berge-Henegouwen GP, van Solinge WW, Palasciano G, van Erpecum KJ. Acute intraduodenal bile salt depletion leads to strong gallbladder contraction, altered antroduodenal motility and high plasma motilin levels in humans. Neurogastroenterol Motil. 2000;12:421-430. [DOI] |
| 26. | Yang M, Fang DC, Li QW, Sun NX, Long QL, Sui JF, Gan L. Effects of gastric pacing on gastric emptying and plasma motilin. World J Gastroenterol. 2004;10:419-423. [PubMed] |
| 27. | Scott RB. Effect of duodenal bile acid delivery on fasting intestinal motor activity. Am J Physiol. 1986;250:G836-G841. [PubMed] |
| 28. | Hughes SJ, Behrns KE, Sarr MG. Chronic bile diversion does not alter canine interdigestive myoelectric activity. Dig Dis Sci. 1993;38:1055-1061. [PubMed] [DOI] |
| 29. | Van Ooteghem NA, Van Erpecum KJ, Van Berge-Henegouwen GP. Effects of ileal bile salts on fasting small intestinal and gallbladder motility. Neurogastroenterol Motil. 2002;14:527-533. [DOI] |
| 30. | Luiking YC, Kloppers NJ, Roelofs JM, Nieuwenhuijs VB, Peeters TL, Akkermans LM, van Berge Henegouwen GP. Effects of intraduodenal bile on interdigestive gastrointestinal and gallbladder motility in healthy subjects. Digestion. 2001;63:195-202. [PubMed] [DOI] |
| 31. | Kruis W, Haddad A, Phillips SF. Chenodeoxycholic and ursodeoxycholic acids alter motility and fluid transit in the canine ileum. Digestion. 1986;34:185-195. [PubMed] [DOI] |
| 32. | Small DM, Dowling RH, Redinger RN. The enterohepatic circulation of bile salts. Arch Intern Med. 1972;130:552-573. [PubMed] [DOI] |
| 33. | Kajiyama Y, Irie M, Enjoji A, Ozeki K, Ura K, Kanematsu T. Role of bile acids in duodenal migrating motor complexes in dogs. Dig Dis Sci. 1998;43:2278-2283. [PubMed] [DOI] |