修回日期: 2004-07-09
接受日期: 2004-08-20
在线出版日期: 2004-10-15
目的: 探讨动脉化疗栓塞术(Transcatheter Arterial Chemoem-bolization, TACE)对估计不能切除的小儿肝母细胞瘤治疗的临床可行性、疗效及其在综合治疗中的作用.
方法: 常规估计不能切除的肝母细胞瘤15例经动脉化疗栓塞治疗18次, 再行Ⅱ期外科手术切除, 比较分析治疗前后临床症状、体征和血AFP的变化、术中情况及随访远期疗效.
结果: TACE术后数天至1 mo复查, 和术前相比, 肿瘤体积平均缩小58.6%(配对t检验, t = 3.171, P = 0.007), 血AFP平均降低57.4%(配对t检验, t = 1.784, P = 0.096), 无明显的化疗毒性反应, 肿瘤手术完整切除12例, 术后病理显示肿瘤明显坏死, 平均坏死区域面积为63.1%. 随访6-30 mo, 1年生存率为93.3%(14/15), 2年生存率为66.6%(10/15), 3年生存率为40.0%(6/15).
结论: TACE治疗肝母细胞瘤安全有效, 无严重并发症, 能使部分不能Ⅰ期手术的患儿重新获得手术机会, 并对减少术中肿瘤细胞的扩散和术中出血、改善预后有较大作用.
引文著录: 陈伟, 李家平, 杨建勇, 庄文权, 刘唐彬, 李桂生. 动脉化疗栓塞治疗小儿肝母细胞瘤15例. 世界华人消化杂志 2004; 12(10): 2360-2363
Revised: July 9, 2004
Accepted: August 20, 2004
Published online: October 15, 2004
AIM: To evaluate the clinical feasibility, therapeutic effect, applications and roles of transcatheter arterial chemoemb-olization (TACE) for the unresectable hepatoblastoma in children.
METHODS: Fifteen cases of unresectable hepatoblastoma were firstly treated with TACE for 18 times before secondary surgical resection. The changes of clinical symptoms, signs and AFP before and after TACE, and the conditions of operation were analyzed. The therapeutic effect in long term was followed up for all the cases.
RESULTS: Re-examinations were performed after several days to 1 month. Tumors treated with TACE shrank with 19-82% (average 58.6%)(Paired samples test, t = 3.171, P = 0.007), and the levels of AFP reduced significantly from 29% to 89%(mean 57.38%) (Paired samples test, t = 1.784,P = 0.096). No significant chemotherapeutic toxicity was observed. Twelve cases of hepatoblastoma were safely excised. Pathological examination showed massive necrosis (63.1% on average) in the resected tumor tissues. The 1-, 2-, and 3-year survival rates were 93.3% (14/15), 66.6% (10/15) and 40%(6/15) respectively by follow-up.
CONCLUSION: TACE is a safe, effective therapeutic method for unresectable hepatoblastoma in children. It is also effective in reducing hemorrhage and tumor cell pervasion during operation.
- Citation: Chen W, Li JP, Yang JY, Zhuang WQ, Liu TB, Li GS. Transcatheter arterial chemoembolization in treatment of hepatoblastoma in children: A report of 15 cases. Shijie Huaren Xiaohua Zazhi 2004; 12(10): 2360-2363
- URL: https://www.wjgnet.com/1009-3079/full/v12/i10/2360.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i10.2360
肝母细胞瘤是小儿肝脏最常见的恶性肿瘤, 因难以完全切除而预后不良. 术前放疗、全身化疗可使肝母细胞瘤病灶局限, 为手术创造条件, 但其效果欠佳且毒副作用较大, 而且仍有部分不能通过手术切除[1-5]. 我们自1997年开始对常规不能切除的15例肝母细胞瘤行经动脉化疗栓塞, 探讨患儿在较小毒副作用和并发症下获得Ⅱ期外科手术切除的可行性, 并观察分析患儿TACE后临床变化、手术情况和远期疗效.
我院1997-2003年收治的肝母细胞瘤15例, 男12例, 女3例, 年龄50 d-2岁9月; 患儿均有腹部肿块, 影像学提示肝内巨大占位病变, AFP值异常升高(表1).
| No | 年龄 | 性别 | 肿瘤大小(L×D, cm) | AFP值(mg/L) | 肿瘤缩小(%) | AFP降低(%) | 肿瘤坏死(%) | ||
| TACE前 | TACE后 | TACE前 | TACE后 | ||||||
| 1 | 2年9 mo | M | 18.6×14.4 | 9.2×9.8 | 3863 208 | 1725 300 | 78% | 55% | 90% |
| 2 | 5 mo | M | 13.0×12.0 | 10.9×7.6 | 1577 690 | 179 566 | 66% | 89% | 69% |
| 3 | 7 mo | F | 10.6×7.1 | 6.3×4.9 | 1 927 | 383 | 72% | 80% | 78% |
| 4 | 50 d | M | 7.0×6.0 | 5.0×6.0 | 839 | 372 | 41% | 56% | 58% |
| 5 | 1年11 mo | M | 8.0×7.3 | 7.0×5.2 | 156 000 | 84 000 | 56% | 46% | 39% |
| 6 | 6 mo | F | 9.0×7.0 | 7.0×5,5 | 301 000 | 153 000 | 52% | 50% | 41% |
| 7 | 2年6 mo | M | 10.5×6.7 | 8.0×6.3 | 34 200 | 4 000 | 51% | 89% | 81% |
| 8 | 1年7 mo | M | 16.0×12.0 | 7.5×6.0 | 24 358 | 17 400 | 82% | 29% | 18% |
| 9 | 1年 | M | 9.0×6.0 | 6.5×4.0 | 43 442 | 12 599 | 68% | 71% | 87% |
| 10 | 2年 5 mo | M | 12.8×7.4 | 11×7.2 | 329 030 | 201 465 | 19% | 39% | 56% |
| 11 | 2年6 mo | M | 12.0×9.0 | 9.0×8.0 | 348 | 210 | 41% | 40% | 29% |
| 12 | 8 mo | M | 13.0×9.5 | 8.8×6.5 | 66 976 | 32 340 | 79% | 52% | 74% |
| 13 | 1年7 mo | M | 10.5×9.5 | 9.0×7.0 | 391 478 | 196 392 | 53% | 50% | 79% |
| 14 | 1年5 mo | F | 8.5×7.2 | 6.0×4.8 | 78 320 | 19 580 | 69% | 75% | 83% |
| 15 | 2年3 mo | M | 11.5×8.5 | 9.5×6.5 | 107 923 | 64 754 | 52% | 40% | 65% |
| 平均 | 配对t检验, | 配对t检验, | |||||||
| 17.7 mo | t = 3.171 | P <0.01 | t = 1.784 | P = 0.09 | 58.6% | 57.38% | 63.13% | ||
氯胺酮基础麻醉后, 心电监护下, 采用Sel-dinger技术, 使用小儿穿刺套针(CooK公司)经皮穿刺股动脉, 引入4F Cobra导管, 先做患儿肝动脉造影, 了解肿瘤血供情况, 再作选择或超选择性插管, 停留导管在肿瘤供血动脉内化疗灌注加栓塞. 化疗常用药物为顺铂、阿霉素、长春新碱、5-Fu二联或三联经导管注入; 栓塞剂采用明胶海绵颗粒、超液化碘油. 其中2次介入者3例, 其余1次, 介入治疗后4-9 wk行Ⅱ期外科切除术. 从CT横断扫描的肿瘤中心层面测量肿瘤径线, 利用公式 体积(V)=高度(L)×横径(D)2×1/2计算肿瘤体积. 肿瘤缩小率≥50%为显效; 25-50%为有效; 缩小或增大≤25%为稳定; 增大≥25%者为恶化. 手术中观察肿瘤包膜、血管形态与周围组织的关系、出血量, 并按改良Shamberge标准评价手术结果, 即完全切除: 无肉眼肿瘤残留; 部分切除: 残留肿瘤≤20%; 未切除: 残留肿瘤≥50%. 观察TACE后患者症状的变化、反应、血AFP值的变化及随访疗效. TACE前后肿瘤体积及AFP值的变化采用配对t 检验作统计学分析.
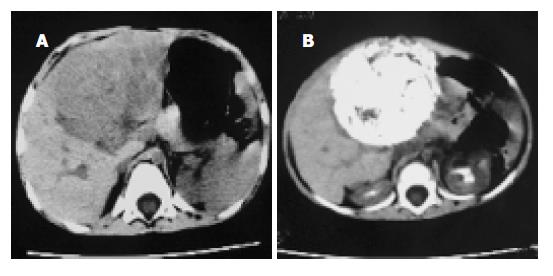
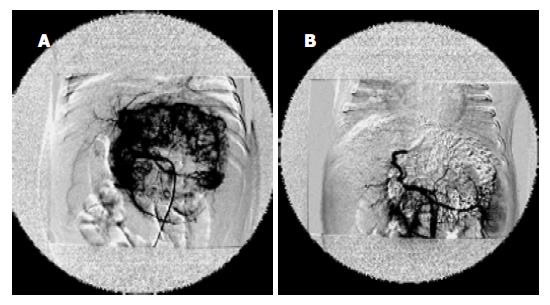
TACE后1 mo复查CT, 肿瘤体积缩小29-82%, 平均58.6%, 显效率80%(12例), 有效率13.3%(2例), 稳定1例(图1-3); AFP水平降低29-89%, 平均为57.4%; TACE 4-9 wk内15例患儿安全地施行Ⅱ期外科手术, 术中见肿瘤包膜形成及增厚, 较易剥离, 完整切除率达80%(12/15), 部分切除率为20%(3/15), 切除标本的病理改变肿瘤明显坏死, 平均坏死区面积达63.13%. TACE前后肿瘤体积的改变有显著性差异(配对t检验, P <0.01), 血AFP改变则无显著性差异(P = 0.09)(表1).
15例全部出现发热, 为37.5-39.5 ℃, 持续2-3 d. 恶心、呕吐、胃纳减低14例, 经对症治疗后3-5 d恢复. 口腔溃疡1例, 腹泻2例, 均短期好转. 脱发2例, 未见穿刺点血肿或过敏反应.
随访3 mo-3年, 平均30 mo. 2例患儿分别于2 mo后肺转移和3年后肺、脑转移死亡, 1例手术切除1年后再行肝移植后死亡, 6例无瘤存活, 其余死于复发引起的脏器功能衰竭. 1年生存率为93.3%(14/15), 2年生存率为96.6%(10/15), 3年生存率为40%(6/15).
肝母细胞瘤发病率占小儿原发肝脏恶性肿瘤的首位(51-56%), 约占儿童腹部肿瘤的9%[6], 而且还有上升的表现[7-8], 手术完整切除肿瘤是本病最主要的治疗方法, 其预后取决于能否施行完整的手术切除, 然而该病大多数由于肝内广泛侵犯而不能切除[9-12]. 在使用有效的术前化疗之前, 临床对巨大肿瘤常使用广泛切除术, 导致严重的致死率和致病率, 首诊后肿瘤的完整切除率也只在50%左右. 术前放化疗疗效较好, 各种化疗方案因此被采用来缩小瘤体和提高切除率、控制微小的残余灶和转移灶[13-15].然而全身化疗的效果不好、毒副作用很大甚至导致患儿早亡[16-20], 曾有报道运用动脉灌注抗癌药物治疗难以切除的成人肝肿瘤, 进而应用经动脉化疗栓塞及其他综合治疗[21-27]. 从1997年开始我们将Seldinger技术和选择性动脉内化疗栓塞技术运用于小儿肝母细胞瘤的治疗[28]. 本组结果显示TACE能有效地抑制肿瘤的迅速生长, 缓解临床症状, 被栓塞的肝动脉僵硬, 呈条索状易于分离, 瘤体表面血管大都萎陷, 呈缺血性坏死外观, 切除手术时出血少, 视野清晰, 操作方便, 动脉的堵塞和静脉的萎陷有效地减少了术中因挤压瘤体导致肿瘤血行转移的机会. 术时瘤体包膜多完整, 易于剥离, 破裂者少. 切除瘤体的切面上显示肿瘤组织广泛的坏死区, 而邻近的正常肝组织未受累及. 介入治疗后出现短暂发热, 与肿瘤坏死有关; 本组没有因化疗毒副作用如骨髓抑制、脱发、呕吐、腹泻而引起的手术延迟. 与同期我院全身化疗患者相比, 介入治疗疗程短、毒副作用发生率低、程度轻, 没有严重并发症. 本组栓塞化疗后肿瘤组织坏死纤维化平均达64.8%以上, 与文献[29-31]报道相似. 而且碘油在平扫CT上易于观察, 能发现其他的影像学检查所不能发现的肝内微小转移灶.
本组死亡率和复发率仍较高, 我们考虑: (1)肝脏4叶8段本为一整体, 各部分之间关系紧密, 影响甚大, 1例在二次介入治疗后行肝右叶切除, 残余肝左叶随访时无肿瘤复发, 但死于慢性肝功能衰竭. 去除手术原因, 考虑多次介入治疗对左叶影响较大, 因此经动脉化疗栓塞时应尽可能超选择, 加强对肿瘤的打击而减少对残肝的损害. 介入治疗前也应严格掌握适应证, 全面考虑肿瘤的大小, 位置、数目、血供、病理分型、临床分期, 如门脉通畅可尽量超选栓塞肝动脉, 若有门脉癌栓应采用单纯肝动脉化疗灌注, 必要时辅以适量栓塞. (2)肝母细胞瘤介入治疗常难以达到肿瘤完全坏死的程度, 残存肿瘤细胞可能在手术时因分离和挤压、部分脱落血中, 引起术后远处转移, 值得注意的是TACE术对原发灶有效, 但对远处转移灶影响甚微, 本组有2例患儿死于广泛的远处转移, 这些转移可能在术前化疗其间已经存在, 为了防止微小转移灶的生长可以考虑结合全身化疗. (3)介入治疗与外科切除术的间隔时间应谨慎掌握, 时间过短肝包膜水肿明显, 解剖结构间隙粘连不清, 这些因素都增加了手术难度, 影响预后, 过长肿瘤又重新增大, 一般以TACE后2 wk左右较宜. (4)所谓"不能切除"常常是个相对概念[5,10], 很大程度与术者的经验有关, 但最客观的评价方式是剖腹探查, 1例介入治疗后1 wk复查肿瘤明显缩小, AFP降低, 但6 wk后肿瘤又增大, 几乎恢复到初诊时的体积, 再次介入治疗后数天, 仍成功行外科手术切除, 患儿恢复良好已存活1年, 不应放弃积极手术的机会. 另外, 对肝母细胞瘤不同病理分型与药代动力学的关系, 以及在动脉内用药的剂量和时间、速率等仍待进一步探讨.
介入治疗的方法与目前广泛应用的成人肝癌相同, 由于小儿血管细小, 介入器械和程序应更精细, 对操作者有更高的要求, 加上患儿大多体质较弱, 手术风险较大以及社会和经济原因使得这项技术的普及受到一定影响. 我们认为, 对不能Ⅰ期外科切除的肝母细胞瘤, TACE能创造Ⅱ期手术切除肿瘤的机会, 改善预后, 提高生存质量, 而且能对防止术中肿瘤细胞的扩散起到一定的作用, 是一种较简便、安全、有效、实用的治疗方法.
| 1. | Cillo U, Ciarleglio FA, Bassanello M, Brolese A, Vitale A, Boccagni P, Zanus G, Zancan L, D'Antiga L, Dall'igna P. Liver transplantation for the management of hepatoblastoma. Transplant Proc. 2003;35:2983-2985. [PubMed] [DOI] |
| 2. | Urata H, Hori H, Uchida K, Inoue M, Komada Y, Kusunoki M. Strategy for the treatment of unresectable hepatoblastoma: neoadjuvant chemotherapy followed by delayed primary operation or liver transplantation. Int Surg. 2004;89:95-99. [PubMed] |
| 3. | Perilongo G, Shafford E, Maibach R, Aronson D, Brugières L, Brock P, Childs M, Czauderna P, MacKinlay G, Otte JB. Risk-adapted treatment for childhood hepatoblastoma. final report of the second study of the International Society of Paediatric Oncology--SIOPEL 2. Eur J Cancer. 2004;40:411-421. [PubMed] [DOI] |
| 4. | Blouin P, Brugières L, Tabone MD, Leverger G, Rubie H, Branchereau S, De Kraker J. Carboplatin-epirubicin regimen for the treatment of hepatoblastoma. Pediatr Blood Cancer. 2004;42:149-154. [PubMed] [DOI] |
| 5. | Otte JB, Pritchard J, Aronson DC, Brown J, Czauderna P, Maibach R, Perilongo G, Shafford E, Plaschkes J; International Society of Pediatric Oncology (SIOP). Liver transplantation for hepatoblastoma: results from the International Society of Pediatric Oncology (SIOP) study SIOPEL-1 and review of the world experience. Pediatr Blood Cancer. 2004;42:74-83. [PubMed] [DOI] |
| 6. | Hanif G. Intra-abdominal tumors in children. J Coll Physicians Surg Pak. 2004;14:478-480. [PubMed] |
| 7. | Reynolds P, Urayama KY, Von Behren J, Feusner J. Birth characteristics and hepatoblastoma risk in young children. Cancer. 2004;100:1070-1076. [PubMed] [DOI] |
| 8. | von Schweinitz D. Neonatal liver tumours. Semin Neonatol. 2003;8:403-410. [PubMed] [DOI] |
| 9. | Towu E, Kiely E, Pierro A, Spitz L. Outcome and complications after resection of hepatoblastoma. J Pediatr Surg. 2004;39:199-202; discussion 199-202. [PubMed] [DOI] |
| 10. | Dicken BJ, Bigam DL, Lees GM. Association between surgical margins and long-term outcome in advanced hepatoblastoma. J Pediatr Surg. 2004;39:721-725. [PubMed] [DOI] |
| 11. | Abbasoğlu L, Gün F, Tansu Salman F, Relik A, Saraq F, Unüvar A, Görgün O, Aksöyek S. Hepatoblastoma in children. Acta Chir Belg. 2004;104:318-321. [PubMed] [DOI] |
| 12. | Hadley GP, Govender D, Landers G. Primary tumours of the liver in children: an African perspective. Pediatr Surg Int. 2004;20:314-318. [PubMed] [DOI] |
| 13. | Suita S, Tajiri T, Takamatsu H, Mizote H, Nagasaki A, Inomata Y, Hara T, Okamura J, Miyazaki S, Kawakami K. Improved survival outcome for hepatoblastoma based on an optimal chemotherapeutic regimen--a report from the study group for pediatric solid malignant tumors in the Kyushu area. J Pediatr Surg. 2004;39:195-8; discussion 195-8. [PubMed] [DOI] |
| 14. | Begemann M, Trippett TM, Lis E, Antunes NL. Brain metastases in hepatoblastoma. Pediatr Neurol. 2004;30:295-297. [PubMed] [DOI] |
| 15. | Tsai HL, Liu CS, Chin TW, Wei CF. Hepatoblastoma and hepatocellular carcinoma in children. J Chin Med Assoc. 2004;67:83-88. [PubMed] |
| 16. | Iida T, Suenaga M, Takeuchi Y, Kobayashi T, Tobinaga J, Miwa T, Takenaka H, Nomura H, Hasegawa S, Oguma K. Successful resection of a ruptured hepatoblastoma prior to chemotherapy: report of a case. Surg Today. 2004;34:710-714. [PubMed] [DOI] |
| 17. | Choudhury SR, Singh D. Advanced hepatoblastoma: successful liver resection following preoperative chemotherapy. Trop Gastroenterol. 2004;25:32-33. [PubMed] |
| 18. | Davies JQ, de la Hall PM, Kaschula RO, Sinclair-Smith CC, Hartley P, Rode H, Millar AJ. Hepatoblastoma--evolution of management and outcome and significance of histology of the resected tumor. A 31-year experience with 40 cases. J Pediatr Surg. 2004;39:1321-1327. [PubMed] [DOI] |
| 19. | Cacciavillano WD, Brugières L, Childs M, Shafford E, Brock P, Pritchard J, Mailbach R, Scopinaro M, Perilongo G. Phase II study of high-dose cyclophosphamide in relapsing and/or resistant hepatoblastoma in children: a study from the SIOPEL group. Eur J Cancer. 2004;40:2274-2279. [PubMed] [DOI] |
| 20. | Bertolini P, Lassalle M, Mercier G, Raquin MA, Izzi G, Corradini N, Hartmann O. Platinum compound-related ototoxicity in children: long-term follow-up reveals continuous worsening of hearing loss. J Pediatr Hematol Oncol. 2004;26:649-655. [PubMed] [DOI] |
| 23. | 申 宝忠, 刘 岩, 李 任飞, 杨 光, 于 友涛, 董 宝玮, 梁 萍. 经动脉化疗栓塞结合经皮微波凝固治疗肝癌的实验和临床研究. 世界华人消化杂志. 2003;11:268-271. [DOI] |
| 24. | 冯 勇, 赵 玲, 张 爱华, 刘 康达, 刘 来村, 王 彦辉, 尹 进强, 杨 秉辉. 肝细胞癌肝动脉化疗栓塞后PCNA和nm23-H1/NDPK的研究. 世界华人消化杂志. 2003;11:912-915. [DOI] |
| 29. | Xianliang H, Jianhong L, Xuewu J, Zhongxian C. Cure of hepatoblastoma with transcatheter arterial chemoembolization. J Pediatr Hematol Oncol. 2004;26:60-63. [PubMed] [DOI] |
| 30. | Ohtsuka Y, Matsunaga T, Yoshida H, Kouchi K, Okada T, Ohnuma N. Optimal strategy of preoperative transcatheter arterial chemoembolization for hepatoblastoma. Surg Today. 2004;34:127-133. [PubMed] [DOI] |
| 31. | Li L, Chen Y, Li YH, Zeng QL, He XF. [Trancatheter arterial chemoembolization in the treatment of hepatoblastoma]. Zhonghua Gan Zang Bing Za Zhi. 2004;12:171-172. [PubMed] |