修回日期: 2003-05-25
接受日期: 2003-06-04
在线出版日期: 2004-01-15
目的: 探讨反义VEGF寡核苷酸(antisense oligodeoxynucleotides, ASODN)转染Walker-256瘤细胞及其与碘油混合后肝动脉注入转染鼠肝癌及在鼠肝、肺、肾组织的分布情况.
方法: 将异硫氰酸荧光素(5'-FITC)标记的VEGF ASODN加入培养的Walker-256瘤细胞培养液中, 不同时间用荧光显微镜观察细胞内ASODN的分布. 12只Walker-256移植性大鼠肝癌模型, 一组肝动脉内注入荧光标记的VEGF ASODN(TAI组, n = 6), 另一组肝动脉内注入荧光标记的VEGF ASODN与超液态碘油的混合液(混合组, n = 6), 两组分别于术后1 d、3 d、6 d取动物的肝、肺、肾组织行冰冻切片, 荧光显微镜观察各组织内ASODN的分布情况.
结果: 荧光标记的ASODN与Walker-256瘤细胞共同培养后2 h时可见瘤细胞胞质内有点状荧光染色, 6 h胞核内有荧光染色, 12 h荧光染色最强, 胞核及胞质中均可见荧光染色, 24 h荧光物质减少, 48 h完全消失. 1 d和3 d时混合组肝癌组织及肝组织内荧光染色强于TAI组, 而肺、肾组织荧光染色弱于TAI组; 6 d时TAI组肝、肺、肾组织内荧光染色基本消失, 而混合组肝、肺、肾组织仍有少许荧光染色. ASODN可以进入肝癌细胞及瘤周肝细胞.
结论: VEGF ASODN可以转染Walker-256细胞, 其与碘油混合后可以延长ASODN在肝内的停留时间, 增加对肝癌组织的转染率, 减少其在肝外组织的分布. 与碘油混合后肝动脉注入是VEGF ASODN反义基因治疗肝癌的理想给药方法.
引文著录: 吴汉平, 冯敢生, 田元. 反义VEGF寡核苷酸与碘油混合肝动脉注入转染鼠肝癌的可行性. 世界华人消化杂志 2004; 12(1): 23-26
Revised: May 25, 2003
Accepted: June 4, 2003
Published online: January 15, 2004
AIM: To study the distribution and stability of VEGF ASODN in Walker-256 cells and to explore the distribution of VEGF ASODN in rat's liver, lung and kidney after mixed with lipiodol for hepatic artery infusion.
METHODS: The 5-FITC labeled VEGF ASODN was given into Walker-256 cell culture media. The cellular distribution was observed by fluorescent microscope. Walker-256 carcinosarcoma was transplanted into Wistar rat liver to establish the liver cancer model. 5'-FITC labeled VEGF ASODN mixed with (mixed group, n = 6) or without (TAI group, n = 6) ultra-fluide lipiodol was administrated via hepatic artery. The frozen samples of rats' liver, lung and kidney tissues were collected at 1, 3, and 6d after ASODN administration. The distribution of ASODN was determined under fluorescent microscope.
RESULTS: ASODN could enter the cytoplasm within 2 h and enter the nuclei within 4 h. Accumulation of the ASODN reached the high point in the nuclei at 6h. After that, they began to disappear. No fluorescence could be seen in cells at 48 h. At 1d and 3d, the fluorescence stained stronger in the liver in the mixed group than that in TAI group. More fluorescence could be detected in lung and kidney in TAI group than that in the mixed group. At 6 d, no fluorescence could be detected in TAI group tissues, but a little florescence could be seen in the mixed group tissues. ASODN could be seen in cancer cells and normal hepatic cells.
CONCLUSION: VEGF ASODN can transfect Walker-256 cells. VEGF ASODN stays longer in the liver, is transfected more into hepatic and cancerous cells and distributes less in other tissue when mixed with lipiodol. VEGF ASODN mixed with lipiodol via hepatic artery is an ideal way treating liver carcinoma.
- Citation: Wu HP, Feng GS, Tian Y. Feasibility of VEGF ASODN mixed with lipiodol transfecting liver cancer via hepatic artery infusion in rats. Shijie Huaren Xiaohua Zazhi 2004; 12(1): 23-26
- URL: https://www.wjgnet.com/1009-3079/full/v12/i1/23.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i1.23
抗血管生成是肿瘤治疗的热点, 血管内皮生长因子(vascular endothelial growth factor, VEGF) 是目前公认主要促进血管形成的因子之一[1-9], 针对VEGF的反义基因治疗可以抑制肿瘤血管生成[10-14]. 反义寡核苷酸(antisense oligodeoxynucleotides, ASODN)由于合成简便, 序列可依据不同的靶基因序列的要求进行变换, 具有较大的适应性, 是反义基因治疗中最为方便的一种方法[15-18]. 实验表明VEGF ASODN可以抑制肿瘤细胞VEGF的表达[19-24], 但ASODN的临床应用大多是全身给药, 靶向性差、转染率低、治疗效果差. 器官的靶向性给药是介入治疗的优势之一, 能否采用介入的方法来提高ASODN在活体反义治疗中的疗效, 目前尚未见报道, 特设计以下实验.
Walker-256瘤细胞株购自武汉大学中国典型物保藏中心; 荧光标记的VEGF ASODN(序列为: 5'-GCAGTAGCTGCGCTGATAGCGC-3', 全长硫代修饰, 5'端FITC荧光素标记)由上海生工生物公司合成; ♂Wistar大鼠由华中科技大学同济医学院实验动物部提供; 荧光显微镜(日本Olympus公司); 超液态碘油(法国Guerbet公司).
1.2.1 体外实验: 取接种Walker-256瘤细胞3-5 d后Wistar大鼠癌性腹水0.2 mL接种于含50 mL/L小牛血清RPMI 1640培养液培养瓶内, 置37 ℃、饱和湿度、50 mL/L CO2的培养箱中培养, 每2 d传代1次. 取第3代培养的Walker-256瘤细胞, 接种在24孔板上, 每孔100 L, 含细胞总数为1103个, 加入荧光密度为10 kA/L ASODN 20 L, 置37 ℃、饱和湿度、50 mL/L CO2的培养箱中培养. 分别在荧光ASODN加入后2 h, 6 h, 12 h, 24 h, 36 h和48 h收集细胞, 用无血清的培养液冲洗3次, 最后将洗涤后的细胞滴在玻片上, 盖上盖玻片, 置于荧光显微镜下观察.
1.2.2 体内实验: 取接种Walker-256瘤细胞3-5 d后Wistar大鼠癌性腹水0.5-1 mL, 无菌条件下注射至健康大鼠皮下, 7-10 d可以长出直径约1-2 cm肿瘤, 切取新鲜鱼肉样瘤组织剪成1 mm3组织块. 预接种大鼠用1 g/L戊巴比妥钠30 mg/kg腹腔麻醉后, 剑突下正中小切口切开腹腔, 挑出肝左外叶, 用眼科镊在肝实质内刺一小隧道, 将1 mm3瘤组织块种植到隧道内, 并用明胶海绵小块填塞隧道口部. 将肝左外叶送回腹腔, 关腹. 饲养1 wk后即可长出直径为0.5-1 cm的肝左叶肿瘤. 荷瘤大鼠随机分为2组, 每组6只. TAI组: 肝动脉内缓慢注入荧光ASODN 1A (生理盐水稀释至0.2 mL), 注药同时阻断肝动脉20 min; 混合组: 荧光ASODN 1A与超液态碘油0.2 mL混合后肝动脉注入, VEGF ASODN分子质量为6 766 u, 1A质量为165 g. 荷瘤大鼠于接种后10 d, 腹腔麻醉后, 仰卧固定于实验台上. 上腹部消毒铺巾后, 行正中切口打开腹腔, 暴露肝门及肝十二指肠韧带. 在手术显微镜下游离出肝总动脉、胃十二指肠动脉、肝右动脉, 用丝线打活结法暂时阻断腹腔动脉, 结扎胃十二指肠动脉远段, 用显微剪在结扎处的近肝端剪一小口, 将PE-50管逆行插入胃十二指肠动脉近端, 并结扎固定导管, 再暂时阻断肝右动脉, 经PE-50管注入实验药物. 实验完后拔出PE-50管, 结扎胃十二指肠动脉近端, 松开肝总动脉及肝右动脉, 逐层缝合、消毒、分笼饲养. 于术后1 d, 3 d, 6 d每组各处死2只动物, 取肝左叶肿瘤组织及瘤周肝组织、肺、肾组织, -70 ℃保存. 上述组织行5 m厚冰冻切片, 在荧光显微镜下观察荧光ASODN分布情况.
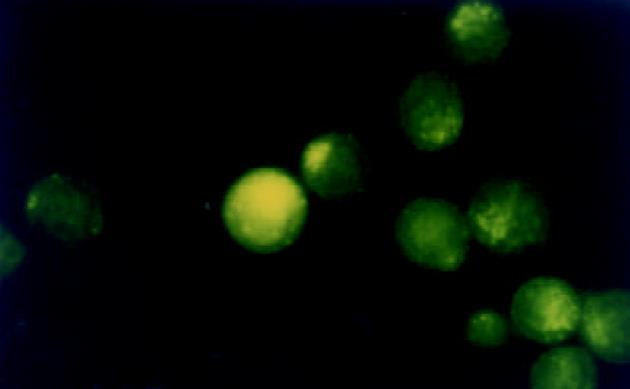
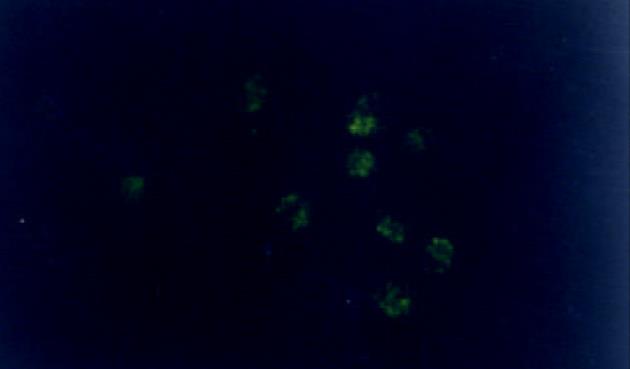
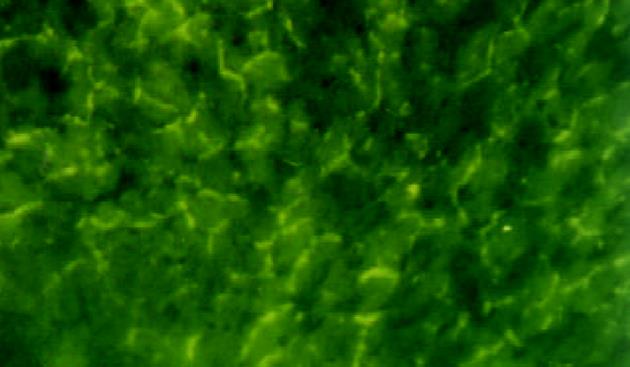
Walker-256瘤细胞呈悬浮方式生长, 圆形. 荧光标记的ASODN在荧光显微镜下显示为黄绿色. 荧光ASODN与Walker-256瘤细胞作用后2 h胞体中即可见清晰的点状荧光聚集, 胞核荧光聚集不明显; 6 h时胞质荧光着色加浓, 部分细胞胞核核膜周围及核内可见点状荧光; 12 h时胞质荧光着色最浓, 呈黄色颗粒状、小片状, 大部分细胞胞核内可见点状荧光着色(图1); 24 h时胞质荧光物质开始减少, 36 h细胞内荧光着色进一步减退, 呈散点状(图2), 48 h细胞内荧光完全消失.
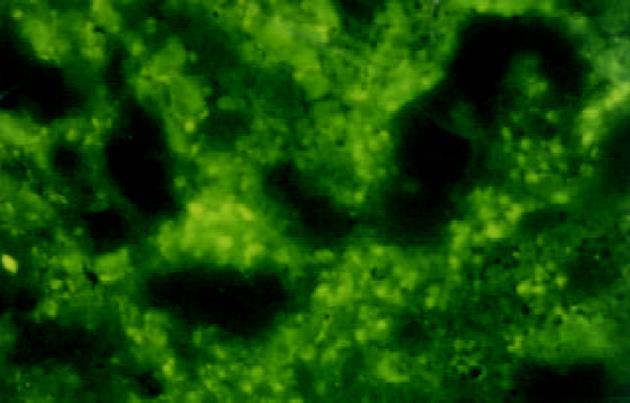
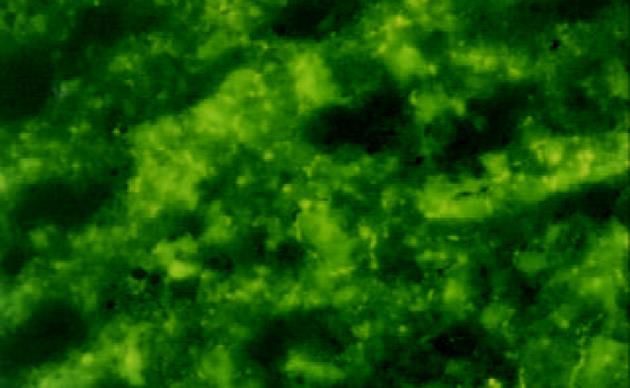
混合组术后1 d时肝脏荧光染色主要见于肿瘤区, 部分瘤周区域也可见到, 荧光染色强, 呈深黄色, 大片状, 细胞界限不清(图3); 肺、肾组织有轻度染色, 其中部分肺组织可见较强的片状荧光染色. 3 d在肝脏肿瘤区及瘤周区域可见较多的荧光染色, 染色强度减弱, 呈星芒状分布, 主要位于肿瘤区域, 大多数的癌细胞内有点状黄色荧光; 肺、肾组织仅有弱染色. 6 d时肝组织内荧光染色减少, 呈簇状分布, 部分癌细胞及肝细胞内可见荧光物质(图4); 肺、肾组织仍可见较弱的荧光染色.
TAI组术后1 d时肝脏肿瘤及瘤周区内肿瘤细胞及肝细胞见浅黄色的荧光染色, 簇状分布(图5); 肺、肾组织有较强的染色. 3 d在肝细胞及癌细胞仅见散在的荧光染色(图6), 肺、肾组织仅有弱染色. 6 d时肝内几乎无荧光染色, 肺、肾组织无染色.
ASODN在基因治疗实验中有较好的疗效, 但价格昂贵, 有毒性作用, 对靶器官及组织的转染效率较低, 增加转染效率有多种方法, 如用阳离子脂质体包裹、肿瘤局部注射等. 经导管动脉内灌注(TAI)化疗和碘油与化疗药混合动脉栓塞已成为治疗中晚期实体肿瘤的重要方法. 与全身给药相比, TAI可使药物直接进入靶器官而不受血流量的影响, 这样使局部药物浓度显著增加, 减少剂量及全身副作用. 采用TAI方法可以增加外源治疗基因在靶组织内的浓度及持续的时间, 提高基因转染率. 郝强et al 研究肝动脉注入重组腺病毒介导的标记基因(LacZ), 结果发现LacZ基因在肝脏表达有器官特异性, 并可以持续21 d以上. 碘油经肝动脉注入后可以选择性在肝癌组织中存积数月甚至1年以上, 碘油与化疗药混合后行肝癌的栓塞可以使化疗药在肿瘤局部缓慢释放, 长期发挥作用. 鉴于碘油在肝癌介入栓塞治疗中的特殊作用, 将外源基因与碘油混合肝动脉注入能否进一步增加其对肝癌的转染效果, 目前国内外尚未见类似的报道.
我们采用的肝癌模型为富血管性肿瘤, 碘油肝动脉灌注后主要积聚在肿瘤组织. 肝动脉注入ASODN与碘油混合物后, ASODN在肝脏中的分布以肿瘤区为主, 可以进入肝细胞及癌细胞内, 且可以维持达5 d以上; 而肝动脉单纯灌注时, ASODN在肝脏的肿瘤区及非肿瘤区分布差不多, 分布的范围及感染的细胞数目明显少于混合组, 且仅在肝脏维持3 d左右. 就ASODN在肺、肾组织的分布而言, 两组均在第1 d染色最强, 但混合组弱于TAI组, 第3天肺、肾组织ASODN均较少, 第5 d时TAI组几乎没有荧光染色, 而混合组还有少量的荧光染色. 这可以得出以下结论: (1)ASODN对肝细胞和肿瘤细胞的转染没有选择性; (2)碘油可以携带ASODN进入肿瘤区域内; (3)与单纯肝动脉注入相比, ASODN与碘油混合后肝动脉注入可以在肿瘤内缓慢释放, 延长与肿瘤细胞作用时间, 增加转染率, 减少肝外组织的分布. 我们发现荧光ASODN在肝细胞及瘤细胞中为点状黄色颗粒, 但混合组第1 d荧光染色呈片状, 细胞界限分辨不清, 这可能是因为ASODN与碘油混合后致使ASODN大量停留在肿瘤局部, 某些尚在血窦内, 未从碘油中分离出来, 加之冰冻切片较厚, 荧光显微镜下主要显示荧光物质, 细胞及组织结构显示相对较差, 致使难以看清细胞结构. 混合组第1 d部分肺组织中可见到较强的片状荧光染色, 这可能和少量碘油与ASODN混合物进入肺组织沉积所致. 一般而言, VEGF主要在肿瘤组织内高表达, 在正常肝、肺、肾组织表达较少, 由于设计的VEGF ASODN对VEGF具有高度的特异性, 因此注入的ASODN对非肿瘤组织的作用较小.
ASODN与碘油混合后肝动脉注入ASODN进入肿瘤细胞的机制并不十分清楚, 我们推测其可能的机制为: (1)ASODN分子量较小, 渗透力强, 细胞可以主动摄取; (2)肿瘤血管发育不成熟, 缺乏弹力层和肌层, 内皮细胞间隙较大等为ASODN进入肿瘤细胞外间隙提供了条件; (3)有研究表明碘油肝动脉栓塞后病理检查发现在肝癌细胞胞质及部分胞核内可以有碘油存在, 推测肝癌细胞可以主动摄取碘油, ASODN可伴随碘油进入癌细胞内.
总之, 我们认为碘油可以作为ASODN的一种载体, 使其主要集中在肿瘤组织内, 缓慢释放, 同时可以减少在肝外组织中的分布, 达到增加基因转染效率, 减少全身副作用的目的, 明显优于单纯肝动脉灌注.
编辑: N/A
| 1. | Du JR, Jiang Y, Zhang YM, Fu H. Vascular endothelial growth factor and microvascular density in esophageal and gastric carcinomas. World J Gastroenterol. 2003;9:1604-1606. [PubMed] [DOI] |
| 2. | Zheng S, Han MY, Xiao ZX, Peng JP, Dong Q. Clinical significance of vascular endothelial growth factor expression and neovascularization in colorectal carcinoma. World J Gastroenterol. 2003;9:1227-1230. [PubMed] [DOI] |
| 3. | Shi H, Xu JM, Hu NZ, Xie HJ. Prognostic significance of expression of cyclooxygenase-2 and vascular endothelial growth factor in human gastric carcinoma. World J Gastroenterol. 2003;9:1421-1426. [PubMed] [DOI] |
| 4. | Xue JT, Wu J, Meng L, Dong ZW, Shou CC. Expression of VEGF(121) in gastric carcinoma MGC803 cell line. World J Gastroenterol. 2000;6:281-283. [PubMed] |
| 5. | Giavazzi R, Sennino B, Coltrini D, Garofalo A, Dossi R, Ronca R, Tosatti MP, Presta M. Distinct role of fibroblast growth factor-2 and vascular endothelial growth factor on tumor growth and angiogenesis. Am J Pathol. 2003;162:1913-1926. [PubMed] [DOI] |
| 6. | Ferrara N. Role of vascular endothelial growth factor in physiologic and pathologic angiogenesis: therapeutic implications. Semin Oncol. 2002;29:10-14. [PubMed] [DOI] |
| 7. | Ziemer LS, Koch CJ, Maity A, Magarelli DP, Horan AM, Evans SM. Hypoxia and VEGF mRNA expression in human tumors. Neoplasia. 2001;3:500-508. [PubMed] [DOI] |
| 8. | Salgado R, Benoy I, Bogers J, Weytjens R, Vermeulen P, Dirix L, Van Marck E. Platelets and vascular endothelial growth factor (VEGF): a morphological and functional study. Angiogenesis. 2001;4:37-43. [PubMed] [DOI] |
| 9. | Cascinu S, Graziano F, Catalano V, Staccioli MP, Barni S, Giordani P, Rossi MC, Baldelli AM, Muretto P, Valenti A. Differences of vascular endothelial growth factor (VEGF) expression between liver and abdominal metastases from colon cancer. Implications for the treatment with VEGF inhibitors. Clin Exp Metastasis. 2000;18:651-655. [PubMed] [DOI] |
| 10. | Riedel F, Gotte K, Li M, Hormann K, Grandis JR. Abrogation of VEGF expression in human head and neck squamous cell carcinoma decreases angiogenic activity in vitro and in vivo. Int J Oncol. 2003;23:577-583. [PubMed] [DOI] |
| 11. | Gu ZP, Wang YJ, Li JG, Zhou YA. VEGF165 antisense RNA suppresses oncogenic properties of human esophageal squamous cell carcinoma. World J Gastroenterol. 2002;8:44-48. [PubMed] [DOI] |
| 12. | Im SA, Kim JS, Gomez-Manzano C, Fueyo J, Liu TJ, Cho MS, Seong CM, Lee SN, Hong YK, Yung WK. Inhibition of breast cancer growth in vivo by antiangiogenesis gene therapy with adenovirus-mediated antisense-VEGF. Br J Cancer. 2001;84:1252-1257. [PubMed] [DOI] |
| 13. | 刘 都户, 张 渭, 粟 永萍, 张 学庸, 黄 裕新. VEGF165正反义表达载体的构建及其对人胃癌细胞VEGF表达的调节. 世界华人消化杂志. 2001;9:886-891. [DOI] |
| 14. | Liu Q, Lu Z, Zhang W, Yan J. Construction and identification of recombinant adenovirus vector containing the hVEGF165 gene. J Tongji Med Univ. 2000;20:186-189. [PubMed] [DOI] |
| 15. | Fluiter K, ten Asbroek AL, de Wissel MB, Jakobs ME, Wissenbach M, Olsson H, Olsen O, Oerum H, Baas F. In vivo tumor growth inhibition and biodistribution studies of locked nucleic acid (LNA) antisense oligonucleotides. Nucleic Acids Res. 2003;31:953-962. [PubMed] [DOI] |
| 16. | Maksymowych WP, Blackburn WD Jr, Tami JA, Shanahan WR Jr. A randomized, placebo controlled trial of an antisense oligodeoxynucleotide to intercellular adhesion molecule-1 in the treatment of severe rheumatoid arthritis. J Rheumatol. 2002;29:447-453. [PubMed] |
| 17. | Taylor AH, al-Azzawi F, Pringle JH, Bell SC. Inhibition of endometrial carcinoma cell growth using antisense estrogen receptor oligodeoxyribonucleotides. Anticancer Res. 2002;22:3993-4003. [PubMed] |
| 18. | Ross PJ, George M, Cunningham D, DiStefano F, Andreyev HJ, Workman P, Clarke PA. Inhibition of Kirsten-ras expression in human colorectal cancer using rationally selected Kirsten-ras antisense oligonucleotides. Mol Cancer Ther. 2001;1:29-41. [PubMed] |
| 19. | Yang PY, Rui YC, Jin YX, Li TJ, Qiu Y, Zhang L, Wang JS. Antisense oligodeoxynucleotide inhibits vascular endothelial growth factor expression in U937 foam cells. Acta Pharmacol Sin. 2003;24:610-614. [PubMed] |
| 21. | Shi W, Siemann DW. Inhibition of renal cell carcinoma angiogenesis and growth by antisense oligonucleotides targeting vascular endothelial growth factor. Br J Cancer. 2002;87:119-126. [PubMed] [DOI] |