修回日期: 2002-12-28
接受日期: 2003-01-08
在线出版日期: 2003-09-15
研究机体免疫因素和肿瘤生物学行为与进展期胃癌病理之间的相关性, 比较并筛选对进展期胃癌预后有影响的指标.
获得61例行根治性切除术的进展期胃癌预后资料, 用免疫组化(SABC法)和TUNEL (原位末端标记)方法检测组织切片中胃癌细胞增生细胞核抗原标记指数(PCNA-LI)、树突状细胞(DCs, dendritic cells)浸润密度, 凋亡指数(AI, apoptosis index), 研究上述指标和病理之间的相关性并进行单因素、多因素生存分析.
PCNA-LI, DCs, AI与TNM分期、淋巴结转移、淋巴管浸润、胃癌分化有相关性. 单因素生存分析表明胃癌患者的年龄、性别、病灶的大小、肿瘤分化、是否有淋巴管癌栓、AI等与胃癌预后无关. 胃癌分期、浸润深度、淋巴结转移、PCNA-LI、DCs浸润密度是胃癌预后的影响因素(Log-rank test, P <0.05). 多参数回归生存分析表明肿瘤大小(RR=2.328), UICC (1997年)TNM分期(RR=5.251)是胃癌预后的独立影响因素(P <0.05).
UICC的胃癌TNM分期是判断胃癌预后有价值的指标. 胃癌细胞本身生物学特性和机体的免疫状态与胃癌病理有一定相关性并且参与了对胃癌预后的影响.
引文著录: 黄海力, 吴本俨, 尤纬缔, 申明识. 进展期胃癌病理和预后影响因素的关系. 世界华人消化杂志 2003; 11(9): 1297-1301
Revised: December 28, 2002
Accepted: January 8, 2003
Published online: September 15, 2003
To investigate the prognostic factors and the relationship between clinicopathologic parameters and biological properties in advanced gastric cancer.
In tumor samples from 61 primary advanced gastric cancer patients with curative resection, following parameters of sex, age, tumor size, grade of differentiation, depth of invasion, lymph node metastasis, lymphatics invasion and TNM stage were evaluated. In addition, DCs infiltration, PCNA-LI and AI were examined by TUNEL (terminal deoxynucleotidyl transferase-mediated deoxyuridine triphosphate biotin nick end labeling) or immunohistochemical methods. The prognostic impact of these parameters was analyzed by univariate and multivariate survival analysis.
PCNA-LI, AI and DCs infiltration were significantly correlated to lymph node metastasis, TNM stage and differentiation grade. Univariate Kaplan-Meier analysis showed that depth of invasion, lymph node metastasis, TNM stage, PCNA-LI and infiltration of DCs had prognostic significances for survial (Log-rank test, P <0.05), while multivariate Cox analysis indicated that only tumor size (RR=2.328) and TNM stage (RR =5.251) were independent prognostic factors for survival.
In advanced gastric cancer, UICC TNM stage and tumor size are independent prognostic factors, and infiltration of DCs and proliferation of cancer cells play a role in the prognostic outcome.
- Citation: Huang HL, Wu BY, You WD, Shen MS. Prognostic factors and pathology of advanced gastric cancer. Shijie Huaren Xiaohua Zazhi 2003; 11(9): 1297-1301
- URL: https://www.wjgnet.com/1009-3079/full/v11/i9/1297.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i9.1297
胃癌的恶性程度、病理特点、预后以及对治疗的不同反应与肿瘤的生物学特性和机体的免疫状态有关[1-3]. 肿瘤的增生、凋亡是肿瘤生物学特性的主要指标[4], 肿瘤局部浸润的树突状细胞数量和功能反映了机体抗肿瘤的免疫状况[5]. 我们随访获得了进展期胃癌根治术后患者61例生存资料, 用免疫组化和原位凋亡技术检测了手术切除组织切片中的DCs浸润和胃癌细胞的增生和凋亡, 分析他们对预后的影响.
1994/2001年在我院行根治性胃大部切除或胃全切的进展期胃癌随访获得61例患者, 术前没有经过放化疗以及免疫治疗, 影像学检查和手术探查未发现有远隔脏器转移, 手术切除标本残端以及切缘均未见有残留癌细胞. 男47例, 女14例, 年龄27-85(平均59)岁, 随访时间1994/05/03-2002/05/01(平均37 mo), 其中死亡30例. SABC 试剂盒购自武汉博士德公司, S-100兔抗牛多克隆抗体及PCNA鼠抗人单克隆抗体PC-10为北京中山公司产品.
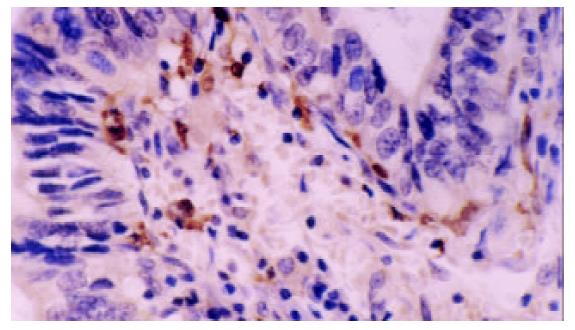
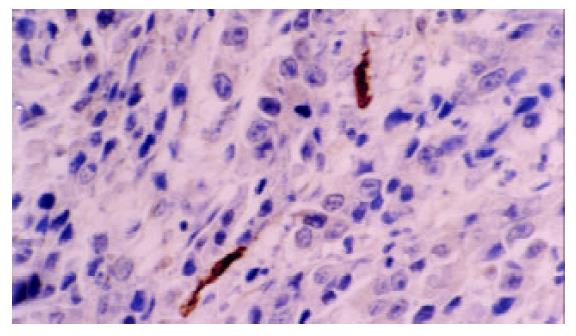
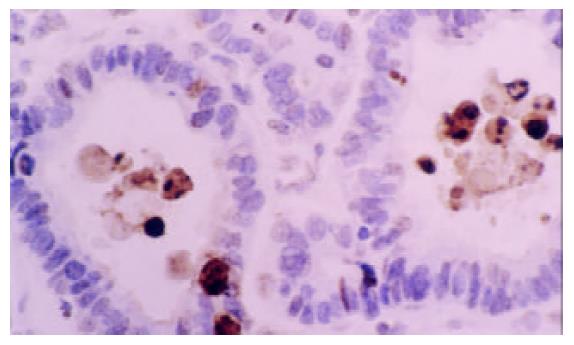
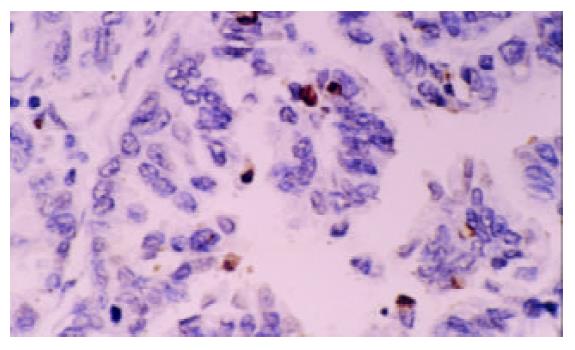
所有组织切片经过病理科医师复核确认, 不包含坏死区域, 能够反映肿瘤浸润的最深部位. 病理诊断均为胃腺癌, 肿瘤的分期和分级依据UICC (1997年)标准. 免疫组织化学采用4 mm厚的连续石蜡切片, SABC法染色按照试剂盒说明书操作, 以TBS代替一抗作为阴性对照. TUNEL法检测胃癌细胞原位凋亡采用德国(boehringer mannheim)公司TUNEL试剂盒, 按照试剂盒说明书操作. 用TBS代替TUNEL反应液作为阴性对照, 阳性对照片经DnaseI预处理30 min后按照试剂盒操作. PCNA阳性细胞细胞核染成颗粒样或片状棕黄色, 400×镜下随机观察5个能代表总体染色情况的阳性信号相对密集区域, 计数1000个癌细胞中PCNA阳性细胞所占比例, PCNA-LI=PCNA阳性细胞数/1 000×100%. DCs细胞为S-100阳性, 细胞核和细胞质均为黄染, 400×镜下随机计数5个视野中S-100阳性细胞总数/5, 用DCs数/HP表示DCs浸润密度. 细胞核呈黄色深染或者有明显凋亡形态学改变的为凋亡胃癌细胞, 400×镜下随机选择10个视野, 避开坏死区域, 计数1 000个胃癌细胞, 其中凋亡细胞所占比例即AI=凋亡细胞数/1000×100%.
统计学处理 采用SPSS 10.0统计软件包. 各组PCNA-LI, AI, DCs浸润程度用均数±标准差(mean±SD)表示, 上述指标的组间差异进行t检验和单因素方差分析(F检验);频数比较用x2检验. 单因素生存分析采用Kaplan-Meier方法, Log-rank检验生存率的显著性差异. 多因素生存分析采用Cox比例风险模型. 上述统计结果判断: P <0.05为差异有显著性.
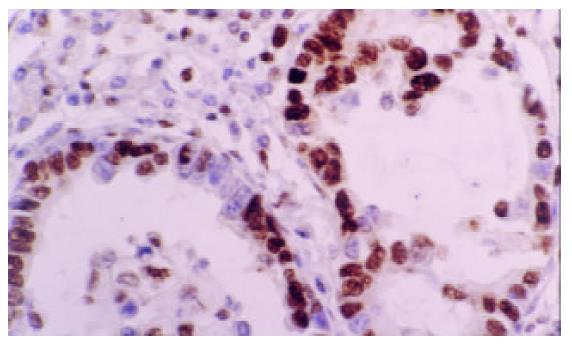
PCNA-LI平均数为52.4±13.4%, AI均数为3.3±1.4%, DCs浸润平均密度为7.2±5.4个/HP(图1-5). 进展期胃癌患者性别、年龄、肿瘤的部位、大小、浸润深度与DCs浸润, PCNA-LI, AI均无相关. 而TNM分期, 淋巴结转移, 淋巴管浸润, 胃癌分化与DCs, PCNA-LI, AI有相关性(表1). 有无淋巴结转移组DCs浸润密度分别为5.5±4.4/HP和8.51±5.57/HP, 两组差异有显著性(P =0.03); 随肿瘤分期的进展, DCs浸润有逐渐减少的趋势, I, II, III期胃癌中DCs浸润数量分别为11.2±6.1/HP, 6.3±4.4/HP和5.5± 5.2/HP, 单因素方差分析表明I期胃癌与II, III期间有统计学差异(P =0.04). 进一步以DC浸润均值7.2/HP为界分为高低DC浸润组, x2检验提示两组间I, II, III期胃癌构成比例分别为10/11/4和4/21/11, 差异有显著性(P =0.036). 有淋巴结转移组PCNA-LI为57.9±11.7%, 高于无淋巴结转移组49.6±13.5% (P =0.015), 有无淋巴管癌栓组PCNA-LI分别62.0±12.9%, 51.8±13.1%, 二者差别有统计学意义(P =0.034). II, III期胃癌PCNA-LI高于I期胃癌, 单因素方差分析显示组间差异有显著性(P =0.006). 进一步以PCNA-LI均值50%为界分为高低PCNA-LI组, 两组淋巴结转移率分别为55.6%和28.0%, x2检验差异有显著性(P =0.033). 胃癌凋亡仅与细胞分化有关, 低、中、高分化胃癌AI分别为2.2±0.7%, 3.4±1.1%, 3.5±1.3%, 单因素方差分析表明低分化胃癌AI低于中、高分化胃癌(P =0.048).
| 变量 | n | DCs/HP | PCNA-LI/% | AI/% |
| 男 | 47 | 7.1±5.5 | 51.9±13.7 | 3.3±1.2 |
| 女 | 14 | 7.6±4.9 | 57.7±11.9 | 3.4±1.3 |
| 年龄 小于60岁 | 25 | 8.7±5.8 | 50.9±12.2 | 3.5±1.2 |
| 大于或等于60岁 | 36 | 6.1±4.9 | 54.9±14.2 | 3.2±1.2 |
| 部位 贲门和胃底 | 27 | 5.7±4.4 | 52.3±14.7 | 3.2±1.2 |
| 胃体 | 10 | 6.9±5.6 | 56.5±14.6 | 3.2±0.7 |
| 胃窦或幽门 | 24 | 9.0±5.9 | 53.1±11.8 | 3.6±1.4 |
| 直径 小于5 cm | 37 | 7.4±5.5 | 53.7±14.2 | 3.3±1.1 |
| 大于或等于5 cm | 24 | 6.8±5.2 | 52.7±12.4 | 3.3±1.4 |
| 浸润 肌层 | 26 | 8.7±5.9 | 49.7±12.8 | 3.1±1.4 |
| 浆膜层 | 35 | 6.1±4.7 | 55.9±13.4 | 3.5±1.1 |
| 分化 低分化 | 34 | 6.7±4.9 | 54.8±14.2 | 2.20.7a |
| 中分化 | 21 | 8.4±5.8 | 51.9±12.9 | 3.4±1.1 |
| 高分化 | 6 | 6.2±6.8 | 49.611.3 | 3.5±1.3 |
| 淋巴结转移 无 | 34 | 8.5±5.6a | 49.6±13.5a | 3.6±1.3 |
| 有 | 27 | 5.5±4.4 | 57.9±11.7 | 2.9±1.1 |
| 淋巴管癌栓 无 | 52 | 7.7±5.5 | 51.8±13.1a | 3.4±1.2 |
| 有 | 9 | 4.3±4.1 | 62.0±12.9 | 2.9±1.1 |
| 分期 I | 14 | 11.2±6.1b | 44.1±10.6b | 3.6±1.5 |
| II | 32 | 6.3±4.4 | 54.4±13.7 | 3.1±1.2 |
| III | 15 | 5.5±5.2 | 59.4±11.2 | 3.3±0.9 |
Kaplan-Meier单因素生存分析并用Log-rank检验生存率差异, 与胃癌预后相关的因素有肿瘤TNM分期、浸润深度、淋巴结是否转移、PCNA-LI、DCs浸润密度, 各组3 a生存率与中位生存时间如 表2所示, 仅肌层浸润的胃癌预后好于浸润至浆膜层者(P =0.0145), 无淋巴结转移的胃癌预后好于有淋巴结转移者(P =0.0001), TNM分期越晚预后越差(P =0.0000), 胃癌细胞增生指数越高则预后越差(P =0.017), DCs浸润密度高者预后好于DCs浸润低者(P =0.03), 而患者的性别、年龄、肿瘤部位、分化程度、肿瘤大小、是否有淋巴管癌栓等因素与胃癌预后无关. 对胃癌临床病理、胃癌细胞增生、凋亡以及DCs浸润等多项指标进行Cox逐步回归分析. 仅有UICC TNM分期和肿瘤的大小是胃癌预后的独立影响因子. 其相对危险度均大于2, 说明随肿瘤直径的增大和肿瘤分期的进展预后越来越差(表3). 而肿瘤浸润深度, 淋巴结转移, PCNA-LI, DCs浸润密度只能作为预后影响相关因子, 而不是独立预后影响因子.
| 指标 | 回归 系数(b) | b标 准误 | x2值 | P值 | 相对危险 度(RR) | 95%CI |
| 肿瘤大小 | 0.854 | 0.391 | 4.670 | 0.031 | 2.328 | 1.082-5.009 |
| TNM分期 | 1.658 | 0.359 | 21.369 | 0.000 | 5.251 | 2.599-10.608 |
以往胃癌生物学行为和预后研究的结论不很一致. 我们尽可能排除了放化疗, 免疫治疗, 以及残留肿瘤的影响, 从400例行根治性切除的进展期胃癌患者中严格选出有预后资料的61例, 免疫组化显示有淋巴结转移, 淋巴管浸润, TNM分期晚的肿瘤其PCNA-LI越高, PCNA-LI高的胃癌淋巴结转移率高, 与以往研究结论相同[6-8], 转移灶中肿瘤细胞的PCNA-LI显著高于原发灶, 浸润至肌层和浆膜层的肿瘤细胞PCNA-LI高于仅浸润至黏膜层和黏膜下层. 上述研究说明增生活性越高的胃癌细胞侵袭能力越强, 胃癌的进展也越快, 另一方面也提示胃癌越是晚期, 其增生能力越强. 由于增生活性高的肿瘤其分泌的VEGF, MMP, EGF, 黏附分子等肿瘤侵袭性因子的能力越强, 这从分子水平解释了PCNA-LI与肿瘤恶性度之间的内在联系[9,10].
凋亡又称程序性细胞死亡, 1972年首先由英国生物学家Kerr et al [11]提出. 他是机体普遍存在的生理现象. 1992年Gavrieli et al [12]根据凋亡发生的原理, 研究出原位凋亡检测方法, 简称为TUNEL. 该方法敏感性和特异性高, 与DNA梯带电泳(DNA ladder), 电镜、流式细胞染色以及组织HE染色目测有很好的相关性[13]. 与正常组织相比, 肿瘤细胞抗凋亡能力增强[14]. 部分肿瘤中, 肿瘤细胞的凋亡比例能够反映肿瘤的恶性程度和预后[15,16]. 但是, 胃癌中凋亡的意义目前还不明确. 多数研究认为: 胃癌细胞凋亡与增生程度相关, 增生明显的部位凋亡细胞越多[17-20]. 但是, 凋亡与胃癌浸润深度, 淋巴结转移, 肿瘤分期, 分化以及预后相关性的研究结论不一致[19-22]. 本研究中凋亡仅与胃癌分化有关, 分化越低的胃癌细胞凋亡越少, 提示分化差的胃癌对细胞凋亡可能存在某些逃避机制[23,24]. 由于凋亡受到细胞增生状态, 机体免疫状态, 肿瘤周边环境等多种因素的影响, 因此, 需要大样本研究来评价凋亡在胃癌中的生物学意义.
树突状细胞是机体抗肿瘤免疫中关键的抗原提呈细胞, 其作用越来越引起重视[5,25]. DCs本身及其介导的特异性免疫反应对肿瘤细胞有抑制和杀伤作用 [26-30], 而肿瘤细胞可以分泌VEGF, MMP, EGF等一系列细胞因子抑制DCs的成熟和迁移[25,31,32], 因此肿瘤组织局部DCs浸润数量是肿瘤和机体相互作用的综合反映. 我们研究表明有淋巴结转移以及分期晚的胃癌DCs浸润少于无淋巴结转移和分期较早的胃癌, 高DC浸润组中早期胃癌比例高而晚期胃癌比例低, 与前人研究结论相同[33,34]. 一方面说明晚期胃癌存在对机体免疫抑制作用, 另一方面也提示高DC浸润在一定程度上有抑制胃癌进展的作用.
我们单因素生存分析表明胃癌的预后有关的因素有:PCNA-LI, DC浸润, 浸润深度, 淋巴结转移和TNM分期, 与以往研究的结论相符 [6,8,33,34]. 此外, 胃窦癌患者中位生存时间比贲门癌长, 但是, 可能是病例数的限制, 未发现有统计学差异. 进一步多因素生存分析表明TNM和肿瘤的大小是胃癌独立预后影响因子, 本研究中DC, PCNA-LI和TNM分期均具有相关性, 说明TNM分期能够综合反映胃癌的生物学特性和机体免疫的影响, 因此TNM是迄今判断胃癌预后最有价值的指标[35-37]. 部分研究认为DC, PCNA-LI是独立预后影响因子, 但目前结论不一致. 我们的多参数生存分析表明他们不是独立预后影响因子, 可能与样本数量较少有关, 要得出确切结论需要大样本研究.
总之, 肿瘤的生物学特性, 机体的免疫状态等诸多因素是造成胃癌个体差异和不同预后的内在因素, 对他们之间的相关性进行分析和检测有助于筛选出有价值的预后指标, 认识胃癌的个体差异, 为胃癌诊断、治疗提供新的途径.
| 1. | Baba H, Korenaga D, Kakeji Y, Haraguchi M, Okamura T, Maehara Y. DNA ploidy and its clinical implications in gastric cancer. Surgery. 2002;131:63-70. [DOI] |
| 2. | Fiocca R, Luinetti O, Villani L, Mastracci L, Quilici P, Grillo F, Ranzani GN. Molecular mechanisms involved in the pathogenesis of gastric carcinoma interactions between genetic alterations, cellular phenotype and cancer histotype. Hepatogastroenterology. 2001;48:1523-1530. |
| 3. | Becker KF, Keller G, Hoefler H. The use of molecular biology in diagnosis and prognosis of gastric cancer. Surg Oncol. 2000;9:5-11. [DOI] |
| 4. | Evan GI, Vousden KH. Proliferation, cell cycle and apoptosis in cancer. Nature. 2001;411:342-348. [DOI] |
| 5. | Steinman RM, Dhodapkar M. Active immunization against cancer with dendritic cells: the near future. Int J Cancer. 2001;94:459-473. |
| 6. | Sendler A, Gilbertz KP, Becker I, Mueller J, Berger U, Fink U, van Beuningen D, Siewert JR. Proliferation kinetics and prognosis in gastric cancer after resection. Eur J Cancer. 2001;37:1635-1641. [DOI] |
| 8. | Konno S, Takebayashi Y, Aiba M, Akiyama S, Ogawa K. Clinicopathological and prognostic significance of thymidine phosphorylase and proliferating cell nuclear antigen in gastric carcinoma. Cancer Lett. 2001;166:103-111. [DOI] |
| 9. | Werner M, Becker KF, Keller G, Hofler H. Gastric adenocarcinoma: pathomorphology and molecular pathology. J Cancer Res Clin Oncol. 2001;127:207-216. [DOI] |
| 10. | Koide N, Nishio A, Kono T, Yazawa K, Igarashi J, Watanabe H, Nimura Y, Hanazaki K, Adachi W, Amano J. Histochemical study of vascular endothelial growth factor in squamous cell carcinoma of the esophagus. Hepatogastroenterology. 1999;46:952-958. |
| 11. | Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer. 1972;26:239-257. |
| 12. | Gavrieli Y, Sherman Y, Ben-Sasson SA. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J Cell Biol. 1992;119:493-501. |
| 13. | Gaffney EF, O'Neill AJ, Staunton MJ. In situ end-labelling, light microscopic assessment and ultrastructure of apoptosis in lung carcinoma. J Clin Pathol. 1995;48:1017-1021. |
| 14. | Graeber TG, Osmanian C, Jacks T, Housman DE, Koch CJ, Lowe SW, Giaccia AJ. Hypoxia-mediated selection of cells with diminished apoptotic potential in solid tumours. Nature. 1996;379:88-91. [DOI] |
| 15. | Wang J, Liu X, Jiang W, Liang L. Telomerase activity and expression of the telomerase catalytic subunit gene in non-small cell lung cancer: correlation with decreased apoptosis and clinical prognosis. Chin Med J (Engl). 2000;113:985-990. |
| 16. | Adell GC, Zhang H, Evertsson S, Sun XF, Stal OH, Nordenskjold BA. Apoptosis in rectal carcinoma: prognosis and recurrence after preoperative radiotherapy. Cancer. 2001;91:1870-1875. |
| 17. | Pan W, Ishii H, Ebihara Y, Gobe G. Prognostic use of growth characteristics of early gastric cancer and expression patterns of apoptotic, cell proliferation, and cell adhesion proteins. J Surg Oncol. 2003;82:104-110. |
| 18. | Jesionek-Kupnicka D, Tenderenda M, Rutkowski P. Extent of spontaneous apoptosis in gastric cancer: relation to proliferative index, p53 expression, CD 34 expression and histopathological features. J Exp Clin Cancer Res. 2002;21:371-375. |
| 19. | Ikeguchi M, Cai J, Yamane N, Maeta M, Kaibara N. Clinical significance of spontaneous apoptosis in advanced gastric adenocarcinoma. Cancer. 1999;85:2329-2335. [DOI] |
| 20. | Aizawa K, Ueki K, Suzuki S, Yabusaki H, Kanda T, Nishimaki T, Suzuki T, Hatakeyama K. Apoptosis and Bbcl-2 expression in gastric carcinomas: correlation withclinicopathological variables, p53 expression, cell proliferation and prognosis. Int J Oncol. 1999;14:85-91. [DOI] |
| 21. | Osaki M, Kase S, Kodani I, Watanabe M, Adachi H, Ito H. Expression of Fas and Fas ligand in human gastric adenomas and intestinal-type carcinomas: correlation withproliferation and apoptosis. Gastric Cancer. 2001;4:198-205. |
| 22. | Koshida Y, Saegusa M, Okayasu I. Apoptosis, cell proliferation and expression of Bcl-2 and Bax in gastric carcinomas: immunohistochemical and clinicopathological study. Br J Cancer. 1997;75:367-373. [DOI] |
| 23. | Shinohara T, Ohshima K, Murayama H, Kikuchi M, Yamashita Y, Shirakusa T. Apoptosis and proliferation in gastric carcinoma: the association with histological type. Histopathology. 1996;29:123-129. |
| 24. | Inada T, Kikuyama S, Ichikawa A, Igarashi S, Ogata Y. Bcl-2 expression as a prognostic factor of survival of gastric carcinoma. Anticancer Res. 1998;18:2003-2010. |
| 25. | Gunzer M, Janich S, Varga G, Grabbe S. Dendritic cells and tumor immunity. Semin Immunol. 2001;13:291-302. [DOI] |
| 26. | Shimamura H, Cumberland R, Hiroishi K, Watkins SC, Lotze MT, Baar J. Murine dendritic cell-induced tumor apoptosis is partially mediated by nitric oxide. J Immunother. 2002;25:226-234. |
| 27. | Chapoval AI, Tamada K, Chen L. In vitro growth inhibition of a broad spectrum of tumor cell lines by activated human dendritic cells. Blood. 2000;95:2346-2351. |
| 28. | Tang ZH, Qiu WH, Wu GS, Yang XP, Zou SQ, Qiu FZ. The immunotherapeutic effect of dendritic cells vaccine modified with interleukin-18 gene and tumor cell lysate on mice with pancreatic carcinoma. World J Gastroenterol. 2002;8:908-912. |
| 29. | Zhang JK, Li J, Chen HB, Sun JL, Qu YJ, Lu JJ. Antitumor activities of human dendritic cells derived from peripheral and cord blood. World J Gastroenterol. 2002;8:87-90. |
| 31. | Takahashi A, Kono K, Itakura J, Amemiya H, Feng Tang R, Iizuka H, Fujii H, Matsumoto Y. Correlation of vascular endothelial growth factor-C expression with tumor-infiltrating dendritic cells in gastric cancer. Oncology. 2002;62:121-127. |
| 33. | Ishigami S, Natsugoe S, Tokuda K, Nakajo A, Xiangming C, Iwashige H, Aridome K, Hokita S, Aikou T. Clinical impact of intratumoral natural killer cell and dendritic cell infiltration in gastric cancer. Cancer Lett. 2000;159:103-108. |
| 34. | Saito H, Tsujitani S, Kondo A, Ikeguchi M, Maeta M, Kaibara N. Combined analysis of tumour neoangiogenesis and local immune response in advanced gastric carcinoma. Oncol Rep. 1999;6:459-463. |
| 35. | Samson PS, Escovidal LA, Yrastorza SG, Veneracion RG, Nerves MY. Re-study of gastric cancer: analysis of outcome. World J Surg. 2002;26:428-433. |
| 36. | Green D, Ponce de Leon S, Leon-Rodriguez E, Sosa-Sanchez R. Adenocarcinoma of the stomach: univariate and multivariate analysis of factors associated with survival. Am J Clin Oncol. 2002;25:84-89. [DOI] |
| 37. | Klein Kranenbarg E, Hermans J, van Krieken JH, van de Velde CJ. Evaluation of the 5th edition of the TNM classification for gastric cancer:improved prognostic value. Br J Cancer. 2001;84:64-71. [DOI] |