修回日期: 2003-03-20
接受日期: 2003-04-16
在线出版日期: 2003-08-15
研究乙型肝炎病毒(HBV)羧基末端截短型表面抗原中蛋白(MHBst)的反式激活作用, 利用差异显示技术, 筛选克隆MHBst蛋白的反式激活作用的靶基因, 发现新型基因, 为阐明MHBst对于肝细胞表达基因谱的影响, 探索新的研究方向.
利用多聚酶链反应技术(PCR)扩增MHBst的编码基因片段, 构建真核表达载体pcDNA3.1-MHBst, 转染肝母细胞瘤细胞系HepG2, 与仅转染空白载体pcDNA3.1的HepG2细胞进行差异显示, 利用抑制性消减杂交技术(SSH)克隆鉴定MHBst的反式激活作用的靶基因, 通过生物信息学技术, 确定新基因的序列, 设计序列特异性引物, 利用HepG2细胞来源的mRNA进行逆转录PCR (RT-PCR)扩增, 克隆新基因, 并对于新基因的序列以及编码基因产物序列进行分析. 利用生物信息学技术确定TTP1基因是新基因.
构建表达载体pcDNA3.1-MHBst, 经过序列分析和酶切鉴定正确. 转染HepG2细胞系, 利用SSH技术获得差异表达的基因片段. 经对于美国生物工程信息学中心(NCBI)建立的核苷酸序列的数据库(GenBank)检索, 证实这是一个新型基因片段. 通过对于同源基因序列的比对, 根据Kozak规则和终止密码子下游的多聚腺苷酸信号序列, 确定新基因的序列, 将这种MHBst反式激活的新基因命名为TTP1, 并在GenBank中注册登录.
克隆并鉴定了乙型肝炎病毒羧基末端截短型表面抗原中蛋白反式激活作用的新型靶基因TTP1, 为今后研究MHBst的反式激活作用, 开辟了新的研究方向和可能.
引文著录: 刘妍, 成军, 王琳, 王建军, 陆荫英, 李克. 羧基末端截短型乙型肝炎病毒表面抗原中蛋白反式激活基因1的克隆化研究. 世界华人消化杂志 2003; 11(8): 1102-1106
Revised: March 20, 2003
Accepted: April 16, 2003
Published online: August 15, 2003
To investigate the transactivation effects of C-terminally truncated middle surface protein (MHBst) of hepatitis B virus (HBV) by differential display method. To clone new gene with unknown function that could be transactivated by MHBst with suppression subtractive hybridization (SSH), and pave the way for the study and better understanding of the transactivation effects of MHBst.
Polymerase chain reaction (PCR)technique was employed to amplify the coding sequence of MHBst, and the expressive vector pcDNA3.1-MHBst was constructed by routine molecular biological method. The differentially expressed genes were screened and identified by SSH method between the HepG2 cells transfected with pcDNA3.1-MHBst and the vector pcDNA3.1, respectively. Bioinformatics techniques were used to search homologously expressed sequence tag (EST) and full-length coding sequence transactivated by MHBst. The mRNA was purified from HepG2 cells and the DNA fragment was amplified by reverse transcription PCR (RT-PCR) technique. The coding sequence was analyzed by bioinformatics. The new gene transactivated by MHBst was designated as target gene 1 transactivated by truncated middle surface protein of HBV (TTP1).
The expressive vector pcDNA3.1-MHBst was constructed and confirmed by restriction enzyme digestion and sequencing. SSH method was employed for the screening and identification of the differentially expressed genes from the HepG2 cells transfected with pcDNA3.1-MHBst and pcDNA3.1, respectively. Among the target genes, we identified a new gene with unknown function and deposited its sequence into GenBank. From the homology search, we evaluated this gene as a new gene with unknown function.
The gene 1 transactivated by C-terminally truncated middle surface protein of hepatitis B virus was identified.
- Citation: Liu Y, Cheng J, Wang L, Wang JJ, Lu YY, Li K. Cloning of gene 1 transactivated by C-terminally truncated middle surface protein of hepatitis B virus. Shijie Huaren Xiaohua Zazhi 2003; 11(8): 1102-1106
- URL: https://www.wjgnet.com/1009-3079/full/v11/i8/1102.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i8.1102
乙型肝炎病毒(HBV)与肝细胞之间的相互关系非常复杂. HBV既需要肝细胞中的蛋白质成分的结合与调控, 决定其嗜肝细胞的特性, 同时HBV基因组表达的蛋白对于肝细胞的基因表达谱产生影响, 参与HBV的致病过程[1-12]. HBV编码蛋白由于其细胞内分布和功能的特点, 某些结构形式的病毒蛋白对于肝细胞的基因表达谱具有显著影响. 羧基末端截短型的表面抗原中蛋白(MHBst)就是其中的典型代表. 具有反式激活作用的MHBst是从肝癌细胞中整合的HBV DNA序列中鉴定的, 对于其反式激活作用进行了广泛的研究, 认为MHBst是HBV感染引发肝细胞癌(HCC)的重要机制[13-28]. 但是, 最近我们从慢性乙型病毒性肝炎患者外周血中也克隆到了MHBst的编码基因, 说明MHBst编码基因除了与肝细胞基因组整合的存在方式之外, 在外周血中也是存在的. 关于外周血中MHBst编码基因的发现, 拓展了MHBst存在的意义和研究范围[29-34].
关于MHBst的反式激活作用, 首先在体外实验中以异源性启动子指导的报告基因的表达得到了证实. 构建了MHBst的表达载体, 与SV40早期启动子指导的氯霉素乙酰化转移酶(CAT)的表达载体进行共转染试验, 发现MHBst的表达对于SV40的启动子活性具有显著的激活作用, 通过抑制性消减杂交(suppression subtractive hybridization, SSH)技术的筛选, 我们也筛选到MHBst的反式激活作用的靶基因, 而且我们应用Western blot杂交技术证实MHBst对于肝细胞中的原癌基因c-myc的表达上调作用. 同时, 我们还克隆、鉴定了一种未知功能的新基因, 命名为羧基末端截短型乙型肝炎病毒表面抗原中蛋白反式激活基因1(TTP1), 提示MHBst反式激活作用具有新的靶位.
肝母细胞瘤细胞系HepG2细胞及大肠杆菌JM109(本室保存), pcDNA3.1(-)真核表达载体(Invitrogen), Lipofectamine PLUS 转染试剂(Gibco), mRNA Purification试剂盒(Amersham pharmacia biotech), PCR-Select cDNA Subtraction试剂盒(Clontech), 50×PCR Enzyme Mix、Advantage PCR Cloning试剂盒(Clontech), High Pure PCR Product Purification试剂盒(Boehringer Mannheim), T7、SP6通用引物及pGEM-Teasy载体(Promega)[35].
1.2.1 真核表达载体的构建及细胞转染 MHBst真核表达质粒pcDNA3.1(-)-Mt167由本室构建[36]. 用Lipofectamine PLUS 转染试剂将2 μg pcDNA3.1(-)-Mt167及pcDNA3.1(-)空载体分别转染35 mm平皿HepG2细胞, 48 h后收获细胞.
1.2.2 细胞mRNA提取 使用mRNA Purification试剂盒, 直接提取转染了重组表达质粒及空载体的HepG2细胞mRNA, 经琼脂糖凝胶电泳及分光光度计进行定性、定量分析.
1.2.3 双链cDNA(dscDNA)合成 使用PCR-Select cDNA Subtraction Kit中的试剂, 以获得的mRNA为模板逆转录合成cDNA.
1.2.4 消减杂交文库的建立 采用PCR-Select cDNA Subtraction Kit, 常规SSH方法按说明书进行: 转染了重组表达质粒及空载体的HepG2 细胞cDNA分别标记为Tester和Driver, 经RsaI(一种识别4碱基序列的内切酶)消化, 产生相对较短的平端片段, 纯化酶切产物. 将Tester的cDNA分为两份, 分别连接试剂盒提供的特殊设计的寡核苷酸接头Adapter 1和Adapter 2, 然后与过量的Driver cDNA进行杂交; 合并两种杂交产物后再与Driver cDNA作第2次杂交; 然后将杂交产物做选择性PCR扩增, 使Tester cDNA中特异性表达或高表达的片段得到特异性扩增.
1.2.5 克隆鉴定分析 扩增产物与pGEM-Teasy载体连接, 转化JM109感受态细菌, 在含氨苄青霉素的LB/X-gal/IPTG培养板上, 37 °C培养18 h. 挑取白色菌落, 增菌, 以pGEM-Teasy载体多克隆位点两端T7/SP6引物进行菌落PCR扩增, 证明含有插入片段后(200-800 bp), 测序(上海博亚公司). 应用生物信息学将测得序列与GenBank数据库进行同源性分析.
1.2.6 多聚酶链反应扩增 设计引物5'-ATG GAC CTT CAG GCC GCC GGG GCC CAG GCG-3'和5'-TCA ATC TTC AGC ATC GTC AAA CTG TCC TGT-3'从HepG2细胞提取mRNA, 逆转录后进行PCR扩增, 进行Teasy载体的克隆化, 测序.
使用高质量的mRNA是保证cDNA高产量的前提. 紫外分光检测显示, 转染了真核表达质粒及空载体的HepG2 细胞mRNA分别为5.64 μg和5.20 μg, A260/A280 = 1.95. 10 g/L琼脂糖凝胶电泳见mRNA为大于0.5 kb清晰慧尾片状条带, 证实mRNA质优量足.
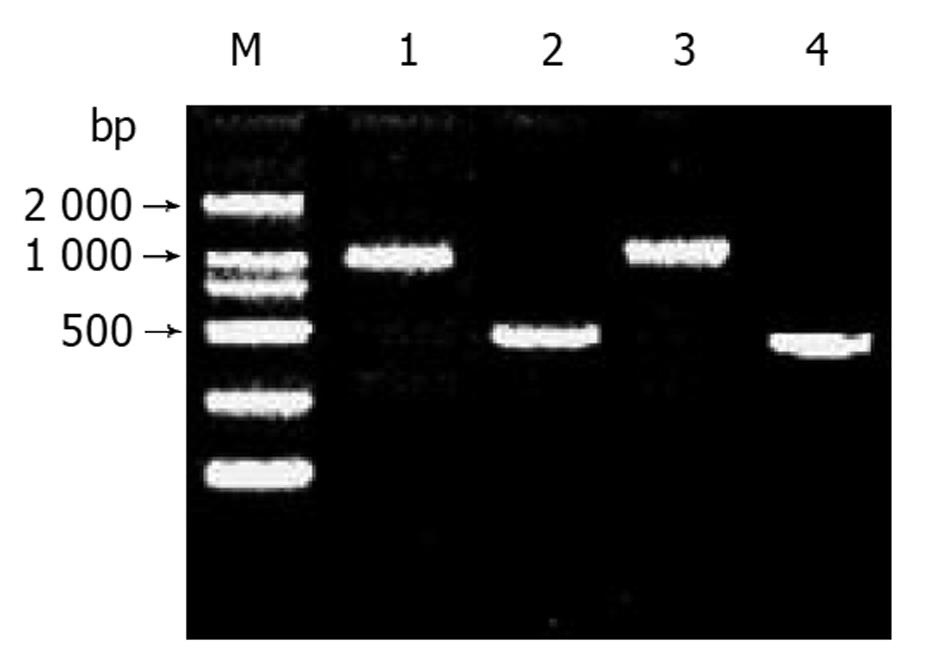
dscDNA与接头连接效率的高低是决定抑制性消减杂交成败的最关键步骤. 将连接有adaptor l和adaptor 2的两组dscDNA分别用不同的特异性引物(看家基因甘油三磷酸脱氢酶G3PDH引物)进行28个循环扩增, 产物用20 g/L琼脂糖凝胶电泳鉴定. 结果显示两组dscDNA扩增产物浓度相当, 说明dscDNA已与接头高效率连接(图1).
分别以消减及未消减PCR产物为模板, 用G3PDH引物进行PCR扩增, 分别在18、23、28、33次循环结束时从体系中吸取5 μL进行电泳鉴定. 结果显示: 与未消减组PCR产物相比, 消减组PCR产物中G3PDH基因产物大大减少, 说明所构建的消减文库具有很高的消减效率(图2).
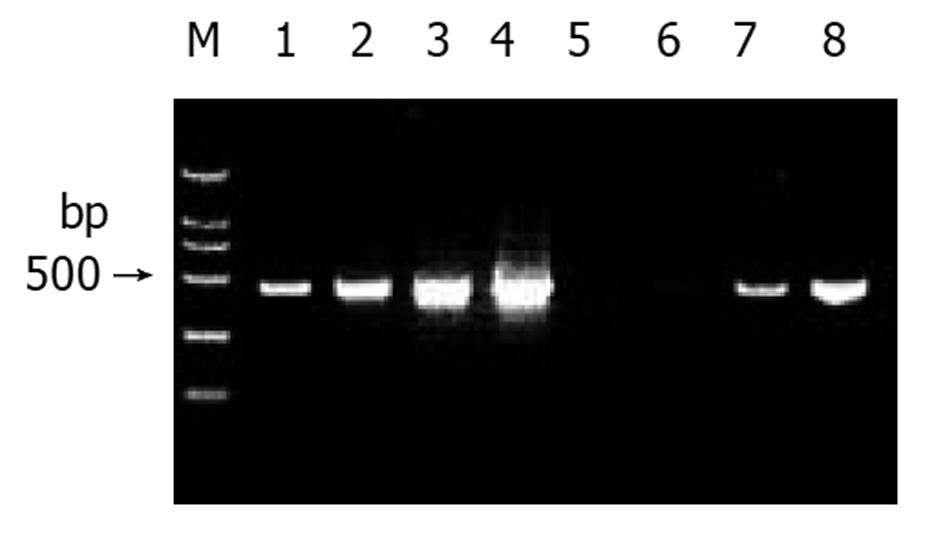
杂交产物经两轮PCR扩增后, 凝胶电泳显示部分差异表达的cDNA条带, 这些条带可能代表差异表达的基因片段(图3).
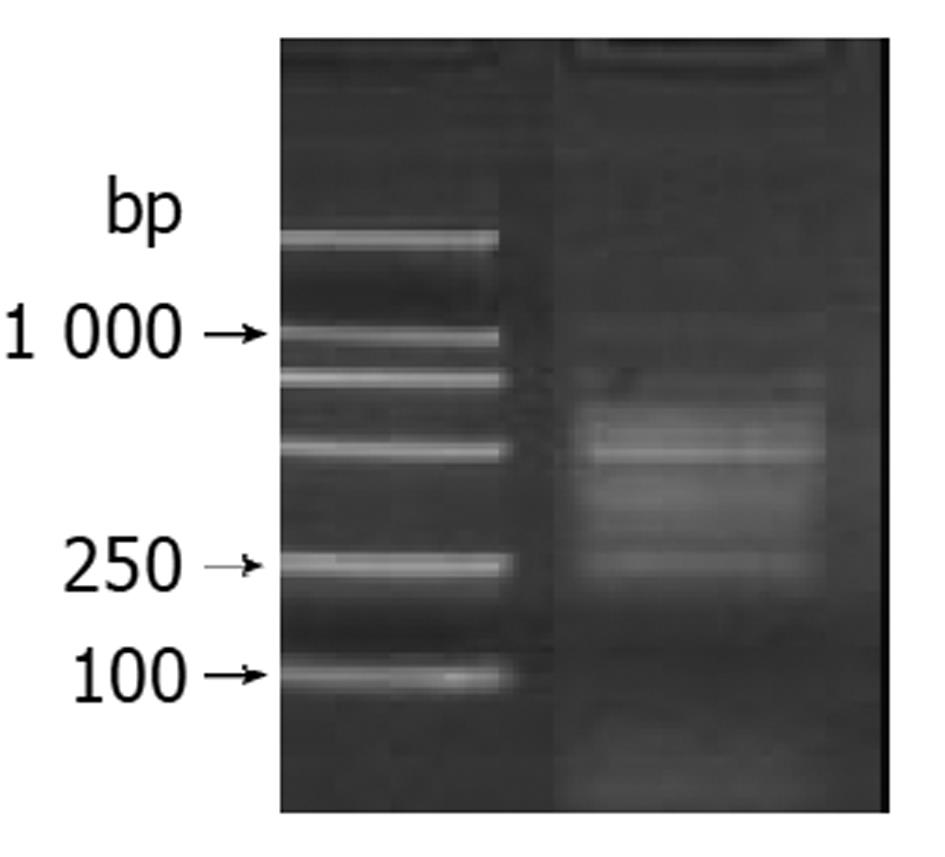
差异表达基因片段的克隆 菌落PCR扩增结果显示为200-800 bp大小不等的插入片段(图4), 所获得的94个克隆中均含有插入片段.
挑选50个克隆测序, 与GenBank数据库进行初步比较. 其中4个克隆未检索到任何对应的相似序列, 可能代表了某些新基因, 进一步的分析鉴定出一个未知功能的新基因, 即TTP1.
TTP1新基因长度为555 nt, 四种核苷酸组成分别为A135、C 147、G 170、T 103, GC比率占57%, 编码的蛋白由184 aa组成, 序列如图5所示. TTP1基因序列已经在GenBank中注册, 注册号为AF407672.
乙型肝炎病毒MHBst具有复杂的分子生物学调节功能. Caselmann et al [23]构建了羧基末端缺失167 aa的表面抗原中蛋白的表达载体MHBst167, 首先验证了对于HBV本身调节元件的作用. 在以CAT作为报告基因的细胞共转染实验研究中, 发现MHBst167对于HBV的增强子I的活性具有促进作用, 但是对于HBV的其他调节元件如X启动子、SP1和SP2启动子、增强子II、核心启动子等没有反式激活作用. 目前还没有证据表明MHBst167与DNA之间具有直接的结合作用, 因此认为MHBst167主要是通过与细胞核内转录因子蛋白的相互作用, 间接产生转录调节作用. 因此, MHBst167在细胞内的蛋白-蛋白相互作用的研究也十分重要. 在体外的DNA-蛋白结合的电泳泳动度迁移率试验(EMSA)中, 发现转录因子蛋白Sp1、AP1、NF-κB等都是MHBst167反式激活作用的介导因子. 但是CREB、NF1或肝特异性因子C/EBP与此无关. 这些研究结果表明MHBst167是具有多种调节作用的蛋白. 其作用没有显著的肝细胞特异性, 但影响的基因类型在肝细胞的增生和炎症中具有十分重要的作用.
Lauer et al[27]从肝癌组织中克隆了羧基末端截短型的前-S2/St, 既往的研究证实前-S2/St具有激活原癌基因 c-myc、c-fos的功能, 因此对于AP1转录因子的作用进行了研究. 如果在c-myc 基因启动子的序列中, 缺失掉AP1 (Jun-Fos)转录因子蛋白的结合序列, 前-S2/St激活c-myc启动子的活性就消失. 如果在基因的启动子区插入多个AP-1的结合序列, 就可以具备前-S2/St诱导的功能. 抑制AP-1的激活, 就可以抑制前-S2/St的反式激活作用. 除了AP-1之外, 前-S2/St还可以激活另外一个与之无关的转录因子NF-κB和AP-2的功能, 表明前-S2/St可以通过几种不同的机制间接影响细胞基因的转录功能. 因为转录因子AP-1的调节涉及到一系列的与肿瘤有关的基因的表达, 因此前-S2/St的反式激活作用在HBV感染相关的HCC的发生发展中具有十分重要的作用.
MHBst的反式激活作用可能与其在细胞内的亚细胞定位有关. Hildt et al [37]在昆虫细胞Sf9中表达了羧基末端缺失76 aa的表面抗原中蛋白MHBst76, 在蛋白水平上研究了MHBst76的生物学功能. 研究发现MHBst76在细胞内与内质网(ER)有关, 在高尔基体中停留. MHBst76蛋白是否经过糖基化修饰对于其反式激活功能没有显著影响. 以大肠杆菌表达的 MHBst76也同样具有反式激活作用.
Natoli et al [38,39]为了研究MHBst的结构与反式激活功能相互之间的关系, 进行了一系列的缺失突变分析. 构建一系列的MHBst基因, 在腺病毒主要晚期启动子的指导下表达, 利用c-myc和c-fos的调节序列作为反式激活作用的靶基因进行研究. S基因的缺失突变研究证实, 疏水区的缺失突变的范围超过第一个内质网插入信号(ER signal I)时反式激活作用就消失, 说明这一结构对于其反式激活作用非常重要. 发现转录因子TRE、SRE、NF-κB等在MHBst的反式激活作用都有重要的地位和作用.
对于HBV基因组编码的MHBst反式激活作用目前有了公认的认识, 但是其作用的机制研究还处于初步阶段[40-44]. 虽然已经积累了一些资料, 但是关于MHBst的反式激活作用的具体的分子生物学机制目前还有许多环节没有阐明, 研究MHBst反式激活作用及其靶基因的方法有多种, 其中之一就是基因表达谱的差异分析技术. 近几年来根据差异表达的原理建立的技术包括差异杂交技术、任意引物差异显示逆转录多聚酶链反应(AP-DD-RT-PCR)、抑制性消减杂交技术、基因芯片(DNA chip)技术等. 相比较而言, 基因芯片的高通量筛选更有吸引力, 但目前商业途径服务的基因芯片的容量一般较小, 只是基因组表达基因类型的一小部分, 而且大部分都是已知功能的基因, 对于以发现新基因为主要目的的研究不合适. 经过进一步的改进, 抑制性消减杂交技术也具有其独特优点. 因为这一技术对于要研究的对象不进行特别的要求, 因此更加适合新基因的克隆化研究. 我们构建了MHBst的表达载体, 转染以后在HepG2细胞中得到了MHBst的表达, 通过与仅转染空白载体的HepG2细胞的比较, 发现一个基因片段与目前GenBank中收录的已知功能的基因没有同源性, 通过对于GenBank中收录的表达序列标签(EST)的比较, 克隆了MHBst蛋白反式激活的新基因TTP1. 关于新基因TTP1的结构与功能、表达与调控, 以及其生物学和临床医学意义, 正在研究之中.
| 9. | 洪 源, 成 军, 董 菁, 李 克, 王 琳, 王 刚, 刘 妍. 乙型肝炎病毒HBsAg重组疫苗与表面抗原DNA疫苗诱导H-2b小鼠免疫应答的实验研究. 世界华人消化杂志. 2002;10:137-140. |
| 11. | 陆 荫英, 王 琳, 刘 妍, 于 敏, 李 克, 王 业东, 张 玲霞, 成 军. 乙肝病毒核心抗原单链抗体细胞内免疫抗乙肝病毒基因治疗研究. 世界华人消化杂志. 2002;10:765-769. |
| 12. | Tu H, Bonura C, Giannini C, Mouly H, Soussan P, Kew M, Paterlini-Brechot P, Brechot C, Kremsdorf D. Biological impact of natural COOH-terminal deletions of hepatitis B virus X protein in hepatocellular carcinoma tissues. Cancer Res. 2001;61:7803-7810. [PubMed] |
| 14. | Huo TI, Wang XW, Forgues M, Wu CG, Spillare EA, Giannini C, Brechot C, Harris CC. Hepatitis B virus X mutants derived from human hepatocellular carcinoma retain the ability to abrogate p53-induced apoptosis. Oncogene. 2001;20:3620-3628. [PubMed] [DOI] |
| 15. | Gilbert S, Galarneau L, Lamontagne A, Roy S, Belanger L. The hepatitis B virus core promoter is strongly activated by the liver nuclear receptor fetoprotein transcription factor or by ectopically expressed steroidogenic factor 1. J Virol. 2000;74:5032-5039. [DOI] |
| 16. | Gottlob K, Pagano S, Levrero M, Graessmann A. Hepatitis B virus X protein transcription activation domains are neither required nor sufficient for cell transformation. Cancer Res. 1998;58:3566-3570. [PubMed] |
| 17. | Su TS, Hwang WL, Yauk YK. Characterization of hepatitis B virus integrant that results in chromosomal rearrangement. DNA Cell Biol. 1998;17:415-425. [PubMed] [DOI] |
| 18. | Caselmann WH, Renner M, Schluter V, Hofschneider PH, Koshy R, Meyer M. The hepatitis B virus MHBst167 protein is a pleiotropic transactivator mediating its effect via ubiquitous cellular transcription factors. J Gen Virol. 1997;78:1487-1495. [PubMed] [DOI] |
| 19. | Kumar V, Jayasuryan N, Kumar R. A truncated mutant (residues 58-140) of the hepatitis B virus X protein retains transactivation function. Proc Natl Acad Sci USA. 1996;93:5647-5652. [DOI] |
| 20. | Henkler FF, Koshy R. Hepatitis B virus transcriptional activators: mechanisms and possible role in oncogenesis. J Viral Hepat. 1996;3:109-121. [DOI] |
| 21. | Mita E, Hayashi N, Kamada T. Transactivation function of X gene-cellular gene fusion product or 3' truncated pre S2/S gene cellular gene fusion product from integrated hepatitis B virus DNA. Nippon Rinsho. 1995;53:89-93. [PubMed] |
| 22. | Wei Y, Etiemble J, Fourel G, Vitvitski-Trepo L, Buendia MA. Hepadna virus integration generates virus-cell cotranscripts carrying 3 truncated X genes in human and woodchuck liver tumors. J Med Virol. 1995;45:82-90. [DOI] |
| 23. | Caselmann WH. Transactivation of cellular gene expression by hepatitis B viral proteins: a possible molecular mechanism of hepatocarcinogenesis. J Hepatol. 1995;22:34-37. [PubMed] |
| 24. | Natoli G, Avantaggiati ML, Chirillo P, De Marzio E, Collepardo D, Falco M, Balsano C, Levrero M. Modulation of intracellular signal transduction pathways by the hepatitis B virus transactivator pX. J Hepatol. 1995;22:14-20. [PubMed] |
| 25. | Murakami S, Cheong JH, Kaneko S. Human hepatitis virus X gene encodes a regulatory domain that represses transactivation of X protein. J Biol Chem. 1994;269:15118-15123. [PubMed] |
| 26. | Tsuei DJ, Hsu TY, Chen JY, Chang MH, Hsu HC, Yang CS. Analysis of integrated hepatitis B virus DNA and flanking cellular sequences in a childhood hepatocellular carcinoma. J Med Virol. 1994;42:287-293. [DOI] |
| 27. | Lauer U, Weiss L, Lipp M, Hofschneider PH, Kekule AS. The hepatitis B virus preS2/St transactivator utilizes AP-1 and other transcription factors for transactivation. Hepatology. 1994;19:23-31. [DOI] |
| 30. | 刘 妍, 董 菁, 成 军, 夏 小兵, 李 克, 王 琳, 施 双双, 段 惠娟, 杨 继珍. 乙肝病毒X基因在真核细胞中的表达及反式激活SV40病毒早期启动子的研究. 解放军医学杂志. 2001;26:404-406. |
| 32. | 刘 妍, 董 菁, 皇甫 竞坤, 成 军, 韩 萍, 牟 劲松, 李 克, 钟 彦伟. 乙型肝炎病毒核心启动子区基因异质性及对其转录活性的影响. 解放军医学杂志. 2002;27:128-130. |
| 34. | 刘 妍, 成 军, 王 刚, 李 克, 段 惠娟, 王 琳, 李 莉, 张 玲霞, 陈 菊梅. HCV核心蛋白与截短型HBV表面抗原中蛋白协同反式激活功能的研究. 中华肝脏病杂志. 2002;10:354-357. |
| 35. | 刘 妍, 成 军, 张 跃新, 段 惠娟, 牟 劲松, 韩 萍, 李 莉, 张 玲霞, 陈 菊梅. 截短型HBsAg中蛋白反式激活基因的克隆. 中华传染病杂志. 2002;20:218-221. |
| 37. | Hildt E, Urban S, Lauer U, Hofschneider PH, Kekule AS. ER-localization and functional expression of the HBV transactivator MHBst. Oncogene. 1993;8:3359-3367. |
| 38. | Natoli G, Avantaggiati ML, Balsano C, De Marzio E, Collepardo D, Elfassi E, Levrero M. Characterization of the hepatitis B virus preS/S region encoded transcriptional transactivator. Virology. 1992;187:663-670. [PubMed] [DOI] |
| 39. | Natoli G, Balsano C, Avantaggiati ML, De Marzio E, Artini M, Collepardo D, Elfassi E, Levrero M. Truncated pre-S/S proteins transactivate multiple target sequences. Arch Virol Suppl. 1992;4:65-69. [DOI] |
| 40. | Yamamoto S, Nakatake H, Kawamoto S, Takimoto M, Koshy R, Matsubara K. Transactivation of cellular promoters by an integrated hepatitis B virus DNA. Biochem Biophys Res Commun. 1993;192:111-118. [PubMed] [DOI] |
| 41. | Nakatake H, Yamamoto S, Matsubara K. Trans-activating function of integrated hepatitis B virus. Nippon Rinsho. 1993;51:357-363. [PubMed] |
| 42. | Kwee L, Lucito R, Aufiero B, Schneider RJ. Alternate translation initiation on hepatitis B virus X mRNA produces multiple polypeptides that differentially transactivate class II and III promoters. J Virol. 1992;66:4382-4389. [PubMed] |
| 43. | Takada S, Koike K. Trans-activation function of a 3 truncated X gene-cell fusion product from integrated hepatitis B virus DNA in chronic hepatitis tissues. Proc Natl Acad Sci USA. 1990;87:5628-5632. [PubMed] [DOI] |