修回日期: 2002-10-20
接受日期: 2002-10-30
在线出版日期: 2003-07-15
观察选择性环氧合酶-2(COX-2)抑制剂Celebrex对裸鼠胰腺癌PC-3细胞株移植瘤生长和肿瘤组织VEGF和PGE2表达的影响.
观测Celebrex对移植瘤生长的影响, 并采用放射免疫测定(RIA)和酶联免疫黏附测定(ELISA)检测裸鼠移植瘤组织中PGE2和VEGF的表达.
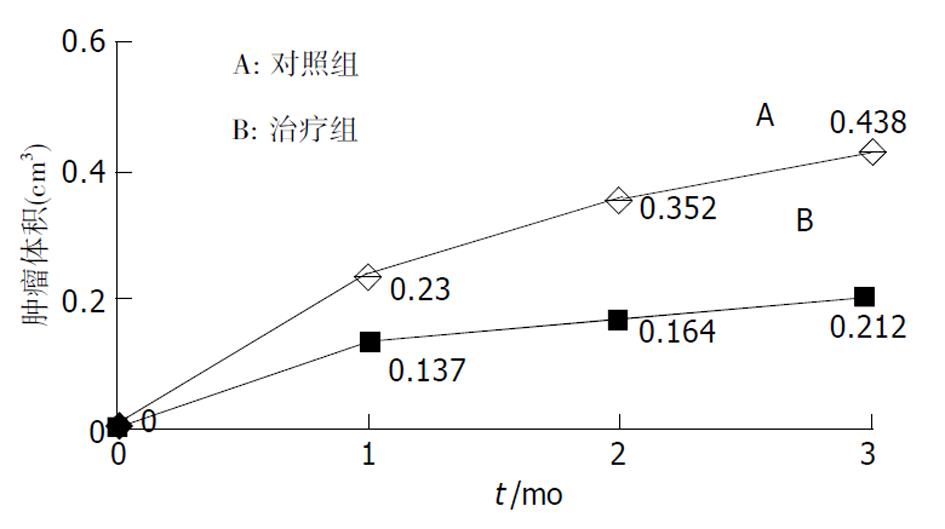
治疗组移植瘤生长曲线较对照组明显低平. 对照组移植瘤近似体积为0.438 cm3, 治疗组为0.212 cm3(抑瘤率为51.6%, P<0.05). PGE2表达, 对照组为66±12 ng/g, 治疗组为29±5 ng/g, 两组间表达有非常显著性(P<0.01). VEGF表达, 对照组1.11±0.11 μg/g, 治疗组0.66±0.11 μg/g, VEGF抑制率为40.6%, 两组间有显著性差异(P<0.05).
COX-2可能参与了肿瘤新生血管的生成, 而PGE2可能在该过程中起着重要的介导作用, 选择性COX-2抑制剂Celebrex则具有抑制肿瘤生长和对抗肿瘤新生血管生成的作用.
引文著录: 谢传高, 王兴鹏, 董育玮, 杜勤, 蔡建庭, 钱可大. 选择性环氧合酶-2抑制剂Celebrex对胰腺癌PGE2和血管内皮因子表达的影响. 世界华人消化杂志 2003; 11(7): 979-981
Revised: October 20, 2002
Accepted: October 30, 2002
Published online: July 15, 2003
To investigate the effects of Celebrex, a selective cyclooxygenase-2 inhibitor, on tumor growth and the expression of vascular endothelial growth factor (VEGF) and PGE2 in pancreatic carcinoma of xenografted nude mice induced by pancreatic carcinoma PC-3 cell lines.
The effects of Celebrex on tumor growth, and the expression of VEGF and PGE2 were assayed by using enzyme-linked immuno-adsordent assay (ELISA) and radioimmunoassay (RIA), respectively.
Compared to control mice, the growth curve of treated mice was much lower and flatter. Average tumor volume from control mice was 0.438 cm3 as compared with 0.212 cm3 from treated mice (51.6% inhibition, P<0.05). The expression of PGE2 in control mice (66±12 ng/g) was significantly higher than that in treated mice(29±5 ng/g) (P<0.01). VEGF expression was significantly down regulated in the Celebrex-treated tumors. ELISA revealed the expression of VEGF was 1.11±0.11 μg/g in control mice, while 0.66±0.11 μg/g in treated mice (P<0.05). The inhibitory rate of VEGF was 40.6%
COX-2 may play an important role in the angiogenesis of pancreatic carcinoma, PGE2 is likely to act as an important intermediate part between COX-2 and tumor generation. The selective COX-2 inhibitor, Celebrex, can inhibit angiogenesis and tumor growth.
- Citation: Xie CG, Wang XP, Dong YW, Du Q, Cai JT, Qian KD. Effects of the selective cyclooxygenase-2 inhibitor Celebrex on the expressions of PGE2 and VEGF in pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi 2003; 11(7): 979-981
- URL: https://www.wjgnet.com/1009-3079/full/v11/i7/979.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i7.979
环氧合酶-2(cyclooxygenase-2, COX-2)与肿瘤的关系密切[1,2]. COX-2参与肿瘤形成的具体机制还不明确. 我们研究选择性COX-2抑制剂Celebrex对肿瘤组织中血管内皮生长因子(VEGF)和PGE2表达的影响, 探讨COX-2参与肿瘤生成的可能机制, 并为药物Celebrex的临床应用提供必要的理论依据.
4-6周龄BALB/C-nu/nu裸小鼠购自上海肿瘤研究所; 胰腺癌PC-3细胞株由北京协和医院刘彤华教授建立并惠赠; RPMI1640购自Gibco公司; 小牛血清购自华美公司; 2.5 g/L胰蛋白酶为Hyclon公司产品; 选择性COX-2抑制剂Celebrex为美国希尔公司产品. 裸鼠移植瘤模型的PC-3细胞用含50 mL/L小牛血清的RPMI1640培养基, 另添加Na2CO3(20 mmol/L)和抗生素(100 kU/L青霉素和100 mg/L链霉素), 置37 ℃, 50 mL/L CO2混合气体的孵箱中培养, 细胞换液时间为1-2 d, 传代3-5 d, 传代前用2.5 g/L胰酶消化.
质量18-22 g, 4-6周龄BALB/C-nu/nu裸鼠30只, 均为♂, 实验前观察1 wk, 若裸鼠生长正常(死亡率不超过10%), 于左后腿外侧皮内注射PC-3人胰腺癌细胞1×107, 1 wk后, 待移植瘤肉眼可见时, 随机分为2组: 对照组和Celebrex处理组(治疗组). 治疗组予以蒸馏水配制的15 mg/L浓度的Celebrex液饮用, 对照组则只给予正常蒸馏水. 定期观察小鼠精神、饮食及排便情况, 称质量, 估算肿瘤近似体积, 绘制生长曲线. 3 mo后结束实验, 取下肿瘤组织, 计算抑瘤率: [1-(治疗组开始平均体积-治疗组结束平均体积)÷(对照组开始平均体积-对照组结束平均体积)] ×100%, 部分组织甲醛溶液固定, 常规包埋切片, 部分组织置液氮冻存备用. 每个标本取100 mg, 加入生理盐水1 mL, 用研磨器将组织磨碎, 然后取其匀浆至1.5 mL的Eppendorf管, 编号. 10 000 r·min-1离心10 min, 将上清液分装于数个小的Eppendorf管中, 每小管100 μL, -20 ℃冰箱储存. 用ELISA检测VEGF量, 并计算VEGF抑制率: (对照组VEGF值-处理组VEGF值)÷对照组VEGF值×100%, 另部分标本采用RIA法检测肿瘤组织中PGE2量.
统计学处理 实验数据以mean±SD表示, 采用计量资料两样本均数比较的t检验, P<0.05为有统计学意义.
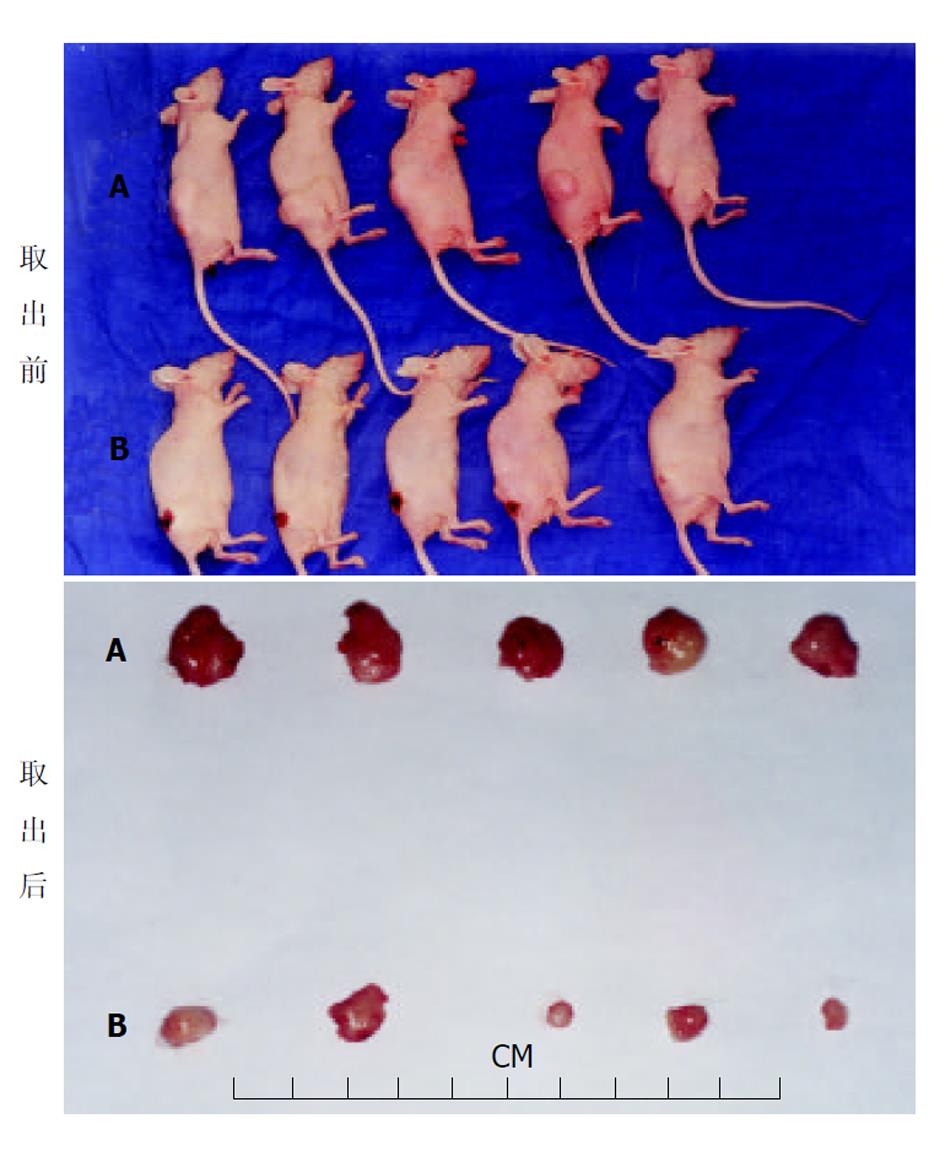
对照组肿瘤呈递增性生长, 而治疗组生长曲线则较为低平, 并且两组肿瘤在开始一段时间内, 生长比较迅速, 此后, 生长速度逐渐减慢(图1). 抑瘤率为51.6%. 肿瘤组织取出后, 无论是体积(0.438 vs 0.215 cm3, P<0.05)还是肿瘤质量(0.552 vs 0.244 g, P<0.05), 2组间均存在显著性差异(图2).
对照组VEGF表达量为1.11±0.11 μg/g, 治疗组为0.66±0.11 μg/g, 两组间有显著性差异(P<0.05), VEGF表达的抑制率为40.6%. RIA对裸鼠肿瘤组织上清液PGE2表达的检测结果显示, 治疗组中PGE2的表达较对照组明显降低, 二者之间存在显著性差异(66±12 vs 29±5 ng/g, P<0.01).
环氧合酶是花生四烯酸代谢过程中前列腺素合成的限速酶, 目前已经知道其至少存在两种亚型, COX-1和COX-2. COX-1属结构型(consititutive)酶, 在多种组织中呈微量表达, 其催化产物只要参与维持细胞结构的完整性[3]; COX-2属诱导型(inducible)酶, 正常组织中很少表达, 在各种刺激因素如细胞因子, 炎性递质以及促癌剂等作用下, 其表达则迅速上调[4,5]. 其上调可能与MAPK, PKC等激酶途径的激活有关[6,7], 此外, 生成的前列腺素也可能反馈上调COX-2的表达[8,9]. COX-2抑制剂分为选择性和非选择性两种. 实验中我们所采用的Celebrex又名Celecoxib, 就是一种特异性COX-2抑制剂. 研究表明, 高脂饮食尤其是6-n簇多不饱和脂肪酸的摄入增加可能与胰腺癌的发病率上升有关[10,11]. 晚近, 对脂质代谢紊乱与肿瘤的相关性研究则揭示有COX-2途径导致的脂质代谢紊乱可能是促进消化系统肿瘤发生和发展的重要原因之一.
COX-2与消化系统肿瘤的关系, 首先表现为COX-2在多种肿瘤中的过度表达[12-14]. 其次, 表现为COX-2抑制剂对肿瘤生长的抑制作用[15,16]. 与其他肿瘤类似, 胰腺癌同样也存在着COX-2的过度表达情况[17,18]. 我们应用Celebrex来干预胰腺癌移植瘤的生长, 结果发现, 应用Celebrex的裸鼠, 移植瘤生长曲线低平, 体积和质量较对照组均明显减少, 抑瘤率达到51.6%, 证实了Celebrex对肿瘤生长的抑制作用. COX-2参与肿瘤生成的具体机制还不清楚, 考虑可能与肿瘤细胞增生与凋亡的紊乱、肿瘤新生血管生成以及细胞间的黏附、浸润等多个环节有关. 实验中, 我们重点探讨了COX-2与肿瘤新生血管生成之间的关系. 目前已经知道, 血管生成的主要原因是血管生成促进因子和抑制因子表达平衡的失调, 其中尤以VEGF最为重要. 大量资料表明, COX-2可能参与了肿瘤的新生血管生成. 为了证实这个问题, 我们首先通过ELISA检测了肿瘤组织间VEGF表达情况, 结果显示治疗组VEGF表达较对照组明显降低, 这与Liu et al的研究结果相类似. 这就提示我们, COX-2有可能是通过诱导以VEGF为主的血管生成因子表达失衡来参与肿瘤新生血管生成的, 而选择性COX-2抑制剂Celebrex对肿瘤生长的抑制作用可能部分与其抑制VEGF等血管生成因子表达有关.
环氧合酶上调血管因子表达的途径可能是通过其下游的前列腺素来实现的. 目前引起人们注意的前列腺素主要有PGE1, PGE2和PPARγ. 实验表明, 单一的PGE2就可独自刺激血管的形成. 在COX-2高表达的胃癌患者中, PGE2的表达较对照组明显增高. 在PC-3ML前列腺癌细胞株中, 加入外源性的PGE2后, 也可使受抑的VEGF表达重新上调, 且应用COX-2抑制剂抑制肿瘤COX-2表达后, PGE2与VEGF的表达情况基本一致. 可见, COX-2来源的PGE2的确可能在肿瘤新生血管的生成中发挥着重要的作用. 上调的PGE2可能通过EP受体/cAMP途径来调节生长因子的表达的. 类似的实验中还发现了PGE1和PPARγ对VEGF的上调作用. 并认为其分别是通过特殊的PGE受体和PPARγ(15 d-PGJ2的核内受体)来发挥上述作用的. 实验中, 我们通过RIA对移植瘤组织中PGE2表达情况进行了检测, 结果显示治疗组PGE2表达较对照组明显降低, 两组间具有显著性差异, 且肿瘤组织中PGE2变化趋势与VEGF变化趋势基本一致, 所有这些均提示我们, PGE2可能在COX-2参与肿瘤新生血管生成中起着重要的介导作用.
由于胰腺癌的预后极差, 5 a的存活率仅为0.4%, 上述研究无疑为胰腺癌的预防和治疗提供了一条新的思路. 但值得注意的是, 肿瘤血管生成是一个多因素参与的复杂过程, 是由于肿瘤中基因的变化(包括癌基因的激活和/或抑癌基因的丢失), 导致了众多酶及受体表达的表化, 并进而引起血管生成促进因子和抑制因子间失衡的综合结果. 在脂质代谢紊乱方面, 应该是调节脂质代谢的各种酶及受体相互间表达失调, 导致各种前列腺素代谢平衡的打破, 某些前列腺素可能被上调, 而某些前列腺素则可能被下调, PGE2可能是被下调的一种, 且可能与血管生成关系较为密切. 尽管我们重视VEGF和PGE2在COX-2参与肿瘤新生血管生成中的作用, 但我们同样不应忽视其他血管生成因子和前列腺素在该过程的作用.
| 1. | Howe LR, Dannenberg AJ. A role for cyclooxygenase-2 inhibitors in the prevention and treatment of cancer. Semin Oncol. 2002;29:111-119. [DOI] |
| 2. | Dannenberg AJ, Altorki NK, Boyle JO, Dang C, Howe LR, Weksler BB, Subbaramaiah K. Cyclo-oxygenase-2: a pharmacological target for the prevention of cancer. Lancet onclol. 2001;2:544-555. [DOI] |
| 3. | Smith WL, Garavito RM, DeWitt DL. Prostaglandin endoperoxide H synthases (cyclooxygenase)-1 and2. J Biol Chem. 1996;271:33157-33160. [PubMed] [DOI] |
| 4. | Eberhart CE, Dubois RN. Eicosanoids and the gastrointestinal tract. Gastroenterology. 1995;109:285-301. [DOI] |
| 5. | Xie WL, Chipman JG, Robertson DL, Erikson RL, Simmons DL. Expression of a mitogen-responsive gene encoding prostaglandin synthase is regulated by mRNA splicing. Proc Natl Acad Sci USA. 1991;88:2692-2696. [PubMed] [DOI] |
| 6. | Mestre JR, Mackrell PJ, Rivadeneira DE, Stapleton PP, Tanabe T, Daly JM. Redundancy in the signaling pathways and promoter elements regulating cyclooxygenase-2 gene expression in endotoxin-treated macrophage/monocytic cells. J Biol Chem. 2001;276:3977-3982. [PubMed] [DOI] |
| 7. | Lo CJ, Cryer HG, Fu M, Lo FR. Regulation of macrophage eicosanoid generation is dependent on nuclear factor kappa B. J Trauma. 1998;45:19-23. [PubMed] [DOI] |
| 8. | Lau CK, Black WC, Belley M, Chan C, Charleson S, Denis D, Gauthier JY, Gordon R, Guay D, Hamel P. From indomethacin to a selective COX-2 inhibitor. Development of indolalkanoic acids as potent and selective cyclooxygenase-2 inhibitors. Adv Exp Med Biol. 1997;407:73-78. [PubMed] [DOI] |
| 9. | Tjandrawinata RR, Dahiya R, Hughes-Fulford M. Induction of cyclo-oxygenase-2 mRNA by prostaglandin E2 in human prostatic carcinoma cells. Br J Cancer. 1997;75:1111-1118. [PubMed] [DOI] |
| 10. | Bueno de Mesquita HB, Maisonneuve P, Runia S, Moerman CJ. Intake of foods and nutrients and cancer of the exocrine pancreas: a population-based case-control study in the Netherlands. Int J Cancer. 1991;48:540-549. [PubMed] [DOI] |
| 11. | Wenger FA, Jacobi CA, Kilian M, Zieren J, Zieren HU, Huller JM. Dose dietary alpha-linolenic acid promote liver metastases in pancreatic carcinoma initiated by BOP in Syrian hamster. Ann Nutr Metab. 1999;43:121-126. [PubMed] [DOI] |
| 12. | Zimmermann KC, Sarbia M, Weber AA, Borchard F, Gabbert HE, Schror K. Cyclooxygenase-2 expression in human esophageal carcinoma. Cancer Res. 1999;59:198-204. [PubMed] |
| 13. | Koga H, Sakisaka S, Ohishi M, Kawaguchi T, Taniguchi E, Sasatomi K, Harada M, Kusaba T, Tanaka M, Kimura R. Expression of cyclooxygenase-2 in human hepatocellular carcinoma: relevance to tumor dedifferentiation. Hepatology. 1999;29:688-696. [PubMed] [DOI] |
| 14. | Lim HY, Joo HJ, Choi JH, Yi JW, Yang MS, Cho DY, Kim HS, Nam DK, Lee KB, Kim HC. Increased expression of cyclooxygenase-2 protein in human gastric carcinoma. Clin Cancer Res. 2000;6:519-525. [PubMed] |
| 15. | Rosenberg L, Palmer JR, Zauber AG, Warshauer ME, Stolley PD, Shapiro S. A hypothesis: non-steroidal anti-inflammatory drugs reduce the incidence of large bowel cacner. J Natl Cancer Inst. 1991;83:355-358. [PubMed] [DOI] |
| 16. | Giovannucci E, Egan KM, Hunter DJ, Stampfer MJ, Colditz GA, Willett WC, Speizer FE. Aspirin and the risk of colorectal cancer in women. N Engl J Med. 1995;333:609-614. [PubMed] [DOI] |
| 17. | Yip-Schneider MT, Barnard DS, Billings SD, Cheng L, Heilman DK, Lin A, Marshalll SJ, Crowell PL, Marshall MS, Sweeney CJ. Cyclooxygenase-2 expression in human pancreatic adenocarci- nomas. Carcinogenesis. 2000;21:139-146. [DOI] |
| 18. | Tucker ON, Dannenberg AJ, Yang EK, Zhang F, Teng L, Daly JM, Soslow RA, Masferrer JL, Woerner BM, Koki AT. Cyclooxygenase-2 expression is up-regulated in human pancreatic cancer. Cancer Res. 1999;59:987-990. [PubMed] |