修回日期: 2002-09-20
接受日期: 2002-10-03
在线出版日期: 2003-07-15
观察联合应用粉防己碱(Tet)与甘草酸Glz)对实验性肝纤维化大鼠细胞外基质代谢的影响, 并探讨其作用机制.
将四氯化碳诱导的Sprague-Dawely大鼠肝纤维化动物模型随机分为模型对照组、5 mg/kg体重Tet组、10 mg/kg体重Tet组、20 mg/kg体重Tet组、5 mgTet+50 mgGlz组、10 mgTet+50 mgGlz组、20 mgTet+50 mg Glz组及50 mg/kg体重Glz组. 分别给予不同剂量Tet剂量和/或Glz灌胃和/或腹腔注射, 对照组给予相应溶媒等干预. 用放射免疫法、VG染色法和 RT-PCR法检测血清透明质酸、层粘连蛋白和III型前胶原肽含量及组织病理学变化和I、III型前胶原mRNA表达.
与模型组比较, 联合应用Tet与Glz能够降低血清HA、LN及PIIIP水平(121.8±9.5 vs 58.4±7.6, 85.7±12.1 vs 46.2±7.3, 35.9±3.5 vs 23.5±2.9; P<0.05); 减轻肝组织细胞外基质沉积(P<0.05); 较单独应用Tet效果更显著(69.2±11.1 vs 58.4±7.6; 52.3±6.7 vs 46.2±7.3; 29.9±3.2 vs 23.5±2.9; P<0.05). 与模型组比较, 联合应用Tet与Glz能够显著抑制纤维化大鼠肝组织I、III型前胶原mRNA表达(0.53±0.07 vs 0.26±0.09, 0.47±0.05 vs 0.21±0.07; P<0.05); 较单独应用Tet效果更显著(0.33±0.06 vs 0.26±0.09, 0.29±0.04 vs 0.21±0.07; P<0.05).
联合应用Tet与Glz较单独用药更显著的抑制肝纤维化细胞外基质合成, 有望将二种药物制成复方以提高抗肝纤维化疗效.
引文著录: 王志荣, 陈锡美, 李定国, 魏红山, 黄新, 展玉涛, 陆汉明. 联合应用粉防己碱与甘草酸抑制肝纤维化大鼠细胞外基质表达. 世界华人消化杂志 2003; 11(7): 970-974
Revised: September 20, 2002
Accepted: October 3, 2002
Published online: July 15, 2003
To investigate effects and mechanism of tetrandrine(Tet) and glycyrrhizinic acid(Glz) in combination on metabolism of extracellular matrix in hepatic fibrotic rats induced by carbon tetrachloride.
The hepatic fibrosis model rats induced with carbon tetrachloride were grouped randomly into 5 mg/kg, 10 mg/kg, 20 mg/kg Tet, 5 mg/kgTet+50 mg/kgGlz, 10 mg/kgTet+50 mg/kgGlz, 20 mg/kgTet+50 mg/kgGlz and 50 mg/kgGlz groups. Rats in experimental groups were administrated with Tet and or Glz by gavage or peritoneal injection every day. Serum levels of HA, LN, and PIIIP were detected with radioimmunoassay. Histopathological change was examined with VG staining and observed under light-microscope. mRNA of collagen type I and III were evaluated by RT-PCR.
In comparison with model group, Tet and Glz in combination could markedly decrease serum levels of HA, LN and PIIIP(121.8±9.5 vs 58.4±7.6, 85.7±12.1 vs 46.2±7.3, 35.9±3.5 vs 23.5±2.9; P<0.05), and suppress the expressions of type I, III procollagen mRNA(0.53±0.07 vs 0.26±0.09, 0.47±0.05 vs 0.21±0.07; P<0.05), and reduce deposition of extracellular matrix. Compared with Tet (10mg/kg)only group, Tet with Glz in combination could markedly reduced the serum levels of HA, LN and PIIIP(69.2±11.1 vs 58.4±7.6; 52.3±6.7 vs 46.2±7.3; 29.9±3.2 vs 23.5±2.9; P<0.05), and inhibit the expression of type I, III procollagen mRNA(0.33±0.06 vs 0.26±0.09, 0.29±0.04 vs 0.21±0.07; P<0.05).
Tet and Glz in combination could inhibit expression and deposition of extracellular matrix in fibrotic rats more significantly than either Tet or Glz.
- Citation: Wang ZR, Chen XM, Li DG, Wei HS, Huang X, Zhan YT, Lu HM. Suppression of expression extracellular matrix in hepatic fibrosis rat with tetrandrine and glycyrrhizinic acid. Shijie Huaren Xiaohua Zazhi 2003; 11(7): 970-974
- URL: https://www.wjgnet.com/1009-3079/full/v11/i7/970.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i7.970
细胞外基质(extracellular matrix, ECM)合成过多、降解减少而沉积于组织间隙是肝纤维化发生发展的基本病理过程, 调节ECM代谢是防治肝纤维化的关键. 迄今为止尚无特效药物能够完全阻断慢性肝病肝脏ECM过多表达与沉积[1,2]. 既往研究资料表明粉防己碱(tetrandrine, Tet)具有保护肝细胞、抗炎、抗氧化、阻断Ca2+通道及抗肝纤维化作用[3]; 但由于Tet的中毒剂量与有效剂量较为接近而影响其临床推广应用. 甘草酸(glycyrrhizinic acid, Glz)具有保护细胞膜、清除自由基、调节免疫及抗肝纤维化功能[4,5]. 为了达到提高疗效, 减少毒副反应的目的, 本研究探讨了联合应用Tet与Glz对实验性肝纤维化大鼠肝脏ECM代谢的影响, 并探讨其机制.
实验动物♂Sprague-Dawely大鼠, 体重为200±10 g, 清洁级, 购自中国科学院上海实验动物中心. 普通饲料喂养, 自由饮水及进食. 四氯化碳为上海长江化工厂产品. Tet粉剂为浙江金华第三制药厂产品. Glz(由江苏正大天晴制药有限公司产品提供). 透明质酸(hyaluronic acid, HA)、层粘连蛋白(laminin, LN)及III型前胶原肽(procollagen type III peptide, PIIIP)测定试剂盒购自海军上海医学研究所产品. RNA抽提试剂盒(TRIzol Reagent)和DNA Marker(7zf(+)DNA/HaeIII): 华舜生物工程公司产品. 逆转录试剂盒(AccuPowerTM RTPreMix): 赛百盛公司公司产品. Taq DNA聚合酶、随机引物、 dNTP及10 Reaction Buffer: 上海生工生物工程有限公司产品. I型、III型前胶原及磷酸甘油醛脱氢酶(glyceraldhyde phosphate dehydrogenase, GAPDH)基因引物序列为I型前胶原: Sense 5'-CCTGGCAAGAACGGAGATGA T-3', Antisense 5'-ACCGAC AGCACCATCGTTACC-3', III型前胶原: Sense 5'TGGCCAACCAGGAG AGAA GG 3', Antisense 5'ATCCGTCTCGACGTGGCTGA3', GAPDH: Sense 5'CATG GTCTACACGTTCCAGT3', Antisense 5'GGCTAAGCAGTTGG TGGTGC 3', 由生工公司合成.
动物模型的建立: 按照0.3 ml/100 g 体重剂量, 於大鼠腹股沟或背部皮下注射40% CCl4溶液, 首次剂量加倍, 以后每3 d给药1次, 共6 wk. 动物分组及处理: 81只♂Sprague-Dawely大鼠随机分为9组: I组: 模型组; II组: 5 mg/kg体重Tet组; III组: 10 mg/kg体重Tet; IV组: 20 mg/kg体重Tet组; V组: 5 mg/kg体重Tet +50 mg/kg体重Glz组; VI组: 10 mg/kg体重Tet +50 mg/kg体重Glz组; VII组: 20 mg/kg体重Tet +50 mg/kg体Glz组; VIII组: 50 mg/kg体重Glz组; IX组: 正常组. 模型对照组给予相应剂量CCl4皮下注射, 各剂量Tet干预组及各联合干预组同时给予相应剂量的Tet混悬液灌胃, 1次/d; Glz干预组及各联合干预组给予相应剂量Glz注射液腹腔注射, 1次/d; 其余各组给予相同体积溶媒皮下或腹腔注射和/或灌胃, 共42 d. 最后1次给药24 h后处死动物, 取血清和肝组织标本, 置-80 ℃冰箱中保存待测. 并取部分肝组织用10 %中性甲醛固定, 用于组织病理学检测. 采用放射免疫法检测血清HA、LN及PIIIP含量, 具体步骤分别按试剂盒说明书进行.
用van Gieson苦味酸酸性复红染色法检测肝纤维化组织病理学, 参照有关文献[6], 进行肝纤维化程度计分.
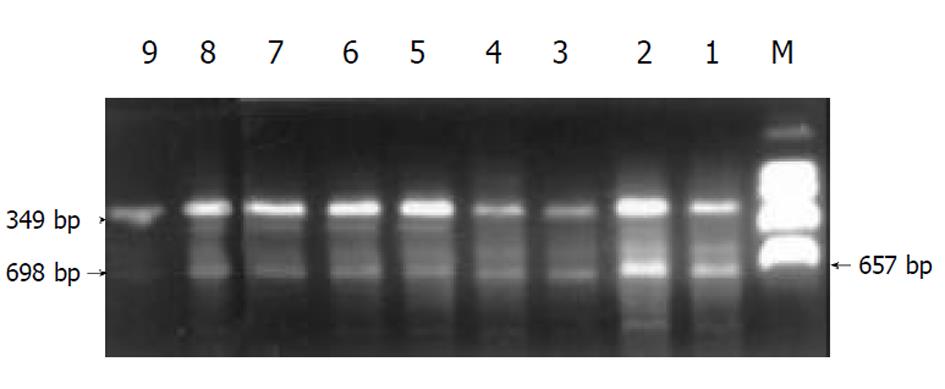
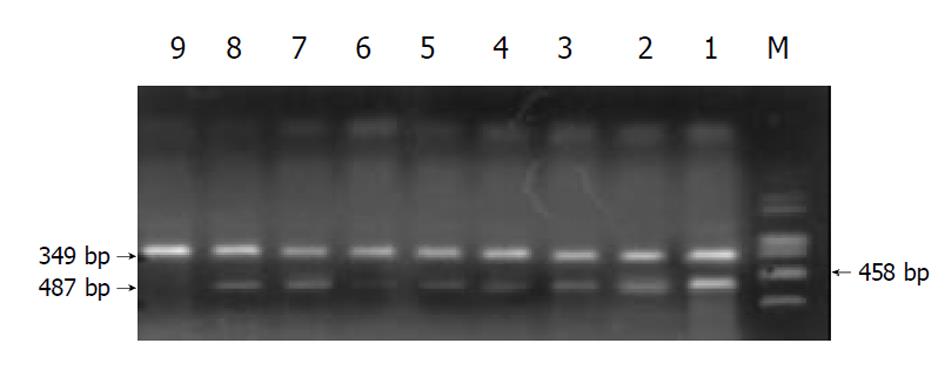
RT-PCR法检测I型和III型前胶原mRNA表达, 采用异硫氰酸胍一步法, 按试剂盒说明书操作, 提取大鼠肝组织总RNA后. 按逆转录试剂盒说明逆转录成cDNA. 采用体积为25 ml的PCR反应体系进行扩增, 在0.5 ml薄壁反应管内依次加入: (1)H2O 14 μl; (2)10×Reaction Buffer 2.5 μl; (3)dNTP(2 mM) 1 μl; (4)MgCl2 (25 mM) 1 μl; (5)Sense primer (10 pmol) 2 μl; (6)Antisense primer (10 pmol) 2 μl; (7)TaqDNApolymerase (2.5 u) 0.5 μl; (8)逆转录产物 2 μl. 置PCR仪中进行扩增. I型前胶原mRNA 扩增条件为: 94 ℃3 min; 94 ℃ 30 s, 51.5 ℃ 30 s, 72 ℃ 1 min, 共30个循环; 72 ℃ 5 min. 扩增片断长度为698 bp. III前胶原mRNA扩增条件为: 94 ℃ 3 min; 94 ℃ 30 s, 55 ℃ 30 s, 72℃1 min, 共30个循环; 72 ℃ 5 min. 扩增片断长度为487 bp. GAPDH mRNA扩增条件为: 94 ℃ 3 min; 94 ℃ 30 s, 51.5 ℃ 30 s, 72 ℃ 1 min, 共30个循环; 72 ℃ 5 min. 扩增片断长度为349 bp. PCR产物经2%琼脂糖凝胶, 25 mV, 50 mA条件下电泳. 电泳结果经Fluors-Multimager扫描仪扫描成像. 用Multi-Analyst software package进行PCR产物半定量. I型、III型前胶原mRNA相对含量用I型、III型前胶原mRNA相对含量用I型、III型前胶原吸光度×面积与APDH吸光度×面积之比值表示.
统计学处理计量资料用mean±SD表示, 经SAS统计分析软件包进行ANOVA及Ridit分析.
各组动物血清HA、LN及PIIIP水平见表1, I组动物血清HA、LN及PIIIP浓度均显著高于IX组(P< 0.001). III组、IV组、VI组及VII组血清LN 含量显著低于I组(P<0.05), VI组及VII组最为明显; II组、V组及VIII组动物血清LN无明显降低(P>0.05). III组、V、VI、VII组及VIII组动物血清PIIIP含量均低于I组 (P<0.05), VI组效果最优; II组和IV动物血清PIIIP含量与II无差异(P>0.05). III组、IV组、V组、VI组、VII组及VIII组动物血清HA含量均显著低于I组(P<0.05), VI组和VII组血清HA浓度最低, 两组间无差异(P>0.05); II组与I组比较无显著降低(P>0.05). 结果提示除5 mg/kg体重组外, 各药物干预组均能不同程度地降低肝纤维化大鼠血清HA、LN及PIIIP含量, 10 mg/kg体重或20 mg/kg体重Tet与Glz联合应用效果更好.
| n | Ln(μg/L) | PIIIP(ng/L) | HA(ng/L) | |
| I组 | 8 | 85.7±12.1a | 35.9±3.5a | 121.8±9.5a |
| II组 | 9 | 78.2±7.9 | 33.7±2.6 | 110.3±13.4 |
| III组 | 8 | 52.3±6.7b | 29.9±3.2b | 69.2±11.1b |
| IV组 | 9 | 61.3±8.4b | 32.3±3.3 | 78.5±8.6b |
| V组 | 8 | 69.3±7.5 | 31.0±3.3b | 94.7±18.4b |
| VI组 | 8 | 46.2±7.3bc | 23.5±2.9bc | 58.4±7.6bc |
| VII组 | 9 | 48.1±3.4b | 30.8±3.4b | 65.8±7.2b |
| VIII组 | 8 | 71.7±6.5 | 30.4±3.4b | 89.1±16.8b |
| IX组 | 9 | 37.1±6.3 | 15.6±2.8 | 33.1±3.7 |
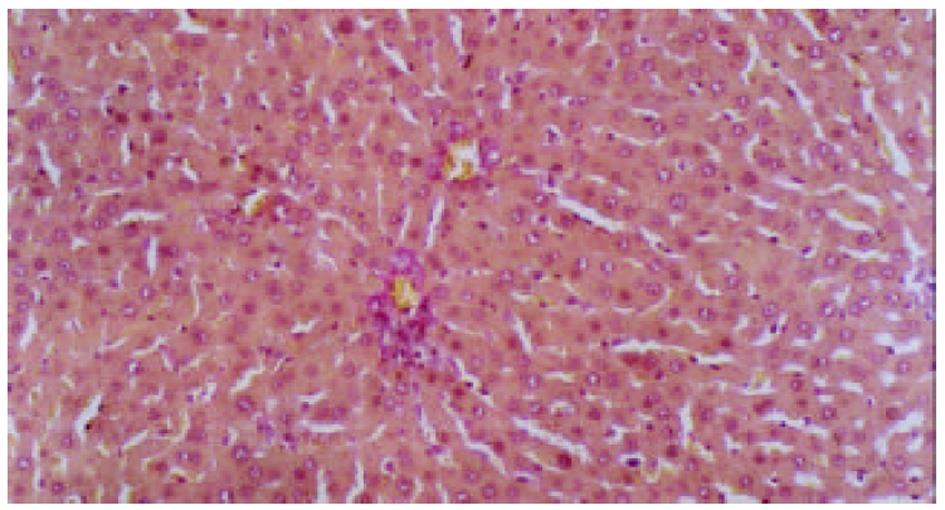
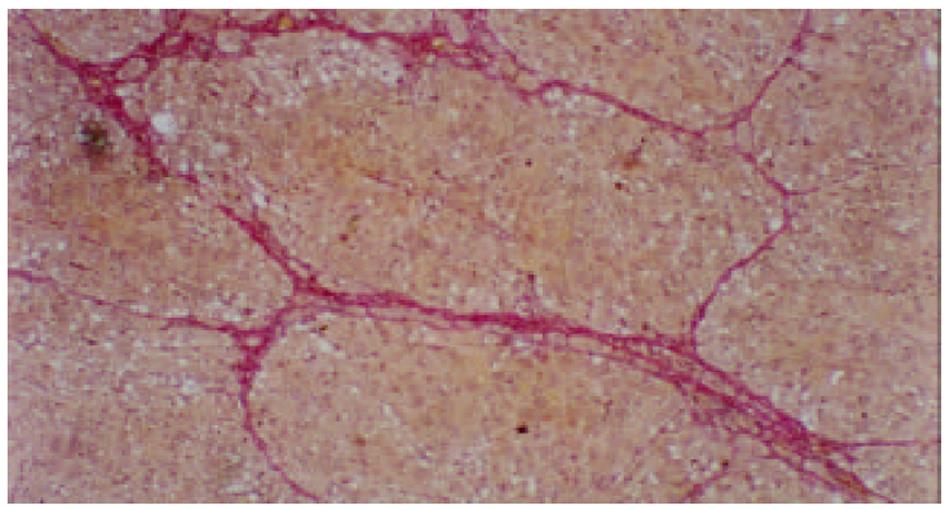
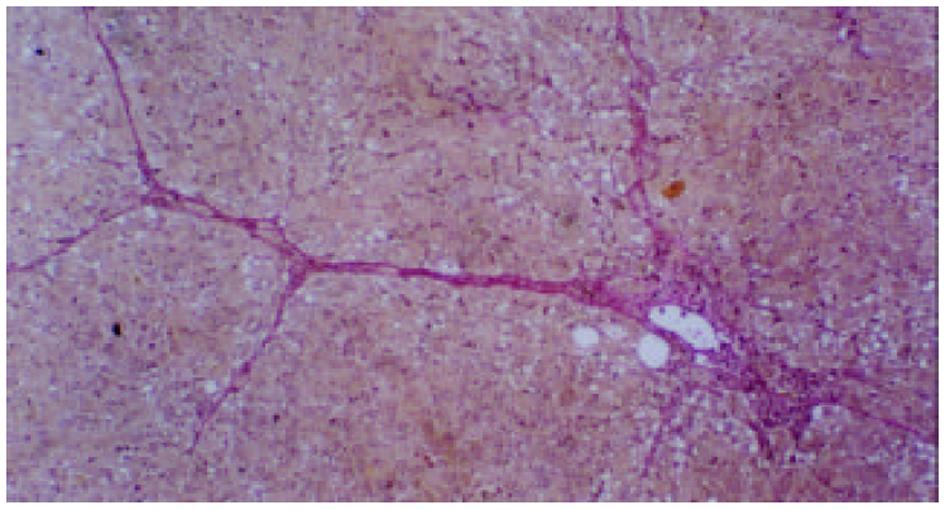
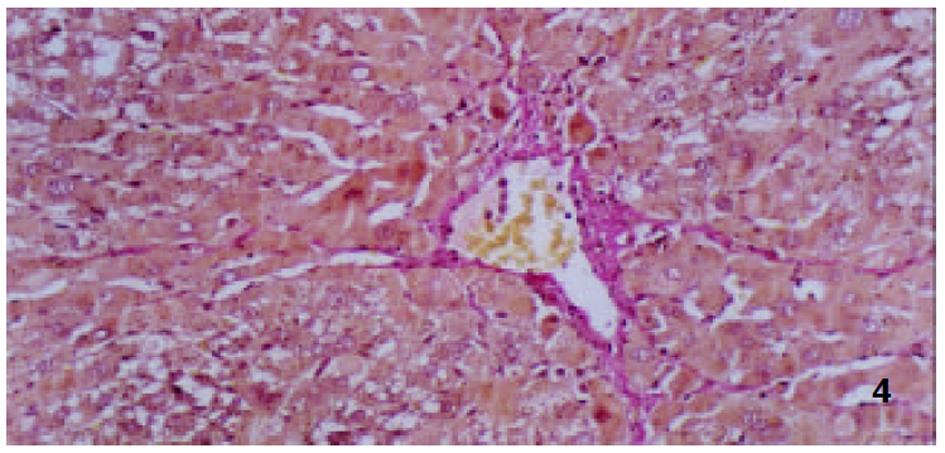
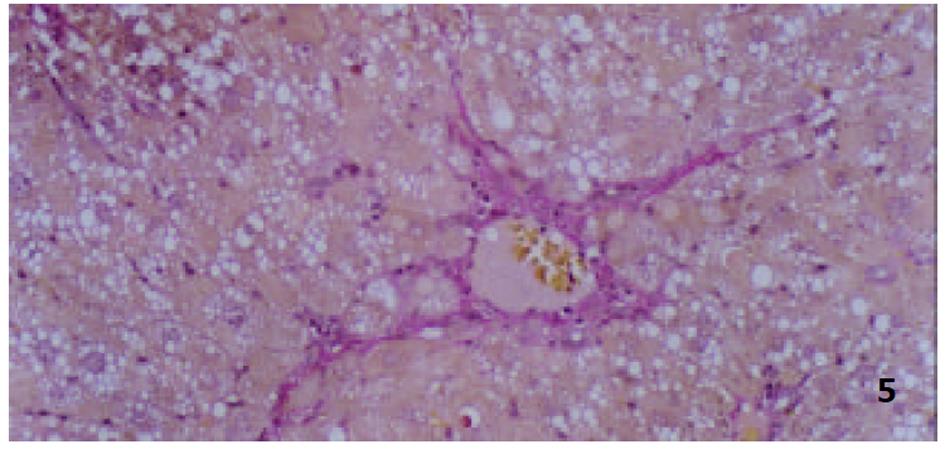
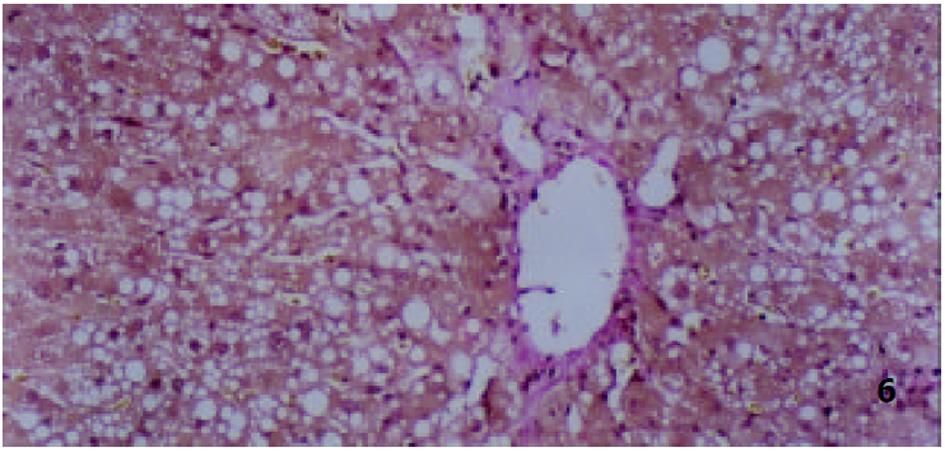
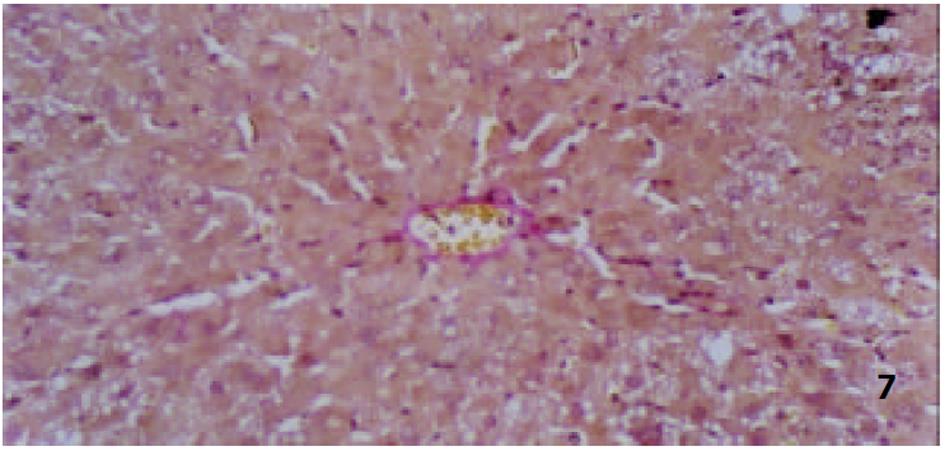
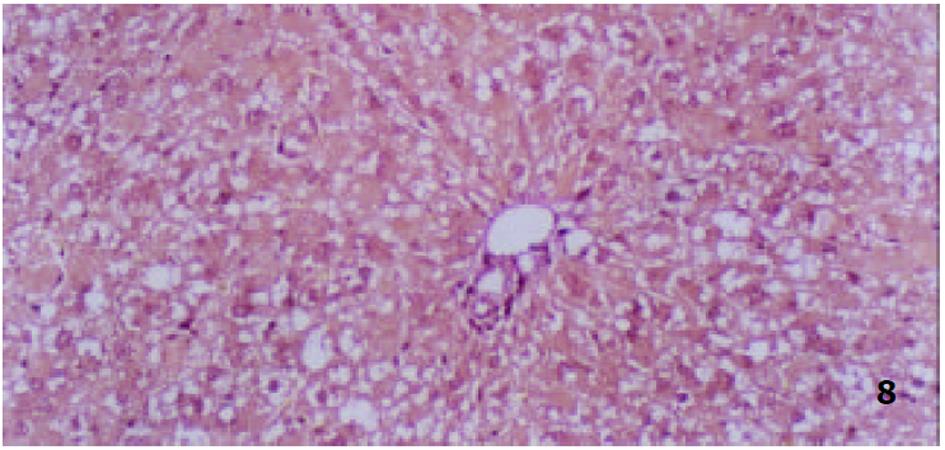
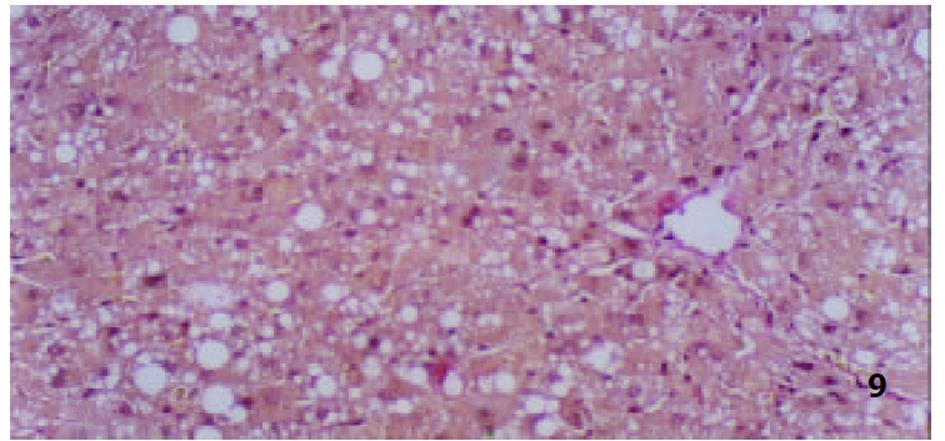
各组动物肝组织病理学变化见表2及组织学照片(图1-9). 结果显示I组大鼠肝组织中可见明显的肝细胞脂肪变性、坏死及炎性细胞浸润; 汇管区胶原纤维沉积, 纤维结缔组织自汇管区呈放射状扩展、向小叶周围延伸; 部分中央静脉区纤维结缔组织沉积增多; 有典型的假小叶形成; 肝纤维化积分显著高于IX组(图1, 图2). III组、IV组、V组、VI组、VII组及VIII组大鼠肝组织中肝细胞变性坏死明显减轻, 纤维结缔组织沉积减少, 纤维间隔及假小叶形成率明显低于I组, VI组疗效最为显著(图4-9); II组与I组差异不显著(图2, 图3). 提示10 mg/kg体重Tet、20 mg/kg体重Tet、50 mg/kg体重Glz单独运用, 或不同剂量Tet与Glz联合应用能够显著减轻肝纤维化组织病理学变化.
| n | 病理分级 | |||||
| 0 | 1 | 2 | 3 | 4 | ||
| I组a | 8 | 0 | 0 | 1 | 3 | 4 |
| II组 | 9 | 0 | 1 | 2 | 3 | 3 |
| III组b | 8 | 1 | 2 | 3 | 1 | 1 |
| IV组b | 9 | 1 | 3 | 2 | 2 | 1 |
| V组b | 8 | 0 | 3 | 3 | 1 | 1 |
| VI组b | 8 | 1 | 4 | 2 | 1 | 0 |
| VII组b | 9 | 1 | 2 | 3 | 2 | 1 |
| VIII组b | 8 | 0 | 2 | 3 | 2 | 1 |
| IX组 | 9 | 8 | 0 | 0 | 0 | 0 |
各组动物肝组织I型及III型前胶原mRNA相对含量见表3及(图10, 11). I组大鼠肝组织I型及III型前胶原mRNA相对含量显著高于IX组(P<0.001); III组、IV、V组、VI组、VII组及VIII组动物肝组织I型和III型胶原mRNA含量显著低于I组(P<0.05); VI组动物肝组织I型和III型胶原mRNA含量低于Tet及Glz单独用药组. II组与I组比较无显著差异(P>0.05).
肝脏ECM由胶原、糖蛋白及蛋白聚糖成分组成, 主要包括HA、LN和I、III、IV型胶原等. 生理状况下, 肝组织ECM含量相对较少, 具有维持组织正常生理结构和内环境稳定的作用[6,7]. 肝纤维化时, HSC分泌I型、III型及IV型胶原、HA、LN及纤维连接素等增加; 同时由于窦周毛细血管化、内皮细胞功能障碍等因素使得ECM降解减少, 血循环中HA、LN及PIIIP含量升高. I型及III型胶原、HA及LN合成增多、降解相对减少而沉积于细胞间隙[8-10]. 组织病理学检查可见肝细胞变性坏死的同时小叶间、汇管区扩大, 汇管区胶原纤维沉积, 纤维结缔组织增生明显并自汇管区呈放射状扩展、向小叶周围延伸; 部分中央静脉区纤维结缔组织沉积增多; 典型的假小叶形成时即可诊断为肝硬化. 本研究表明模型组动物肝组织病理改变与上述文献[11,12]报道一致. 我们发现单独应用10 mg/kg体重、20 mg/kg体重Tet或50 mg/kg体重Glz, 或不同剂量Tet与Glz联合应用均能不同程度地降低纤维化大鼠血清HA、LN及PIIIP水平, 以10 mg/kg、20 mg/kg体重Tet联合Glz治疗组效果最为显著. 给予10 mg/kg体重、20 mg/kg 体重Tet可显著降低实验性肝纤维化大鼠肝组织汇管区及中央静脉区结缔组织沉积, 与有关资料报道[13]相似. 给予50 mg/kg体重Glz可显著减轻肝纤维化程度. 我们还发现各剂量Tet联合Glz应用可显著减少ECM的沉积, 肝纤维化组织病理学积分较各单独用药组显著降低, 以10 mg/kg体重Tet联合Glz组效果最为显著. 表明Tet与Glz在抑制HSC激活、增生转化及ECM合成, 促进ECM降解等方面有协同效应.
从基因转录水平检测肝组织或HSC I型和III型前胶原表达调控是研究肝纤维化发生机制、探讨抗肝纤维化药物作用机制的重要手段. 研究资料[14]表明连续给予皮下注射CCl4或胆管结扎诱导大鼠肝纤维化, 肝组织I型及III型胶原mRNA表达水平上调5-10倍. 本实验结果显示正常组动物肝组织I型和III型前胶原mRNA表达很弱, 而模型组肝组织I型和III型前胶原mRNA表达显著增强; 10 mg/kg体重和20 mg/kg体重Tet及50 mg/kg体重Glz能够显著抑制I型和III型前胶原mRNA表达, 表明二种药物可在转录水平抑制胶原蛋白合成, 联合应用Tet与Glz能够更加显著地抑制肝纤维化大鼠肝组织I型和III型前胶原mRNA的表达, 10 mg/kg体重Tet与Glz联合组效果最为显著, 与病理组织学结果相吻合. 其诱导I型和III型前胶原mRNA表达下调的机制为 (1)Tet和Glz分别能够抑制HSC增生, HSC细胞总数目及转化为肌成纤维样母细胞数目减少[15,16], 故组织mRNA含量下降; (2)Tet和Glz还能通过抑制脂质过氧化反应、廓清自由基, 减少TGFβ1、PDGF、TNFα等细胞因子及其受体表达, 阻断Ca2+、PKC及IP-3K、 MAPK、JNKs等细胞内信号传导通路, 下调NFκB结合活性[17-19], 从而在转录水平或转录上游水平减少I型和III型前胶原mRNA生成.
本研究结果提示联合应用Tet和Glz单独应用均能有效地抑制ECM表达与沉积, 两种药物联合应用疗效显著优于单独应用Tet及Glz. 这种协同效应可能与Glz保护肝细胞、降低Tet的细胞毒等作用有关. 联合用药可为防治肝纤维化提供新的途径.
| 1. | Li D, Friedman SL. Liver fibrogenesis and the role of hepatic stellate cells: new insights and prospects for therapy. J Gastroenter Hepatol J. 1999;14:618-633. [DOI] |
| 2. | Liu HL, Li XH, Wang DY, Yang SP. Matrix metalloproteinase-2 and tissue inhibitor of metalloproteinase-1 expression in fibrotic rat liver. World J Gastroenterol. 2000;6:881-884. [PubMed] [DOI] |
| 4. | van Rossum TG, Vulto AG, de Man RA, Brouwer JT, Schalm SW. Review article: glycyrrhizin as a potential treatment for chronic hepatitis C. Aliment Pharmacol Ther J. 1998;12:199-205. [DOI] |
| 5. | Wang JY, Zhang QS, Guo JS, Hu MY. Effects of glycyrrhetinic acid on collagen metabolism of hepatic stellate cells at different stages of liver fibrosis in rats. World J Gastroenterol. 2001;7:115-119. [DOI] |
| 6. | 王 泰龄, 王 宝恩, 刘 霞, 贾 继东, 赵 静波, 李 新民, 张 晶, 李 宁章. 慢性病毒性肝炎纤维化分期与血清学指标的关系. 中华病理学杂志. 1998;27:185-190. [PubMed] |
| 7. | Huang X, Li DG, Wang ZR, Wei HS, Cheng JL, ZhanYT , Zhou X, Xu QF, Li X, Lu HM. Expression changes of activin A in the development of hepatic fibrosis. World J Gastroenterol. 2001;7:37-41. [DOI] |
| 8. | Du WD, Zhang YE, Zhai WR, Zhou XM. Dynamic changes of type I, III and IV collagen synthesis and distribution of collagen producing cells in carbon tetrachloride-induced rat liver fibrosis. World J Gastroenterol. 1999;5:397-403. [DOI] |
| 9. | Ma L, Zhao LS, Li CH, Lu Q, Li RK, Deng SS. A study on the dynamic alterations of serum HA in rats with carbon tetrachloride induced liver fibrosis. World J Gastroenterol. 2000;6:60. |
| 10. | Wang YD, Jia LW, Li CM. Hepatic content of collagens and laminin in rat model of experimental liver fibrosis. World J Gastroenterol. 2000;6:73. |
| 11. | McCrudden R, Iredale JP. Liver fibrosis, the hepatic stellate cell and tissue inhibitors of metalloproteinases. Histol Histopathol J. 2000;15:1159-1168. |
| 12. | Jung SA, Chung YH, ParkNH , Lee SS, Kim JA, Yang SH, Song IH, Lee YS, Suh DJ, Moon IH. Experimental model of hepatic fibrosis following repeated periportal necrosis induced by allylalcohol. Scand J Gastroenterol. 2000;35:969-975. [DOI] |
| 14. | Bueno MR, Daneri A, Armendariz-Borunda J. Cholestasis-induced fibrosis is reduced by interferon alpha-2a and is associated with elevated liver metalloprotease activity. J Hepatol. 2000;33:915-925. [DOI] |
| 16. | Matsushima Y, Baba T. An antigranulomatous effect of glycyrrhizin. J Exp Pathol. 1992;6:25-30. [PubMed] |
| 17. | Ho LJ, Chang DM, Lee TC, Chang ML, Lai JH. Plant alkaloid tetrandrine downregulates protein kinase C-dependent signaling pathway in T cells. Eur J Pharmacol. 1999;367:389-398. [DOI] |
| 18. | O'Brian CA, Ward NE, Vogel VG. Inhibition of protein kinase C by the 12-O-tetradecanoylphorbol-13-acetate antagonist glycyrrhetic acid. Cancer Lett. 1990;49:9-12. [DOI] |
| 19. | Chen F, Lu Y, Demers LM, Rojanasakul Y, Shi X, Vallyathan V, Castranova V. Role of hydroxyl radical in silica-induced NF-kappa B activation in macrophages. Ann Clin Lab Sci. 1998;8:1-13. |