修回日期: 2002-08-15
接受日期: 2002-08-23
在线出版日期: 2003-05-15
构建表达人cox-2反义RNA的腺病毒载体, 研究其对人食管癌细胞株DNA和蛋白质合成的影响.
把人cox-2的cDNA片段反向克隆于穿梭质粒pHCMVSP1A的CMV启动子之下, 获得pAd-AShcox-2, 通过脂质体与pJM17共转染293细胞, 经同源重组产生编码cox-2反义RNA的重组腺病毒--Ad-AShcox-2. 经PCR的方法鉴定为阳性克隆并大量扩增、纯化, 转染食管癌细胞EC9706, 采用生长细胞计数, 免疫细胞化学、3H-TdR、3H-Leucine掺入法, 研究对食管癌细胞生长、DNA及蛋白质合成的影响.
成功构建并扩增、纯化得到编码cox-2反义RNA的重组腺病毒Ad-AShcox-2, 滴度达0.86×1012 PFU/ml; Ad-AShcox-2感染肿瘤细胞后, cox-2表达水平明显降低, 3H-TdR、3H-Leucine掺入量明显减少, 与对照组在48h、72h、96h比较有显著性差异(q48 h = 16.36及16.36 , q72 h = 39.07及19.90, q96 h= 54.80及30.33; P<0.001); 同时发现食管癌细胞的生长明显受抑制.
表达cox-2反义RNA重组腺病毒感染人食管癌细胞后可降低cox-2表达水平, 使DNA合成降低、蛋白质合成减少, 且抑制食管癌细胞生长、增生, 提示抑制cox-2的表达可能是治疗食管癌的一种新途经.
引文著录: 李胜保, 吴清明, 王强, 王小虎, 谢国建. 腺病毒介导的cox-2反义RNA对食管癌细胞株DNA和蛋白质合成的影响. 世界华人消化杂志 2003; 11(5): 517-521
Revised: August 15, 2002
Accepted: August 23, 2002
Published online: May 15, 2003
To construct the recombinant adenovirus encoding human cox-2 antisense RNA, and to investigate its effect on synthesis of DNA and proteins in esophgeal carcinoma cell line EC9706.
The shuttle plasmid encoding antisense cox-2 was constructed by cloning cox-2 cDNA fragment in the reverse direction into the pHCMVSP1A. Then the plasmid pJM17 and the shuttle plasmid were cotransferred into 293 cells with lipofectamine for homologouserecombinantion to acquire recombinant adenovirus confirmed by PCR. The expressions of cox-2 in esophgeal carcinoma cell line EC9706 cells were evaluated, and its effects on cell proliferation were determined by cell growth rate, 3H-TdR and 3H-Leucine incorporation.
The recombinant adenovirus encoding antisense cox-2 fragment ad-AShcox-2 was obtained with the titer of 0.86±1012 PFU/ml. Ad-AShcox-2 can reduce the expression of cox-2, and inhibit cell growth rate and cause cellular death. Meanwhile, The efficiency of 3H-TdR and 3H-Leucine incorporation was significant lower than that in the control group at 48, 72, 96 hours (q48 h = 16.36 vs 16.36, q72 h = 39.07 vs 19.90 , q96 h= 54.80 vs 30.33; P<0.001).
Reducing the expression of cox-2 may inhibit the proliferation of esophageal cancer cells through inhibiting the synthesis of DNA and protein.
- Citation: Li SB, Wu QM, Wang Q, Wang XH, Guo-JianXie. Effects of adenovirus-mediated human cox-2 antisense RNA on synthesis of DNA and proteins in esophgeal carcinoma cell line. Shijie Huaren Xiaohua Zazhi 2003; 11(5): 517-521
- URL: https://www.wjgnet.com/1009-3079/full/v11/i5/517.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i5.517
近年来, 流行病学资料研究表明长期坚持服用非甾体类抗炎药(non-steroidal anti-inflammatory drugs, NSAID)如阿司匹林等可使大肠癌的危险性降低40-50%[1,2], 使家族性腺瘤型息肉病(familial adenomatous polyposis, FAP)的癌变率和死亡率降低, 使息肉数量和体积减小[3]. NSAID类药物作用的中心环节是抑制环氧化酶(cyclooxygenase, cox)的活性, 而cox是花生四烯酸转化为前列腺素(prostaglandins, PGs)的限速酶, 他有两个同工异构体[4]-cox-1和cox-2, 其中cox-1为原生型, 在机体大多数组织中都有不同水平的表达, 经cox-1途径产生的PGs在机体中主要起生理性保护作用, 因此cox-1又称"管家基因"(housekeeping gene); cox-2为诱生型, 在机体大多数组织中无表达(平滑肌细胞血管内皮细胞、炎性细胞除外), 多因各种生长因子、丝裂原、内毒素、前致癌物等刺激后迅速产生, 在许多癌组织中高度表达, 可能与癌症的发生、发展有关[5]. 本课题利用基因重组技术构建cox-2的反义RNA重组腺病毒, 转染人食管癌细胞株EC9706, 研究其对食管癌细胞生长、DNA合成的影响, 进一步探讨cox-2的促癌机制.
内切酶BamHI、XbaI、T4DNA Ligase购自华美生物工程公司; 1640、Lipofectamine购自GIBCO/BRL公司, 低熔点琼脂糖, X-gal购自Promega公司; CsCl购自Sigma公司; 3H-TDR、3H-Leucine购自北京原子能研究所; cox-1、cox-2抗体购自Santa Cruz公司, SP试剂盒购自北京中山生物公司; cox-2cDNA及腺病毒PCR引物由赛百胜生物公司设计、合成. 质粒和菌株 Ad-LacZ由我分子生物学实验室王家宁博士惠赠, cox-2质粒PCRTMⅡVector由美国Vanderbilt University管又飞博士惠赠, pHCMVSP1A和pJM17由军事科学院二所吴祖泽院士惠赠. DH5α由北京医科大学第一医院心内科彭旭博士惠赠. 细胞系293细胞为腺病毒E1区基因转化的人胚肾细胞系, 培养条件为10%新生小牛血清的高糖DMEM培养液, 在37 ℃、5%CO2孵箱中培养.食管癌细胞株EC9706由中国医学科学院王明荣教授惠赠, 培养条件为3% 1640, 在37 ℃、5% CO2孵箱中培养. 仪器高速冷冻离心机(Jouan, 意大利), 二氧化碳培养箱(sanyD, 日本), 超高冷冻离心机(Hitachi, 日本), 倒置相差显微镜(Olympus IX-70, 日本), PCR扩增仪(美国), 液体闪烁计数仪(美国 Beckman), 紫外分光光度计(752型, 上海), 空气浴、水浴摇床.
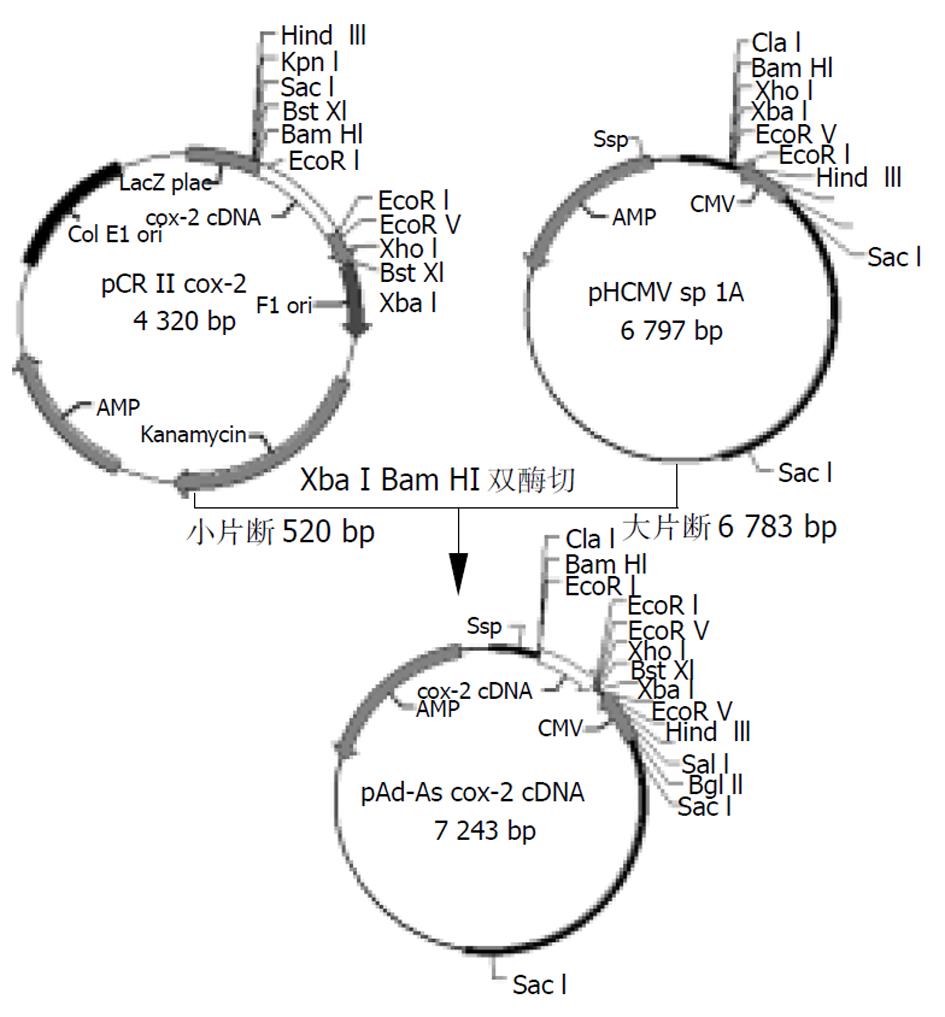
(1)cox-2反义RNA重组腺病毒载体的构建、鉴定、扩增、纯化、滴度测定 质粒pCRTMIIcox-2经Xba I BamH I双酶切获得COX-2 cDNA片段, 反向克隆于穿梭质粒pAdHCMV SP1A的Xba I、 BamH I两位点上; 连接产物为pAd-AShcox-2, 后者经转化大肠杆菌DH5α进行质粒扩增, 酶切鉴定为阳性质粒后进行大量扩增、纯化. Lipofectamin介导穿梭质粒pAd-AShcox-2与pJM17 共转染293细胞, 待293细胞出现病变、脱落细胞约20%再收集上清. 取病毒上清提取病毒DNA, 经PCR鉴定. cox-2上游引物: 5'-TTGGCTTCAAGACTGAGATA-3', 下游引物: 5'-AGCCCAAATTATTGGTTC; 腺病毒引物上游引物: 5'-TCGTTTCTCAGCAGCTGTTG-3', 下游引物: 5'-CATCTGAACTCAAAGCGTGG-3'. PCR反应体系: 取病毒DNA10 μl, 20 μmol/L引物各10 μl(腺病毒引物为5 μl), 10×PCR buffer 5 μl, MgCl2 2 μl , 2 mmol/L dNTP5 μl, Taq酶1 μl, 加水至PCR反应终体积50 μl, 用矿物油覆盖, 94 ℃变性5 min, 然后94 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 60 s, 循环30次, 最后72 ℃延伸10 min, 在1.0%琼脂糖凝胶中进行电泳, 能同时扩增cox-2的cDNA片段和腺病毒片段为阳性重组克隆, 不加模板进行PCR扩增作为阴性对照.鉴定为阳性重组腺病毒后反复转染293细胞, 收集293细胞, 反复冻融碎裂293细胞, 用CsCl超速梯度离心2次, 收集病毒, 经透洗袋纯化病毒, 最后用有限稀释法进行病毒滴度测定. (2)病毒感染率测定 用带有LacZ报告基因的重组腺病毒Ad-LacZ按不同的感染倍数(multplicity of infection, MOI)感染食管癌细胞, 48 h后固定细胞, X-gal染色, 显微镜下记数被染成蓝色的细胞, 即为LacZ基因表达的阳性细胞, 确定蓝染百分率. (3)细胞生长曲线 细胞按1×104/孔分别接种在24孔培养板中, 细胞长至40-50%融合时, 按一定的MOI感染癌细胞, 定期消化收集细胞, 每个时间点设三个平行组, 计数取平均值及标准差, 连续计数4 d. 对照组包括加病毒Ad-LacZ组和不加病毒组. (4)食管癌细胞cox-2的表达的测定 分别取第24、48、72、96小时培养的癌细胞进行消化、收集、离心, PBS漂洗1次, 吹散食管癌细胞, 作细胞涂片, 电吹风吹干后, 用4 ℃冷丙酮固定10 min.此后按SP免疫细胞化学实验方法进行. (5)3H-TdR及3H-Leucine掺入试验按1×104/孔分别接种在24孔培养板中, 待细胞长到40-50%融合时, 实验组和对照组3% Fcs1 640培养3 h后改为无Fcs1 640, 培养12 h, 各组加入1 μCi 3H-TdR或3H-Leucine, 分别于24 h, 48 h, 72 h用PBS漂洗1次, 甲醇固定10 min, 无水乙醇10 min, 最后加0.1 M的NaOH 200 μl, 经吹打后各取200 μl入5 ml闪烁液中混匀、过夜, 次日测定3H放射强度(CPM); 每组设三孔, 重复三次.
统计学处理 先F检验, 后用q检验.
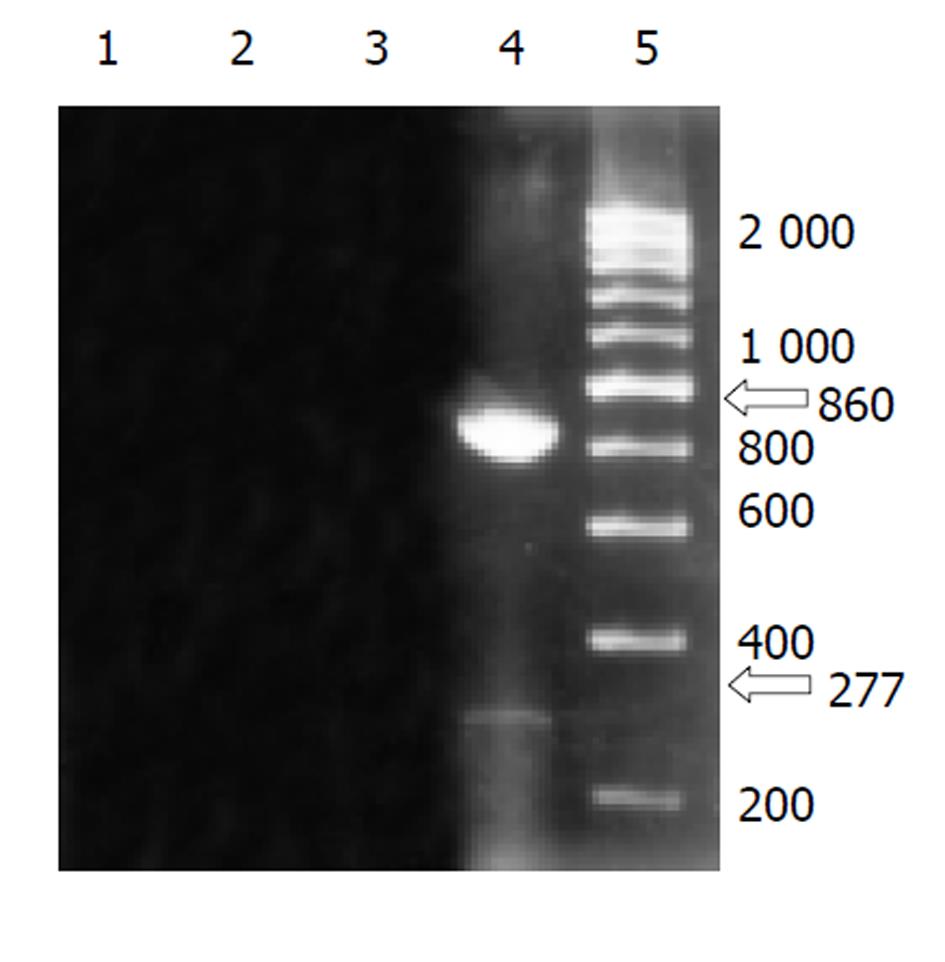
将目的基因cox-2 cDNA片段反向克隆到pAdHCMVSP1A上, 酶切鉴定挑选表达cox-2反义RNA的重组质粒pAd-AShcox-2, (见图1), 使其和pJM17共转染293细胞, 经同源重组, 产生编码cox-2反义RNA的复制缺陷型重组腺病毒Ad-AShcox-2, PCR鉴定结果(见图2), 扩增产物为277 bp的cox-2 cDNA片段和860 bp的病毒基因骨架片段; Ad-AShcox-2经扩增、提取、纯化, 经测定Ad-AShcox-2滴度达0.86×1012PFU/ml.
Ad-LacZ按MOI为25、50、100、200的强度分别感染食管癌细胞, 48 h后进行X-gal染色, 显示转染效率分别为90%、100%、100%、100%, 表明MOI>25时, 90%以上的EC9 706细胞被Ad-LacZ感染.
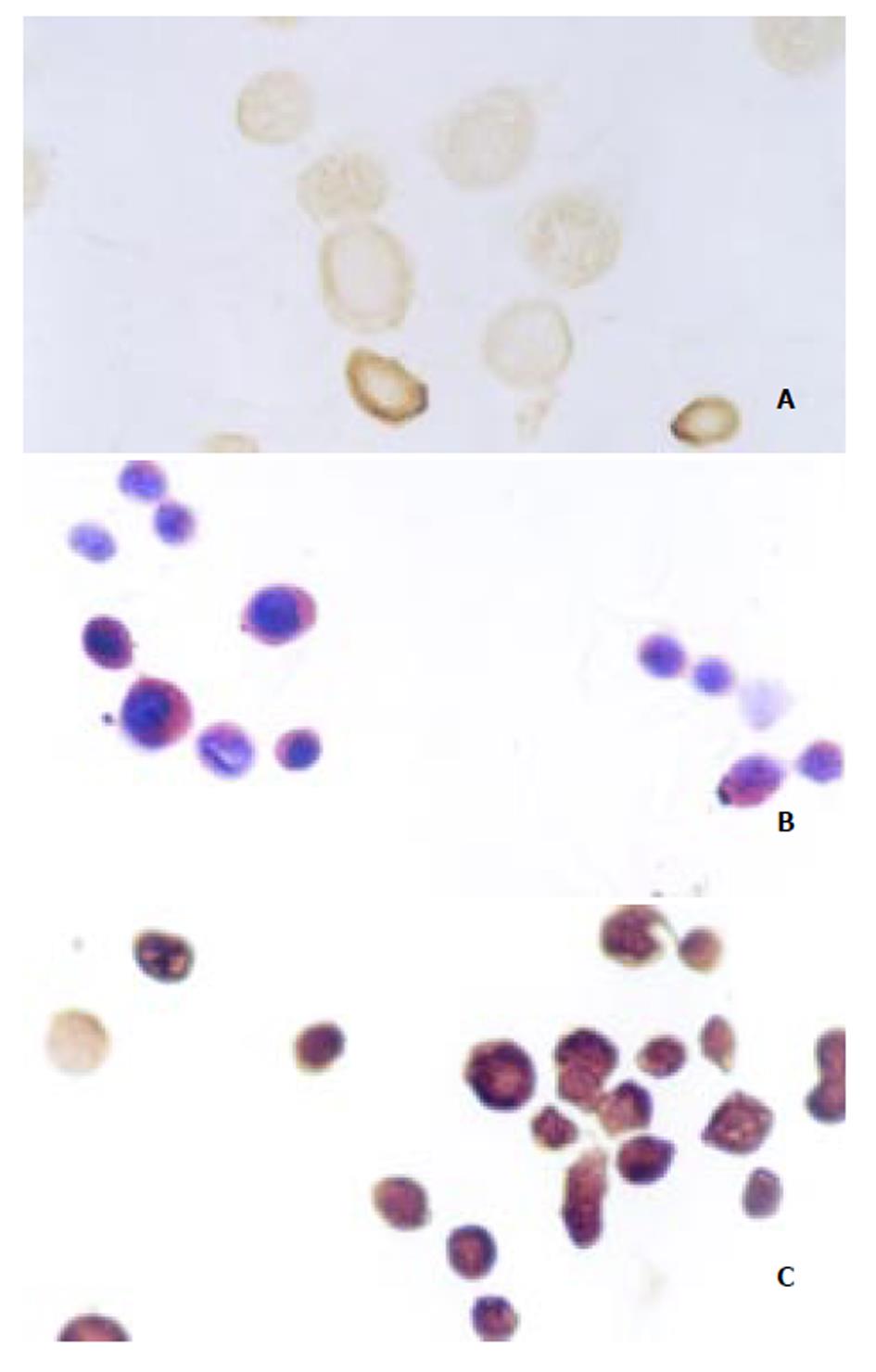
结果显示: 实验组Ad-AShcox-2 cox-2表达与对照组Ad-LacZ组和空白对照组比较明显减少, 病毒转染第3天表达水平最低(见图3).
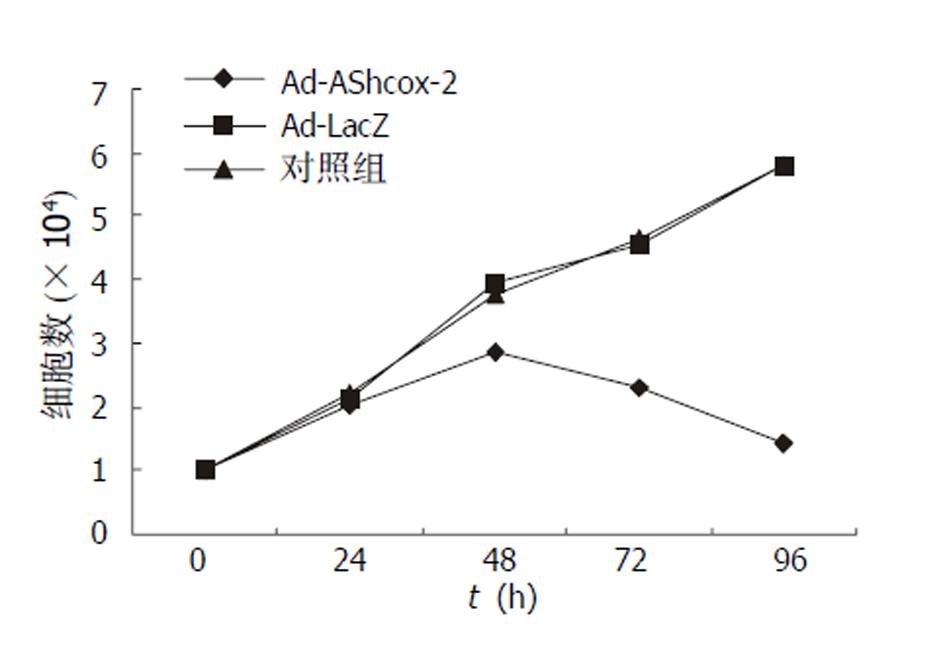
细胞生长曲线显示Ad-AShcox-2组癌细胞计数随时间推移有明显降低的趋势, 第96小时细胞计数最少; 而Ad-LacZ组和空白对照组癌细胞计数随时间的推移有明显增多的趋势(见图4).
Ad-AShcox-2组3H-TdR及3H-Leucine掺入量明显低于对照组(P<0.001), 并随着时间的推移有下降的趋势, 以第4天最明显; 而Ad-LacZ组和空白对照组3H-TdR及3H-Leucine掺入量均在增加, 二者比较无统计学差异(P>0.05)(见表1, 表2).
| 组别 | 48 h | 72 h | 96 h |
| Ad-AShcox-2 | 2504.67±340.74b | 2372.22±115.18b | 279.22±45.36b |
| Ad-LacZ | 3481.78±114.57 | 3656.44±82.75 | 4424.67±82.75 |
| Control group | 3679±99.51 | 3750.67±71.77 | 4400.44±381.56 |
| 组别 | 48 h | 72 h | 96 h |
| Ad-AShcox-2 | 546.22±53.54b | 499.22±24.76b | 232.44±67.74b |
| Ad-LacZ | 989.33±102.44 | 1038.11±83.07 | 1024.56±90.45 |
| 空白组 | 959.33±62.11 | 1081.567±110.78 | 1009.56±70.37 |
食管癌是常见的消化系统恶性肿瘤之一, 死亡率很高, 近年来发病率呈上升趋势. 对食管癌的治疗传统方法有手术、放疗、化疗和生物治疗[6-9], 但这些方法对中晚期食管癌效果差、并发症多, 使临床应用受限; 因此, 寻求一种新的方法极为迫切. 近几十年来, 大量研究发现食管癌癌变过程是一个多因素、多阶段、多基因变异的综合过程, 尤其基因结构的改变和表达异常是食管癌发生的分子基础.反基因技术就是针对这种机制设计治疗癌症的一种新方法[10-16].
我们构建表达cox-2反义RNA重腺病毒就是利用反义核酸技术的原理, 能持续表达cox-2的反义RNA, 封闭cox-2基因, 使之表达减少. 本研究结果显示Ad-AShcox-2感染食管癌细胞株EC9706后, cox-2表达明显减少, 这是因为Ad-AShcox-2能抑制cox-2的转录、翻译, 与mRNA结合使mRNA稳定性降低; 另外与腺病毒的高效转导有关[17].
大量的研究报道cox-2在胃癌、肝癌、大肠癌等[18-21]消化道肿瘤中高度表达, 而正常组织不表达或弱表达; 我们前期的研究[22]也证实cox-2在食管癌组织中高度表达, 与淋巴转移有关; Tsujii et al[23]将cox-2基因转染到小鼠肠上皮细胞时发现, cox-2高表达可使上皮细胞异型性增生, 出现恶性表型, 使抗凋亡基因表达下调; 使用cox-2的抑制剂可对抗这种作用[24-26], 说明cox-2在癌症的发生、发展中可能扮演重要角色. 本研究结果显示Ad-AScox-2转染食管癌细胞株后, 细胞生长曲线呈下降趋势, 而对照组呈上升趋势, 表明Ad-AScox-2能抑制食管癌细胞的生长增生.吴汉平et al[27]也发现cox-2反义核酸转染胃癌细胞时癌细胞生长受限, 提示cox-2可能成为癌症基因治疗的一个靶位. Ad-LacZ组与空白对照组食管癌细胞生长曲线几乎重叠, 表明腺病毒对食管癌细胞无毒害作用.
细胞3H-TdR掺入量的多少是细胞DNA合成快慢的标志[28], 3H-Leucine掺入量可以反映蛋白质合成的快慢[29], 本研究发现Ad-AShcox-2组与对照组比较, 3H-TdR及3H-Leucine掺入量均明显减少(P<0.001), 说明Ad-AShcox-2使cox-2表达降低后, 可抑制肿瘤细胞DNA和蛋白质的合成, 使EC9706细胞有丝分裂所需原料合成减少, 从而发挥抑癌作用.
另外, 我们实验中还发现Ad-AShcox-2转染癌细胞后, 有大量癌细胞脱落、坏死、呈葡萄状改变, 说明Ad-AShcox-2对癌细胞有直接杀死作用, 可能与诱导细胞凋亡作用有关[30].
本研究结果显示表达cox-2反义RNA重组腺病毒感染人食管癌细胞后可降低cox-2表达水平, 使DNA和蛋白质合成降低, 且抑制食管癌细胞生长、增生, 进一步说明cox-2与食管癌的发生发展有关; 抑制cox-2的表达可能是治疗食管癌的一种新途经.
| 1. | Williams CS, Smalley W, DuBois RN. Aspirin use and potential mechanisms for colorectal cancer prevention. J Clin Invest. 1997;100:1325-1329. [PubMed] [DOI] |
| 2. | Wang Q, Fan LY, He J, Wang YH. Inhibitory effect of sulindac against chemically = -Induced primary colonic tumors by N-methyl-N-nitrosourea in mice. China Natl J New Gastroenterol. 1997;3:16-18. |
| 3. | Giardiello FM, Spannhake EW, DuBois RN, Hylind LM, Robinson CR, Hubbard WC, Hamilton SR, Yang VW. Prostaglandin levels in human colorectal mucosa: effects of sulindac in patients with familial adenomatous polyposis. Dig Dis Sci. 1998;43:311-316. [PubMed] [DOI] |
| 4. | Williams CS, DuBois RN. Prostaglandin endoperoxide synthase: why two isoforms? Am J Physiol. 1996;270:G393-400. [DOI] |
| 5. | Williams CS, Tsujii M, Reese J, Dey SK, DuBois RN. Host cyclooxygenase-2 modulates carcinoma growth. J Clin Invest. 2000;105:1511-1513. [PubMed] [DOI] |
| 10. | Tang YC, Li Y, Qian GX. Reduction of tumorigenicity of SMMC-7721 hepatoma cells by vascular endothelial growth factor antisense gene therapy. World J Gastroenterol. 2001;7:22-27. [PubMed] [DOI] |
| 13. | Chen JP, Lin C, Xu CP, Zhang XY, Wu M. The therapeutic effects of recombinant adenovirus RA538 on human gastric carcinoma cells in vitro and in vivo. World J Gastroenterol. 2000;6:855-860. [PubMed] [DOI] |
| 15. | Cao GW, Qi ZT, Pan X, Zhang XQ, Miao XH, Feng Y, Lu XH, Kuriyama S, Du P. Gene therapy for human colorectal carcinoma using human CEA promoter controled bacterial ADP-ribosylating toxin genes human CEA: PEA & DTA gene transfer. World J Gastroenterol. 1998;4:388-391. [PubMed] [DOI] |
| 16. | Zhang XY. Some recent works on diagnosis and treatment of gastric cancer. World J Gastroenterol. 1999;5:1-3. [DOI] |
| 17. | Dixon DA, Kaplan CD, McIntyre TM, Zimmerman GA, Prescott SM. Post-transcriptional control of cyclooxygenase-2 gene Expression. The role of the 3-untranslateo region. J BiolChem. 2000;275:11750-11757. [PubMed] [DOI] |
| 18. | Ristimaki A, Honkanen N, Jankala H, Sipponen P, Harkonen M. Expression of cyclooxygenase-2 in human gastric carcinoma. Cancer Res. 1997;57:1276-1280. [PubMed] |
| 19. | Shiota G, Okubo M, Noumi T, Noguchi N, Oyama K, Takano Y, Yashima K, Kishimoto Y, Kawasaki H. Cyclooxygenase-2 expression in hepatocellular carcinoma. Hepatogastroenterology. 1999;46:407-412. [PubMed] |
| 20. | Eberhart CE, Coffey RJ, Radhika A, Giardiello FM, Ferrenbach S, DuBois RN. Up-regulation of cyclooxygenase 2 gene expression in human colorectal adenomas and adenocarcinomas. Gastroenterology. 1994;107:1183-1188. [DOI] |
| 23. | Tsujii M, DuBois RN. Alterations in cellular adhesion and apoptosis in epithelial cells overexpressing prostaglandin endoperoxide synthase 2. Cell. 1995;83:493-501. [DOI] |
| 24. | Wu YL, Sun B, Zhang XJ, Wang SN, He HY, Qiao MM, Zhong J, Xu JY. Growth inhibition and apoptosis induction of sulindac on human gastric cancer cells. World J Gastroenterol. 2001;7:796-800. [PubMed] [DOI] |
| 25. | Tian G, Yu JP, Luo HS, Yu BP, Yue H, Li JY, Mei Q. Effect of nimesulide on proliferation and apoptosis of human hepatoma SMMC-7721cells. World J Gastroenterol. 2002;8:483-487. [PubMed] [DOI] |
| 26. | Meyer-Siegler K. COX-2 specific inhibitor, NS-398, increases macrophage migration inhibitory factor expression and induces neuroendocrine differentiation in C4-2b prostate cancer cells. Mol Med. 2001;7:850-860. [PubMed] |
| 27. | 吴 汉平, 吴 开春, 李 玲, 幺 立萍, 兰 梅, 王 新, 樊 代明. 人环氧合酶-2(hcox-2)编码基因的克隆及其反义核酸转染胃癌细胞的初步研究. 世界华人消化病杂志. 2000;8:1211-1217. |
| 28. | Lavezzi AM, Biondo B, Repetti ML, Varesi C, Masini B, Matturri L. Prognostic implications of the proliferation index (3H-TdR-labeling index) and ploidy in neuroectodermal tumors (astrocytomas and glioblastomas). Minerva Med. 1992;83:115-119. [PubMed] |
| 29. | Rabinovitz YM, Pinus HA, Kotelnikova AV. A study of dependence of protein synthesis in mitochondria on the transmembrane potential. Mol Cell Biochem. 1977;14:109-113. [PubMed] [DOI] |
| 30. | Sheng H, Shao J, Morrow JD, Beauchamp RD, DuBois RN. Modulation of apoptosis and Bcl-2 expression by prostaglandin E2 in human colon cancer cells. Cancer Res. 1998;58:362-366. [PubMed] |