修回日期: 2002-05-01
接受日期: 2002-06-08
在线出版日期: 2003-02-15
目的: 了解乙型肝炎病毒(HBV)准种遗传异质性对干扰素(IFN-α)应答性的影响.
方法: 用构象敏感凝胶电泳(CSGE)对20例(完全应答者和无应答者各10例)已接受IFN-α治疗的慢性乙型肝炎患者治疗前血清中HBV准种的异质性进行检测, 分析准种的异质性与IFN-α应答性的关系.
结果: HBV DNA含量在IFN-α应答患者和非IFN-α应答患者之间无差异(7.27 ×1010±8.79×1010vs 5.16×1010±5.13×1010, P>0.05), 但是, 在无应答患者HBV准种的复杂性和遗传差异性明显高于应答患者(8.30±1.89 vs 18.5±2.68, P<0.001和0.926±0.008 vs 0.869±0.016, P<0.001).
结论: HBV准种的异质性对IFN-α的应答性有影响.
引文著录: 兰林, 王宇明. 乙型肝炎病毒准种异质性对干扰素应答性的影响. 世界华人消化杂志 2003; 11(2): 169-172
Revised: May 1, 2002
Accepted: June 8, 2002
Published online: February 15, 2003
AIM: To study effects of quasi-species heterogeneity of hepatitis B virus (HBV) on response to interferon(IFN)-α therapy.
METHODS: Serum quasi-species heterogeneity of HBV in 20 patients (10 responders and 10 non-responders) with chronic hepatitis B before administration of IFN-α was detected with conformation-sensitive gel electrophoresis (CSGE), and the relationship between response to IFN-α and quasi-species heterogeneity of HBV was analyzed.
RESULTS: No significant difference in levels of HBV DNA between responders (7.27×1010±8.79×1010) and non-responders (5.16×1010±5.13×1010) before IFN-α therapy was found (P > 0.05). But the quasi-species complexity and genetic diversity in non-responders were significantly higher than those in responders (8.30±1.89 vs 18.5±2.68, P < 0.001 and 0.926±0.008 vs 0.869±0.016, P < 0.001).
CONCLUSION: The level of quasi-species heterogeneity of HBV was reversely associated with the probability of response to IFN-α therapy.
- Citation: Lan L, Wang YM. Effects of quasi-species heterogeneity of HBV on response to IFN-a therapy. Shijie Huaren Xiaohua Zazhi 2003; 11(2): 169-172
- URL: https://www.wjgnet.com/1009-3079/full/v11/i2/169.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i2.169
α-干扰素(interferon-α, IFN-α)是抗HBV的主要药物, 但疗效并不理想. 在治疗的病例中, HBeAg和HBV DNA的阴转率仅比对照组高20%, HBsAg 的阴转率只仅比对照组高5%-6%[1]. 影响IFN-α应答性的因素尚不完全清楚[2-5]. 在病毒学方面, 有关变异株对IFN-α应答性影响的研究报道很多[6-14]. 但有关HBV准种遗传异质性对IFN-α应答性影响的研究尚未见报道. 我们检测了对IFN-α治疗完全应答和无应答的各10例慢性乙型肝炎患者治疗前体内HBV的准种情况, 观察HBV准种的异质性对IFN-α疗效的影响.
2001年度住院接受IFN-α 2 b治疗的慢性乙型肝炎20例, 完全应答和无应答各占10例, 男13例, 女7例, 年龄23-56岁, 临床诊断符合2000-09西安会议《病毒性肝炎防治方案》标准. 临床检测HbsAg、 HBeAg和抗-HBc阳性. 患者均无使用HBV疫苗史和抗病毒治疗史. 无甲、丙、丁和戊型肝炎病毒合并感染. 患者在治疗开始前抽取静脉血, 保存于-70℃备用. 所有患者均接受IFN-α 2 b 6Mu肌注, 3次/wk, 疗程3 mo, 治疗结束后随访3 mo. IFN-α治疗完全应答的标准是: 治疗结束时 HBV DNA、HBeAg均转阴, ALT复常, 治疗停止后3 mo仍维持不变. IFN-α治疗无应答的标准是: HBV DNA、HBeAg均未转阴, ALT亦未复常. IFN-α 2 b为安徽安科生物高技术有限公司产品. 血清HBV DNA的定量检测采用荧光定量PCR法(FQ-PCR), FQ-PCR试剂盒为深圳匹基生物技术公司产品, Lightcycler检测仪为Roche公司产品.
血清DNA提取, 用蛋白酶K消化、饱和酚: 氯仿抽提法提取患者血清100 mL中的DNA. PCR引物合成, 以adr亚型[15]HBV基因序列为依据设计引物. 上游引物: 5'-TGTACTAGGAGGCTGTAG-3'(1 769-1 786 nt), 下游引物: 5'-CCACCTTATGAGTCCAAG-3'(2 481-2 464 nt), 扩增片段长约712 bp, 扩增区域包括整个C-ORF区序列. PCR100 mL 产物在10 g/L琼脂糖凝胶中电泳后, 长波紫外灯下切取目的条带, 用玻璃奶法(上海生工)回收PCR产物, 取纯化产物1-2 mL与pCRβ2.1T载体(Invitrogen公司产品)14℃连接过夜. 次日用连接混合物转化INVαF' 感受态细菌, 细菌复苏后涂于含有氨苄青霉素和X-gal的LB琼脂平板上, 37℃培养20 h. 从转化的克隆中分别用消毒牙签挑出40个左右的白色菌落, 分别"接种"进PCR反应混合物中(PCR反应体积100 mL中包含10×缓冲液10 mL、25 mmol/L MgCI2 2 mL、10 mmol/L dNTP 2 mL、二种引物各1 mL(50 pmoL)、和Taq 酶 0.5 mL(5M u/L). 同时牙签分别划种在另一含氨苄青霉素的LB琼脂平板上, 以备复查. PCR循环条件为94℃ 1 min, 58℃ 1 min, 72℃ 1 min, 先做6次循环. 接着94℃ 1 min, 54℃ 1 min, 72℃ 1 min, 继续再做24次循环, 总共30个循环. 反应结束后, 取PCR产物5 mL, 在含EB的10 g/L琼脂糖凝胶中电泳, 检查每个样品的扩增结果. 随机从扩增阳性的样本中选取34个PCR产物, 再从中随机选取1个PCR产物作为驱动序列进行构像敏感凝胶电泳(conformation-sensitive gel electrophoresis, CSGE)检测[16]. 聚丙烯酰胺凝胶主要成分: 60 g/L聚丙烯酰胺、150 g/L乙二醇、200 g/L甲酰胺和150 g/L尿素. 电泳缓冲液为0.5×TTE(1×TTE含89 mmol/L Tris、15 mmol/L Taurine、0.5 mmol/L EDTA pH 9.0). 电泳条件, 电压200 V, 室温下电泳18 h. 准种异质性分析参照Delwart et al[17]方法进行, 包括: 准种复杂性 = 不相同电泳带型克隆的数目(代表组成准种的病毒株数); 准种内病毒株(克隆)频率 = 相同电泳带型克隆的数目÷克隆总数(33)×100%; 准种毒株平均遗传差异性 = 所有克隆两条异源双链条带的平均相对移行距离之和÷驱动克隆同源双链条带的相对移行距离×克隆总数(33).
统计学处理t检验.
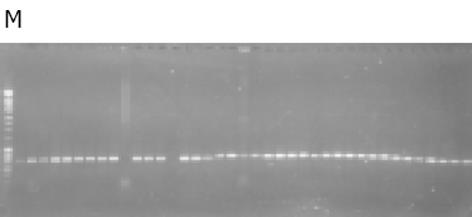
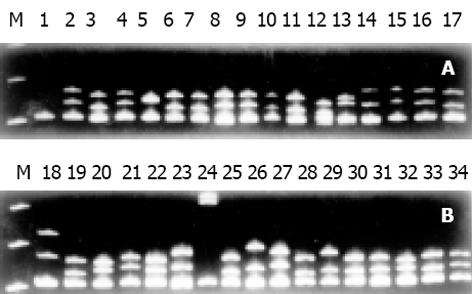
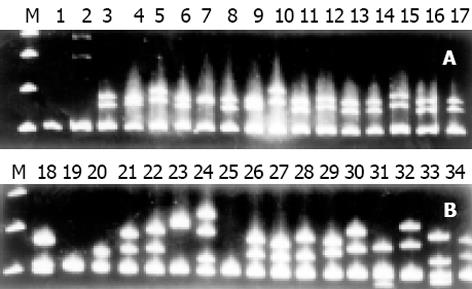
从待测血清中扩增的HBV C-ORF片段经纯化、连结和转化感受态细胞后, 在2个90 mm LB 平板上共获得大约200个转化克隆, 其中70-80%为白色菌落. 在挑出的40个菌落中, PCR证实90%以上含有插入片段(图1). 20例患者CSGE均获得清晰的电泳图谱(图2, 图3). HBV准种复杂性、毒株频率及毒株遗传距离的结果见表1.在两组患者HBV DNA 含量7.27×1010±8.79×1010vs 5.16×1010±5.13×1010(P>0.05), HBV准种复杂性8.30±1.89 vs 18.5±2.68(P<0.001), 毒株间遗传差异0.926±0.008 vs 0.869±0.016(P<0.001).
| Patient | HBV DNA load | Quasispecies Heterogeneity | ||
| n = 20 | (copies/L) | Complexity | Clonal frequencies (%) | Diversity |
| Sustained Responsive (SR) | ||||
| 1 | 9.538×1010 | 6 | 3-48.5 | 0.926 |
| 2 | 2.547×1010 | 10 | 3-57.6 | 0.931 |
| 3 | 5.574×1010 | 9 | 3-51.5 | 0.927 |
| 4 | 4.896×109 | 11 | 3-45.5 | 0.942 |
| 5 | 2.760×1010 | 5 | 3-69.7 | 0.924 |
| 6 | 2.248×1011 | 10 | 3-60.6 | 0.933 |
| 7 | 3.436×109 | 8 | 3-72.7 | 0.923 |
| 8 | 2.987×1010 | 8 | 3-63.6 | 0.921 |
| 9 | 2.384×1011 | 9 | 3-57.6 | 0.918 |
| 10 | 2.162×1010 | 7 | 3-66.7 | 0.914 |
| Nonresponsive(NR) | ||||
| 11 | 2.206×1010 | 27 | 3-12.1 | 0.897 |
| 12 | 1.158×1011 | 16 | 3-18.2 | 0.856 |
| 13 | 7.656×1010 | 16 | 3-18.2 | 0.869 |
| 14 | 1.769×107 | 18 | 3-21.2% | 0.843 |
| 15 | 1.341×1011 | 18 | 3-21.2 | 0.895 |
| 16 | 1.069×1011 | 17 | 3-24.2 | 0.876 |
| 17 | 2.647×1010 | 16 | 3-21.2 | 0.855 |
| 18 | 4.518×109 | 13 | 3-18.2 | 0.847 |
| 19 | 1.197×1010 | 21 | 3-21.2 | 0.889 |
| 20 | 2.153×106 | 11 | 3-15.2 | 0.812 |
| mean±SD | ||||
| SR | 7.27×1010 ±8.79×1010a | 8.30±0.89b | 0.926±0.008c | |
| NR | 5.16×1010±5.13×1010 | 18.5±2.68 | 0.869±0.016 | |
病毒准种(quasispecies)是病毒在感染个体内, 由于不断的变异和选择而形成的异质性病毒群体[18-21]. 病毒准种特性及其临床意义的研究近来受到了越来越多的关注. 但是准种理论的大量研究结论主要来自于对HIV和HCV等RNA病毒的研究[22-29]. 而有关HBV病毒准种特性的研究报道很少, 目前国外只有少量的研究报道, 初步证实了在慢性HBV感染者中HBV存在准种特性, 国内也有学者研究了HBV多个基因区及HBV基因组全序列[30-35], 研究结果表明在慢性HBV感染者中的确存在准种现象, 并发现HBV准种有如下特点: (1)HBV准种是慢性HBV感染者普遍存在的现象, 而不是个别患者的特点; (2)HBV准种特点贯穿于HBV整个基因组; (3)HBV准种特性具有重要地生物学和临床意义; (4)HBV准种的研究, 将HBV基因序列的动态变化和种群的概念引入了HBV的研究领域中, 在HBV感染的个体内, 病毒株的变异不再是指单-病毒基因序列的改变, 而是指HBV种群的漂变(shift). 不过这些研究报道的病例数和分析的克隆数均较少(2-8克隆/每份血清样本). HBV准种是一个异质性的病毒群体, 慢性乙型肝炎患者血液中HBV DNA拷贝数常在百万至十亿之间, 随机抽取单个或少数几个克隆株可能难以真实地代表HBV的准种组成. 在前期的研究中, 我们从1例慢性乙型肝炎患者的血清样本克隆中, 随机选取34个克隆进行核酸序列分析, 从中就发现28种不同的核酸序列(已提交NIH GenBank, 查询号是AF480337-AF480364). 在本研究中, 我们对每份血清样本分析了33 个克隆, 克隆型(clonotype 待检样本与驱动子所形成的异源双链和同源双链在CSGE图谱上的带型组合, 不同的克隆型代表不同的准种成份)介于5-27之间. 表明HBV准种组成在部分慢性乙型肝炎是非常复杂的, 需要尽可能多地分析HBV的准种成份, 才可能对其有一个全面的了解.
多数有关HBV变异株对IFN-α应答性影响的研究集中在HBV的C-ORF区[36-38], 因而本研究我们也选择了这个区域. 我们的研究结果显示: 在慢性乙型肝炎患者血清中, HBV种群在 C-ORF区序列的确存在明显多态性, 且HBV准种的复杂性和病毒株间的遗传差异性在IFN-α治疗应答患者和无应答患者之间存在显著性差异. 研究结果证实在慢性乙型肝炎患者体内HBV存在准种特性, 且HBV准种的异质性对IFN-α的应答性有影响. 本研究结果与在HCV所作的相关研究相-致[39-43]. 另外, 我科前期的另一项研究已经发现, 在感染个体内HBV基因高同源性是急性自限性乙型肝炎的主要特征[44]. 我们再次从另一个角度证实了HBV准种特性的临床意义. 我们的研究结果还显示, 治疗前HBV DNA 的载量在两组患者中无显著性差异. 本研究共研究了20份病例, 对每份样本均分析了33个克隆, 相对具有较好的代表性, 研究结果较好的展示了慢性乙型肝炎HBV准种的异质性.
准种特性的存在可能是病毒进化的一种生存优势, 病毒最大限度地"制造"出自己的大量变异株, 在这些变异株中可能包括了潜在有用的病毒, 如对抗病毒制剂有抵抗能力、能逃避CTL攻击和诱导免疫耐受的病毒变异株. 这样当环境改变后病毒可以快速的做出反应, 从而保证其在宿主体内的生存. 最近的研究还发现病毒准种类似于人体免疫系统具有记忆能力, 当准种再次遇到经历过的环境时, 保存在突变体谱内的少量病毒株将迅速地大量复制成为准种的主要序列[45-47]. 因此如果病毒准种的异质性越大, 组成准种的病毒株就越复杂, 其中包含的各种抵抗株可能就越多, 其适应环境变化的能力就越强. 另外, 要清除这样复杂的病毒群体, 对宿主免疫系统也是一个很大的负荷. 所以IFN-α治疗的难度可能就越大. 这-点在HCV的研究中已得到证实. 从理论上分析, 复杂性和差异性二者都是与病毒变异性相关的指标, 二者越大, 组成准种的病毒株就越复杂, 对IFN-α治疗的应答性就越差. 而HBV DNA载量主要是由准种中主要序列的复制能力所决定, 这与IFN-α的应答性之间没有直接地联系. 所以HBV准种的异质性对IFN-α治疗的应答性有影响, 而血清中HBV DNA载量与IFN-α的应答性无关. 对HBV DNA载量对IFN-α治疗应答性的影响目前有不同的报道, 本文所研究的病例数偏少, 下一步可能还需要研究更多的病例以证实这个问题. 早期研究发现IFN-α疗效与ALT高低有密切的关系, 而ALT升高是宿主对HBV产生免疫应答的重要标志, 但ALT变化的影响因素众多, 不-定能准确预测IFN-α疗效, 为此, 我们设想, 患者IFN-α治疗前HBV准种的异质性可以作为预测IFN-α疗效的补充指标.
编辑: N/A
| 2. | Gordien E, Rosmorduc O, Peltekian C, Garreau F, Bréchot C, Kremsdorf D. Inhibition of hepatitis B virus replication by the interferon-inducible MxA protein. J Virol. 2001;75:2684-2691. [PubMed] [DOI] |
| 3. | Sagnelli E, Coppola N, Scolastico C, Mogavero AR, Stanzione M, Filippini P, Felaco FM, Piccinino F. Isolated anti-HBc in chronic hepatitis C predicts a poor response to interferon treatment. J Med Virol. 2001;65:681-687. [PubMed] [DOI] |
| 4. | Simon K, Rotter K, Zalewska M, Gładysz A. HBV-DNA level in blood serum as a predictor of good response to therapy with interferon-alpha-2b of patients with chronic hepatitis B. Med Sci Monit. 2000;6:971-975. [PubMed] |
| 5. | Fukuda R, Ishimura N, Hamamoto S, Moritani M, Uchida Y, Ishihara S, Akagi S, Watanabe M, Kinoshita Y. Co-infection by serologically-silent hepatitis B virus may contribute to poor interferon response in patients with chronic hepatitis C by down-regulation of type-I interferon receptor gene expression in the liver. J Med Virol. 2001;63:220-227. [PubMed] [DOI] |
| 6. | Blum HE. Variants of hepatitis B, C and D viruses: molecular biology and clinical significance. Digestion. 1995;56:85-95. [PubMed] [DOI] |
| 7. | Hannoun C, Horal P, Krogsgaard K, Lindh M; INTERPRED Study Group. Mutations in the X region and core promoter are rare and have little impact on response to interferon therapy for chronic hepatitis B. J Med Virol. 2002;66:171-178. [PubMed] [DOI] |
| 8. | Papatheodoridis GV, Hadziyannis SJ. Diagnosis and management of pre-core mutant chronic hepatitis B. J Viral Hepat. 2001;8:311-321. [PubMed] [DOI] |
| 9. | Zhang X, Han Y, Lu Z, Gao J, Luo Z, Zhang D. Effect of multiple mutations in the core promoter and pre-core/core region of hepatitis B virus genome on the response to interferon in e antigen-positive chronic hepatitis B. J Gastroenterol Hepatol. 2001;16:393-398. [PubMed] [DOI] |
| 10. | Okamoto H, Tsuda F, Akahane Y, Sugai Y, Yoshiba M, Moriyama K, Tanaka T, Miyakawa Y, Mayumi M. Hepatitis B virus with mutations in the core promoter for an e antigen-negative phenotype in carriers with antibody to e antigen. J Virol. 1994;68:8102-8110. [PubMed] |
| 11. | Li J, Buckwold VE, Hon MW, Ou JH. Mechanism of suppression of hepatitis B virus precore RNA transcription by a frequent double mutation. J Virol. 1999;73:1239-1244. [PubMed] |
| 12. | Buckwold VE, Xu Z, Chen M, Yen TS, Ou JH. Effects of a naturally occurring mutation in the hepatitis B virus basal core promoter on precore gene expression and viral replication. J Virol. 1996;70:5845-5851. [PubMed] |
| 13. | Nakao K, Nakata K, Yamashita M, Tamada Y, Hamasaki K, Ishikawa H, Kato Y, Eguchi K, Ishii N. p48 (ISGF-3gamma) is involved in interferon-alpha-induced suppression of hepatitis B virus enhancer-1 activity. J Biol Chem. 1999;274:28075-28078. [PubMed] [DOI] |
| 14. | Rang A, Heise T, Will H. Lack of a role of the interferon-stimulated response element-like region in interferon alpha -induced suppression of Hepatitis B virus in vitro. J Biol Chem. 2001;276:3531-3535. [PubMed] [DOI] |
| 15. | Fujiyama A, Miyanohara A, Nozaki C, Yoneyama T, Ohtomo N, Matsubara K. Cloning and structural analyses of hepatitis B virus DNAs, subtype adr. Nucleic Acids Res. 1983;11:4601-4610. [PubMed] [DOI] |
| 16. | Ganguly A, Rock MJ, Prockop DJ. Conformation-sensitive gel electrophoresis for rapid detection of single-base differences in double-stranded PCR products and DNA fragments: evidence for solvent-induced bends in DNA heteroduplexes. Proc Natl Acad Sci U S A. 1993;90:10325-10329. [PubMed] [DOI] |
| 17. | Delwart EL, Shpaer EG, Louwagie J, McCutchan FE, Grez M, Rübsamen-Waigmann H, Mullins JI. Genetic relationships determined by a DNA heteroduplex mobility assay: analysis of HIV-1 env genes. Science. 1993;262:1257-1261. [PubMed] [DOI] |
| 18. | Eigen M. Selforganization of matter and the evolution of biological macromolecules. Naturwissenschaften. 1971;58:465-523. [PubMed] [DOI] |
| 19. | Domingo E, Holland JJ. RNA virus mutations and fitness for survival. Annu Rev Microbiol. 1997;51:151-178. [PubMed] [DOI] |
| 20. | Holland J, Spindler K, Horodyski F, Grabau E, Nichol S, VandePol S. Rapid evolution of RNA genomes. Science. 1982;215:1577-1585. [PubMed] [DOI] |
| 21. | Ruiz-Jarabo CM, Arias A, Baranowski E, Escarmis C, Domingo E. Memory in viral quasispecies. J Virol. 2000;74:3543-3547. |
| 22. | Farci P, Strazzera R, Alter HJ, Farci S, Degioannis D, Coiana A, Peddis G, Usai F, Serra G, Chessa L. Early changes in hepatitis C viral quasispecies during interferon therapy predict the therapeutic outcome. Proc Natl Acad Sci U S A. 2002;99:3081-3086. [PubMed] [DOI] |
| 23. | Hirschel B. Planned interruptions of anti-HIV treatment. Lancet Infect Dis. 2001;1:53-59. [PubMed] [DOI] |
| 24. | Asselah T, Martinot M, Cazals-Hatem D, Boyer N, Auperin A, Le Breton V, Erlinger S, Degott C, Valla D, Marcellin P. Hypervariable region 1 quasispecies in hepatitis C virus genotypes 1b and 3 infected patients with normal and abnormal alanine aminotransferase levels. J Viral Hepat. 2002;9:29-35. [PubMed] [DOI] |
| 25. | Alves K, Canzian M, Delwart EL. HIV type 1 envelope quasispecies in the thymus and lymph Nodes of AIDS patients. AIDS Res Hum Retroviruses. 2002;18:161-165. [PubMed] [DOI] |
| 26. | Collins KR, Quinones-Mateu ME, Wu M, Luzze H, Johnson JL, Hirsch C, Toossi Z, Arts EJ. Human immunodeficiency virus type 1 (HIV-1) quasispecies at the sites of Mycobacterium tuberculosis infection contribute to systemic HIV-1 heterogeneity. J Virol. 2002;76:1697-1706. [DOI] |
| 27. | Fraser C, Ferguson NM, Anderson RM. Quantification of intrinsic residual viral replication in treated HIV-infected patients. Proc Natl Acad Sci U S A. 2001;98:15167-15172. [PubMed] [DOI] |
| 28. | Domingo E, Ruiz-Jarabo CM, Sierra S, Arias A, Pariente N, Baranowski E, Escarmis C. Emergence and selection of RNA virus variants: memory and extinction. Virus Res. 2002;82:39-44. [DOI] |
| 29. | Toja M, Escarmís C, Domingo E. Genomic nucleotide sequence of a foot-and-mouth disease virus clone and its persistent derivatives. Implications for the evolution of viral quasispecies during a persistent infection. Virus Res. 1999;64:161-171. [PubMed] [DOI] |
| 30. | Blum HE. Hepatitis B virus: significance of naturally occurring mutants. Intervirology. 1993;35:40-50. [PubMed] [DOI] |
| 31. | Carman W, Thomas H, Domingo E. Viral genetic variation: hepatitis B virus as a clinical example. Lancet. 1993;341:349-353. [PubMed] [DOI] |
| 32. | Dong J, Cheng J, Wang QH, Shi SS. The preliminary study on hepatitis B virus quasispecies in a patient with chronic HBV infection. Chin J Intern Med. 2000;39:838-839. |
| 33. | Dong J, Li J, Shi SS. The study on quasispecies of hepatitis B virus(HBV): HBV genome as an example. Med J Chin PLA. 2002;27:116-118. |
| 34. | Liu Y, Dong J, Huang JK. Effect of hepatitis B virus x gene heterogeneity on ittransactivation. Med J Chin PLA. 2002;27:125-127. |
| 35. | Liu Y, Dong J, Huang JK. Effect of hepatitis B virus core promoter gene heterogeneity on it抯 transcriptional activity. Med J Chin PLA. 2002;27:128-130. |
| 36. | Manesis EK, Hadziyannis SJ. Interferon alpha treatment and retreatment of hepatitis B e antigen-negative chronic hepatitis B. Gastroenterology. 2001;121:101-109. [PubMed] [DOI] |
| 37. | Wartelle-Bladou C, Lafon J, Trépo C, Pichoud C, Picon M, Pellissier JF, Zoulim F. Successful combination therapy of polyarteritis nodosa associated with a pre-core promoter mutant hepatitis B virus infection. J Hepatol. 2001;34:774-779. [PubMed] [DOI] |
| 38. | Yuen MF, Hui CK, Cheng CC, Wu CH, Lai YP, Lai CL. Long-term follow-up of interferon alfa treatment in Chinese patients with chronic hepatitis B infection: The effect on hepatitis B e antigen seroconversion and the development of cirrhosis-related complications. Hepatology. 2001;34:139-145. [PubMed] [DOI] |
| 39. | Yeh BI, Han KH, Lee HW, Sohn JH, Ryu WS, Yoon DJ, Yoon J, Kim HW, Kong ID, Chang SJ. Factors predictive of response to interferon-alpha therapy in hepatitis C virus type 1b infection. J Med Virol. 2002;66:481-487. [PubMed] [DOI] |
| 40. | Takahashi K, Takahashi T, Takahashi S, Watanabe K, Boku S, Matsui S, Arai F, Asakura H. Difference in quasispecies of the hypervariable region 1 of hepatitis C virus between alcoholic and non-alcoholic patients. J Gastroenterol Hepatol. 2001;16:416-423. [PubMed] [DOI] |
| 41. | Gürsoy M, Gür G, Arslan H, Ozdemir N, Boyacioglu S. Interferon therapy in haemodialysis patients with acute hepatitis C virus infection and factors that predict response to treatment. J Viral Hepat. 2001;8:70-77. [PubMed] [DOI] |
| 42. | Hu KQ, Vierling JM, Redeker AG. Viral, host and interferon-related factors modulating the effect of interferon therapy for hepatitis C virus infection. J Viral Hepat. 2001;8:1-18. [DOI] |
| 43. | Sarrazin C, Kornetzky I, Rüster B, Lee JH, Kronenberger B, Bruch K, Roth WK, Zeuzem S. Mutations within the E2 and NS5A protein in patients infected with hepatitis C virus type 3a and correlation with treatment response. Hepatology. 2000;31:1360-1370. [PubMed] [DOI] |
| 44. | Zhang R, Wang HL, Gu CH. High homogeneity of HBV genes is mainly character of acute hepatitis B. Shijie Huaren Xiaohua Zazhi. 1999;7:434-435. |
| 45. | Domingo E, Ruiz-Jarabo CM, Sierra S, Arias A, Pariente N, Baranowski E, Escarmis C. Emergence and selection of RNA virus variants: memory and extinction. Virus Res. 2002;82:39-44. [PubMed] |
| 46. | Ruíz-Jarabo CM, Arias A, Molina-París C, Briones C, Baranowski E, Escarmís C, Domingo E. Duration and fitness dependence of quasispecies memory. J Mol Biol. 2002;315:285-296. [PubMed] [DOI] |