修回日期: 2002-10-15
接受日期: 2002-10-21
在线出版日期: 2003-02-15
目的: 建立针对乙型肝炎病毒(HBV)全长型(fRNA)和顿挫型转录体(trRNA)的血清学检测方法, 并探讨其临床应用价值.
方法: 自患者血清中提取病毒核酸, 经PCR及PRT-PCR进行扩增, 琼脂糖电泳显示产物, Southern印迹验证反应的特异性. 取代表性产物克隆, 测序.
结果: 在HBV慢性携带者的血清中检测到了在上述不同poly(A)位点成熟的病毒RNA. 血清中fRNA的检出与e抗原阳性和较强的病毒DNA信号相对应, 与转氨酶活性呈正相关, 这-血清学指标反映了病毒复制; 而trRNA的检出与e抗原阳性和转氨酶活性无关, 不象 fRNA那样依赖于血清中病毒DNA的量. 二者检出率随年龄有不同变化, 前者随年龄增加而进行性减低乃至转阴; 而后者在10-20岁期间检出率升至80%, 以后维持在较高水平. 即使在某些表面抗原阴性血清中, 也能检测到trRNA和不在上述两个位点成熟的病毒RNA. 这些转录体在某些隐源性肝硬变和丙型肝炎患者血清中也存在.
结论: 病毒转录体的血清学检测有助于确定目前尚不认识的HBV感染期, 可用来更准确地区分复制期和非复制期以及检出隐匿性HBV感染.
引文著录: 苏勤, 张伟, 刘节, 王淑芳, KunioTakegoshi, Claus HSchrÖer. 乙型肝炎病毒慢性感染者血清中不同类型病毒转录体的检测及其意义. 世界华人消化杂志 2003; 11(2): 134-143
Revised: October 15, 2002
Accepted: October 21, 2002
Published online: February 15, 2003
AIM: To establish an assay for detecting serum hepatitis B virus (HBV) transcripts including the full-length (fRNA) and truncated RNA molecules (trRNA) in chronic HBV carriers, and to investigate its clinical significance.
METHODS: The serum viral nucleic acids were analyzed using PCR and RT-PCR targeted to the HBV x protein-encoding region. Reaction specificity was confirmed by Southern blotting. Representative amplification products were cloned and sequenced.
RESULTS: Different viral transcripts including fRNA and trRNA were identified in sera of HBV carriers. Presence of fRNA was closely correlated with seropositivity of hepatitis B e antigen and viral DNA. However, trRNA did not depend on serum e antigen, its association with circulating viral DNA was weak. Similarly, no remarkable correlation was observed between the levels of trRNA and the degrees of liver damage. Different age-dependent representations for fRNA and trRNA were recognized, fRNA was progressively decreased to undetectable levels and trRNA increased to high levels in the second decade of life and then remained in high level in the rest of life. The trRNA and RNA without polyadenylation at either of the two addition sites were detected even in the absence of any other conventional HBV markers such as viral DNA. They were also observed in sera from patients with cryptogenic cirrhosis or chronic hepatitis C.
CONCLUSION: The viral transcripts are potential serum markers for identifying replicative and non-replicative infection stages and diagnosis of occult HBV infection.
- Citation: Su Q, Zhang W, Liu J, Wang SF, Takegoshi K, SchrÖer CH. Detection of different viral transcripts in sera of patients with chronic hepatitis B virus infection. Shijie Huaren Xiaohua Zazhi 2003; 11(2): 134-143
- URL: https://www.wjgnet.com/1009-3079/full/v11/i2/134.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i2.134
通常乙型肝炎病毒慢性感染是指血中乙型肝炎表面抗原(HBsAg)阳性持续达6 mo, 依其病程分为复制期和非复制期[1,2]. 不管是否引起临床上可检测到的慢性肝炎, HBsAg携带状态导致肝细胞癌(HCC)发生危险性明显增加[2-4]. 对于众多的已感染HBV的患者来讲, HCC发生的早期检测是一项迫切需要解决的任务[5].
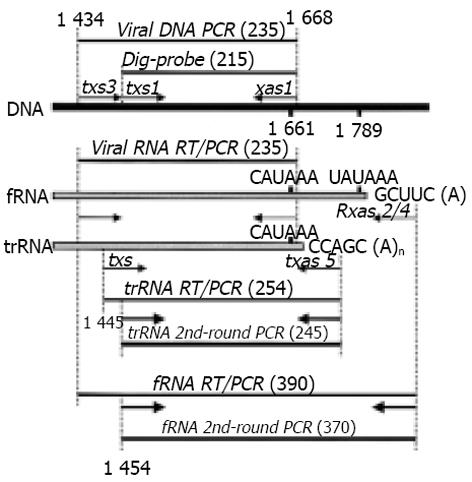
HBV有4个阅读框, 分别称为PreS2/PreS1/S, PreC/C, 聚合酶和X基因, 转录为3 500个核苷酸的前基因组转录体和2 400及700个核苷酸的亚基因组转录体. 其中最小转录体的翻译产物称为乙型肝炎x蛋白(hepatitis B x protein, HBx), 与HCC发生有关[5-8]. 在复制期间, 所有上述病毒转录体利用同一个信号成熟, 这-信号位于1 789位上的UAUAAA结构区[9], 此研究中这一类HBV转录体称为全长型RNA(full-length RNA, fRNA). 然而, 整合入染色体内的病毒DNA常有HBx阅读框3'端缺失[10,11], 因而fRNA的产生受到影响, 转录时HBx序列与下游的细胞序列融合, 形成相应的嵌合转录体和病毒/细胞融合蛋白[12]. 另一种病毒转录体还可利用HBx阅读框内一个CAUAAA结构区(1661位)成熟, 称为顿挫型RNA(truncated RNA, trRNA). trRNA存在于HCC及其周围的肝实质细胞内[12], 编码的顿挫型蛋白可能保持有全长HBx的生长调控作用[13].
能区分上述两种病毒RNA 3'端结构的技术已经建立, 但这种检测通常需要新鲜肝标本[14]. 此研究建立了利用血清来源RNA检测HBV 转录体的技术, 并且从多数HBsAg阳性血清中检测到fRNA, 其存在提示复制期感染; 而trRNA为主则提示更晚期改变.
此研究共检查了437例血清标本(表1). 其中观察组为295例, 118例标本来自HCC患者(第四军医大学唐都医院71例, 天津医科大学肿瘤医院25例, 陕西省肿瘤医院16例, 日本Takaoka地区Takegoshi内科医院8例), 168例来自无HCC的HBsAg携带者(唐都医院167例, Takegoshi内科医院1例), 9例来自收住唐都医院的隐源性肝硬变患者; 对照组为142例HBsAg阴性标本, 75例来自以非肝脏病变在唐都医院住院的患者, 37名来自健康西安市民, 30例来自德国Lueck市的健康献血申请者. 血清分离后贮于-80℃冰箱. 应用试剂盒(Roche, mannheim, germany)提取病毒核酸, 每次提取用血清200 mL, 提取物终体积为50 mL.
| 血清来源 | 检测n | DNA+RNA(%) | 病毒DNA(%) | 病毒转录体(%) | ||
| HBx RNA | fRNA | trRNA | ||||
| HBsAg +a | 237 | 220(92.8) | 165(69.6) | 211(89.0) | 143(60.3) | 142(59.9) |
| 有HCC | 69 | 62(89.9) | 58(84.1) | 56(81.2) | 46(66.7) | 34(49.3) |
| 无HCC | 168 | 158(94.0) | 107(63.7) | 155(92.3) | 97(57.7) | 108(64.3) |
| HBsAg -/有HCCb | 49 | 29(59.2) | 9(18.4) | 19(38.8) | 9(18.4) | 14(28.6) |
| HBV抗体+c | 26 | 19(73.1) | 6(23.1) | 12(46.2) | 7(26.9) | 10(38.5) |
| HBV抗体- | 23 | 10(43.5) | 3(13.0) | 7(30.4) | 2(8.7) | 4(17.4) |
| HBsAg -, 有肝硬变d | 9 | 5(55.6) | 0(0.0) | 2(22.2) | 2(22.2) | 3(33.3) |
| HBsAg -, 其他患者e | 75 | 11(14.7) | 1(1.3) | 5(6.7) | 4(5.3) | 9(12.0) |
| 健康市民, 中国西安 | 37 | 4(10.8) | 0(0.0) | 3(8.1) | 0(0.0) | 2(5.4) |
| 健康市民, 德国Lueck | 30 | 0(0.0) | 0(0.0) | 0(0.0) | 0(0.0) | 0(0.0) |
上游引物包括txs3(1434, Xho I酶切排序): 5'-TCT CAT CTG CCG GAC CGT GT -3', txs1(1 454): 5'-GCA CTT CGC TTC ACC TCT GC -3', txs(1 445): 5'-GGA CCG TGT GCA CTT CGC TT -3', souts(0 001): 5'-TCG AGG ACT GGG GAC CCT GC -3', sins(0 482): 5'-TCC CAT CAT CCT GGG CTT TC -3', couts(1 732): 5'-ACT GTT CAA GCC TCC AAG CT -3', cins(1 760): 5'-GGT GGC TTT AGG GCA TGG AC -3', GAPDH1(3 755): 5'-CAT CTC TGC CCC CTC TGC TGA -3'; 下游引物包括txas5 (1683): 5'-(T)15 GCT GG -3', Rxas2(1808): 5'-(T)15 GAA GC -3', Rxas4(1806): 5'-(T)15 AGC TC -3', xas1(1 668): 5'-AAT TTA TGC CTA CAG CCT CC -3', xas2(1 634): 5'-TTA ACC TAA TCT CCT CCC CC -3', soutas(0 646): 5'-TGT ACA GAC TTG GCC CCC AA -3', sinas(0 624): 5'-CCA CAT CGT CCA TAT AAC TG -3', coutas(2 157): 5'-AGT GCG AAT CCA CAC TC -3', cinas(1 931): 5'-GTA TGG TGA GGT GAA CAA TG -3', GAPDH2(4 344): 5'-GGA TGA CCT TGC CCA CAG CCT -3'; 用于确定PCR产物极性的探针包括1 561+: 5'-GAC CGA CCT TGA GGC ATA CTT CAA AGA CTG -3', 1590-: 5'-CAG TCT TTG AAG TAT GCC TCA AGG TCG GTC -3'.
取2 μL提取物, 在含有引物对txs3/xas1的50 mL反应体系中应用Tag DNA聚合酶(Gibco BRL, Life technologies inc. , Gaithersburg, MD)按标准条件扩增35个循环. 应用fRNA的cDNA质粒pMT9T40A [12](200 pg)和trRNA的cDNA质粒pMT9T41A [12](200 pg)作为阳性对照, 用水作为阴性对照.
此研究把跨越引物对txs3/xas1结合点(1 434/1 638, Xho I酶切排序; 图1)的RNA统称为HBx RNA. 这-反应检测到的成分包括fRNA, trRNA和不在上述任何一个位点成熟的RNA分子, 其构成每例各不相同(见下文). 血清核酸提取物经过DNase I(Gibco)消化后, 应用50 μL单管RT-PCR系统(Roche)进行逆转录和扩增. 反应阳性对照仍然采用质粒DNA pMT9T40A和pMT9T41A, 阴性对照包括水, DNase I处理过的上述质粒DNA以及上述核酸提取过程中使用过的载体, 即18 S和22 S核糖体RNA(1 ng). 为了验证此反应的RNA特异性, 30份经过DNase I处理的来自HCC患者的标本(HBsAg阳性17例, 阴性13例)分别进行PCR和RT-PCR反应, 反应产物(2 mL)再加入到含有内引物对txs1/xas1或txs1/xas2的反应体系进行第2轮PCR. 为了确保上述HBx RNA检测反应的可靠性以及显示选择不同病毒基因区段作为检测靶序列的敏感性, 对于上述30份经DNase I处理的标本逆转录后还进行了HBV S和C区的巢式扩增. 病毒转录体的C区的体系中外引物对为couts/coutas, 内引物对为cins/cinas, 长度为172 bp; 预期产物检测S区检测体系外引物对为souts/soutas, 内引物对为sins/sinas, 预期反应产物长度为143 bp. 为了表明血清中RNA的广泛存在和其分子的相对完整性, 应用含有引物对GAPDH1/GAPDH2 [15]的RT-PCR体系对相同的标本中3-磷酸甘油醛脱氢酶(GAPDH) RNA进行逆转录和扩增.
由于锚定oligo d(T)引物能够特异的扩增poly(A) RNA [14], 检测病毒RNA的3'端结构的反应不需要DNase I预处理标本. 如图1所示, 检测fRNA的RT-PCR应用引物txs3/Rxas2和Rxas4, 第二轮PCR反应用引物txs1/Rxas2/Rxas4; 检测trRNA的RT-PCR用引物对txs3/txas5, 第二轮PCR用txs/txas5.为了进一步显示反应的扩增效率及特异性, 始终应用质粒DNA pMT9T40A和pMT9T41A进行平行扩增. 前者为fRNA RT-PCR阳性而trRNA反应阴性; 后者为fRNA反应阴性而trRNA反应阳性[14]. 其次, 1例自肝炎组织内提取的仅含有fRNA的提取物以及来自1例HCC组织仅含trRNA的提取物[14]也被用来做对照反应. 此外, 去离子水和18S/22S核糖体RNA也被用来作为阴性对照. 始终参照Kwok和Higuchi提出的原则[16]避免实验室内污染. 所有的反应至少重复-次.
应用含有引物对txs1/xas1的PCR体系以pMT9T40A作为模板, 以地高辛(digoxin, Dig)标记的dUTP作为掺入物制备杂交探针, 应用较低的掺入比(Dig-11-dUTP: dTTP = 1: 20)来证实反应产物的HBx区序列特异性.
扩增产物(15 mL)上样到含溴化乙锭(0.2 mg/mL)的琼脂糖凝胶(2%)进行电泳, 紫外线下观察, 然后将产物转印到Hybond-N+膜(Amersham)上, 应用Dig标记的探针进行杂交, 用羊抗Dig抗体(Roche)和碱性磷酸酶标记的兔抗羊IgG(Jackson immuno research laboratories, inc.)来显示杂交信号. 由于锚定oligo d(T)引物介导的RT-PCR反应常产生2条带, 一条泳动位置与预期的相同, 另一条泳动得较快. 应用P32-ATP标记的极性相反的探针(1 651+和1 590-)分别进行杂交, 以显示上述凝胶中每个带的DNA链构成.
部分血清标本的fRNA和trRNA扩增物被用来重组进克隆载体pCRβ2.1-TOPOβ(Invitrogen, groningen, the netherlands), 以Sanger等的方法进行DNA测序.
统计学处理 如表1所示, 此研究共发现286例HBV阳性标本, 其中237份HBsAg阳性, 49份HBsAg阴性但病毒核酸阳性. 这些标本都被用来分析上述不同种类的病毒转录体与年龄和血清免疫学指标的关系. 所有检测标本被分为4组:(1) HBsAg+/乙型肝炎e抗原(HBeAg) +;(2) HBsAg+/HBeAg-;(3)HBsAg-/病毒核酸+;(4)HBsAg-/病毒核酸-. 根据来自相当于40 mL血清内提取的病毒DNA和RT-PCR阳性信号强度估算其中靶分子的含量, 分级为弱(1+), 中(2+)和强(3+), 分别与应用1 fg, 10-100 fg和≥1 pg的cDNA(pMT9T40A和pMT9T41A)进行平行扩增得到的信号强度相当.
应用S-PLUS和StatXact 3 for Windows(Cytel software corp.)进行统计学运算, 应用Pearson相关系数(g)反映血清中病毒RNA和DNA与血清HBV免疫学标志, 谷-丙转氨酶(ALT)值以及年龄的关系, 并给出95%可信限(CI), 应用Krushal-Wallis等级检验描述不同年龄组间病毒RNA和DNA阳性率及阳性强度的区别, 应用Wilcoxon等级检验进行逐对比较. 应用Fisher检验(双侧)比较乙型肝炎核心抗体(anti-HBcAg)阳性和阴性以及携带和不携带HCC患者组病毒转录体以及DNA的检出率. 对于50例以内的小标本, 应用Fisher精确检验进行比较; 达到50例的大样本, 则用x2检验或StatXact中的近似精确检验来评价两组样本间的关系. 此文中所有相关值均以绝对值形式给出, 其方向从正文或图中都可看出. P<0.05被认为统计学显著.
首先应用PCR技术检测了HBsAg阳性组和阴性组以及携带或不携带HCC患者血清中对应于X基因区段的RNA和DNA, 以期与早先用肝组织及肝癌标本得到的数据[14]进行比较.
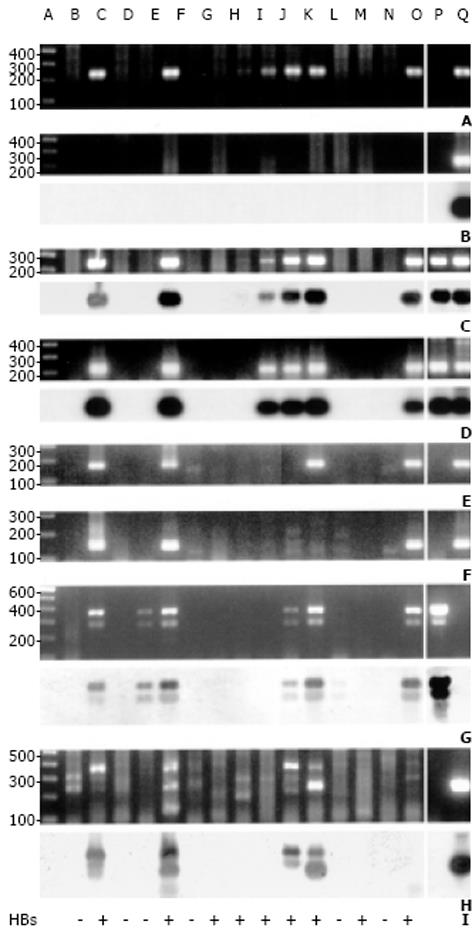
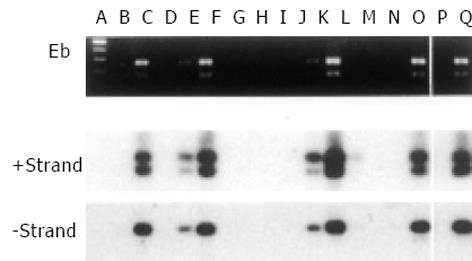
图1显示了待检测的HBx区DNA和不同RNA分子的位置及其引物对, 同时也列出了核酸杂交探针所处的位置(1454-1668). 图2所示为15份来自HCC患者代表性血清的检测数据. 病毒核酸提取物经过或不经DNase I消化分别进行PCR及RT-PCR, 显示标本B, E, I, K和O 中既含有病毒DNA又含有病毒转录体, 后者的检测中, HBx区的反应结果与S区和C区的检测结果基本-致, 但优于后两者(比较系列c, d, e和f). 已表明fRNA和trRNA RT-PCR特异扩增HBV RNA的3'端结构[14]. 此研究中, 有的病毒DNA阴性标本中也可检测到fRNA和trRNA(图2, 标本D和L; 图3, 标本M, S-U; 图4, 标本B, D和H), 这进一步证实了上述扩增反应的RNA特异性. 在检查过的437份标本中, GAPDH RT-PCR反应全部能显示出一个产物. 这-产物大小都为305 bp, 证实确定属于GAPDH的转录体, 而非其DNA, 因为这-引物在GAPDH DNA分子所跨的距离不是305 bp, 而是590 bp.
图3和图4显示了有代表性的标本中的RT-PCR和PCR结果, 多数标本中HBx RNA阳性, 但信号强度变化很大. 溴化乙锭染色和在Southern印迹膜上进行的杂交都显示, fRNA信号为2条带. 上边一条为主带, 位于预期的位置上(370 bp); 泳动较快的一条带强度较弱, 可能是由不对称扩增产生的过剩单股负链DNA. 产物的股极性测定试验证实了这-推测(图5), trRNA的3'端结构扩增产物大小为245 bp, 与预期的相同. 在fRNA中度及强阳性病例, trRNA RT-PCR也能显示出370 bp的信号, 克隆测序结果显示, 这-370 bp的cDNA片段与fRNA相同. 这-结果表明, trRNA扩增用的锚定oligo d(T)引物与fRNA 末端1 803-1 806位置的结构也有-定亲合力. 然而, trRNA信号(245 bp)的存在并不依赖于370 bp的fRNA产物(图3, 比较标本A, B和C). 很显然, 目前所用的trRNA RT-PCR既能识别trRNA, 也能检出fRNA.
上述阳性信号反映了40 mL 血清中的病毒RNA含量, 按其强度分级为弱(1+), 中(2+)和强(3+), 分别与应用1 fg, 10-100 fg和≥1pg cDNA质粒(pMT9T40A或pMT9T41A)产生的信号强度大致相当. 这忽略了体系中其他种类的RNA对反应的敏感性的影响, 因而这-估计仅反映了待测标本中靶RNA的最低值.
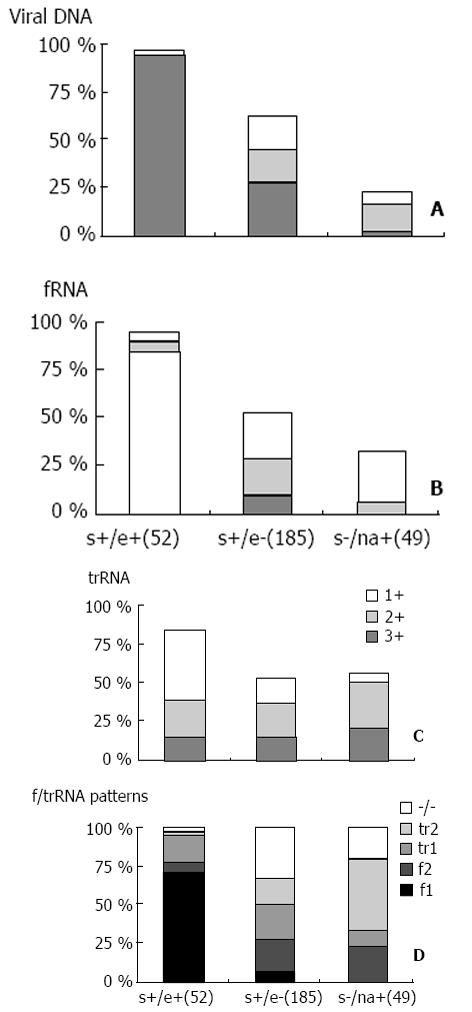
根据样本中fRNA和trRNA的存在与否及其相对强度, 将此组病例分为5型(图6D): fRNA为主型并强阳性(3+; 见图3, 标本B, C, E, F, H-J, O和Q); fRNA为主型并较弱阳性(2+或1+; 见图3标本K和图4中标本B); trRNA为主型(图3, 标本G和T); trRNA单独型(1+到3+; 见图3中A, M, N, S, R和图4中D和H)和fRNA-/trRNA-型(图3中D和R, 图4中A, E和I).
表2分别列出不同病例来源的fRNA和trRNA扩增产物的序列, 黑体字母显示与野生型不同的核苷酸残基. 已经明确, 病毒基因组1635/1639位(Xho I酶切坐标位置, 相当于Eco RI酶切坐标的1762/1764位)以及1526和1626位点上的替代突变标志着HBV感染进入晚期[17,18]. 我们的测序数据显示, trRNA既来源于保守的病毒DNA, 也转录于上述变异体(表2, trRNA); fRNA的测序结果与trRNA相似, 但不如后者保守(表2, fRNA).
| fRNAc(n = 17) | 位置b | ||||||||
| 1 484 | 1 486 | 1 526 | 1 592 | 1 600 | 1 619 | 1 626 | 1 635/1 637 | trRNAc(n = 16) | |
| 0 | G | G | C | T | A | G | T | AG | 1 |
| 1 | G | G | C | T | A | G | T | AG | 0 |
| 0 | C | G | C | T | G | G | T | AG | 2 |
| 0 | G | G | C | T | G | C | T | AG | 2 |
| 0 | G | G | T | T | G | G | T | AG | 1 |
| 0 | G | A | C | T | G | G | T | AG | 1 |
| 1 | G | G | C | T | G | G | T | AG | 2 |
| 1 | G | G | C | G | A | G | T | AG | 0 |
| 1 | G | G | C | G | C | G | T | AG | 0 |
| 0 | G | A | C | T | A | G | T | TA | 1 |
| 1 | G | A | C | T | A | G | C | TA | 0 |
| 1 | G | A | T | T | A | G | T | TA | 1 |
| 2 | G | G | C | T | A | G | C | TA | 0 |
| 0 | G | G | C | T | A | G | T | TA | 1 |
| 2 | G | G | T | T | A | G | T | TA | 2d |
| 0 | G | G | T | G | G | G | T | TA | 1 |
| 1 | G | G | C | G | G | G | C | TA | 0 |
| 1 | G | G | C | T | G | G | G | TA | 0 |
| 0 | G | A | C | T | G | G | G | TA | 1 |
| 1 | G | G | C | T | G | G | T | TA | 0 |
| 2 | G | G | C | G | A | G | C | TA | 0 |
| 1 | G | A | T | G | A | G | T | TA | 0 |
| 1 | G | A | C | G | T | G | T | TA | 0 |
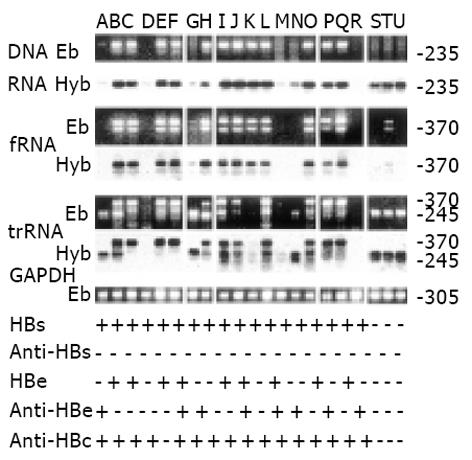
237例HBsAg阳性标本中, 多数呈病毒转录体阳性. fRNA和trRNA的总体阳性率相似, 约为60%(表1). 在几乎所有的fRNA阳性标本中, HBx RNA阳性信号也存在, 并与fRNA信号强度基本-致(图2, 3). 与半巢式PCR扩增的trRNA信号相比, 自trRNA为主或独有型的标本中经过-轮RT-PCR检测到的HBx RNA信号往往较弱(图3, 标本A, G, N和S). 有63例HBsAg阳性标本fRNA和trRNA均为阴性, 其中39例尚可检测到HBx RNA信号(图2, 标本I; 图3, 标本D), 提示这种标本中含有病毒RNA, 但他们不带上述poly(A)信号.
某些HBsAg阴性的标本也含有上述类型的病毒核酸, 因而也被认为是HBV携带者. 血清中病毒DNA的存在及其量反映了病毒复制过程. 为了探讨fRNA及trRNA与病毒DNA含量的关系, HBsAg阳性(n = 237)和HBsAg阴性但病毒核酸阳性的病例(n = 49)都被用来进行Pearson检验, fRNA与病毒DNA含量之间关系密切(g = 0.79, P<0.05), 但trRNA与病毒DNA含量之间的相关性很弱(g = 0.14, P<0.05). 很显然, 血清中trRNA的存在与否不象fRNA那样依赖于病毒DNA存在.
HBsAg+/HBeAg+, HBsAg+/HBeAg-和HBsAg-/病毒核酸阳性这三组病例的平均年龄为28.7, 42.0和52.7岁, 差别显著(P<0.01). 如图6所示, 病毒DNA信号在绝大数HBeAg阳性血清中很强, 但HBeAg转阴后多数明显减弱, 随HBsAg转阴进一步减弱(P<0.05); 血清中fRNA水平也有相同的变化(P<0.05), 与病毒DNA水平-致. 然而, 上述过程中trRNA的改变不明显(P>0.05). 可以明确的是, 上述过程中fRNA/trRNA比例明显改变了(P<0.05).
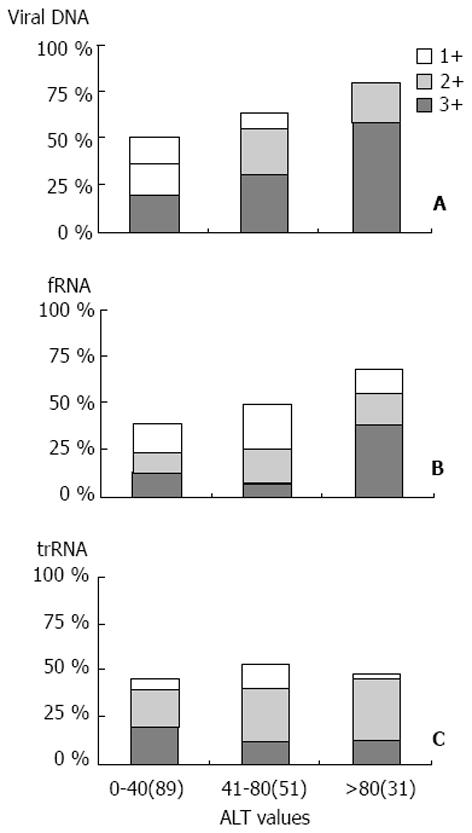
依常理而论, 血清中所有类型HBV 转录体的存在应该与肝细胞损伤有关. 如果真正是这样, 目前检测的上述指标只不过是反映了慢性肝炎的活动性, 病毒转录体的存在应该与ALT水平升高相关. 为了澄清这-点, 把171例检查过ALT的HBsAg阳性标本分为正常范围(0-40 IU/L), 轻度(41-80 IU/L)和重度升高组(>80 IU/L). 血清中fRNA(P<0.05; 图7B)和病毒DNA水平(P<0.05; 图7A) 与ALT值呈-定程度的正相关. 然而, trRNA的水平与ALT值无明显相关性(P>0.05; 图7C). 很显然, 血清中fRNA及病毒DNA的存在与肝损伤有-定程度的关联, 但trRNA的存在与肝实质损伤无关.
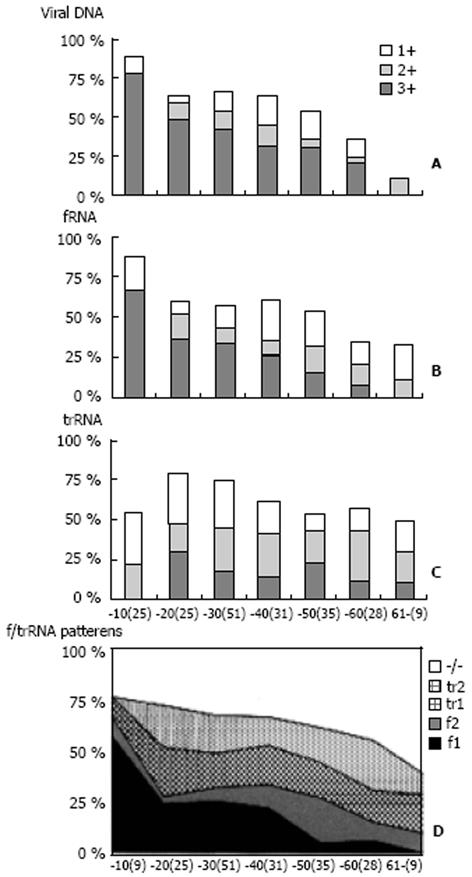
但trRNA持续存在 在HBV流行区, 绝大数慢性携带者是在围产期或婴儿期受到的感染[2]. 因此, 患者的年龄可反映病程的长短. 把来自未患HCC患者的168例HBsAg阳性标本和20例HBsAg阴性但病毒核酸阳性标本按年龄分组, 比较不同年龄组间病毒RNA和DNA水平的差别. 青少年患者血清中fRNA水平较高, 随着年龄增加其水平逐渐降低(P<0.05; 图8B), 这与病毒DNA水平的改变一致(P<0.05; 图8A). 然而, 血清trRNA水平改变不明显, 10岁以内其平均水平低于fRNA, 但在第二个10 a其水平与fRNA相当, 其后几十年仍保持较高水平, 无明显减低(P>0.05; 图8C). 在几十年进展中, 血清病毒RNA分子中fRNA比例逐渐减少而trRNA比例渐升高(P<0.05; 图8D). 在30-50岁区段, fRNA为主型的病例也由高水平转变为较低水平, 这类标本往往仍含有较高水平的病毒DNA. 高水平的fRNA为主型, 较低水平fRNA为主型, trRNA为主型, trRNA单独存在型和fRNA-/trRNA-型的平均年龄分别为27.5, 36.6, 34.6, 39.2和42.4岁, 其中第一组病例的平均年龄明显低于后四组任何一组(P<0.05).
或肝硬变患者血清中 在这组HBsAg阴性的HCC病例中, 超过半数的血清样本中可检出病毒核酸(29/49, 59.2%), anti-HBcAg和anti-HBsAg阳性样本的病毒核酸检出率(19/26, 73.1%)明显高于HBV免疫学标志完全阴性的病例(10/23, 43.5%; P<0.05). 在检出的29例病毒核酸阳性病例中, 20例仅检出病毒转录体(图2, 标本D和L), 5例查到病毒RNA和DNA同时存在, 4例中为病毒转录体阴性但DNA呈弱阳性. 在这49例HBsAg阴性标本中, fRNA和trRNA的检出率分别为18.4%和28.6%, HBx RNA的检出率高达38.8%(19/49; 表1).
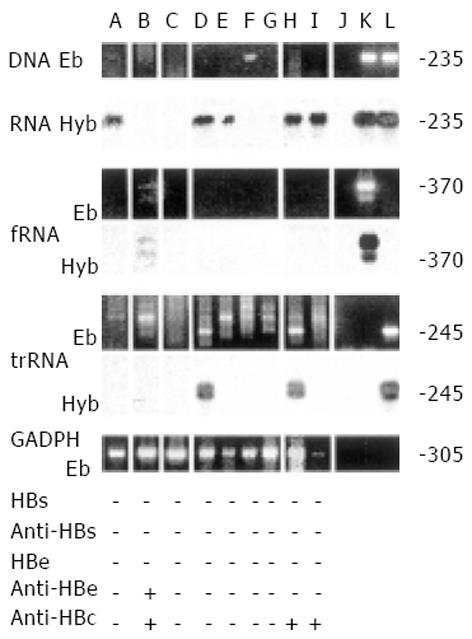
在这些HBsAg阴性HCC病例中, 9例HCV抗体阳性, 其中6例来自日本, 3例来自中国. 检测结果表明, 其中7例标本中有HBV核酸. 在这7例阳性标本中5例携带HBx RNA, 其中2例还查到trRNA; 1例仅查到fRNA, 余下1例仅查到病毒DNA(图4).
此研究还检查了9例来自西安的隐源性肝硬变患者的血清标本. 如表1所示, 5例为病毒转录体阳性(3例trRNA阳性, 2例fRNA阳性, 2例HBx RNA阳性), 无1例呈病毒DNA阳性.
此研究还检查了取自75例患有肝外慢性疾病的住院患者血清, 11例带有病毒转录体(14.7%), 其中1例还携带病毒DNA(1.3%). 在这11例阳性标本中, 9例的病毒转录体全部(7例; 图3, S和U)或主要(2例; 图3T)利其隐匿poly(A)信号终止, 2例的转录体仅受标准信号指导成熟.
来自中国西安的城市居民血清37份和自德国Lueck健康献血申请者的血清30份也被用作参照组. 如表1所示, 所有标本均为病毒DNA阴性. 在西安参照组, 4例携带病毒转录体, 其中3例trRNA阳性, 1例仅携带不上述2种3'端结构的病毒RNA分子. 在德国参照组, 现有的检测手段未能显示出任何病毒RNA信号.
在高流行区, HBV多数于围产期或幼儿期通过母-婴方式传播, 容易慢性化[2]. 慢性感染早期是病毒高复制阶段, 常为HBeAg阳性, 血中有高水平的病毒DNA[1]. 随着血清HBeAg转阴, 血中病毒DNA随之减少, 这种病例可检测到anti-HBeAg [17]. 尽管血清中HBsAg相对稳定, 每年也有约1%(0.1%-2.0%)转阴[2], 这是HBV慢性感染的更晚期阶段. 在某些病例, HBsAg转阴后-段时间内血液中仍存在anti-HBcAg [19-22].
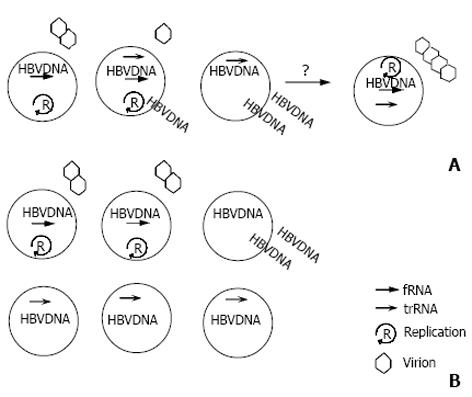
大多数学者相信, HBsAg转阴后血中病毒DNA消失[2,23], 但此时HBV DNA仍可以整合形式存在于肝组织内[10,24-29]. 病毒转录体, 尤其是HBx区RNA, 也存在于HBsAg阴性患者的肝组织和HCC组织中[10,27-29], 其转录模板可能是整合型的病毒DNA[10,11]. 已有报道显示, HBsAg转阴后-段时间内可观察到低水平的病毒复制[20,21]. 这种情况下, 部分RNA也可能来自于游离病毒DNA(图9). HCV二重感染可能会抑制HBsAg产生, 并影响病毒复制过程, 导致某些血液免疫学指标转阴, 但肝组织内可检测到HBV转录体[30]. 对慢性乙型肝炎组织中HBx区转录体的观察已经使我们开始认识不同类型的病毒RNA分子[12,14,27], 但对其在慢性肝炎进展过程中的变化和意义所知甚少.
此研究在90%的HBsAg阳性血清中检测到HBx区RNA. 这与以前在肝组织内观察到的结果相似. HBx区RNA也存在于半数来自HCC(50%)或隐源性肝硬变患者(5/9) 的HBsAg阴性血清标本中. 这些数据表明, 作为一种有潜在应用价值的血清学指标, 病毒RNA测定有助于确定病毒复制停止后的晚期感染状态.
我们的研究表明, fRNA与血中DNA水平和HBeAg密切相关, 也与血ALT水平相互关联, 提示fRNA与 病毒复制有关联(图9A), 这与应用新鲜肝组织得到的数据-致[14]. trRNA的存在与否与上述病毒复制指标及ALT值没有明确相关性, 在迄今为止所有的HBV血清学指标中trRNA表现最稳定. 上述数据提示, 染色体内整合的HBV DNA可能是trRNA的主要转录模板(图9B).
除了fRNA和trRNA外, 我们还检测到一种病毒RNA, 既不在标准的终止位点上成熟, 又不使用隐匿的终止信号. 基于这种RNA类型(HBx RNA+/fRNA-/trRNA-) 出现较晚, 平均年龄为42.4岁, 这种标本中多数检测不到病毒DNA, 我们认为, 这种HBx RNA分子与trRNA表现相似, 在慢性感染的病程中逐渐增加, 也可能转录自整合型病毒DNA. 目前尚不清楚这种转录体是否代表含HBx区的病毒/细胞RNA嵌合分子.
HBV病毒颗粒在肝细胞内的形成依赖于病毒DNA存在. 此研究表明某些血清标本中trRNA独立于fRNA和病毒DNA而存在. 很显然, 这种情况下病毒逆转录无法进行, 肝细胞内也不会形成正常的病毒颗粒(图9B). 肝细胞质膜面经常脱出一些微小囊泡[31]. 我们设想, 这-过程可能是肝细胞内RNA释放入血循环的一种机制. 血液中还可能存在其他成分保护RNA分子免遭降解. 这尚待更多的研究证实.
嗜肝病毒感染过后相当-部分病例病毒复制停止, 血清表面抗原转阴. 尽管如此, 这样的人群[32,33]和土拨鼠[34]HCC危险性明显高于未感染者. 目前这种状态的诊断缺乏可靠指标. 此研究在超过-半的来源于HCC或隐源性肝硬变患者的HBsAg阴性血清中检测到HBx编码区RNA, 尤其是trRNA, 在约15%的来自西安住院患者的HBsAg阴性血清中也检测到这种病毒转录体, 表明HBV RNA可被用作一种新的血清学指标来检测上述隐匿性感染[35]. 我们还检查了37例来自健康的西安居民的HBsAg阴性血清, 约10%携带有HBx RNA, 而来自Lueck 的30名健康献血申请者的血清全为阴性. 这种差别是否反映了中国的HBV高感染率(>60% [2,3]), 有待较大规模的调查证实.
肝细胞染色体中整合型HBx DNA的相对稳定性确保了HBx区RNA表达几十年, 这种表达在游离病毒被完全清除后仍可进行. 这可能会增加宿主患HCC的危险性. HBV DNA整合入肝细胞可能促进恶性表型的形成, 而对恶性表型的维持并非必需[5,7]. 已有报道显示, HBx区DNA和RNA存在于HBsAg阴性, HCV抗体阳性患者的HCC组织内[10,25,26,29,36]. 针对HBsAg阴性, HCV抗体阳性患者的两项前瞻性调查表明, 肝组织内病毒DNA或RNA阳性或血清anti-HBcAg阳性者HCC发生危险性高[29,37]. 此研究检查了9例来自日本和中国的HBsAg阴性, HCV抗体阳性的HCC患者的血清, 在6例中发现有HBx RNA, 1例中有病毒DNA. 这提示在所谓"HCV相关的HCC"发生过程中, HBx可能是一个不容忽视的角色.
我们的观察还表明, 检测HBV隐匿感染也可应用的血清标本, 肝组织活检并非必需. 通过外科手术取得肝组织标本来诊断HBV隐匿性感染是不现实的. 即使是通过细针穿刺抽吸进行肝组织活检, 也较难接受, 有的病例还可能发生并发症, 而且取得的肝组织量常常有限. 应用血清标本不但方便, 得出的数据可能更具有代表性.
此研究曾得到Harald zur Hausen, 刘振立和成诗银教授的长期支持, 还受益于与Astrid Kairat, Lutz Edler, 邹菊贤, Milena Ilievsta-Arsova, R黡iger Braun和Anita Mohos等同道的讨论; 在技术上曾得到Raoul Breitkreutz, Maria Mildenberger, Bettina Ehret和Anja Reiman协助; 梁秀芬, 牛昀和Holger Hennig大夫提供部分标本. 作者非常感激. 此论文经过Peter Bannasch, 刘彦仿, 潘伯荣, Angel Alonso和Holger Friesel五位教授认真审阅. 在此-并致谢.
编辑: N/A
| 1. | Raimondo G, Burk RD, Lieberman HM, Muschel J, Hadziyannis SJ, Will H, Kew MC, Dusheiko GM, Shafritz DA. Interrupted replication of hepatitis B virus in liver tissue of HBsAg carriers with hepatocellular carcinoma. Virology. 1988;166:103-112. [PubMed] [DOI] |
| 2. | Mahoney FJ. Update on diagnosis, management, and prevention of hepatitis B virus infection. Clin Microbiol Rev. 1999;12:351-366. [PubMed] |
| 3. | Su Q, Benner A, Hofmann WJ, Otto G, Pichlmayr R, Bannasch P. Human hepatic preneoplasia: phenotypes and proliferation kinetics of foci and nodules of altered hepatocytes and their relationship to liver cell dysplasia. Virchows Arch. 1997;431:391-406. [PubMed] [DOI] |
| 4. | Kew MC. Hepatitis viruses and hepatocellular carcinoma. Res Virol. 1998;149:257-262. [PubMed] [DOI] |
| 5. | 苏 勤. 病毒性肝炎致癌机制. 刘泽富, 聂青和. 病毒性肝炎的诊断和治疗. 北京: 人民军医出版社 2001; 221-262. |
| 6. | Feitelson MA, Duan LX. Hepatitis B virus X antigen in the pathogenesis of chronic infections and the development of hepatocellular carcinoma. Am J Pathol. 1997;150:1141-1157. [PubMed] |
| 7. | Su Q, Schröder CH, Hofmann WJ, Otto G, Pichlmayr R, Bannasch P. Expression of hepatitis B virus X protein in HBV-infected human livers and hepatocellular carcinomas. Hepatology. 1998;27:1109-1120. [PubMed] [DOI] |
| 9. | Cattaneo R, Will H, Hernandez N, Schaller H. Signals regulating hepatitis B surface antigen transcription. Nature. 1983;305:336-338. [PubMed] [DOI] |
| 10. | Poussin K, Dienes H, Sirma H, Urban S, Beaugrand M, Franco D, Schirmacher P, Bréchot C, Paterlini Bréchot P. Expression of mutated hepatitis B virus X genes in human hepatocellular carcinomas. Int J Cancer. 1999;80:497-505. [PubMed] [DOI] |
| 11. | Unsal H, Yakicier C, Marçais C, Kew M, Volkmann M, Zentgraf H, Isselbacher KJ, Ozturk M. Genetic heterogeneity of hepatocellular carcinoma. Proc Natl Acad Sci U S A. 1994;91:822-826. [PubMed] [DOI] |
| 12. | Hilger C, Velhagen I, Zentgraf H, Schröder CH. Diversity of hepatitis B virus X gene-related transcripts in hepatocellular carcinoma: a novel polyadenylation site on viral DNA. J Virol. 1991;65:4284-4291. [PubMed] |
| 13. | Rakotomahanina CK, Hilger C, Fink T, Zentgraf H, Schröder CH. Biological activities of a putative truncated hepatitis B virus X gene product fused to a polylysin stretch. Oncogene. 1994;9:2613-2621. [PubMed] |
| 14. | Kairat A, Beerheide W, Zhou G, Tang ZY, Edler L, Schröder CH. Truncated hepatitis B virus RNA in human hepatocellular carcinoma: its representation in patients with advancing age. Intervirology. 1999;42:228-237. [PubMed] [DOI] |
| 15. | Hsu EM, McNicol PJ. Characterization of HPV-16 E6/E7 transcription in CaSki cells by quantitative PCR. Mol Cell Probes. 1992;6:459-466. [PubMed] [DOI] |
| 17. | Kramvis A, Kew MC. The core promoter of hepatitis B virus. J Viral Hepat. 1999;6:415-427. [PubMed] [DOI] |
| 19. | Brunetto MR, Rodriguez UA, Bonino F. Hepatitis B virus mutants. Intervirology. 1999;42:69-80. [PubMed] [DOI] |
| 20. | Uemoto S, Sugiyama K, Marusawa H, Inomata Y, Asonuma K, Egawa H, Kiuchi T, Miyake Y, Tanaka K, Chiba T. Transmission of hepatitis B virus from hepatitis B core antibody-positive donors in living related liver transplants. Transplantation. 1998;65:494-499. [PubMed] [DOI] |
| 21. | Marusawa H, Uemoto S, Hijikata M, Ueda Y, Tanaka K, Shimotohno K, Chiba T. Latent hepatitis B virus infection in healthy individuals with antibodies to hepatitis B core antigen. Hepatology. 2000;31:488-495. [PubMed] [DOI] |
| 23. | Imperial JC. Natural history of chronic hepatitis B and C. J Gastroenterol Hepatol. 1999;14 Suppl:S1-S5. [PubMed] [DOI] |
| 24. | Mason AL, Xu L, Guo L, Kuhns M, Perrillo RP. Molecular basis for persistent hepatitis B virus infection in the liver after clearance of serum hepatitis B surface antigen. Hepatology. 1998;27:1736-1742. [PubMed] [DOI] |
| 25. | Koike K, Shimotouno K, Okada S, Okamoto H, Hayashi N, Ueda K, Kaneko S, Koike K, Yokosuka O, Chiba T. Survey of hepatitis B virus co-infection in hepatitis C virus-infected patients suffering from chronic hepatitis and hepatocellular carcinoma in Japan. Jpn J Cancer Res. 1999;90:1270-1272. [PubMed] [DOI] |
| 26. | Shibata Y, Nakata K, Tsuruta S, Hamasaki K, Hayashida Y, Kato Y, Nakao K, Eguchi K. Detection of hepatitis B virus X-region DNA in liver tissue from patients with hepatitis C virus-associated cirrhosis who subsequently developed hepatocellular carcinoma. Int J Oncol. 1999;14:1153-1156. [PubMed] [DOI] |
| 27. | Paterlini P, Poussin K, Kew M, Franco D, Brechot C. Selective accumulation of the X transcript of hepatitis B virus in patients negative for hepatitis B surface antigen with hepatocellular carcinoma. Hepatology. 1995;21:313-321. [PubMed] |
| 28. | Kobayashi S, Saigoh Ki, Urashima T, Asano T, Isono K. Detection of hepatitis B virus x transcripts in human hepatocellular carcinoma tissues. J Surg Res. 1997;73:97-100. [PubMed] [DOI] |
| 29. | Tamori A, Nishiguchi S, Kubo S, Koh N, Moriyama Y, Fujimoto S, Takeda T, Shiomi S, Hirohashi K, Kinoshita H. Possible contribution to hepatocarcinogenesis of X transcript of hepatitis B virus in Japanese patients with hepatitis C virus. Hepatology. 1999;29:1429-1434. [PubMed] [DOI] |
| 30. | Chu CM, Yeh CT, Liaw YF. Low-level viremia and intracellular expression of hepatitis B surface antigen (HBsAg) in HBsAg carriers with concurrent hepatitis C virus infection. J Clin Microbiol. 1998;36:2084-2086. [PubMed] |
| 31. | Black PH. Shedding from normal and cancer-cell surfaces. N Engl J Med. 1980;303:1415-1416. [PubMed] [DOI] |
| 32. | Okada S, Sato T, Okusaka T, Ishii H, Ikeda M, Nakasuka H, Kosakamoto H, Yoshimori M, Wakabayashi K. Past exposure to hepatitis B virus as a risk factor for hepatocellular carcinoma in patients with chronic liver disease. Br J Cancer. 1998;77:2028-2031. [PubMed] [DOI] |
| 33. | Kubo S, Nishiguchi S, Hirohashi K, Tanaka H, Tsukamoto T, Hamba H, Shuto T, Yamamoto T, Ikebe T, Kinoshita H. Clinical significance of prior hepatitis B virus infection in patients with hepatitis C virus-related hepatocellular carcinoma. Cancer. 1999;86:793-798. [DOI] |
| 34. | Korba BE, Wells FV, Baldwin B, Cote PJ, Tennant BC, Popper H, Gerin JL. Hepatocellular carcinoma in woodchuck hepatitis virus-infected woodchucks: presence of viral DNA in tumor tissue from chronic carriers and animals serologically recovered from acute infections. Hepatology. 1989;9:461-470. [PubMed] [DOI] |
| 36. | Cacciola I, Pollicino T, Squadrito G, Cerenzia G, Orlando ME, Raimondo G. Occult hepatitis B virus infection in patients with chronic hepatitis C liver disease. N Engl J Med. 1999;341:22-26. [PubMed] [DOI] |