修回日期: 2002-07-25
接受日期: 2002-07-31
在线出版日期: 2003-01-15
目的: 以复制缺陷的腺病毒为疫苗载体, 构建基于胃癌MG7-Ag模拟表位的重组腺病毒疫苗.
方法: 将编码MG7-Ag模拟表位的互补序列设计到上游引物的5/端. 以含有HBcAg全序列的质粒p1.2Ⅱ为模板, 通过PCR扩增, 获得MG7-Ag模拟表位与HBcAg的融合基因. 经序列测定证实后, 亚克隆至pAdTrack-CMV穿梭质粒, 再与pAdEasy-1质粒在大肠杆菌BJ5 183中进行同源重组. 经抗性筛选及酶切鉴定的重组质粒, 再用导入293细胞进行包装, 利用Adeasy系统上的绿色荧光蛋白标签鉴定病毒表达.
结果: 序列测定证实, PCR产物为胃癌MG7-Ag模拟表位与HBcAg的融合基因片段; 酶切鉴定表明胃癌MG7-Ag模拟表位与HBcAg的融合基因片断插入了pAdTrack-CMV穿梭质粒, 卡那霉素进行抗性筛选及PacⅠ酶切鉴定证实腺病毒重组质粒构建成功. PacⅠ酶切线性化的重组质粒导入293细胞3 d后见明显的绿色荧光蛋白表达. 回收病毒, 可重复感染293细胞, 证实有感染能力的病毒颗粒包装成功.
结论: 胃癌MG7-Ag模拟表位的重组腺病毒载体的构建成功, 为进一步研究胃癌MG7-Ag模拟表位诱发抗胃癌免疫打下了基础.
引文著录: 林涛, 丁杰, 孟繁平, 韩全利, 喻召才, 郭长存, 刘志国, 樊代明. 利用细菌内重组腺病毒系统构建胃癌MG7-Ag模拟表位疫苗. 世界华人消化杂志 2003; 11(1): 14-17
Revised: July 25, 2002
Accepted: July 31, 2002
Published online: January 15, 2003
AIM: To develop a cancer vaccine based on MG7-Ag of gastric cancer using recombinant adenovirus as vector.
METHODS: PCR was performed to get fusion gene of the MG7-Ag mimotope and HbcAg. The fusion gene was then subcloned into the pAdTrack-CMV shuttle vector. The resultant plasmid(pAdTrack-CMV-MG7) was cotransduced into E. coli. BJ5183 cells with pAdEasy-1 plasmid to undergo homologous recombination. The linearized recombinant plasmid(pAd-MG7) was transfected into 293 cells. The recombinant adenovirus was detected by examining the expression of the green fluorescence protein tag in the 293 cells.
RESULTS: By sequencing, it was confirmed that the PCR product was a fusion gene of MG7-Ag mimotope gene and HBcAg. Restriction endonuclease analysis confirmed the successful cloning of the fusion gene into the pAdTrack-CMV. The recombinants(pAd-MG7) were selected for kanamycin resistance, and recombination was confirmed by restriction endonuclease analysis. Presence of the recombinant adenoviruses was confirmed by GFP expression.
CONCLUSION: The Recombinant adenovirus vaccine of the MG7-Ag mimotope was constructed successfully, which is helpful to the further investigation of its potentiality in the immunotherapy of gastric cancer.
- Citation: Lin T, Ding J, Meng FP, Han QL, Yu ZC, Guo CC, Liu ZG, Fan DM. Construction and identification of recombinant adenovirus vaccines of gastric cancer MG7-Ag mimotope. Shijie Huaren Xiaohua Zazhi 2003; 11(1): 14-17
- URL: https://www.wjgnet.com/1009-3079/full/v11/i1/14.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i1.14
肿瘤疫苗是肿瘤基因治疗[1-10]的一个活跃领域, 目前用于胃癌免疫治疗的有效疫苗较少[11-13]. 胃癌MG7-Ag是我研究所发现的胃癌特异性标志物[11-15], 在胃癌组织中表达较高特异性好, 为胃癌疫苗的构建提供了良好的候选靶位[11-13]. 但从胃癌组织中提取和纯化MG7-Ag难度很大. 最近, 韩全利et al[14]利用噬菌体显示文库技术成功筛选得到了胃癌MG7-Ag的模拟表位多肽, 体外实验证实该模拟表位多肽能够较好地模拟原始抗原, 因此是构建胃癌疫苗的理想候选分子. 复制缺陷的重组腺病毒是一种高效的基因转运工具[16-26], 且因其自身免疫原性强, 能引起较强的细胞和体液免疫反应[22-26], 其自身可起到佐剂的作用. 本研究利用 AdEasy腺病毒细菌内同源重组系统[21]构建了MG7-Ag模拟表位与HBcAg的融合基因的复制缺陷的重组腺病毒疫苗.
腺病毒细菌内同源重组系统包括E. coli BJ5183, 穿梭质粒pTrack-CMV, 及腺病毒骨架质粒pAdEasy-1, 由美国John Hopkins University and the Howard Hughes Medical Institute的Bert Vogelstein博士惠赠. Hind Ⅲ、NotⅠ、T4连接酶、胰蛋白胨及酵母提取物购自宝泰克公司. PmeⅠ、PacⅠ为New England Biolabs 公司产品. GeneRulerTM 100 bp DNA Ladder Plus(100-3 000 bp), GeneRulerTM DNA Ladder Mix(100-10 000 bp)均为MBI Fermentas公司产品, 购自上海生工公司. 西班牙产电泳用琼脂糖、Lambda DNA/HindIII Marker购自华美公司. 质粒小量提取试剂盒和小量胶回收试剂盒, 购自上海华舜公司. E. coli DH5α及模板质粒p1.2Ⅲ为本所保存.
1.2.1 表位基因与载体基因片段PCR连接: (1)引物设计: 上游引物P1.1的序列为: 5'-TGCCATGGGAAAACCGCACGTTCACACTAAAGGTGGTGGTTCTCTTGGGTGGCTTTGGG GC-3', 含ATG及编码MG7-Ag模拟表位的序列; 下游引物P1.2的序列为: 5'- CCAAGCTTCTAACATTGAGATTCCCG-3'均由上海博亚公司合成.(2)以质粒p1.2 ℃(1 888- 2 450 bp)为模板进行PCR: 94 ℃变性1 min, 58 ℃退火1 min, 72 ℃延伸1 min.2个循环后, 再94 ℃变性1 min, 65 ℃退火、延伸3 min, 共28个循环, 最后于72 ℃延伸5 min. 扩增产物用1%琼脂糖凝胶进行电泳. 经鉴定条带的位置正确后, 切下条带, 参照柱式小量胶回收试剂盒操作说明, 进行回收、纯化.
1.2.2 PCR产物的克隆及测序: 将回收并纯化的PCR产物, 与载体pUCm-T 按浓度比3: 1, 用T4连接酶连接. 以连接产物转化0.1 mol/L CaCl2制备的 E. coli DH5α感受态细菌, 涂布于含氨苄青霉素(100 mg/L)并预先涂布了X-gal 40 mL(20 g/L)和IPTG 4 mL(200 g/L)的90 mm固体LB培养基上, 以蓝白筛选法筛选阳性克隆. 随机挑取4个白色菌落, 用柱式小量质粒提取试剂盒提取质粒. 经NotⅠ和Hind Ⅲ双酶切后, 进行琼脂糖凝胶电泳, 观察有无600 bp左右的条带. 将经鉴定的重组阳性克隆, 用M13/pUC反向引物, 以Sanger双脱氧链终止法, 进行反向序列测定. 命名为pUC-MG7.
1.2.3 MG7-Ag模拟表位/HbcAg融合基因亚克隆到pAdTrack-CMV穿梭质: PCR产物的亚克隆: 提取测序正确克隆的质粒, 经NotⅠ和 Hind Ⅲ双酶切及琼脂糖凝胶电泳后, 回收约600 bp左右大小的电泳条带. pAdTrack-CMV穿梭质粒用相同内切酶双酶切, 电泳回收约9 200 bp片段. 两次回收大、小片段分子浓度比按1: 3, 用T4连接酶16 ℃连接16 h, 转化0.1 mol/L CaCl2制备的E. coli DH5α感受态细菌, 涂于含卡那霉素(50 mg/l)的固体LB培养基37 ℃培养过夜. 随机挑取4个菌落, 提取质粒, Hind Ⅲ, NotⅠ双酶切鉴定阳性克隆的重组质粒. 命名为pAdTrack-CMV-MG7
1.2.4 细菌内同源重组产生包含MG7-Ag模拟表位/HbcAg融合基因的重组腺病毒质粒: 用10%的冰浴冷的无菌甘油制备E. coli BJ5 183及E. coli DH5α电穿孔感受态菌. 提取重组质粒pAdTrack-CMV-MG7用PmeⅠ酶切线性化, 电泳回收约9 800 bp片段. 与腺病毒骨架质粒pAdEasy-1等浓度比混合, 在2 500 V, 200Ω, 25 mF条件下, 电穿孔共转化20 mL BJ5 183感受态菌, 卡那霉素(50 mg/L)固体LB培养基筛选, 16 h后随机挑取4个克隆, 提质粒. 挑选电泳鉴定大小与pAdEasy-1相似的质粒, 将其电穿孔转化E. coli DH5α菌, 提取质粒, 用PacⅢ酶切鉴定阳性克隆的重组腺病毒质粒. 命名为pAd-MG7.
1.2.5 293细胞中产生重组腺病毒: 转染前24 h, 在25 cm2塑料培养瓶中接种2×106的HEK293细胞. 转染当天, 将4 mg pAd-MG7质粒用PacⅢ酶切线形化, 用20 mL Lipofectamine 2 000按说明转染293细胞, 2 d后用荧光显微镜观测绿色荧光蛋白的表达, 7-10 d后收集细胞. 反复冻融3-4次, 取1/3病毒提取上清再感染293细胞扩增, 3-4 d后收集细胞, PBS重悬, 反复冻融, 最后离心, 取上清收集病毒, 保存于-80 ℃.
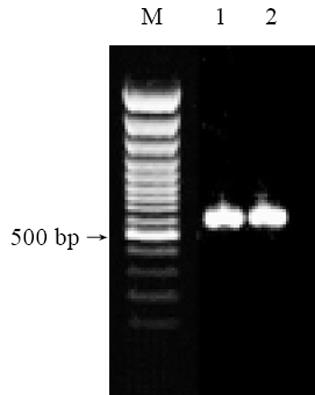
以质粒p1.2Ⅱ(1 888-2 450 bp)的序列为模板, 将MG7-Ag模拟表位基因和编码HBcAg的基因设计于引物中, 用PCR方法将表位基因与该段载体基因连接在一起. 扩增产物为600 bp左右的片段, 与预计的结果相符(图1).
将纯化的PCR产物克隆于载体pUCm-T中, 转化E. coli DH5α感受态细菌. 通过蓝白筛选, 随机挑取4个白色菌落提取质粒, 用NcoⅠ和Hind Ⅲ双酶切后, 均切出600 bp左右的片段. 再用M13反向引物, 将4号克隆以Sanger双脱氧链终止法进行反向测序. 结果表明, PCR产物为目的基因和载体基因的融合片段, 两端分别含有NcoⅠ和Hind Ⅲ的酶切位点.
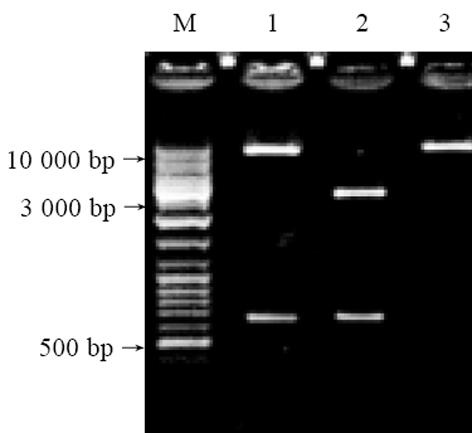
提取含有MG7-Ag模拟表位/HbcAg融合基因的阳性克隆的重组质粒, 用NotⅠ和 Hind Ⅲ双酶切后回收600 bp左右的片段. 将其与用相同酶切回收的pAdTrack-CMV穿梭质粒大片段连接, 转入宿主菌E. coli DH5α, 用NotⅠ和 Hind Ⅲ双酶切阳性克隆中的重组质粒, 可切出600 bp大小的片段, 与pUCm-MG7双酶切释放的目的片断大小相符, 而无目的片段的pAdTrack-CMV相同双酶切, 无片段释放(图2).
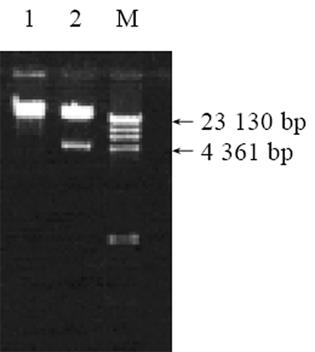
将重组质粒pAdTrack-CMV-MG7用PmeⅠ酶切线性化, 与等浓度的腺病毒骨架粒pAdEasy-1电穿孔共转化20 mL BJ5183感受态菌, 进行同源重组. 将阳性克隆转化电穿孔转化E. coli DH5α菌, 提取阳性克隆质粒, 用PacⅠ酶切鉴定能释放约4.5 kb大小片段, 而pAdEasy-1用相同的酶切未释放片断, 从而证明为重组的腺病毒质粒(图3).
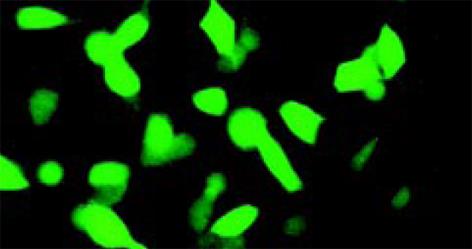
把重组的腺病毒质粒pAd-MG7, 用PacⅠ酶切线形化转染293细胞, 2 d后即可通过荧光显微镜观察到GFP表达(图4). 取1/3病毒提取上清可再感染293细胞扩增. 说明有感染能力的病毒颗粒包装成功.
随着分子免疫学的发展, 免疫治疗在肿瘤治疗中的作用日益突出. 而寻找肿瘤特异性或相关抗原成为关键的一环. 我研究所利用低分化胃癌细胞株成功的制备了抗胃癌的单克隆抗体MG系列, 其中MG7的特异性最强, 在胃癌组织中高表达[11-15]. 实验证实, MG7抗原与已知的胃癌抗原不同, 推测是一种新的胃癌相关抗原, 其抗原决定簇表达在糖链上[11-14]. 所以从肿瘤组织中提取、纯化的MG7-Ag十分困难. 本研究所利用抗MG7-Ag mAb筛选噬菌体随机肽文库, 得到了MG7-Ag的模拟表位基因, 其结合抑制试验效果肯定[14].
腺病毒因其具有安全性较好, 感染能力强, 可感染各细胞周期的细胞; 蛋白表达量高; 不整合到宿主的染色体中, 没有插入性突变; 成为基因转染和治疗常用的载体[16-21], 又因其具有较强的免疫原性, 能激发肌体的体液及细胞免疫, 因而是疫苗的常用载体[22-26].
本研究中选用的腺病毒表达系统是由构建的一种新型的重组腺病毒系统 [21]. 他利用E. coli BJ5 183内高效的同源重组系统, 进行腺病毒的同源重组, 提高了病毒的重组效率, 缩短了病毒包装所需的时间; 在腺病毒包装前就可检验目的片断是否装入重组的腺病毒质粒中; 并带有绿色荧光蛋白标记, 可直接观测转染的效率和病毒感染的情况; 是高效便捷的腺病毒重组系统, 在基因治疗中有很好的前景.
病毒样颗粒能在表面合适的位置规则的排列所需的多肽, 使其成为理想的免疫分子载体. 而无传染性的HbcAg为最佳选择[27], 其由183个氨基酸组成, 能形成20面体微粒, 在外源性的蛋白插入时, 仍可形成对称性颗粒. 使插入的外源性抗原具有较好的免疫活性, 能明显刺激B细胞及T细胞产生免疫反应, 是一种很有潜力的疫苗载体[27-30].
本研究成功构建含有MG7-Ag 模拟表位基因的胃癌重组腺病毒疫苗, 希望能够利用腺病毒的高效表达系统及HBcAg和腺病毒刺激免疫的作用, 使其能产生强而持久的免疫. 为进一步研究MG7-Ag模拟表位在诱发抗胃癌免疫中的作用, 打下基础.
编辑: N/A
| 1. | Zhang SN, Yuan SZ. Gene therapy for pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi. 1999;7:269-270. [DOI] |
| 2. | Meng ZH, He ZP. Current situation of gene therapy studies in inhibition of liver cancer. Shijie Huaren Xiaohua Zazhi. 1999;7:350-352. [DOI] |
| 3. | Dai YM. Targeting chemo_therapy: a new focus in gene therapy vesearch. Shijie Huaren Xiaohua Zazhi. 1999;7:469-472. [DOI] |
| 4. | Yu WL, Huang ZH. Progress in studies on gene therapy for gastric cancer. Shijie Huaren Xiaohua Zazhi. 1999;7:887-889. [DOI] |
| 5. | Leng JJ, Chen YQ, Leng XS. Genetic therapy for pancreatic neoplasms. Shijie Huaren Xiaohua Zazhi. 2000;8:916-918. [DOI] |
| 6. | Tang YC, Li Y, Qian GX. Reduction of tumorigenicity of SMMC-7721 hepatoma cells by vascular endothelial growth factor antisense gene therapy. World J Gastroenterol. 2001;7:22-27. [PubMed] [DOI] |
| 7. | Dai WJ, Jiang HC. Advances in gene therapy of liver cirrhosis: a review. World J Gastroenterol. 2001;7:1-8. [PubMed] [DOI] |
| 8. | Chen B, Zhang XY, Zhang YJ, Zhou P, Gu Y, Fan DM. Antisense to cyclin D1 reverses the transformed phenotype of human gastric cancer cells. World J Gastroenterol. 1999;5:18-21. [PubMed] [DOI] |
| 9. | Zhang XY. Some recent works on diagnosis and treatment of gastric cancer. World J Gastroenterol. 1999;5:1-3. [PubMed] [DOI] |
| 10. | Zhang FX, Zhang XY, Fan DM, Deng ZY, Yan Y, Wu HP, Fan JJ. Antisense telomerase RNA induced human gastric cancer cell apoptosis. World J Gastroenterol. 2000;6:430-432. [PubMed] [DOI] |
| 11. | Meng FP, Ding J, Yu ZC, Han QL, Guo CC, Fan DM. Development and preliminary identification of the attenuated Salmonella typhimurium vaccine expressing the gastric cancer MG7-Ag mimotope. Xibao Yu Fenzhi Mianyixue Zazhi. 2002;18:138-143. |
| 12. | Guo C, Ding J, Yu Z, Han Q, Meng F, Liu N, Fan D. [Development of oral DNA vaccine based on MG(7)-Ag mimotope of gastric cancer]. Zhonghua Zhong Liu Za Zhi. 2002;24:110-113. [PubMed] |
| 13. | Ning XX, Wu KC, Shi YQ, Wang X, Zhao YQ, Fan DM. Construction and expression of gastric cancer MG7 mimic epitope fused to heat shock protein 70. Shijie Huaren Xiaohua Zazhi. 2001;9:892-896. [DOI] |
| 14. | Han QL, Ding J, Yu ZC, He FT, Fan DM. Selection of mimic epitope of gastric cancer associated antigen by using peptide library. Disi Junyi Daxue Xuebao. 2000;21:1162-1164. |
| 15. | Ren J, Chen Z, Juan SJ, Yong XY, Pan BR, Fan DM. Detection of circulating gastric carcinoma-associated antigen MG7-Ag in human sera using an established single determinant immuno-polymerase chain reaction technique. Cancer. 2000;88:280-285. [PubMed] [DOI] |
| 16. | Chen JP, Lin C, Xu CP, Zhang XY, Fu M, Deng YP, Wei Y, Wu M. Transduction effici ency, biologic effects and mechanism of recombinant RA538, antisense C-myc adenovirus on different cell lines. Shijie Huaren Xiaohua Zazhi. 2000;8:266-270. |
| 17. | Lu JG, Lin C, Huang ZQ, Wu JS, Fu M, Zhang XY, Liang X, Yao X, Wu M. Inhibitory effects of human cholangiocarcinoma cell line by recombinant adenoviruses p16 with CDDP. Shijie Huaren Xiaohua Zazhi. 2000;8:641-645. |
| 18. | Chen JP, Lin C, Xu CP, Zhang XY, Wu M. The therapeutic effects of recombinant adenovirus RA538 on human gastric carcinoma cells in vitro and in vivo. World J Gastroenterol. 2000;6:855-860. [PubMed] [DOI] |
| 19. | Shen LZ, Wu WX, Xu DH, Zheng ZC, Liu XY, Ding Q, Hua YB, Yao K. Specific CEA-producing colorectal carcinoma cell killing with recombinant adenoviral vector containing cytosine deaminase gene. World J Gastroenterol. 2002;8:270-275. [PubMed] |
| 20. | Wu HG, Zhou LB, Shi DR, Liu SM, Liu HR, Zhang BM, Chen HP, Zhang LS. Morphological study on colonic pathology in ulcerative colitis treated by moxibustion. World J Gastroenterol. 2000;6:861-865. [PubMed] [DOI] |
| 21. | He TC, Zhou S, da Costa LT, Yu J, Kinzler KW, Vogelstein B. A simplified system for generating recombinant adenoviruses. Proc Natl Acad Sci U S A. 1998;95:2509-2514. [PubMed] [DOI] |
| 22. | Timmerman JM, Caspar CB, Lambert SL, Syrengelas AD, Levy R. Idiotype-encoding recombinant adenoviruses provide protective immunity against murine B-cell lymphomas. Blood. 2001;97:1370-1377. [PubMed] [DOI] |
| 23. | Bruce CB, Akrigg A, Sharpe SA, Hanke T, Wilkinson GW, Cranage MP. Replication-deficient recombinant adenoviruses expressing the human immunodeficiency virus Env antigen can induce both humoral and CTL immune responses in mice. J Gen Virol. 1999;80:2621-2628. [PubMed] [DOI] |
| 24. | Flanagan B, Pringle CR, Leppard KN. A recombinant human adenovirus expressing the simian immunodeficiency virus Gag antigen can induce long-lived immune responses in mice. J Gen Virol. 1997;78:991-997. [PubMed] [DOI] |
| 25. | Li W, Berencsi K, Basak S, Somasundaram R, Ricciardi RP, Gönczöl E, Zaloudik J, Linnenbach A, Maruyama H, Miniou P. Human colorectal cancer (CRC) antigen CO17-1A/GA733 encoded by adenovirus inhibits growth of established CRC cells in mice. J Immunol. 1997;159:763-769. [PubMed] |
| 26. | He Z, Wlazlo AP, Kowalczyk DW, Cheng J, Xiang ZQ, Giles-Davis W, Ertl HC. Viral recombinant vaccines to the E6 and E7 antigens of HPV-16. Virology. 2000;270:146-161. [PubMed] [DOI] |
| 27. | Ulrich R, Nassal M, Meisel H, Krüger DH. Core particles of hepatitis B virus as carrier for foreign epitopes. Adv Virus Res. 1998;50:141-182. [PubMed] [DOI] |
| 28. | Koletzki D, Biel SS, Meisel H, Nugel E, Gelderblom HR, Krüger DH, Ulrich R. HBV core particles allow the insertion and surface exposure of the entire potentially protective region of Puumala hantavirus nucleocapsid protein. Biol Chem. 1999;380:325-333. [PubMed] [DOI] |
| 29. | Karpenko LI, Ivanisenko VA, Pika IA, Chikaev NA, Eroshkin AM, Veremeiko TA, Ilyichev AA. Insertion of foreign epitopes in HBcAg: how to make the chimeric particle assemble. Amino Acids. 2000;18:329-337. [PubMed] [DOI] |
| 30. | Pumpens P, Razanskas R, Pushko P, Renhof R, Gusars I, Skrastina D, Ose V, Borisova G, Sominskaya I, Petrovskis I. Evaluation of HBs, HBc, and frCP virus-like particles for expression of human papillomavirus 16 E7 oncoprotein epitopes. Intervirology. 2002;45:24-32. [PubMed] [DOI] |