修回日期: 2023-12-19
接受日期: 2024-01-26
在线出版日期: 2024-02-28
CDH1基因编码的蛋白质E-cadherin在维持上皮组织完整性中发挥重要作用, 了解CDH1基因对胃类器官生长和E-cadherin表达的作用机制对于揭示器官发育的分子基础至关重要. 因此假设CDH1基因通过调控E-cadherin的表达参与调控胃类器官的发育和生长过程.
探究钙黏蛋白1(cadherin-1, CDH1)基因对小鼠胃类器官生长和E-钙黏蛋白(E-cadherin)表达的作用机制.
采用CRISPR/Cas9基因敲除技术获得CDH1-/-C57BL/6品系小鼠10只, 及野生型(WT)C57BL/6品系小鼠10只作为实验对照组. 分离小鼠胃组织并培养胃类器官, 免疫荧光染色观察胃类器官中E-cadherin表达, 比较小鼠胃类器官数量和直径, MTT检测胃类器官细胞活力, 蛋白质印迹法和RT-PCR法检测胃类器官中E-cadherin蛋白和mRNA表达.
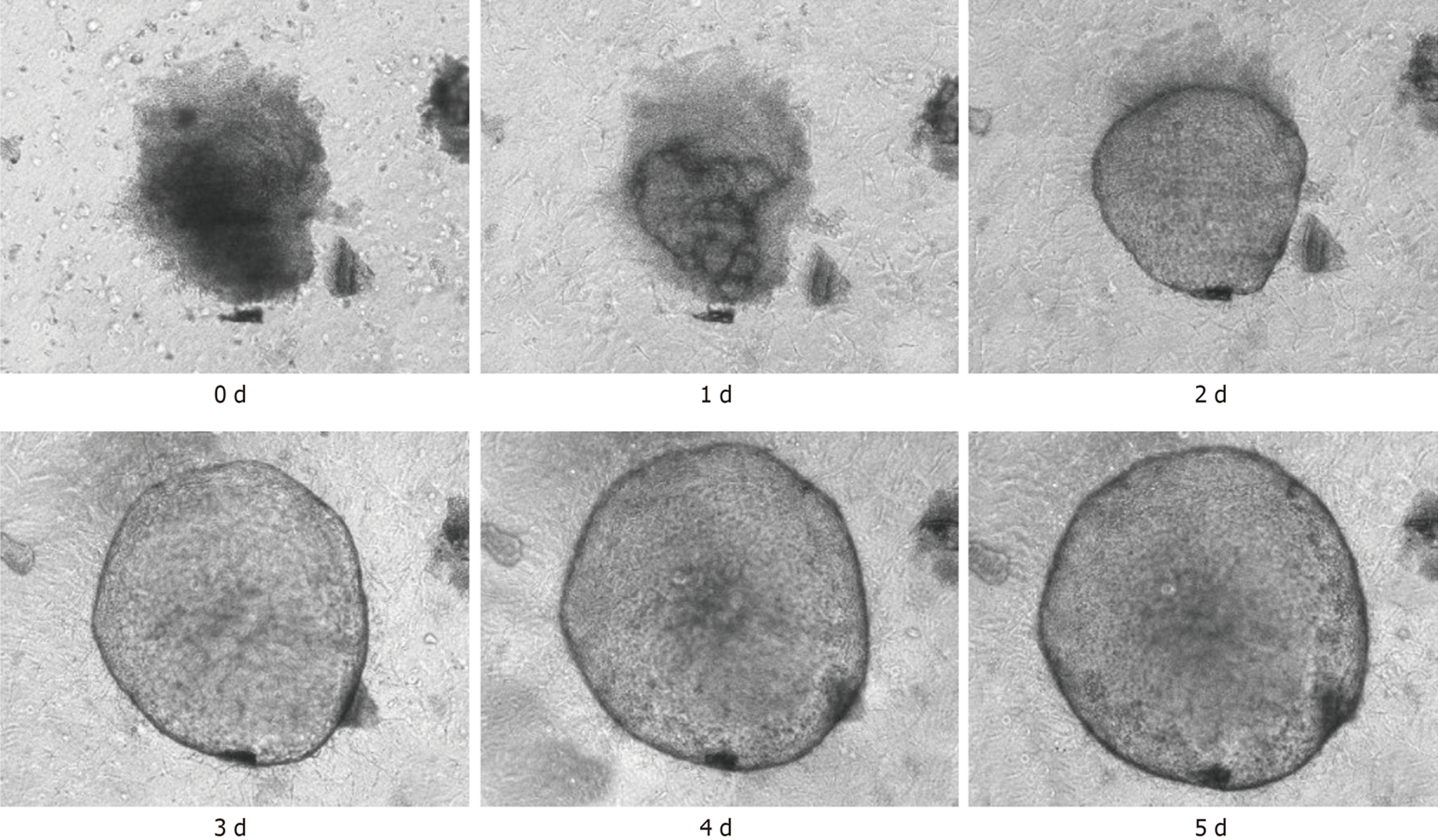
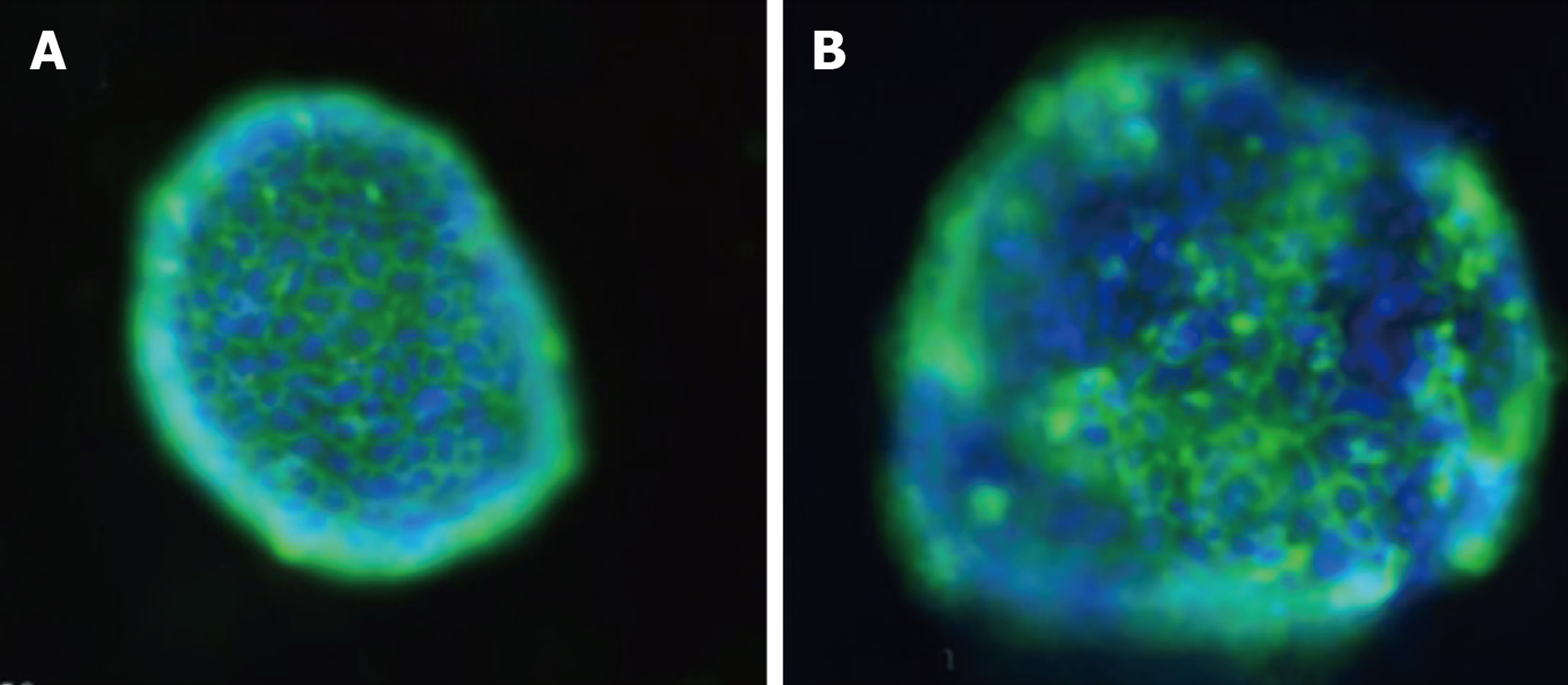
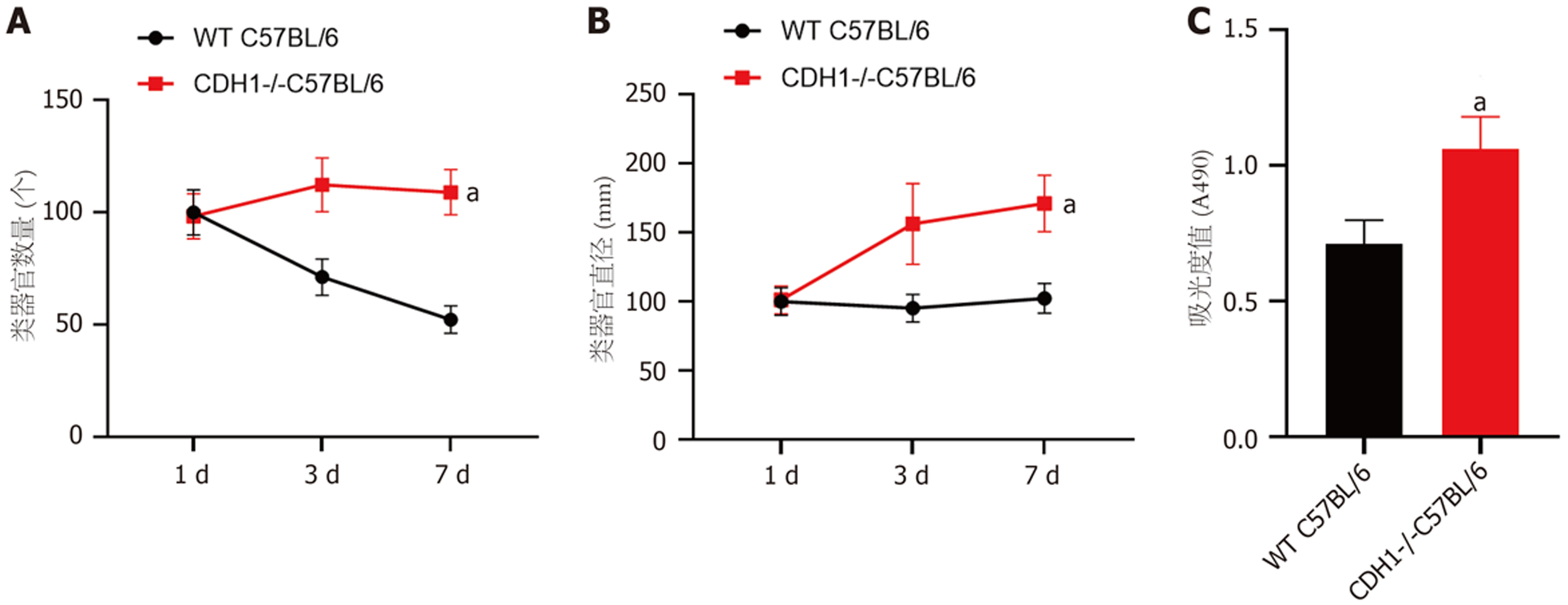
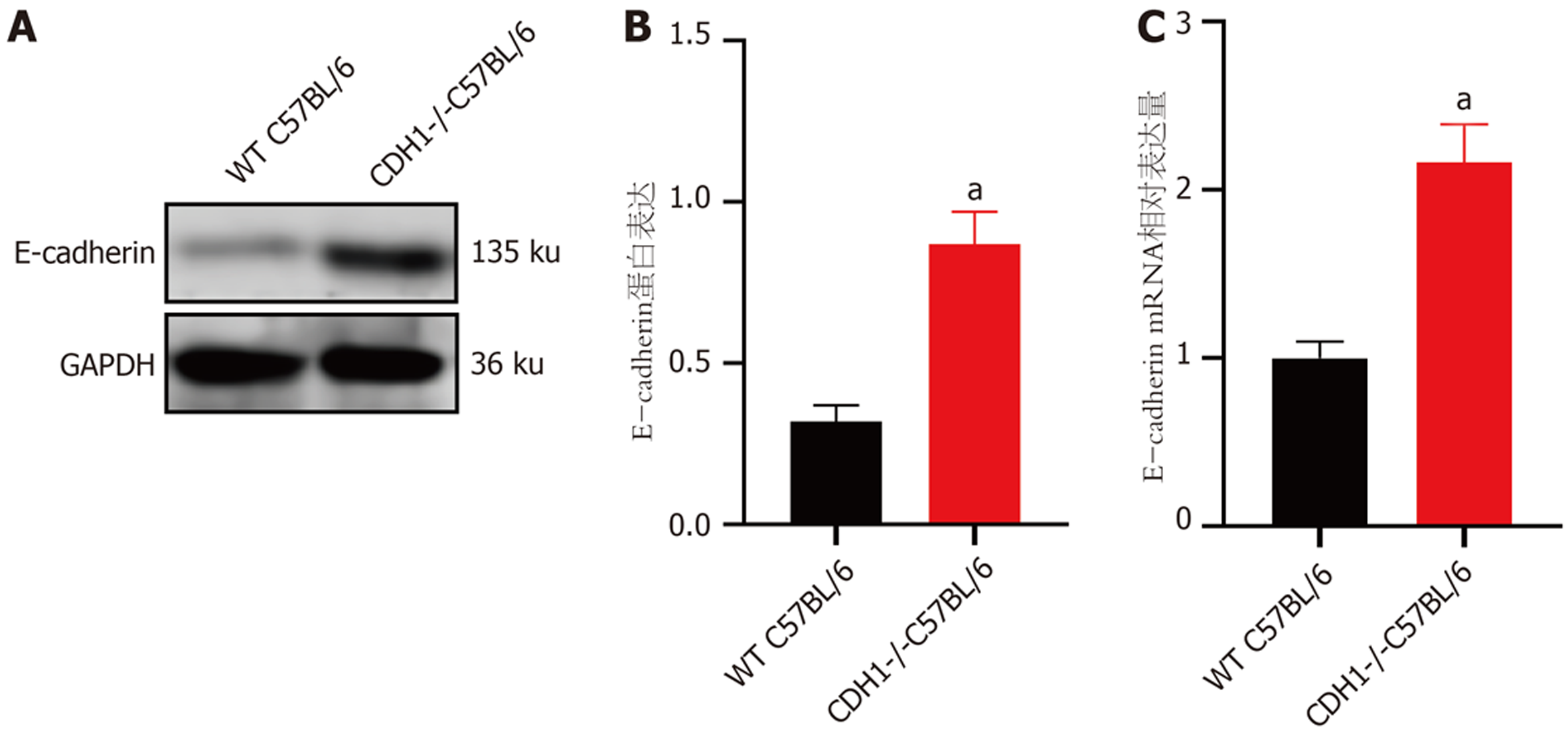
在光学显微镜下可见小鼠胃组织在培养基中不断生长与分裂, 从第0 d开始组织在24 h内形成囊性结构, 然后经历快速生长阶段. 器官样细胞扩展为大的3D球形结构, 到第5 d后逐渐出芽并开始形成胃类器官, 提示胃类器官初步构建. 免疫荧光染色结果显示, WT C57BL/6小鼠胃类器官中E-cadherin呈阳性表达, 进一步提示胃类器官成功构建. 和WT C57BL/6小鼠相比, CDH1-/-C57BL/6小鼠胃类器官数量、胃类器官直径、吸光度值及胃类器官中E-cadherin蛋白和E-cadherin mRNA相对表达量均明显减少(P<0.05).
CDH1基因敲除可抑制胃类器官生长形成及E-cadherin表达.
核心提要: 钙黏蛋白1(cadherin-1, CDH1)基因敲除抑制了小鼠胃类器官的生长形成, 并降低了E-钙黏蛋白的表达水平. 这一发现揭示了CDH1基因在胃类器官发育过程中的重要作用, 为了解器官发育的分子机制提供了重要线索.
引文著录: 邵伟, 余友杰, 夏海娜, 郑优优, 孙展杭, 严皓哲. CDH1基因对小鼠胃类器官生长和E-caherin表达的作用机制. 世界华人消化杂志 2024; 32(2): 141-147
Revised: December 19, 2023
Accepted: January 26, 2024
Published online: February 28, 2024
The E-cadherin protein encoded by the CDH1 gene plays an important role in maintaining epithelial tissue integrity. Understanding the mechanism of the CDH1 gene on gastric organoid growth and E-cadherin expression is crucial for revealing the molecular basis of organ development. Therefore, it was assumed that the CDH1 gene participates in regulating the development and growth of gastric organoids by regulating the expression of E-cadherin.
To investigate the mechanism of CDH1 gene on the growth of gastric organoids and E-cadherin expression in mice.
CRISPR/Cas9 gene knockout technique was used to obtain 10 CDH1-/- C57BL/6 mice, and 10 wild-type (WT) C57BL/6 mice were used as controls. Mouse gastric tissue was separated and cultured to obtain gastric organoids to observe the expression of E-cadherin in gastric organoids using immunofluorescence staining, compare the number and diameter of gastric organoids in mice, detect the cell viability in gastric organoids using MTT, and detect the expression of E-cadherin protein and mRNA in gastric organs using Western blot and RT-PCR methods, respectively.
Under the light microscope, it was observed that the gastric pylorus tissue of mice continued to grow and divide in the culture medium, forming a cystic structure within 24 h from day 0, and then undergoing a rapid growth. Organ like cells expanded into large three-dimensional spherical structures, and after the 5th day, they gradually sprouted and began to form stomach like organs, preliminarily indicating that gastric organoids were obtained. Immunofluorescence staining showed that E-cadherin was positively expressed in the gastric organs of WT C57BL/6 mice, further indicating the successful construction of gastric organoids. Compared with WT C57BL/6 mice, CDH1-/- C57BL/6 mice showed a significant decrease in the number, diameter, absorbance value, and relative expression of E-cadherin protein and mRNA in gastric organoids (P < 0.05).
Knockout of the CDH1 gene can inhibit the growth and formation of gastric organoids and the expression of E-cadherin.
- Citation: Shao W, Yu YJ, Xia HN, Zheng YY, Sun ZH, Yan HZ. Mechanism of action of CDH1 gene on gastric organoid growth and E-cadherin expression in mice. Shijie Huaren Xiaohua Zazhi 2024; 32(2): 141-147
- URL: https://www.wjgnet.com/1009-3079/full/v32/i2/141.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i2.141
类器官是近年来新开发的三维细胞培养系统, 由原代组织的成体干细胞或胚胎干细胞/诱导多能干细胞组成, 细胞嵌入富含层黏连蛋白的细胞外基质中, 可模仿天然的细胞外微环境[1]. 类器官培养不仅比动物模型的操作简便, 而且研究人员可直接进行动态监测并进行研究[2]. 胃类器官是消化系统中一种重要的组成部分, 因其能对胃干细胞驱动上皮细胞增殖和分化过程准确的表现出来, 在癌症领域的研究中有重要的意义. 过去研究发现[3], 胃类器官的生长和发育受到多种因素的调控. 钙黏蛋白1(cadherin-1, CDH1)是依赖性钙离子的细胞黏附分子之一, 也是编码E-钙黏蛋白(E-cadherin)的重要基因, 在维持细胞间粘附和上皮细胞架构方面起重要作用[4]. 有学者研究发现[5], CDH1基因突变可能介导弥漫性胃癌的发生发展, 可能是导致慢性胃癌的主要危险因素之一, 而CDH1对胃类器官生长的作用机制尚不清楚. E-cadherin作为肿瘤抑制基因, 沉默突变和E-cadherin表达下调可导致细胞显示出低分化、强侵袭性、丧失极性和间充质表型[6]. 研究发现[7], E-cadherin基因突变可介导弥漫性胃癌发生发展, 且和患者生存预后密切相关. 除此之外, 在胃类器官中E-cadherin可作为一种形成标志. 但CDH1对胃类器官生长和胃类器官中E-cadherin表达的作用尚未见相关报道. 因此, 本研究旨探究CDH1对小鼠胃类器官生长和E-cadherin表达的机制.
1.1.1 实验动物: 采用CRISPR/Cas9基因敲除技术获得CDH1-/-C57BL/6品系小鼠10只(赛业生物科技有限公司), 经PCR验证CDH1-/-小鼠基因型, 选择6 wk-8 wk龄, 体质量20 g-22 g的野生型(WT)C57BL/6品系小鼠10只作为实验对照组. 野生型C57BL/6购自北京华皁康生物科技有限公司, 许可证号SCXK(京)2020-0004. 将所有小鼠统一饲养在特定病原体(SPF)、且具有独立通气设备系统的小鼠笼中, 维持室温恒定22 ℃-26 ℃, 相对湿度40%-70%, 光照12 h/黑暗12 h, 自由饮食. 此研究已通过伦理委员会批准(2021002KY).
1.1.2 试剂和仪器: Advanced DMEM/F12(美国Corning公司); 胃泌素1(Gastrain1, 上海MedChemExpress公司); N2、B27、青链霉素(美国Thrmofisher公司); 小鼠E-cadherin抗体(美国R&D公司); HRP标记的山羊抗兔IgG(北京百奥博莱科技有限公司); MTT检测试剂盒(上海泽叶科技有限公司); 蛋白质印迹配胶试剂盒、蛋白提取试剂盒(杭州开泰生物技术有限公司); 离心机(型号: Centra 3C, 美国国际设备公司); il60型CO2培养箱(上海一恒科学仪器有限公司); CKX-41型倒置显微镜(上海光学仪器六厂).
1.2.1 小鼠胃类器官培养: 小鼠均禁食24 h后处死, 解剖后获取全胃, 使用剪刀将其与胃肠道的其余部分分离, 后将胃放入10 cm的培养皿的盖子中, 使用镊子轻轻按压胃组织, 排出所有凝结的乳汁. 使用一个新的无菌镊子, 在4个分开的30 mm的细胞培养皿中洗涤胃组织4次, 每个培养皿中含有100 L的PBS和庆大霉素50 g/mL, 后将洗涤过的胃放入1.5 mL的Eppendorf管中, 管中含有100 L的PBS和50 g/mL的龙胆米星. 使用一把新的无菌剪刀, 将胃组织在Eppendorf管中剪碎成1 mm左右的组织块. 将得到的组织块用5 mmol/L的EDTA冰上温和消化20 min-30 min, 离心并弃掉上清液, 用Matrigel包裹并重悬胃组织, 接种于24孔板中. 按照200个/孔的密度接种组织于24孔板中, 其中Matrigel体积25 μL/孔. 将24孔板置于5%CO2、37 ℃培养箱中, 20 min待Matrigel胶完全凝固后, 将完全培养基加入到24孔板中, 750 μL/孔, 再次将孔板置于5%CO2、37 ℃培养箱中培养, 每天统一时间观察细胞的状态, 2-3 d换液1次. 当观察到小鼠的胃类器官的体积有明显变大时, 且小鼠的胃类器官直径明显大于400 μm时, 对小鼠的胃类器官进行传代. 将胶原酶Ⅳ加入到孔板的每孔中, 孵育孔板于37 ℃环境中, 10 min吹打细胞一次, 并观察类器官形态变化, 当发现多数的细胞均分散开, 并形成5-10个细胞组成的粘连形成时消化细胞, 离心机细胞后收集上清液, 用Matrigel包裹胃组织并重悬, 将组织接种于24孔板中, 加入750 μL完全培养基/孔, 将孔板置于5%CO2、37 ℃的培养箱中继续培养.
1.2.2 免疫荧光染色: 将小鼠的胃类器官置于4%甲醛溶液中固定, 将流水冲洗组织后用乙醇脱水, 用石蜡包埋组织, 后用石蜡切片机切成组织薄片, 厚度为4 μm, 将组织切片用二甲苯脱蜡3次, 10 min/次, 将组织置于乙醇中水化, 脱掉二甲苯后乙醇梯度脱水, 将组织切片用高温高压抗原修复, 后用3%H2O2冷却组织切片10 min, 用PBS洗涤切片1次, 在室温的环境中孵育一抗E-cadherin(1:200)2 h, 后置于4 ℃环境中, 孵育切片过夜; 加入荧光标记的二抗(1:200), 在37 ℃环境中孵育二抗30 min, 核用DAPI染色, 封片后将组织切片置于荧光显微下, 观察组织中E-cadherin表达.
1.2.3 MTT检测细胞活力: 将胃类器官溶解消化成单细胞, 用Matrigel包裹细胞, 以2000个细胞/孔的密度接种细胞于24孔板中, 将500 μg/mL的MTT溶液加入到24孔板中, 10 μL/孔, 孵育孔板4 h; 后将甲醛晶体置于100 μL DMSO中溶解, 于490 nm处测定吸光度A490, 计算胃类器官细胞活力. 根据MTT试剂盒检查操作, 分别于生长的第1 d、3 d、7 d时检测.
1.2.4 蛋白质印迹法检测细胞中E-cadherin蛋白表达: 将胃类器官消化并制成单细胞悬液, 用RIPA裂解细胞, 并用BCA法测定细胞中总蛋白浓度. 热水煮沸蛋白样品(终浓度为2 μg·mL-1)10 min, 后于-20 ℃冰箱中保存蛋白样品. 去50 μg的蛋白样品, 加入上样缓冲液混匀, 于沸水中变性. 将蛋白样品用SDS-PAGE分离后转移到PVDF膜上, 用脱脂牛奶(5%)封闭1 h; 用含1 mL/吐温的Tris缓冲盐溶液(TBST)洗膜, 将膜与一抗(1:1000)在4 ℃下孵育过夜, 然后用清洗剂冲洗干净PVDF膜. 将二抗(1:1000)加入膜中, 在室温的环境中孵育二抗2 h. 将ECL发光液加入到细胞中显影曝光, 用Image Lab软件分析E-cadherin蛋白条带的灰度值.
1.2.5 RT-PCR检测细胞中E-cadherin mRNA表达: 将胃类器官消化并制成单细胞悬液, 将TRIzol裂解液加入到细胞中裂解, 按照试剂盒说明书提物组织或细胞中总RNA, 将组织或细胞中总RNA逆转录为cDNA. 根据PCR试剂盒说明书操作, 配制10 μL的反应体系(2×SYBR mix 5 μL、cDNA 0.4 μL、上下游引物各0.4 μL、参比染料罗丹明X0.4 μL、DEPC水3.4 μL). 实时荧光定量PCR反应程序为: 95 ℃预变性30 s, (变性95 ℃ 5 s, 延伸60 ℃ 30 s)×40个循环, 采用β-actin为内参, 用2-△△CT法计算基因表达量水平. E-cadherin引物序列, 上游引物: 5'-TCACATCCTACACTGCCCAG-3', R: 5'-AGTGTCCCTGTTCCAGTAGC-3'; GAPDH引物序列, 上游引物: 5'-TCAAGAAGGTGGTGAAGCAGG-3', R: 5'-TCAAAGGTGGAGGAGTGGGT-3'.
统计学处理 实验数据采用Graphpad priam 8.0软件进行统计学分析. 数据以均值±标准差(mean±SD)表示. 不同组间数据采用重复测量方差和单因素方差(one-way ANOVA)分析, 各组间两两比较采用LSD-t检验, 实验结果以P<0.05表示差异有统计学意义.
在光学显微镜下可见, 培养基中小鼠胃部组织不断的进行生长与分裂, 从第0 d开始组织在24 h内形成囊性结构, 然后经历快速生长阶段. 器官样细胞扩展为大的3D球形结构, 到第5 d后开始出芽并逐渐形成胃类器官(图1), 由此可见, 胃类器官初步构建.
免疫荧光染色检测E-cadherin阳性表达结果显示, CDH1-/-C57BL/6小鼠胃类器官结构中E-cadherin蛋白被完全染色, 而WT C57BL/6小鼠胃类器官中E-cadherin阳性表达增多(图2), E-cadherin可作为胃类器官成功构建的标志, 提示胃类器官成功构建.
和WT C57BL/6小鼠相比, CDH1-/-C57BL/6小鼠胃类器官数量、胃类器官直径均由明显减少(P<0.05); CDH1-/-C57BL/6小鼠胃类器官吸光度值低于WT C57BL/6小鼠, CDH1-/-C57BL/6小鼠细胞活性降低(P<0.05), 提示CDH1基因敲除可以抑制胃类器官生长(图3).
和WT C57BL/6小鼠相比, CDH1-/-C57BL/6小鼠胃类器官中E-cadherin蛋白和E-cadherin mRNA相对表达量明显减少(P<0.05), 提示CDH1基因敲除能抑制胃类器官中E-cadherin表达(图4).
胃癌和消化性溃疡病是胃部常见疾病, 主要由慢性幽门螺旋杆菌感染所致, 影响全世界约10%的人口的生命健康[8]. 胃是一个肌肉器官, 由贲门、胃底、胃体和胃窦四部分组成, 在食物储存和消化过程中起重要作用[9]. 胃体是胃酸分泌酸和消化酶的主要部位, 胃窦在激素和粘液分泌中发挥重要作用[10]. 胃是在长期接触营养物质、毒素和细菌-RIA共同产生的一个有毒的环境, 为了确保胃黏膜的完整和功能性, 上皮细胞需要持续的自我更新.
随着类器官培养技术的发现, 为研究胃干细胞和胃上皮细胞损伤以及再生的模型提供了更理想的选择[11]. 类器官是近年来新开发的一种从原代组织的成体干细胞(AdSCs)或胚胎干细胞(ESCs)/诱导多能干细胞(iPSCs)中获得的单位细胞培养系统, 由于细胞被嵌入在一个富含层黏连蛋白的细胞外基质中, 可模仿一个天然的细胞外微环境[12]. 类器官不仅可表现出衍生器官的生理功能, 其培养物中的干细胞还具有出自我更新和无限的增长能力, 因此在多种情况下能构成一个接近生理的细胞培养模型. 目前类器官被广泛应用于模拟器官发生、感染、恶性肿瘤等研究[13]. 尽管胃类器官的研究近年来取得了快速发展, 但国内对该领域的研究相对较少. 因此, 研究CDH1在胃癌和癌前病变的中的作用和机制, 利用胃类器官为研究对象, 是一个具有潜力的研究方向.
CDH1基因是位于染色体16q22.1上, 其与胃类器官疾病有密切的关联. 研究发现[14], CDH1基因的突变与家族性弥漫性胃癌的发生密切相关. CDH1基因的多态性和表达水平的变化也与其他胃类器官疾病, 如胃溃疡和胃息肉的发生和发展有关. 研究发现[15], CDH1基因通过调节信号通路的激活和抑制, 如Wnt和Src信号通路, 来调控细胞增殖和分化, 从而影响胃类器官的发育和生长. 本研究结果显示, CDH1基因缺失可抑制胃类器官的生长. E-cadherin是依赖性粘附的钙黏蛋白家族成员之一, E-cadherin蛋白在上皮细胞中广泛存在, 具有多种生物学作用, 如维持细胞骨架、增加细胞流动性、参与细胞间质表型等. 有研究表明, 侵袭和转移是E-cadherin在恶性肿瘤中最显著的生物学特征[16]. 低表达E-cadherin可对肿瘤的侵袭、转移及对上皮间质转化发挥促进作用, 还能通过影响多种信号通路从而促进肿瘤细胞的增殖和转移. Tang等[17]研究表明, E-cadherin对维持Lgr5胃窦干细胞稳态方面起关键作用, 当E-cadherin的缺失时, Lgr5干细胞池会减少, 导致胃窦上皮的稳态受损以及以内胃类器官的生长受到限制. 相关研究表明[18], CDH1基因通过转录因子和调节子的结合, 直接或间接地调控E-cadherin的转录和翻译过程, 其对E-cadherin的表达也起着重要的调控作用. CDH1基因突变会导致E-cadherin的表达丧失, 进一步促进肿瘤的侵袭和转移. 研究发现[19], CDH1基因的突变或表达水平的异常会导致E-cadherin的表达下调, 从而影响胃类器官的形态和功能. 研究发现[20], CDH1基因的缺失会导致小鼠除了胚胎期脐带等细胞外结构外, 几乎所有组织中E-cadherin的表达丧失, 这进一步导致上皮细胞分离、迁移和增殖的障碍, 从而影响胃类器官的正常发育和生长. 本研究结果显示, CDH1基因敲除小鼠胃类器官中E-cadherin表达明显受到抑制, 因此猜测, CDH1基因敲除抑制胃类器官生长可能和抑制E-cadherin表达有关, 但具体的作用机制还需进一步的探究.
综上所述, CDH1基因敲除可对胃类器官生长形成及E-cadherin表达发挥抑制作用. 但由于时间和成本等因素, 本研究仅得出结论可能和调控E-cadherin表达有关, 但具体的作用机制尚未完全明确, 使研究结果可能存在一定的局限性, 在今后的研究中会增加相关的实验研究, 探究CDH1对胃类器官生长的具体作用.
钙黏蛋白1(cadherin-1, CDH1)基因是一个编码E-钙黏蛋白(E-cadherin)的基因, 在细胞间黏附和组织形态维持中起着重要作用. CDH1基因突变与多种癌症相关, 其中包括胃癌. 了解CDH1基因在胃类器官发育和胃肿瘤形成中的作用机制对于深入了解胃类器官发育和肿瘤生物学, 并且为相关治疗策略的研究提供理论依据.
本篇论文的主题是探究CDH1基因敲除对胃类器官生长和形成的影响, 特别是E-cadherin的表达变化. 通过研究CDH1基因的功能, 在解决胃类器官发育和肿瘤形成的关键问题上有重要意义, 并且对于进一步推动该领域的研究具有重要贡献.
本文目标是通过CDH1基因敲除模型, 探究CDH1基因对胃类器官发育的调控机制, 通过实验结果, 提出新的理论和见解, 为胃类器官发育和肿瘤研究提供新的思路和方向.
本篇论文采用基因敲除技术来模拟CDH1基因的缺失状态. 通过使用动物模型等实验手段, 观察CDH1基因敲除对胃类器官生长和形成的影响, 并通过蛋白质印迹等方法来分析E-cadherin的表达的变化. 这些研究方法具有特色和独创性, 可以为CDH1基因在胃类器官中的功能提供深入了解.
通过CDH1基因敲除实验, 发现CDH1基因敲除能够抑制胃类器官的生长和形成, 并导致E-cadherin的表达显著降低. 这为探究胃类器官发育和肿瘤形成提供了新的线索和理论基础.
本研究的新发现包括CDH1基因敲除能够抑制胃类器官生长和形成, 以及E-cadherin表达降低等. 通过对CDH1基因的功能研究, 我们提出了新的理论, 恰当归纳了相关知识, 并提出了独到的见解. 此外, 本研究还提出了一些假设和新的研究方法, 通过实验发现了一些新的现象, 并验证了相应的假设. 最后, 本研究对临床实践可能产生影响, 为胃肿瘤的治疗策略提供了新的方向和思路.
本研究需要进一步探究CDH1基因调控胃类器官发育的详细机制, 并加强与其他信号通路的相互关系研究. 未来需探索CDH1基因的潜在调控机制、开发新的治疗策略以及进一步研究胃类器官发育和肿瘤形成的相关问题. 最佳的研究方法为使用更多的动物模型、组织工程技术和细胞培养实验等以获取更详尽的数据和更准确的结果.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Tang XY, Wu S, Wang D, Chu C, Hong Y, Tao M, Hu H, Xu M, Guo X, Liu Y. Human organoids in basic research and clinical applications. Signal Transduct Target Ther. 2022;7:168. [PubMed] [DOI] |
| 2. | LeSavage BL, Suhar RA, Broguiere N, Lutolf MP, Heilshorn SC. Next-generation cancer organoids. Nat Mater. 2022;21:143-159. [PubMed] [DOI] |
| 3. | de Jongh D, Massey EK; VANGUARD consortium, Bunnik EM. Organoids: a systematic review of ethical issues. Stem Cell Res Ther. 2022;13:337. [PubMed] [DOI] |
| 4. | Gamble LA, Heller T, Davis JL. Hereditary Diffuse Gastric Cancer Syndrome and the Role of CDH1: A Review. JAMA Surg. 2021;156:387-392. [PubMed] [DOI] |
| 5. | Hansford S, Kaurah P, Li-Chang H, Woo M, Senz J, Pinheiro H, Schrader KA, Schaeffer DF, Shumansky K, Zogopoulos G, Santos TA, Claro I, Carvalho J, Nielsen C, Padilla S, Lum A, Talhouk A, Baker-Lange K, Richardson S, Lewis I, Lindor NM, Pennell E, MacMillan A, Fernandez B, Keller G, Lynch H, Shah SP, Guilford P, Gallinger S, Corso G, Roviello F, Caldas C, Oliveira C, Pharoah PD, Huntsman DG. Hereditary Diffuse Gastric Cancer Syndrome: CDH1 Mutations and Beyond. JAMA Oncol. 2015;1:23-32. [PubMed] [DOI] |
| 6. | Minikes AM, Song Y, Feng Y, Yoon C, Yoon SS, Jiang X. E-cadherin is a biomarker for ferroptosis sensitivity in diffuse gastric cancer. Oncogene. 2023;42:848-857. [PubMed] [DOI] |
| 7. | Wang Q, Qi C, Min P, Wang Y, Ye F, Xia T, Zhang Y, Du J. MICAL2 contributes to gastric cancer cell migration via Cdc42-dependent activation of E-cadherin/β-catenin signaling pathway. Cell Commun Signal. 2022;20:136. [PubMed] [DOI] |
| 8. | Hunt RH, Camilleri M, Crowe SE, El-Omar EM, Fox JG, Kuipers EJ, Malfertheiner P, McColl KE, Pritchard DM, Rugge M, Sonnenberg A, Sugano K, Tack J. The stomach in health and disease. Gut. 2015;64:1650-1668. [PubMed] [DOI] |
| 9. | Jiang H, Yu D, Yang P, Guo R, Kong M, Gao Y, Yu X, Lu X, Fan X. Revealing the transcriptional heterogeneity of organ-specific metastasis in human gastric cancer using single-cell RNA Sequencing. Clin Transl Med. 2022;12:e730. [PubMed] [DOI] |
| 10. | Lee M, Cho HJ, Park KS, Jung HY. ELK3 Controls Gastric Cancer Cell Migration and Invasion by Regulating ECM Remodeling-Related Genes. Int J Mol Sci. 2022;23. [PubMed] [DOI] |
| 11. | Xu H, Jiao D, Liu A, Wu K. Tumor organoids: applications in cancer modeling and potentials in precision medicine. J Hematol Oncol. 2022;15:58. [PubMed] [DOI] |
| 12. | Dekkers JF, van Vliet EJ, Sachs N, Rosenbluth JM, Kopper O, Rebel HG, Wehrens EJ, Piani C, Visvader JE, Verissimo CS, Boj SF, Brugge JS, Clevers H, Rios AC. Long-term culture, genetic manipulation and xenotransplantation of human normal and breast cancer organoids. Nat Protoc. 2021;16:1936-1965. [PubMed] [DOI] |
| 13. | Hendriks D, Artegiani B, Hu H, Chuva de Sousa Lopes S, Clevers H. Establishment of human fetal hepatocyte organoids and CRISPR-Cas9-based gene knockin and knockout in organoid cultures from human liver. Nat Protoc. 2021;16:182-217. [PubMed] [DOI] |
| 14. | Blair VR, McLeod M, Carneiro F, Coit DG, D'Addario JL, van Dieren JM, Harris KL, Hoogerbrugge N, Oliveira C, van der Post RS, Arnold J, Benusiglio PR, Bisseling TM, Boussioutas A, Cats A, Charlton A, Schreiber KEC, Davis JL, Pietro MD, Fitzgerald RC, Ford JM, Gamet K, Gullo I, Hardwick RH, Huntsman DG, Kaurah P, Kupfer SS, Latchford A, Mansfield PF, Nakajima T, Parry S, Rossaak J, Sugimura H, Svrcek M, Tischkowitz M, Ushijima T, Yamada H, Yang HK, Claydon A, Figueiredo J, Paringatai K, Seruca R, Bougen-Zhukov N, Brew T, Busija S, Carneiro P, DeGregorio L, Fisher H, Gardner E, Godwin TD, Holm KN, Humar B, Lintott CJ, Monroe EC, Muller MD, Norero E, Nouri Y, Paredes J, Sanches JM, Schulpen E, Ribeiro AS, Sporle A, Whitworth J, Zhang L, Reeve AE, Guilford P. Hereditary diffuse gastric cancer: updated clinical practice guidelines. Lancet Oncol. 2020;21:e386-e397. [PubMed] [DOI] |
| 15. | Seidlitz T, Merker SR, Rothe A, Zakrzewski F, von Neubeck C, Grützmann K, Sommer U, Schweitzer C, Schölch S, Uhlemann H, Gaebler AM, Werner K, Krause M, Baretton GB, Welsch T, Koo BK, Aust DE, Klink B, Weitz J, Stange DE. Human gastric cancer modelling using organoids. Gut. 2019;68:207-217. [PubMed] [DOI] |
| 16. | Venhuizen JH, Jacobs FJC, Span PN, Zegers MM. P120 and E-cadherin: Double-edged swords in tumor metastasis. Semin Cancer Biol. 2020;60:107-120. [PubMed] [DOI] |
| 17. | Tang Y, Yang G, Zhang J, Li X, Zhang C, Wang Y, Xu J, Chen Y, Teng Y, Yang X. E-cadherin is Required for the Homeostasis of Lgr5(+) Gastric Antral Stem Cells. Int J Biol Sci. 2019;15:34-43. [PubMed] [DOI] |
| 18. | Biswas P, Karim SN, Hossain AI, Roy S, Hossain SA, Saleh AF. E-cadherin Gene (CDH1) Expression in Low Grade Astrocytoma. Mymensingh Med J. 2021;30:315-322. [PubMed] |
| 19. | Matheson J, Bühnemann C, Carter EJ, Barnes D, Hoppe HJ, Hughes J, Cobbold S, Harper J, Morreau H, Surakhy M, Hassan AB. Epithelial-mesenchymal transition and nuclear β-catenin induced by conditional intestinal disruption of Cdh1 with Apc is E-cadherin EC1 domain dependent. Oncotarget. 2016;7:69883-69902. [PubMed] [DOI] |
| 20. | Gregory SN, Davis JL. CDH1 and hereditary diffuse gastric cancer: a narrative review. Chin Clin Oncol. 2023;12:25. [PubMed] [DOI] |