修回日期: 2024-01-31
接受日期: 2024-02-06
在线出版日期: 2024-02-28
胃癌(gastric cancer, GC), 是最常见的消化道恶性肿瘤之一, 发病率占世界恶性肿瘤第五位, 同时为第三大导致死亡的癌症相关恶性肿瘤. 因此, 探究其评估预后指标以及治疗靶点对GC患者预后至关重要. 目前, 半乳糖凝集素-1(Galectin-1, Gal-1)蛋白在组织的表达对GC患者的进展以及预后相关性少有报道.
探究Gal-1在GC组织中的表达情况与GC的病理特征以及预后的关系.
采用免疫组化(immunohistochemistry, IHC)对84名不同GC患者的组织进行染色评估Gal-1的表达水平, 收集患者临床病理参数以及生存情况和生存时间, 统计学分析Gal-1与GC临床病理特征和预后的关系.
IHC结果显示, Gal-1蛋白在GC组织细胞外基质以及间质细胞中呈明显阳性, 细胞内蛋白阳性定位位于胞膜和胞浆. GC组织中Gal-1阳性表达率为50%(42/84), 在癌旁组织中不表达或微弱表达. Gal-1表达跟浸润深度(χ2 = 8.896, P = 0.031)、淋巴结转移(χ2 = 11.433, P = 0.001)、远处转移(χ2 = 5.126, P = 0.024)以及TNM(χ2 = 7.269, P = 0.007)分期具有统计学差异. 同时, 单因素以及多因素COX回归结果显示, Gal-1高表达是GC患者预后不良OS(HR = 2.845, 95%CI = 1.624-4.985, P<0.001; HR = 2.484 95%CI = 1.323-4.667, P = 0.005)的因素,随后根据随访数据进行生存分析Gal-1高表达患者5年总体生存率显著(overall survival, OS)低于Gal-1低表达患者(21.4% vs 52.38%).
Gal-1高表达与GC的发展侵袭转移以及不良预后显著相关, Gal-1可作为判断GC患者预后以及有望成为治疗的分子靶点.
核心提要: 本文通过免疫组化, 分析半乳糖凝集素-1(Galectin-1, Gal-1)表达对胃癌(gastric cancer, GC)患者临床病理特征以及预后的关系, 初步探究Gal-1在GC发生发展中的作用, 为未来GC的治疗提供了新的思路.
引文著录: 潘铮旸, 武美玲, 张威. Gal-1蛋白与胃癌临床病理特征以及预后的关系. 世界华人消化杂志 2024; 32(2): 134-140
Revised: January 31, 2024
Accepted: February 6, 2024
Published online: February 28, 2024
Gastric cancer (GC), one of the most common gastrointestinal malignancies, ranks fifth in incidence and third in mortality among cancer-related malignancies in the world. Therefore, it is very important to explore the prognostic indicators and therapeutic targets for GC patients. At present, the correlation between the expression of Galectin-1 (Gal-1) protein in tissues and the progression and prognosis of GC is rarely reported.
To explore the relationship between the expression of Gal-1 in GC tissues and the pathological features and prognosis of GC.
Immunohistochemistry (IHC) was used to assess the expression level of Gal-1 in GC tissues from 84 patients. The clinicopathological parameters, survival conditions, and survival time of the patients were collected. The relationships between Gal-1 expression and the clinicopathological features and prognosis of GC were statistically analyzed.
IHC results showed that Gal-1 protein was obviously positive in the extracellular matrix and stromal cells of GC tissue, and positive intracellular protein staining was located in the cell membrane and cytoplasm. The positive expression rate of Gal-1 in GC tissues was 50% (42/84), but it was not expressed or weakly expressed in paracancer tissues. The expression of Gal-1 was significantly associated with infiltration depth (χ2 = 8.896, P = 0.031), lymph node metastasis (χ2 = 11.433, P = 0.001), distant metastasis (χ2 = 5.126, P = 0.024), and TNM stage (χ2 = 7.269, P = 0.007). Univariate and multivariate COX regression analyses showed that high Gal-1 expression was associated with a poor prognosis in GC patients (hazard ratio [HR] = 2.845, 95% confidence interval [CI]: 1.624-4.985, P < 0.001; HR = 2.484, 95%CI: 1.323-4.667, P = 0.005). Survival analysis based on follow-up data showed that the 5-year overall survival (OS) rate of patients with high expression of Gal-1 was significantly lower than that of patients with low Gal-1 expression (21.4% vs 52.38%).
The high expression of Gal-1 is significantly correlated with the development, invasion, and metastasis, and poor prognosis of GC. Gal-1 can be used as a molecular marker to judge the prognosis of GC patients and is expected to be a therapeutic target for this malignancy.
- Citation: Pan ZY, Wu ML, Zhang W. Expression of Galectin-1 protein in gastric cancer: Correlation with disease progression and prognosis. Shijie Huaren Xiaohua Zazhi 2024; 32(2): 134-140
- URL: https://www.wjgnet.com/1009-3079/full/v32/i2/134.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i2.134
胃癌(gastric cancer, GC)是最危及生命的恶性肿瘤之一, 也是全球癌症相关死亡的第三大原因[1]. 我国属胃癌高发区, 41-60岁者约占2/3, 男女之比约为3.6:1, 每年约有40万胃癌新发病例, 同时约有30万人死于胃癌, 死亡率据各种肿瘤前列, 严重威胁人民的生命健康[2]. 虽然随着肿瘤治疗的发展, 胃癌的治疗也取得了一定的疗效. 大多数患者在诊断时通常处于晚期, 因此失去了手术的机会, 5年生存率低于5%[3]. 因此, 迫切需要发现新的分子靶点对于评估患者预后并且进行早期干预至关重要.
半乳糖凝集素-1[(Galectin-1, Gal-1), 由LGALS1基因编码]是一种14 kda的凝集素, 是半乳糖苷家族的成员, 与β-半乳糖苷具有亲和力[4]. 它们通过与细胞表面的乙二醇偶联蛋白结合介导细胞间或细胞外成分的通讯[5]. Gal-1在许多肿瘤细胞中广泛表达, 如前列腺癌、乳腺癌等[6,7], 同时又是间质癌症相关成纤维细胞旁分泌的一种可溶性蛋白[8,9], 可以影响肿瘤细胞的粘附、迁移、侵袭、肿瘤诱导的血管生成和凋亡[10,11]. 尽管既往研究表明Gal-1在多种肿瘤组织中表达增高[12], 但是在GC组织中少有系统研究, 并且GC组织中Gal-1表达与预后意义目前尚不明确.
因此, 本研究采用免疫组化GC患者的组织进行染色评估Gal-1的表达水平, 收集患者临床病理参数以及生存情况和生存时间, 分析Gal-1与GC临床病理特征和预后的关系. 旨在为后续Gal-1作为GC预后标志物提供依据.
收集2010-2015的84组在浙江省人民医院GC患者接受R0手术切除患者中获得GC组织标本及其匹配的癌旁组织样本, 所有患者术前均未行化疗或放疗, 将标本制成福尔马林固定石蜡包埋组织样本. 所有采样患者在手术前表示知情并且签署了书面知情同意书. 伦理审批通过了浙江省人民医院医学伦理委员会的审批.
同时通过浙江省人民医院电子病理系统收集临床资料的信息内容包括: 病人的年龄、性别肿瘤病理分级、临床TNM分期、肿瘤分化情况、是否伴有血管侵犯、是否伴有神经侵犯、淋巴结转移数量、肿瘤瘤体直径最大、是否有远处转移、组织学分型、Lauren分型等.
病理学分期根据美国癌症联合会(American Joint Committee on Cancer, AJCC)第8版胃癌TNM分期系统进行评估. 同时对GC患者进行随访, 随访时间为2015-01/2023-01. 随访时CT发现复发征象者, 行胃镜检查和活检诊断后明确, 同时记录患者复发后诊疗方法. 观察结局为总生存(overall survival, OS), 至随访末次时间为止, 无失访病例.
1.2.1 免疫组化化学染色: 免疫组化采用SP法[13], 对常规5 μm的GC以及癌旁组织切片依次放入二甲苯溶液脱蜡以及梯度乙醇溶液进行脱水, 切片在每个试剂中浸泡10 min. 随后加入3%的双氧水浸泡10 min, 弃去双氧水, 用冰PBS小心冲洗3遍, 每次约5 min; 之后再加入0.3 mol/L柠檬酸缓冲液, 置于微波炉加热 3 min后缓慢冷却至室温, 使抗原的位点充分暴露出来. 待冷却至室温后, 将柠檬酸缓冲液倒掉, 水洗3次. 甩干玻片表明液体后, 将载玻片置于PBS中5 min, 洗3次, 擦干组织周围的PBS液, 加入山羊血清, 封闭非特异性的位点起来. 擦干水分, 加入适当浓度比例的Gal-1一抗(1:250, #6837-1; Epitomics, Burlingame, CA, USA), 于4 ℃保存、过夜. 然后组织切片与加HRP标记的二抗(PV-9001, 1:1000, 北京中杉金桥公司)37 ℃孵育1 h, PBS冲洗后DAB显色, 苏木素复染3 min, 梯度乙醇脱水, 中性树脂封片晾干后镜下观察.
1.2.2 结果判定: 免疫组织化学染色完成后, 根据染色的强度及范围协助分析所得结果. 根据病理科医生评分进行划分: 没有染色-0分; 浅黄色-1分; 棕黄色-2分; 棕色-3分. 阳性细胞百分率的标准: 0-10%-0分, 10-25%-1分, 26-50%-2分, 51-75%-3分, 76-100%-4分. 最终结果为阳性细胞数乘以染色强度. 当免疫组化评分小于等于6分时, 为低表达, 当免疫评分高于6分时为高表达[14].
统计学处理 采用SPSS 23.0软件进行数据处理和统计学分析. 采用卡方χ2检验或Fisher精确检验探讨高、低Gal-1表达组之间各个临床病理参数的分布是否具有差异性. 通过单因素及多因素Cox回归比例风险模型确定GC患者预后相关因素. 采用Kaplan-Meier生存分析法比较高、低Gal-1表达组的生存差异. 本实验中所有检验均为双侧概率, P<0.05为差异有统计学意义.
84例GC患者平均年龄为58.13岁±11.23岁, 其中男性52例, 女性32例. 按肿瘤部位贲门部肿瘤占10例(11.9%), 胃体部肿瘤占31例(36.9%), 胃窦部肿瘤占42例(51.2%). 按组织学分型乳头状腺癌占4例(4.8%), 管状腺癌65例(77.4%), 粘液腺癌2例(2.4%), 印戒细胞癌13例(15.5%). 根据第8版胃癌临床TNM分期: TNM分期Ⅰ+Ⅱ期32例(38.1%), TNM分期Ⅲ+Ⅳ期52例(61.9%). 84例GC患者中58例(69.1%)GC患者行术后辅助治疗, 26例(30.9%)患者未行术后辅助治疗. 并且84例GC患者中59例(70.2%)于术后复发, 其中7例(11.9%)未行复发挽救治疗, 52例(88.1%)患者中按行复发挽救治疗方式分为手术治疗14例(23.7%), 全身药物治疗28例(47.5%), 手术联合全身药物治疗10例(16.9%), 具体数据详见表1.
| 临床病理参数 | 病例数 | Gal-1(+) | Gal-1(-) | χ2 | P |
| 性别 | 3.231 | 0.072 | |||
| 男性 | 52(61.9) | 22(52.4) | 30(71.4) | ||
| 女性 | 32(38.1) | 20(47.6) | 12(28.6) | ||
| 年龄 | 2.779 | 0.095 | |||
| ≥50 | 68(81.0) | 31(73.8) | 37(88.1) | ||
| <50 | 16(19.0) | 11(26.2) | 5(11.9) | ||
| 肿瘤直径 | 1.224 | 0.268 | |||
| <5 cm | 49(58.3) | 22(52.4) | 27(64.3) | ||
| ≥5 cm | 35(41.7) | 20(47.6) | 15(35.7) | ||
| 分化程度 | 0.764 | 0.382 | |||
| 高分化/中分化 | 40(47.6) | 18(42.9) | 22(52.4) | ||
| 低分化 | 44(52.4) | 24(57.1) | 20(47.6) | ||
| Lauren分型 | 0.765 | 0.512 | |||
| 弥漫型 | 40(47.6) | 22(52.4) | 18(42.9) | ||
| 肠型 | 44(52.4) | 20(47.6) | 24(57.1) | ||
| 组织学分型 | 0.092 | 0.993 | |||
| 乳头状腺癌 | 4(4.8) | 2(4.8) | 2(4.8) | ||
| 管状腺癌 | 65(77.4) | 32(76.2) | 33(78.6) | ||
| 粘液腺癌 | 2(2.4) | 1(2.4) | 1(2.4) | ||
| 印戒细胞癌 | 13(15.5) | 7(16.7) | 6(14.3) | ||
| 浸润深度 | 8.896 | 0.031 | |||
| T1 | 11(13.1) | 2(4.8) | 9(21.4) | ||
| T2 | 13(15.5) | 4(9.5) | 9(21.4) | ||
| T3 | 54(64.3) | 32(76.2) | 22(52.4) | ||
| T4 | 6(7.1) | 4(9.5) | 2(4.8) | ||
| 淋巴结转移 | 11.433 | 0.001 | |||
| 无 | 24(28.6 | 5(11.9) | 19(45.2) | ||
| 有 | 60(71.4) | 37(81.1) | 23(54.8) | ||
| 远处转移 | 5.126 | 0.024 | |||
| 无 | 73(86.9) | 33(78.6) | 40(95.2) | ||
| 有 | 11(13.1) | 9(21.4) | 2(4.8) | ||
| TNM分期 | 7.269 | 0.007 | |||
| Ⅰ+Ⅱ期 | 32(38.1) | 10(23.8) | 22(52.4) | ||
| Ⅲ+Ⅳ期 | 52(61.9) | 32(76.2) | 20(47.6) | ||
| 肿瘤部位 | 0.456 | 0.796 | |||
| 贲门 | 10(11.9) | 6(14.3) | 4(9.5) | ||
| 胃体部 | 31(36.9) | 15(35.7) | 16(38.1) | ||
| 胃窦部 | 43(51.2) | 21(50.0) | 22(52.4) | ||
| 术后辅助治疗 | 3.565 | 0.059 | |||
| 无 | 26(30.9) | 9(34.6) | 17(65.4) | ||
| 有 | 58(69.1) | 33(56.9) | 25(43.1) | ||
| 术后复发 | 2.791 | 0.095 | |||
| 无 | 25(29.8) | 9(36.0) | 16(64.0) | ||
| 有 | 59(70.2) | 33(55.9) | 26(44.1) | ||
| 术后复发行挽救性治疗 | 0.068 | ||||
| 无 | 7(11.9) | 4(57.1) | 3(42.9) | ||
| 手术 | 14(23.7) | 10(71.4) | 4(28.6) | ||
| 药物治疗 | 28(47.5) | 11(39.3) | 17(60.7) | ||
| 手术+药物治疗 | 10(16.9) | 8(80.0) | 2(20.0) |
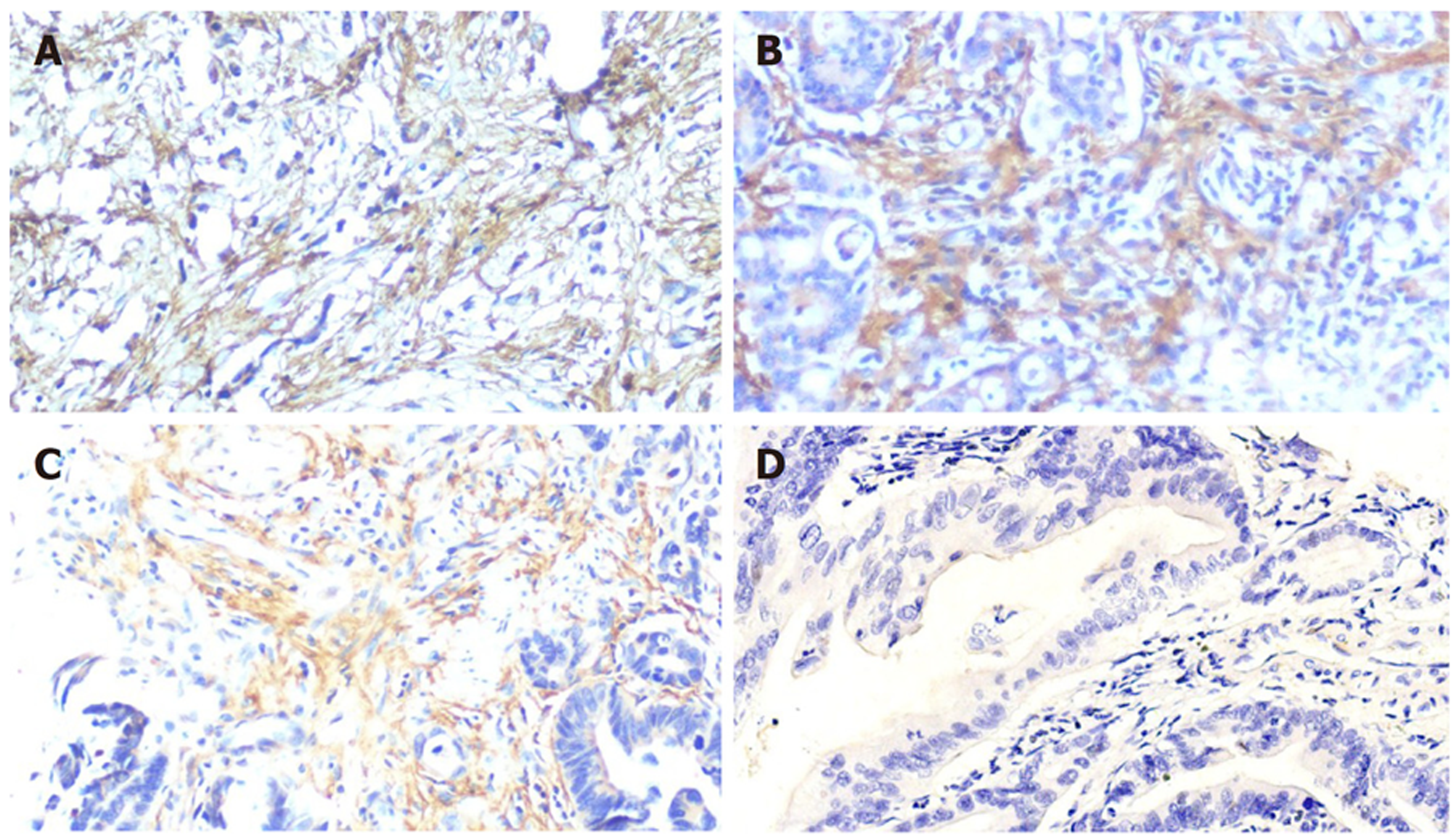
Gal-1蛋白在GC组织中主要表达与肿瘤间质成分, 在肿瘤细胞中不表达或微弱表达. Gal-1蛋白阳性染色为棕黄色, 定位于间质细胞胞膜或胞质中, 染色范围呈片状、弥漫性分布(图1A-C), 同时癌旁组织未见阳性染色(图1D). 在84例GC组织中, 共有42例为Gal-1蛋白IHC染色阳性, GC组织中Gal-1阳性表达率为50%(42/84).
根据上述评分将所有患者分成Gal-1高表达组与低表达组, 探究其表达与常见临床病理参数之间的关系, 如年龄、性别肿瘤病理分级、临床 TNM 分期、肿瘤分化情况、是否伴有血管侵犯、是否伴有神经侵犯、淋巴结转移数量、肿瘤瘤体直径最大、是否有远处转移、组织学分型、Lauren分型、是否术后行辅助治疗、是否术后复发以及复发后挽救治疗方式等. 发现Gal-1表达跟浸润深度(χ2 = 8.896, P = 0.031)、淋巴结转移(χ2 = 11.433, P = 0.001)、远处转移(χ2 = 5.126, P = 0.024)以及TNM(χ2 = 7.269, P = 0.007)分期具有相关性. 但是与性别、年龄、分化程度、Lauren分型、组织学分型、肿瘤部位、术后行辅助治疗、术后复发以及复发后挽救治疗方式无明显相关性(P>0.05, 表1).
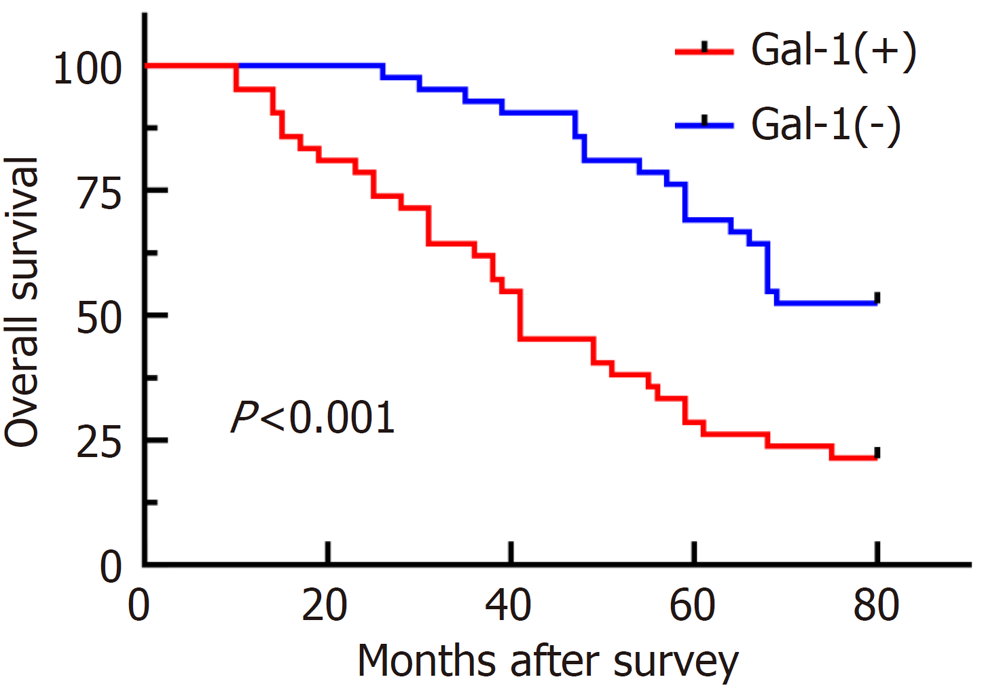
Gal-1高表达患者5年OS率为21.4%, 低表达组5年OS率为52.38%, 高表达Gal-1组OS率显著低于Gal-1低表达患者, 差异具有统计学意义(P<0.001, 图2).
单因素和多因素Cox回归显示Gal-1高表达(HR = 2.484 95%CI = 1.323-4.667, P = 0.005)、肿瘤直径(HR = 1.828, 95%CI = 1.024-3.264, P = 0.041)、有远处转移(HR = 9.551, 95%CI = 3.902-23.379, P<0.001)、术后复发(HR = 7.488, 95%CI = 3.077-22.514, P<0.001)是GC患者不良OS的独立预测因子(表2).
| 临床病理参数 | 单因素COX分析 | 多因素COX分析 | ||
| HR(95%CI) | P值 | HR(95%CI) | P值 | |
| 年龄(<50岁 vs ≥50岁) | 1.122(0.548-2.229) | 0.750 | ||
| 性别(男 vs 女) | 1.726(1.001-2.977) | 0.054 | ||
| 组织学分化(高中分化 vs 低分化) | 1.164(0.678-2.000) | 0.581 | ||
| Lauren分型(弥漫型 vs 肠型) | 0.889(0.519-1.524) | 0.669 | ||
| 浸润深度(T3+T4 vs T1+T2) | 5.513(2.346-12.957) | <0.001 | 2.147(0.787-5.858) | 0.136 |
| 肿瘤直径(<5 cm vs ≥5 cm) | 2.474(1.434-4.268) | 0.001 | 1.828(1.024-3.264) | 0.041 |
| 血管侵犯(无 vs 有) | 3.354(1.909-5.829) | <0.001 | 0.971(0.504-1.869) | 0.929 |
| 淋巴结转移(无 vs 有) | 7.146(2.826-18.074) | <0.001 | 2.246(0.729-6.918) | 0.159 |
| 远处转移(无 vs 有) | 9.516(4.512-20.069) | <0.001 | 9.551(3.902-23.379) | <0.001 |
| 半乳糖凝集素-1表达(低表达 vs 高表达) | 2.845(1.624-4.985) | <0.001 | 2.484(1.323-4.667) | 0.005 |
| 术后辅助治疗(有 vs 无) | 3.035(1.476-6.242) | 0.03 | 0.551(0.225-1.349) | 0.192 |
| 术后复发(无 vs 有) | 7.488(2.960-18.943) | <0.001 | 8.323(3.077-22.514) | <0.001 |
半乳糖凝集素是由LGALS1基因编码. 这是一个聚糖结合蛋白(凝集素)家族, 对含β-半乳糖苷的N-聚糖具有亲和力[12]. 该家族的一个成员是Gal-1, 它具有特定的结构特征. 它作为分泌蛋白能够结合和交联细胞表面的糖缀合物, 包括细胞外基质的不同整合素和糖蛋白, 从而调节细胞粘附、迁移、存活和信号传导[15-17]. 研究证明, Gal-1蛋白在多种肿瘤的发生发展发挥着重要作用. 如Tsai等[16]发现Gal-1在肝癌中可作用于肿瘤细胞糖基化膜受体如TNFR1结合以调节TNF-α/JNK/c-Jun/ATF2下游信号传导, 从而影响肿瘤细胞的粘附、迁移、侵袭. 除此之外, Paz发现[18]在癌细胞摄取Gal-1通过与肿瘤细胞溶质或核蛋白(如H-Ras, FXOP3和Gemin4)相互作用, 可以调节信号转导、基因转录, 从而影响导致细胞周期调控发生紊乱, 致使肿瘤的发生、发展. Gal-1在黑色素瘤中还通过作用于黑色素瘤细胞粘附分子, 抑制Th1型细胞, 从而有助于肿瘤免疫逃避程序[19]. 目前国内外少有对此分泌蛋白的进一步研究报道, 但是在GC中少有系统研究, 与临床病理相关性上缺少大样本量的分析. 因此本文通过观察Gal-1在GC中的表达并且分析与临床病理特征的关系, 为GC探求潜在的治疗靶点提供依据.
本研究结果显示, Gal-1蛋白在GC组织中主要表达与肿瘤间质成分, 在肿瘤细胞中不表达或微弱表达. 这与Spano等[20]在肝癌中免疫组化的结果相一致. 为了进一步研究Gal-1对GC患者的影响, 收集患者临床病理参数以及生存情况和生存时间, 进行统计学分析后, 发现Gal-1表达跟浸润深度(χ2 = 8.896, P = 0.031)、淋巴结转移(χ2 = 11.433, P = 0.001)、远处转移(χ2 = 5.126, P = 0.024)以及TNM(χ2 = 7.269, P = 0.007)分期具有相关性, 单因素和多因素Cox回归显示Gal-1高表达(HR = 2.484, 95%CI = 1.323-4.667, P = 0.005)、肿瘤直径(HR = 1.828, 95%CI = 1.024-3.264, P = 0.041)、有远处转移(HR = 9.551, 95%CI = 3.902-23.379, P<0.001)、术后复发(HR = 7.488, 95%CI = 3.077-22.514, P<0.001)是GC患者不良OS的独立预测因子. 并且Gal-1高表达患者5年OS率为21.4%, 低表达组5年OS率为52.38%, 高表达Gal-1组OS率显著低于Gal-1低表达患者. 以上结果提示Gal-1可作为预测GC进展和预后的有效标记, 且Gal-1表达于晚期GC患者以及细胞恶性生物学行为较高的GC患者. 但其生物学作用及其可能涉及的分子通路具体作用机制还有待于进一步揭示.
总之, 间质中Gal-1表达可能参与了细胞增殖、凋亡、迁移、侵袭以及免疫抑制等过程, 在GC的进展和转移中发挥了重要的作用. Gal-1的高表达与GC的恶性程度转移以及疾病进展程度显著相关, 可作为评价GC患者进展和预后的重要指标, 为早期预防和评估GC恶性肿瘤进展提供新的思路和理论依据.
胃癌(gastric cancer, GC), 是最常见的消化道恶性肿瘤之一, 发病率占世界恶性肿瘤第五位, 同时为第三大导致死亡的癌症相关恶性肿瘤. 因此, 探究其评估预后指标以及治疗靶点对GC患者预后至关重要.
目前, 半乳糖凝集素-1(Galectin-1, Gal-1)蛋白在组织的表达对胃癌患者的进展以及预后相关性少有报道.
明确Gal-1在GC中的表达及对预后的影响, 为早期预防和评估GC恶性肿瘤进展提供新的思路和理论依据.
采用免疫组化(immunohistochemistry, IHC)对84名不同GC患者的组织进行染色评估Gal-1的表达水平, 收集患者临床病理参数以及生存情况和生存时间, 统计学分析Gal-1与GC临床病理特征和预后的关系.
Gal-1在GC组织中间质成分中高表达, Gal-1的高表达与GC的恶性程度转移以及疾病进展程度显著相关且与GC预后负相关.
Gal-1在GC的进展和转移中发挥了重要的作用, 可作为评价GC患者进展和预后的重要指标.
Gal-1在GC中具有较大临床意义, 进一步揭示其生物学作用及其可能涉及的分子通路具体作用机制具有重大前景.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin. 2019;69:7-34. [PubMed] [DOI] |
| 2. | Nie Y, Wu K, Yu J, Liang Q, Cai X, Shang Y, Zhou J, Pan K, Sun L, Fang J, Yuan Y, You W, Fan D. A global burden of gastric cancer: the major impact of China. Expert Rev Gastroenterol Hepatol. 2017;11:651-661. [PubMed] [DOI] |
| 3. | Smyth EC, Nilsson M, Grabsch HI, van Grieken NC, Lordick F. Gastric cancer. Lancet. 2020;396:635-648. [PubMed] [DOI] |
| 4. | Zhang Q, Ali M, Wang Y, Sun QN, Zhu XD, Tang D, Wang W, Zhang CY, Zhou HH, Wang DR. Galectin1 binds GRP78 to promote the proliferation and metastasis of gastric cancer. Int J Oncol. 2022;61. [PubMed] [DOI] |
| 5. | de Visser KE, Joyce JA. The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth. Cancer Cell. 2023;41:374-403. [PubMed] [DOI] |
| 6. | Shih TC, Liu R, Wu CT, Li X, Xiao W, Deng X, Kiss S, Wang T, Chen XJ, Carney R, Kung HJ, Duan Y, Ghosh PM, Lam KS. Targeting Galectin-1 Impairs Castration-Resistant Prostate Cancer Progression and Invasion. Clin Cancer Res. 2018;24:4319-4331. [PubMed] [DOI] |
| 7. | Reynolds NM, Mohammadalipour A, Hall CR, Asghari Adib A, Farnoud AM, Burdick MM. Galectin-1 Influences Breast Cancer Cell Adhesion to E-selectin Via Ligand Intermediaries. Cell Mol Bioeng. 2018;11:37-52. [PubMed] [DOI] |
| 8. | Wu F, Yang J, Liu J, Wang Y, Mu J, Zeng Q, Deng S, Zhou H. Signaling pathways in cancer-associated fibroblasts and targeted therapy for cancer. Signal Transduct Target Ther. 2021;6:218. [PubMed] [DOI] |
| 9. | Wu MH, Hong HC, Hong TM, Chiang WF, Jin YT, Chen YL. Targeting galectin-1 in carcinoma-associated fibroblasts inhibits oral squamous cell carcinoma metastasis by downregulating MCP-1/CCL2 expression. Clin Cancer Res. 2011;17:1306-1316. [PubMed] [DOI] |
| 10. | You X, Wu J, Zhao X, Jiang X, Tao W, Chen Z, Huang C, Zheng T, Shen X. Fibroblastic galectin-1-fostered invasion and metastasis are mediated by TGF-β1-induced epithelial-mesenchymal transition in gastric cancer. Aging (Albany NY). 2021;13:18464-18481. [PubMed] [DOI] |
| 11. | Zhang Z, Liang Z, Li D, Wang L, Chen Y, Liang Y, Jiao W, Niu H. Development of a CAFs-related gene signature to predict survival and drug response in bladder cancer. Hum Cell. 2022;35:649-664. [PubMed] [DOI] |
| 12. | Leung Z, Ko FCF, Tey SK, Kwong EML, Mao X, Liu BHM, Ma APY, Fung YME, Che CM, Wong DKH, Lai CL, Ng IO, Yam JWP. Galectin-1 promotes hepatocellular carcinoma and the combined therapeutic effect of OTX008 galectin-1 inhibitor and sorafenib in tumor cells. J Exp Clin Cancer Res. 2019;38:423. [PubMed] [DOI] |
| 13. | Zhu P, Liu G, Wang X, Lu J, Zhou Y, Chen S, Gao Y, Wang C, Yu J, Sun Y, Zhou P. Transcription factor c-Jun modulates GLUT1 in glycolysis and breast cancer metastasis. BMC Cancer. 2022;22:1283. [PubMed] [DOI] |
| 14. | Li J, Pan C, Boese AC, Kang J, Umano AD, Magliocca KR, Yang W, Zhang Y, Lonial S, Jin L, Kang S. DGKA Provides Platinum Resistance in Ovarian Cancer Through Activation of c-JUN-WEE1 Signaling. Clin Cancer Res. 2020;26:3843-3855. [PubMed] [DOI] |
| 15. | Wu MH, Ying NW, Hong TM, Chiang WF, Lin YT, Chen YL. Galectin-1 induces vascular permeability through the neuropilin-1/vascular endothelial growth factor receptor-1 complex. Angiogenesis. 2014;17:839-849. [PubMed] [DOI] |
| 16. | Tsai YT, Li CY, Huang YH, Chang TS, Lin CY, Chuang CH, Wang CY, Anuraga G, Chang TH, Shih TC, Lin ZY, Chen YL, Chung I, Lee KH, Chang CC, Sung SY, Yang KH, Tsui WL, Yap CV, Wu MH. Galectin-1 orchestrates an inflammatory tumor-stroma crosstalk in hepatoma by enhancing TNFR1 protein stability and signaling in carcinoma-associated fibroblasts. Oncogene. 2022;41:3011-3023. [PubMed] [DOI] |
| 17. | Calon A, Espinet E, Palomo-Ponce S, Tauriello DV, Iglesias M, Céspedes MV, Sevillano M, Nadal C, Jung P, Zhang XH, Byrom D, Riera A, Rossell D, Mangues R, Massagué J, Sancho E, Batlle E. Dependency of colorectal cancer on a TGF-β-driven program in stromal cells for metastasis initiation. Cancer Cell. 2012;22:571-584. [PubMed] [DOI] |
| 18. | Paz A, Haklai R, Elad-Sfadia G, Ballan E, Kloog Y. Galectin-1 binds oncogenic H-Ras to mediate Ras membrane anchorage and cell transformation. Oncogene. 2001;20:7486-7493. [PubMed] [DOI] |
| 19. | Yazawa EM, Geddes-Sweeney JE, Cedeno-Laurent F, Walley KC, Barthel SR, Opperman MJ, Liang J, Lin JY, Schatton T, Laga AC, Mihm MC, Qureshi AA, Widlund HR, Murphy GF, Dimitroff CJ. Melanoma Cell Galectin-1 Ligands Functionally Correlate with Malignant Potential. J Invest Dermatol. 2015;135:1849-1862. [PubMed] [DOI] |