修回日期: 2023-02-17
接受日期: 2023-04-23
在线出版日期: 2023-04-28
幽门螺杆菌(Helicobacter pylori, H. pylori)容易造成胃炎、胃溃疡等胃部疾病, 目前有很多杀灭H. pylori的药物, 多以西药为主, 不宜长期服用, 且易复发. 中药灭菌副作用小, 但是作用机制并不完全清楚.
分析芍药苷(paeoniflorin, PF)通过调控巨噬细胞活性抗H. pylori作用及相关机制.
选取昆明小鼠6只, 新西兰家兔4只, 制备含PF血清, 提取小鼠腹腔巨噬细胞, 含药血清作用于小鼠腹腔巨噬细胞, 实验组加入5%含药血清, 对照组加入无药血清, 各组同时在加入H. pylori 11637, 含药血清在作用6 h后收集细胞. ELISA法检测各组小鼠巨噬细胞的单核细胞趋化蛋白1(monocyte chemoattractant protein-1, MCP-1)、白介素1β(interleukin-1β, IL-1β)、肿瘤坏死因子(tumor necrosis factor-α, TNF-α)含量, Western-Blot检测热休克蛋白70(heat shock protein 70, HSP70)、诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、Toll样受体2(toll-like receptor-2, TLR2)及Toll样受体4(toll-like receptor-4, TLR4)蛋白表达, 荧光定量多聚合酶链式反应检测小鼠巨噬细胞HSP70 mRNA、TLR2 mRNA及TLR4 mRNA相对表达.
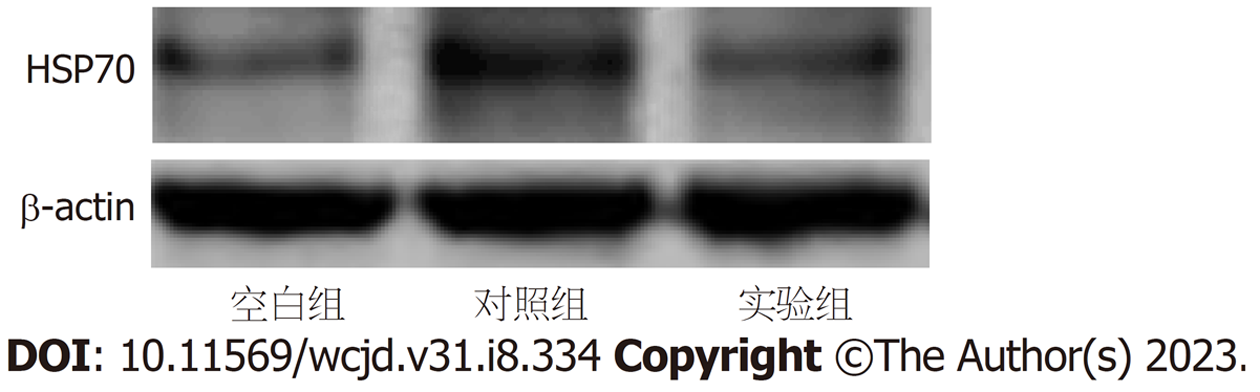
对照组小鼠MCP-1、IL-1β及TNF-α含量较空白组升高, 实验组小鼠MCP-1、IL-1β及TNF-α含量较对照组降低, 差异均有统计学意义(P<0.05); 对照组巨噬细胞iNOS、TLR4及TLR2蛋白表达较空白组升高; 实验组巨噬细胞iNOS、TLR4及TLR2蛋白表达较对照组降低, 差异有统计学意义(P<0.05); 对照组小鼠巨噬细胞TLR4、TLR2 mRNA相对表达量较空白组升高, 实验组小鼠巨噬细胞TLR4、TLR2 mRNA相对表达量较对照组降低, 差异有统计学意义(P<0.05); 对照组小鼠巨噬细胞HSP70 mRNA及蛋白表达较空白组升高, 实验组小鼠巨噬细胞HSP70 mRNA及蛋白表达较对照组降低, 差异有统计学意义(P<0.05).
芍药苷经过调节巨噬细胞活性起到抗H. pylori感染作用, 可抑制巨噬细胞分泌炎症因子与HSP70应激因子, 其抗炎作用可能和抑制巨噬细胞TLR2/4信号通路有关.
核心提要: 芍药苷能够激活小鼠体内的巨噬细胞调节免疫, 巨噬细胞的Toll样受体2/4信号通路被激活, 对侵入体内的幽门螺杆菌进行清除.
引文著录: 徐微, 徐建光, 何雪云, 林小花. 芍药苷通过调控巨噬细胞活性抗幽门螺杆菌作用及其机制研究. 世界华人消化杂志 2023; 31(8): 334-339
Revised: February 17, 2023
Accepted: April 23, 2023
Published online: April 28, 2023
Helicobacter pylori (H. pylori) often causes gastritis, gastric ulcer, and other stomach diseases. At present, there are many drugs available to kill H. pylori, but they are mainly Western medicines, not suitable for long-term use, and often associated with relapse. Traditional Chinese medicines have few side effects, but their mechanism of action is not completely clear.
To analyze the anti-H. pylori activity and mechanisms of action of paeoniflorin (PF).
Six Kunming mice and four New Zealand rabbits were selected to prepare PF-containing serum. Mouse peritoneal macrophages were collected and divided into a study group, a control group, and a blank group. The study group was supplemented with 5% drug-containing serum, and the control group was supplemented with drug-free serum. Both groups were treated with H. pylori 11637, and the cells was collected 6 h after treatment. The contents of monocyte chemoattractant protein-1 (MCP-1), interleukin-1β (IL-1β), and tumor necrosis factor-α (TNF-α) in macrophages of each group were detected by ELISA. The expression of heat shock protein 70 (HSP70), inducible nitric oxide synthase (iNOS), Toll-like receptor-2 (TLR2), and Toll-like receptor-4 (TLR4) was detected by Western blot analysis. The relative mRNA expression of HSP70, TLR2, and TLR4 in mouse macrophages was detected by quantitative polymerase chain reaction.
The contents of MCP-1, IL-1β, and TNF-α in the control group were significantly higher than those in the blank group, and the contents of MCP-1, IL-1β, and TNF-α in the study group were significantly lower than those in the control group (P < 0.05). The protein expression of iNOS, TLR4, and TLR2 in macrophages of the control group was significantly higher than that in the blank group, and the expression of iNOS, TLR4, and TLR2 in the macrophages of the study group was significantly lower than that in the control group (P < 0.05). The relative expression of TLR4 and TLR2 mRNA in macrophages of the control group was higher than that of the blank group, and the relative expression of TLR4 and TLR2 mRNA in the macrophages of the study group was lower than that of the control group (P < 0.05). The expression of HSP70 mRNA and protein in macrophages of the control group was higher than that of the blank group, and the expression of HSP70 mRNA and protein in macrophages of the study group was lower than that of the control group (P < 0.05).
Paeoniflorin can inhibit the secretion of inflammatory cytokines and HSP70 by macrophages by regulating their activity. The anti-inflammatory effect may be related to the inhibition of the TLR2/4 signaling pathway.
- Citation: Xu W, Xu JG, He XY, Lin XH. Paeoniflorin exhibits anti-Helicobacter pylori activity by regulating macrophage activity. Shijie Huaren Xiaohua Zazhi 2023; 31(8): 334-339
- URL: https://www.wjgnet.com/1009-3079/full/v31/i8/334.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i8.334
幽门螺杆菌(Helicobacter pylori, H. pylori)为一种微需氧、螺旋状革兰阴性菌, 多定植于机体胃肠道内, Warren与Marshall在1983年首次从胃内分离中. 流行病学研究表明H. pylori感染了世界范围内一半以上的人口. 目前已知发病率的高低与社会经济水平, 人口密集程度, 公共卫生条件以及水源供应有较密切的关系. 中国及大多数发展中国家人群H. pylori感染因地区有所不同. 低达20%, 高达90%, 人群中总感染率高于发达国家. 临床研究已经明确, H. pylori的长期慢性感染为人们发生胃癌、消化性溃疡、慢性活动性胃炎及黏膜相关淋巴组织淋巴瘤等疾病主要因素[1,2]. 当前, 临床对预防H. pylori相关胃十二指肠疾病主要疗法为根除H. pylori, 西医的三联治疗, 如BAM、OAC等一度使临床患者H. pylori根除率达90%以上[3], 但近些年来, 由于患者对西药耐药率的升高、治疗依从性差及药物不良反应等, 使H. pylori根除率明显降低, 因此, 临床急需一些新的治疗方案. 当前, 随着中医学在临床的广泛应用, 中药有对患者耐药性低、不良发应小及不引起肠道菌群失调等特点, 这说明在对H. pylori感染的治疗方案中医药有一定优势[4]. 芍药苷(paeoniflorin, PF)为单萜类糖苷化合物, 是传统中药芍药主要成分, 有免疫调节、抗炎、抗血小板聚集及抗氧化等影响[5]. 有研究显示, PF可经过对TLR2信号路径抑制来降低巨噬细胞活化[6]. 因此, 本研究经过分析PF通过调控巨噬细胞活性抗H. pylori作用及相关机制, 为临床患者诊疗提供一些借鉴.
1.1.1 实验动物: 昆明小鼠6只, 雌雄各半, 体重22 g-26 g; 新西兰家兔4只, 雌雄各半, 体重2.0 kg-2.6 kg, 均购自上海斯莱克实验动物公司. 常规饲养3 d后开始实验, 室温维持22 ℃-26 ℃, 相对湿度55%-65%, 昼夜循环, 保持12 h光照, 小鼠灌胃、添加饲料及换水等均有专人进行.
1.1.2 实验药物、试剂: 芍药苷(南京广润生物公司), 兔抗TLR2多克隆抗体(美国EMD Millipore公司), 兔抗诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、Toll样受体4(toll-like receptor-4, TLR4)多克隆抗体(美国Abcam公司), 人单核细胞趋化蛋白1(monocyte chemoattractant protein-1, MCP-1)试剂盒(北京瑞博奥生物公司), 白细胞介素(interleukin, IL)-1β、肿瘤坏死因子(tumor necrosis factor-α, TNF-α)(美国RD Systems公司).
(1)确定实验剂量. 急毒实验14 d, 设置药物梯度浓度, 分别为(10, 30, 50, 70, 90) mg/kg, 确定安全的给药剂量EC50, 以EC50进行动物实验; (2)制备含药血清, 家兔实验前禁食12 h, 依据人和动物剂量转换, 药物组灌胃家兔26 mg/kg的PF药液, 对照组家兔灌胃等剂量生理盐水, 共灌胃3次, 首次和第二次灌药间隔20 h, 第二次和第三次灌药间隔4 h. 末次给药后2 h在无菌条件下心脏采血, 室温下静置3 h, 离心机3000 rmp离心15 min, 血清分离, 在同种条件下将药物血清摇匀, 于56 ℃下水浴灭活20 min, 保存备用; (3)提取小鼠腹腔巨噬细胞, 无菌淀粉肉汤2 mL注入至小鼠腹腔内, 1次/d, 共注射3 d. 末次注射后小鼠脱颈椎处死, 在75%乙醇内浸泡5 min. 小鼠取出后酒精沥干, 在无菌纱布上仰卧放置. 在下腹皮肤处剪一小口, 在将全部腹部皮肤剪开, 暴露腹壁. 采用针管吸出3 mL至4 mL的腹腔液, 离心机离心后上清去除. DMEM高糖培养基(含10%胎牛血清、1%双抗)培养, 放置与37 ℃、50 mL/L CO2、饱和湿度二氧化碳培养箱内; (4)含药血清作用于小鼠腹腔巨噬细胞, 实验组加入5%含药血清, 对照组加入无药血清, 各组同时在加入H. pylori 11637, 每组小鼠腹腔内巨噬细胞达到4×106. 含药血清在作用6 h后收集细胞. 未经H. pylori 11637作用的巨噬细胞作为空白组.
(1)采集样品, 小鼠所分离腹腔巨噬细胞注入培养皿内, 在加入培养基(含10%胎牛血清)培养. 在细胞贴壁后将上清和细胞碎片吸走, 实验组在加入含药血清、培养基(含10%胎牛血清)与H. pylori 11637培养上清, 含药血清作用6 h后采用2×106个细胞用于各项检测; (2)采集巨噬细胞培养的上清液, ELISA法检测各组小鼠MCP-1、IL-1β、TNF-α含量, 具体步骤依据试剂盒说明书进行; (3)Western-Blot检测热休克蛋白70(heat shock protein 70, HSP70)、iNOS、Toll样受体2(toll-like receptor-2, TLR2)及TLR4蛋白表达, 细胞研磨, 经组织裂解上样电泳, 起始电压80 V, 溴酚蓝染料前缘进入分离胶上缘后电压提升至100 V, 溴酚蓝泳出分离胶下缘电泳结束. 半干电转移仪于PVDF膜内行蛋白质电转移, 恒流30 mA, 连续90 min. PVDF膜取出5% TBST脱脂奶粉封闭, 震荡60 min. 结束封闭TNS-T漂洗液洗膜10 min, 3次, 膜转转移至杂交袋, 加入适量漂洗液稀释抗体, 封口后4 ℃下孵育过夜; TBST漂洗液洗膜10 min, 3次, 加入漂洗液稀释辣根过氧化物酶标记二抗, 震荡60 min. PVDF膜放置在ECL显色液内震荡温育5 min, 暗室下曝光、显影及定影. 清水冲洗以后, 晾干扫描, IPP软件对扫描图像目的条带行灰度分析; (4)检测小鼠细胞HSP70 mRNA、TLR2 mRNA及TLR4 mRNA表达, Trizol法提取小鼠细胞总RNA行RT-PCR扩增, HSP70上游引物5'-GATTGAGATGATTTTGGAG-3', 下游引物5'-GTATGTTAAGTATATGATTG-3', 扩增片段是482 bp; TLR2上游引物5'-GCTCCAGGAATTCCTCGGTA-3', 下游引物5'-GAGTCCTGCATGCTAGCTAG-3', 扩增片段为389 bp; TLR4上游引物5'-GAATTGCGCGATGTAGTACG-3', 下游引物5'-GTTGTACTGTACTAGGTGCT-3', 扩增片段531 bp; 内参β-actin上游引物5'-CTTGATCGTACGTAGCCTGA-3', 下游引物5'-GTGTAGTGTACTGTCATGCA-3', 扩增片段482 bp. PCR反应条件: 94 ℃下45 s, 55 ℃下50 s, 72 ℃下75 s, 在40次循环以后获取核因子-κB(nuclear factor-κB, NF-κB) mRNA、MyD88 mRNA及TLR4 mRNA循环阈值(Ct), 使用△△Ct(△△Ct = Ct目的基因-△Ct内参基因)分析, 算出2﹣△△Ct目的基因相对表达量.
统计学处理 采用SPSS 19.0统计软件进行数据分析, 计量资料(mean±SD)表示, t检验, 计数资料采用n(%)表示, χ2检验, 多组间比较用单因素方差分析, 两两比较用LSD-t检验, P<0.05差异有统计学意义.
通过有效浓度曲线得出, PF对于家兔的EC50为45 mg/mL.
对照组小鼠MCP-1、IL-1β及TNF-α含量较空白组升高, 实验组小鼠MCP-1、IL-1β及TNF-α含量较对照组降低, 差异均有统计学意义(P<0.05), 详见表1.
对照组巨噬细胞iNOS、TLR4及TLR2蛋白表达较空白组升高; 实验组巨噬细胞iNOS、TLR4及TLR2蛋白表达较对照组降低, 差异有统计学意义(P<0.05), 详见表2, 图1.
对照组小鼠巨噬细胞TLR4、TLR2 mRNA相对表达量较空白组升高, 实验组小鼠巨噬细胞TLR4、TLR2 mRNA相对表达量较对照组降低, 差异有统计学意义(P<0.05), 详见表3.
机体感染H. pylori后, 抵抗H. pylori感染天然屏障为机体内固有免疫, 胃组织内树突状细胞、巨噬细胞等固有免疫细胞经过分泌IL-18等细胞因子, 将免疫细胞激活并分泌炎症介质, 从而起到抗感染的作用[7,8]. H. pylori感染胃组织内巨噬细胞后, 炎症组织局部巨噬细胞经浸润、增生、激活同时分泌TNF-α等细胞因子, 将入侵微生物杀伤并将淋巴细胞活化. 同时TNF-α协同诱导巨噬细胞形成NO, 导致DNA受损引起宿主细胞凋亡[9-11].
长期以来西药治疗H. pylori感染取得了较好疗效, 但对于H. pylori清除仍有一定困难, 患者在停药后易复发. 目前, 在临床上H. pylori对于抗生素, 尤其是甲硝唑、克拉霉素等原发耐药率普遍升高, 这了严重影响了常用根治方案的治疗效果. PF有多重生物学功效, 包含抗风湿、神经保护、诱导肿瘤细胞凋亡、加速肝细胞再生等, 由于其毒副影响较小而在临床广泛使用. 近些年来, 相关研究显示PF还可下调IL-6、IL-1β、TNF-α等细胞因子活性, 发挥广泛抗炎影响[12]. 本文研究显示, 实验组小鼠MCP-1、IL-1β及TNF-α含量较对照组降低, 差异均有统计学意义, 和上述研究结果一致.
TLR4与TLR2为Toll样受体, 为Ⅰ型跨膜受体蛋白, 多在抗原提呈细胞内表达, 激活以后可将MyD88通路启动, 对IRAKs家族招募并结合TRAF6, 将NF-κB活化[13]. NF-κB是Rel家族转录因子, 一般指p65和p50所构成异源二聚体, 在静息时结合抑制蛋白IkB存在细胞质内, 在外界刺激后和IkB解离并进入到细胞核中, 进而释放MCP-1、TNF-α及IL-1β等促炎细胞因子. 另外, TLR4还能够经过TRIF路径将IRF3激活, 行信号转导将炎症反应启动[14]. 本文研究显示, 实验组巨噬细胞LR4、TLR2 mRNA及蛋白表达较对照组降低, 差异有统计学意义, 说明PF对H. pylori感染的治疗, 有巨噬细胞的参与, 且这一抗炎作用可能和TLR2/4通路有关.
HSP70为热休克蛋白家族内主要成员之一, 其分子量约为70 kD. 正常细胞内HSP70水平比较低, 但在应激情况其含量会显著提升. 对于机体胃肠道来讲, H. pylori感染为长期慢性应激, 一般会造成胃黏膜内HSP70高表达. 通常HSP70多位于胞浆中, 若受到热休克刺激细胞核内HSP70含量会快速升高, 仅有少量存在于胞浆内, 细胞在恢复阶段时细胞核中HSP70则会消失, 而胞浆内依然有低水平的HSP70表达, 对细胞内HSP70细胞检测可反映其胃炎进展情况[15]. 实验组小鼠巨噬细胞HSP70 mRNA及蛋白表达较对照组降低, 差异有统计学意义, 说明PF可调控巨噬细胞分泌HSP70, 降低H. pylori对胃黏膜刺激作用.
综上所述, 芍药苷经过调节巨噬细胞活性起到抗H. pylori感染作用, 可抑制巨噬细胞分泌炎症因子与HSP70应激因子, 其抗炎作用可能和抑制巨噬细胞TLR2/4信号通路有关.
中国有的地区感染幽门螺杆菌(Helicobacter pylori, H. pylori)的人群高达90%, 容易引起胃癌、消化性溃疡、慢性活动性胃炎及黏膜相关淋巴组织淋巴瘤等胃部疾病. 西药治疗效果显著, 但是易反复, 且长期服用副作用明显.
目前, H. pylori感染治疗药物主要是四联疗法. 相当一部分人并不适合其中的抗生素治疗, 因此疗效欠佳. 芍药苷治疗H. pylori, 作为中成药, 不仅副作用下, 而且适用于更广泛的人群.
芍药苷的重要特性在治疗H. pylori中发挥了不错的疗效, 但是具体发挥作用的机制并不清楚, 本研究从巨噬细胞的调控入手, 分析芍药苷抗H. pylori的作用及相关机制.
通过小鼠动物模型, 采用Western Blot和荧光定量PCR的方法对巨噬细胞相关的免疫指标进行检测, 观察H. pylori的数量, 分析相关信号通路的相互影响, 判断芍药苷对H. pylori的影响.
与对照组相比, 经过芍药苷处理的小鼠的单核细胞趋化蛋白1、白介素1β、肿瘤坏死因子含量、巨噬细胞诱导型一氧化氮合酶、Toll样受体4(toll-like receptor-4, TLR4)、Toll样受体2(toll-like receptor-2, TLR2)、热休克蛋白70(heat shock protein 70, HSP70)mRNA及蛋白表达均较低.
芍药苷通过调节巨噬细胞分泌炎症因子、HSP70应激因子以及TLR2/4信号通路, 调节巨噬细胞活性, 对H. pylori的感染起到积极的治疗作用.
本研究从巨噬细胞中发现了芍药苷对H. pylori杀灭的机理, 但是是否还有其他相关作用机制还需进一步研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省衢州市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | 董 启超, 梁 晖, 胡 聪, 林 旭, 林 智文. 脾多肽对幽门螺旋杆菌脂多糖诱导RAW264.7巨噬细胞TNF-α、IL-1β、IL-6及IL-17的作用. 海南医学. 2018;4:1-3. [DOI] |
| 2. | 肖 玲巧, 王 超, 谢 成元, 刘 硕, 陈 国栋, 李 杰, 余 敏君, 赵 兰华, 韩 亮, 张 艳. 幽门螺杆菌Tipα蛋白激活NLRP3炎性小体诱导THP-1细胞分泌IL-1β和IL-18. 中国人兽共患病学报. 2017;33:1071-1076. |
| 3. | 张 万岱. 中医药治疗幽门螺杆菌感染的研究现状和展望. 中华中医药学会脾胃病分会全国脾胃病学术交流会. 2011;. |
| 6. | Shao YX, Xu XX, Li YY, Qi XM, Wang K, Wu YG, Meng XM. Paeoniflorin inhibits high glucose-induced macrophage activation through TLR2-dependent signal pathways. J Ethnopharmacol. 2016;193:377-386. [PubMed] [DOI] |
| 7. | Beceiro S, Radin JN, Chatuvedi R, Piazuelo MB, Horvarth DJ, Cortado H, Gu Y, Dixon B, Gu C, Lange I, Koomoa DL, Wilson KT, Algood HM, Partida-Sánchez S. TRPM2 ion channels regulate macrophage polarization and gastric inflammation during Helicobacter pylori infection. Mucosal Immunol. 2017;10:493-507. [PubMed] [DOI] |
| 8. | Kita M, Yokota K, Kageyama C, Take S, Goto K, Kawahara Y, Matsushita O, Okada H. DEC205 mediates local and systemic immune responses to Helicobacter pylori infection in humans. Oncotarget. 2018;9:15828-15835. [PubMed] [DOI] |
| 10. | Kim TJ, Kim ER, Chang DK, Kim YH, Baek SY, Kim K, Hong SN. Helicobacter pylori infection is an independent risk factor of early and advanced colorectal neoplasm. Helicobacter. 2017;22. [PubMed] [DOI] |
| 12. | Wang P, Wang W, Shi Q, Zhao L, Mei F, Li C, Zuo T, He X. Paeoniflorin ameliorates acute necrotizing pancreatitis and pancreatitisinduced acute renal injury. Mol Med Rep. 2016;14:1123-1131. [PubMed] [DOI] |
| 13. | 曹 梦姣, 刘 琳, 李 慧艳, 党 彤, 贾 彦彬. MIF基因多态性与幽门螺杆菌感染及非贲门胃癌关系的研究. 胃肠病学和肝病学杂志. 2017;26:693-696. |