修回日期: 2023-01-28
接受日期: 2023-02-28
在线出版日期: 2023-03-28
黄连厚朴汤(Huanglian Houpo Decoction, HHD)具有抗炎的药理作用, 且能改善溃疡性结肠炎(ulcerative colitis, UC)所致肠道炎性损伤, 但其潜在作用机制尚不清楚.
以核苷酸结合寡聚化结构域样受体蛋白3(nucleotide binding oligomerization domain-like receptor protein 3, NLRP3)炎症小体为切入点, 探讨HHD对UC的作用机制.
将雄性C57BL/6小鼠随机分为正常组、模型组、美沙拉嗪组、黄连厚朴汤低、中、高剂量组. 除正常组外, 采用3%葡聚糖硫酸钠(dextran sodium sulfate, DSS)诱导小鼠UC模型, 造模的同时按分组给药. 给药期间, 每日进行小鼠的一般情况评价, 计算疾病活动指数(disease activity index, DAI). 给药结束后, 取结肠和血清, 测量结肠长度, 评估结肠黏膜损伤指数(colon mucosa damage index, CMDI), 以苏木素-伊红(hematoxylin-eosin, HE)染色观察结肠组织病理改变并进行病理学评分, 酶联免疫吸附测定法(enzyme-linked immunosorbent assay, ELISA)法检测血清中促炎因子白细胞介素1β(interleukin-1β, IL-1β)、白细胞介素6(interleukin-6, IL-6)及肿瘤坏死因子α(tumor necrosis factor, TNF-α)的水平, 蛋白免疫印迹法(Western blot)法检测结肠组织NLRP3和半胱氨酸天冬氨酸蛋白水解酶1(cystein-asparate protease 1, Caspase-1)的蛋白表达水平.
与正常组相比, 模型组小鼠DAI评分显著升高(P<0.01), 结肠长度明显缩短(P<0.01), CMDI评分显著升高(P<0.01), 组织病理学评分显著降低(P<0.01), 血清中IL-1β、IL-6及TNF-α水平显著增高(P<0.01), 结肠组织中NLRP3与Caspase-1蛋白表达显著增多(P<0.01). 与模型组相比, 黄连厚朴汤各剂量组和美沙拉嗪组DAI评分显著改善(P<0.01), 结肠长度明显恢复(P<0.05或P<0.01); 黄连厚朴汤中、高剂量组及美沙拉嗪组CMDI评分明显下降(P<0.05或P<0.01), 组织病理学评分明显降低(P<0.05或P<0.01);黄连厚朴汤各剂量组和美沙拉嗪组血清中促炎因子IL-1β、IL-6及TNF-α水平均明显降低(P<0.05或P<0.01); 黄连厚朴汤中、高剂量与美沙拉嗪组结肠组织中NLRP3与Caspase-1蛋白表达显著降低(P<0.01).
黄连厚朴汤可通过抑制NLRP3炎症小体活化缓解DSS所致小鼠溃疡性结肠炎.
核心提要: 黄连厚朴汤能减轻溃疡性结肠炎模型小鼠的肠道损伤和炎症反应, 且此作用与其抑制核苷酸结合寡聚化结构域样受体蛋白3炎症小体活化有关.
引文著录: 朱文瑞, 赵天文, 徐洪锋. 基于NLRP3炎症小体探讨黄连厚朴汤治疗溃疡性结肠炎的作用机制. 世界华人消化杂志 2023; 31(6): 221-229
Revised: January 28, 2023
Accepted: February 28, 2023
Published online: March 28, 2023
Huanglian Houpo Decoction (HHD) has anti-inflammatory effects, and can improve intestinal inflammatory injury caused by ulcerative colitis (UC), but the underlying mechanism remains unclear.
To investigate the mechanism of HHD in treating UC based on nucleotide binding oligomerization domain-like receptor protein 3 (NLRP3) inflammasome activation.
Male C57BL/6J mice were randomized into a control group, model group, mesalazine group, and low-, medium-, and high-dose HHD groups (HHD-H, HHD-M, and HHD-L, respectively). Except for the control group, all other groups had free access to 3% DSS solution to establish the UC model. Intragastric administration was started at the same time as modeling for 1 wk. During the experiment, the general mental state and disease activity index (DAI) score of mice were daily recorded. At the end of the treatment, colon and serum samples were collected, colon length was measured, and colon mucosa damage index (CMDI) score was calculated. The pathological changes in colon tissue were observed by hematoxylin-eosin (HE) staining and the histological damage score was evaluated. The levels of interleukin-1β (IL-1β), interleukin-6 (IL-6), and tumour necrosis factor-α (TNF-α) were measured by enzyme-linked immunosorbent assay (ELISA). The protein expression of NLRP3 and Caspase-1 (cystein-asparate protease 1) in colon tissues was detected by Western blot.
Compared with the control group, the DAI score and CMDI score of the model group were significantly increased (P < 0.01), while colon length was significantly shortened (P < 0.01). The histological damage score was significantly reduced (P < 0.01). The expression levels of IL-1β, IL-6, and TNF-α increased significantly in serum (P < 0.01). Furthermore, the modeling caused obvious pathological changes and up-regulated the expression of NLRP3 and Caspase-1 in the colon (P < 0.01). Compared with the model group, the HHD groups and the mesalazine group showed significantly improved DAI scores (P < 0.01). The colon length recovered significantly (P < 0.05 or P < 0.01). The CMDI score and histological damage score decreased, especially in the HHD-M group, HHD-H group, and mesalazine group (P < 0.05 or P < 0.01). Compared with the model group, the HHD groups and mesalazine group displayed reduced levels of IL-6, IL-1β, and TNF-α in serum (P < 0.05 or P < 0.01). The HHD-M group, HHD-H group, and mesalazine group showed elevated expression of NLRP3 and Caspase-1 in colon tissues (P < 0.01).
HHD can reduce DSS-induced ulcerative colitis by inhibiting the activation of NLRP3 inflammasome.
- Citation: Zhu WR, Zhao TW, Xu HF. Huanglian Houpo Decoction exerts therapeutic effects on ulcerative colitis by inhibiting NLRP3 inflammasome activation. Shijie Huaren Xiaohua Zazhi 2023; 31(6): 221-229
- URL: https://www.wjgnet.com/1009-3079/full/v31/i6/221.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i6.221
溃疡性结肠炎(ulcerative colitis, UC)是一种累及结直肠黏膜及黏膜下层的慢性非特异性肠道炎症性疾病[1]. 该病具有病程漫长、易反复发作、癌变率高等特点, 被世界卫生组织列为现代难治性疾病之一[2]. 研究报道[3,4], 炎症细胞因子的过度表达是引起UC的一个重要因素. 当受到病原及相关分子模式的刺激时, 结肠黏膜免疫细胞中核苷酸结合寡聚化结构域样受体蛋白3(nucleotide binding oligomerization domain-like receptor protein 3, NLRP3)炎症小体被激活, 诱导大量白细胞介素1β(interleukin-1β, IL-1β)、白细胞介素18(interleukin-18, IL-18)等炎症因子的合成、释放, 在体内引发炎症级联反应, 造成肠黏膜免疫炎症损伤. 已有研究证实[5], UC活动期患者结肠组织中NLRP3表达明显上调, 通过药物抑制NLRP3炎症小体活化, 减少其下游炎症因子的表达, 可改善UC的临床症状[6,7]. 综上所述, 基于NLRP3炎症小体活化的治疗方案可能是防治UC的新思路和新方向. 黄连厚朴汤出自明代《普济方》中的《德生堂方》, 由黄连、厚朴两味药组成, 具有燥湿止痢之效, 原方用于伤寒, 大便自利, 日夜不止等症. 经数据挖掘并总结当代国医大师的临床经验发现, 黄连与厚朴为治疗UC的高频用药[8]. 网络药理学研究预测黄连厚朴汤可能通过参与免疫炎症、细胞凋亡、活性氧等生物过程发挥治疗UC效用[9]. 动物实验证实, 黄连厚朴汤能抑制IL-1β、肿瘤坏死因子α(tumor necrosis factor, TNF-α)等炎症因子表达, 改善UC肠道炎性损伤[10,11], 但黄连厚朴汤是否通过调控其潜在靶点NLRP3炎症小体来发挥抗UC作用还尚未明确. 本研究通过葡聚糖硫酸钠(dextran sodium sulfate, DSS)构建UC小鼠模型, 研究黄连厚朴汤对UC小鼠的治疗作用, 并以NLRP3炎症小体为切入点, 探讨黄连厚朴汤的作用机制, 以期为临床更好地应用该方提供科学依据.
1.1.1 药物与试剂: 黄连(批号220625)和厚朴(批号220701)中药饮片均由绍兴市中医院中药房提供, 经绍兴市中医院徐洪锋副主任药师鉴定为合格药材; DSS(批号160110)购自美国MP Biomedicals公司; 美沙拉嗪缓释颗粒(批号210509)购自上海爱的发制药有限公司; 白细胞介素6(interleukin-6, IL-6)ELISA试剂盒(MM-0163M2)、IL-1β ELISA试剂盒(批号MM-0040M2)、TNF-α ELISA试剂盒(批号MM-0132M2)购自江苏酶免实业有限公司; Caspase-1抗体(批号AF5418)、NLRP3抗体(批号DF7438)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体(批号AF7021)购自美国Affinity公司; 辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗兔免疫球蛋白IgG(goat anti-rabbit, IgG-HRP)(批号7074)购自美国CST公司; 苏木素(批号H3136)、伊红(批号E4009)购自美国sigma公司.
1.1.2 动物: SPF级健康雄性C57BL/6J小鼠, 体质量(20±2) g购于上海灵畅生物科技有限公司, 动物生产许可证号: SCXK(沪)2018-0003, 饲养于SPF级动物房, 实验动物使用许可证号: SYXK(浙)2021-0003. 本研究严格按照动物实验伦理规范进行实验, 伦理审查批准号: ZJEY-20220602-01.
1.2.1 黄连厚朴汤制备: 分别取黄连90 g、厚朴60 g, 加入10倍量水浸泡30 min, 煮沸后, 继续煎煮45 min, 趁热过滤, 滤渣加入8倍量水再次煎煮 30 min, 过滤, 合并滤液, 减压浓缩制成1.0 g/mL生药浓度的黄连厚朴汤, 保存于4 ℃冰箱中备用.
1.2.2 分组、造模及给药: 适应性喂养7 d后, 将36只SPF级C57BL/6雄鼠随机分为正常组(Control)、模型组(DSS)、美沙拉嗪组(5-Amino Salicylic Acid, 5-ASA)、黄连厚朴汤低剂量组(HHD-L)、黄连厚朴汤低剂量组(HHD-M)及黄连厚朴汤低剂量组(HHD-H). 除Control组小鼠自由饮用纯净水外, 其余各组分别自由饮用3% DSS溶液7 d, 诱导UC模型[12]. 各组于造模前0.5 h开始灌胃给药, 参考相关文献[9]以及课题组前期研究设定HHD-L组、HHD-M组、HHD-H组分别以2.5、5、10 g/kg(相当于临床等效剂量的1、2、4倍)进行灌胃, 5-ASA组给予0.52 g/kg美沙拉嗪混悬液灌胃, Control组和DSS组小鼠给予等量生理盐水灌胃, 各组均每日给药1次, 持续7 d.
1.2.3 一般情况评价与疾病活动指数评分: 每天观察并记录各组小鼠体精神状况、毛色、体质量变化、粪便性状及便血程度. 按照表1标准进行疾病活动指数(disease activity index, DAI)评分[13], 以评估疾病活动情况, 计算方法如下: DAI评分 = (体质量下降百分率评分+粪便性状评分+粪便隐血情况评分)/3.
| 评分 | 体质量下降率/% | 粪便性状 | 粪便隐血 |
| 0 | 无 | 正常 | 阴性 |
| 1 | 1-5 | 粪便成形, 但易粘附 | 弱阳性 |
| 2 | 5-10 | 半成形或软便 | 阳性 |
| 3 | 10-15 | 粪便成泥浆状 | 强阳性 |
| 4 | >15 | 腹泻, 粪便粘附于肛门 | 便血 |
1.2.4 结肠长度测量及样本收集: 末次给药后小鼠禁食不禁水12 h, 用10%水合氯醛腹腔注射(0.3 mL/100 g)麻醉小鼠, 摘眼球取血, 于4 ℃ 3000 r/min离心10 min, 取上清, -80 ℃冰箱保存待测. 取血结束后, 脱颈椎处死, 剥离结肠, 测量各组小鼠回盲部到整个结肠长度. 测量结束后, 剪开肠腔, 洗净内容物, 进行结肠黏膜损伤指数(colon mucosa damage index, CMDI)评分; 取近肛门端2 cm结肠组织, 放入4%多聚甲醛固定, 用于结肠组织的病理形态学分析; 剩余结肠组织洗净后置于-80 ℃冻存, 用于Western blot试验.
1.2.5 CMDI评分: 按"1.2.4"项方法分离结肠, 剖开洗净后, 用滤纸吸干, 将结肠平铺于冰盒上, 肉眼观察结肠大体形态, 按表2评分标准[14]进行结肠黏膜损伤评分.
| 评分 | 标准 |
| 0 | 没有损坏 |
| 1 | 局部充血, 无溃疡及坏死 |
| 2 | 肠壁充血和增厚, 但无溃疡 |
| 3 | 有1处小面积溃疡或坏死 |
| 4 | 有2处或多处小面积溃疡或坏死 |
| 5 | 沿肠壁多位点溃疡范围>1 cm(溃疡范围的最大直径) |
| 6-10 | 溃疡或坏死>2 cm或以上, 每增加1 cm长度增加1分 |
1.2.6 HE染色法观察小鼠结肠组织病理变化: 按"1.2.4"项方法将小鼠结肠组织固定, 经梯度乙醇脱水、石蜡包埋、切片、HE染色后, 在光学显微镜下从隐窝结构损伤程度、炎症细胞浸润及炎症损伤深度三方面观察结肠病理改变情况, 按表3评分标准[15]进行组织病理学评分.
| 评分 | 隐窝损伤 | 炎性细胞浸润 | 炎症损伤深度 |
| 0 | 无 | 无 | 无 |
| 1 | 1/3隐窝被损坏 | 轻度 | 黏膜 |
| 2 | 2/3隐窝被损坏 | 中度 | 黏膜及黏膜下层 |
| 3 | 隐窝缺失, 但表面有上皮细胞存在 | 重度 | 透壁 |
| 4 | 隐窝和表面上皮均丢失 |
1.2.7 ELISA法检测血清炎症因子水平: 按"1.2.4"项方法制备血清, 依据ELISA试剂盒步骤操作并计算血清中炎症因子IL-1β、IL-6、TNF-α水平.
1.2.8 Western blot法检测结肠组织中NLRP3和caspase-1蛋白表达水平: 将各组小鼠结肠组织剪成小块, 加入裂解液, 冰上研磨提取总蛋白, BCA法测定蛋白浓度. 用10%聚丙烯酰胺凝胶电泳分离蛋白, 电泳完成后, 将蛋白从凝胶上转至聚偏二氟乙烯膜上, 5%脱脂牛奶封闭, 在4 ℃条件下孵育一抗NLRP3(1:1000)和Caspase-1(1:2000), 过夜, PBST洗膜后, IgG-HRP二抗(1:2000)与一抗室温共同孵育1 h, 加入化学发光试剂, 使用凝胶成像系统进行曝光显影. 利用Image J软件对蛋白条带灰度值进行分析, 以GAPDH(1:5000)为内参, 以目的蛋白与内参蛋白的灰度值比值表示其相对表达量.
统计学处理 采用SPSS 22.0进行数据统计与分析, 计量数据以平均数±标准差(mean±SD)表示, 多组间比较, 采用单因素方差分析; 两组间比较, 采用LSD-t检验和Dunnett-t检验. 以P<0.05认为差异有统计学意义.
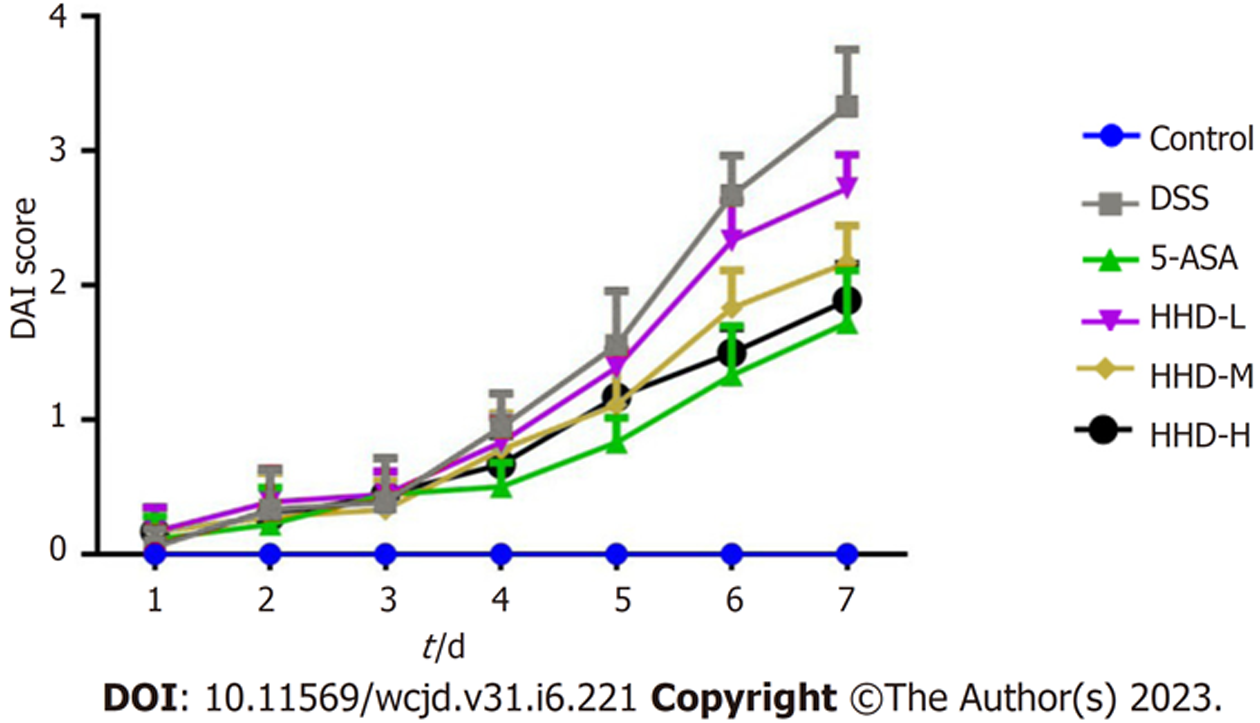
实验过程中, Control组小鼠每日精神状态良好, 活动灵敏, 排便正常, 粪便呈棕黑色麦粒状, 体质量呈缓慢上升趋势. 除Control组外, 各组小鼠从实验第3天起出现精神减退, 活动减少, 便溏、腹泻, 体质量下降等症状, 在实验第4-7天各组小鼠疾病症状呈每日加重趋势. 根据小鼠体重和粪便情况进行DAI评分, 如图1示, Control组每日DAI评分均为0分, DSS组、HHD各剂量组及5-ASA组DAI评分逐日增加. 实验第7天, 与Control组相比, DSS组DAI评分显著升高(P<0.01), 与DSS组比较, HHD各剂量组和及5-ASA组小鼠DAI评分均显著降低(P<0.01).
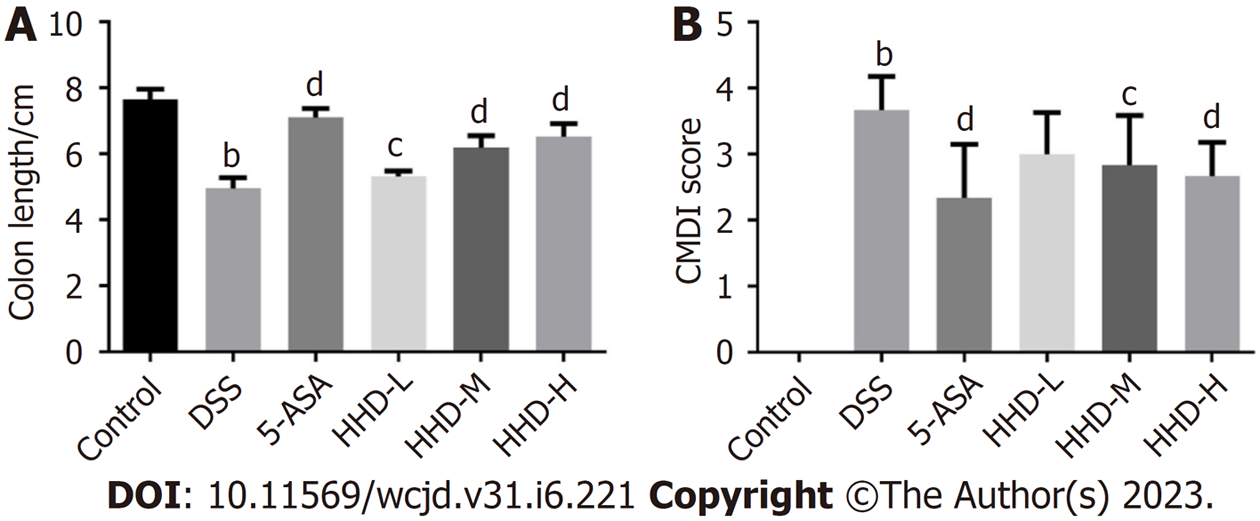
图2A示, 与Control组比较, DSS组小鼠结肠长度显著缩短(P<0.01); 与DSS组比较, HHD各剂量组和5-ASA组小鼠结肠长度明显恢复(P<0.05或P<0.01). 图2B示, 与Control组比较, DSS组小鼠的结肠黏膜CMDI评分显著升高(P<0.01); 与DSS组比较, HHD各剂量组和5-ASA组均能降低CMDI评分, 其中HHD-M组、HHD-H及5-ASA组具有统计学差异(P<0.05或P<0.01).
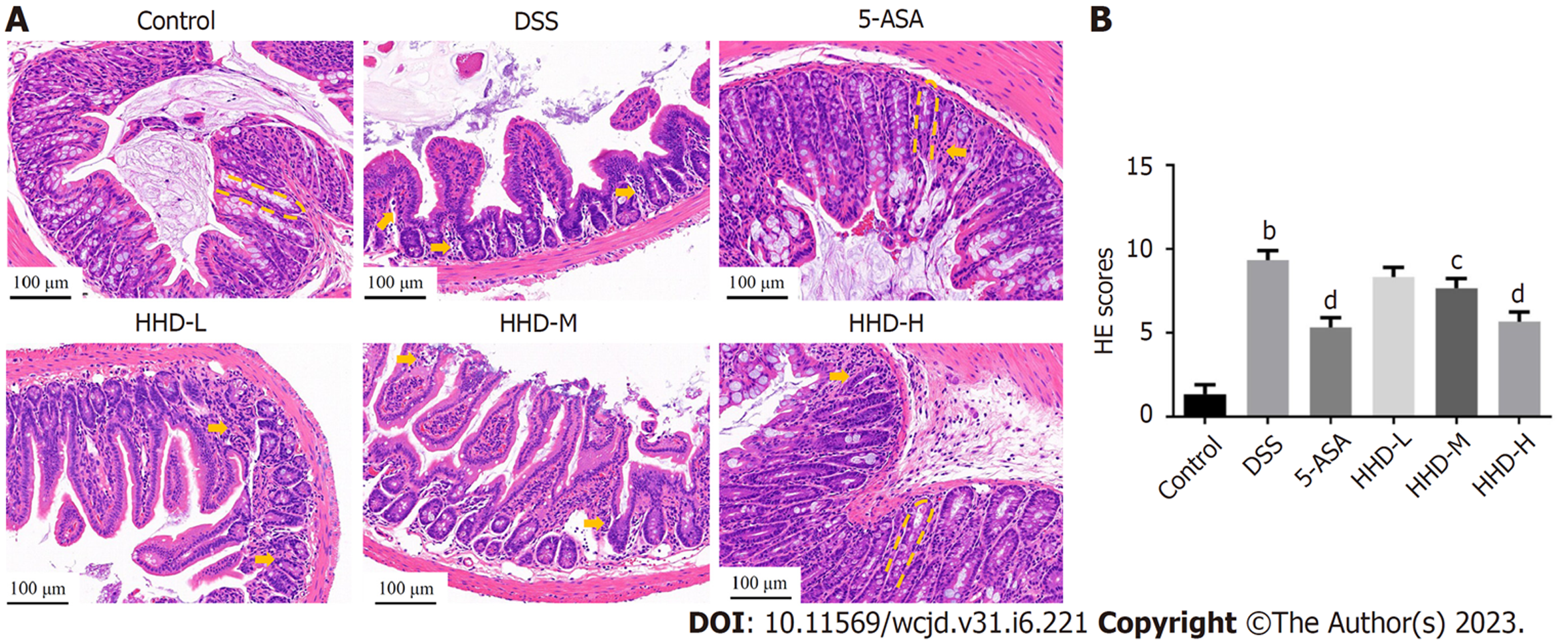
图3A示, Control组小鼠结肠黏膜与隐窝结构完整清晰, 可见大量杯状细胞, 无明显炎性浸润; DSS组小鼠结肠黏膜结构严重损坏, 基本无结构完整的隐窝, 杯状细胞丢失, 黏膜下层及浆膜层可见大量炎性细胞浸润; 与DSS组相比, HHD-L组、HHD-M组可见多处黏膜中断和隐窝结构破坏, 结肠黏膜及黏膜下层仍见多数炎性细胞浸润, 但炎性细胞浸润程度稍低于DSS组; HHD-H组和5-ASA组组织病理改善明显, 黏膜较连续完整、隐窝结构基本正常、杯状细胞数目较多、炎性细胞浸润程度及损伤深度明显减轻. 根据评分标准对HE染色结果进行评分, 结果如图3B示, 与Control组比较, DSS组小鼠结肠组织病理学评分显著升高(P<0.01), 与DSS组比较, HHD各剂量组组织病理学评分均有降低, 但低剂量组评分差异无统计学意义, HHD-H组与和5-ASA组组织病理学评分降低最为显著(P<0.01).
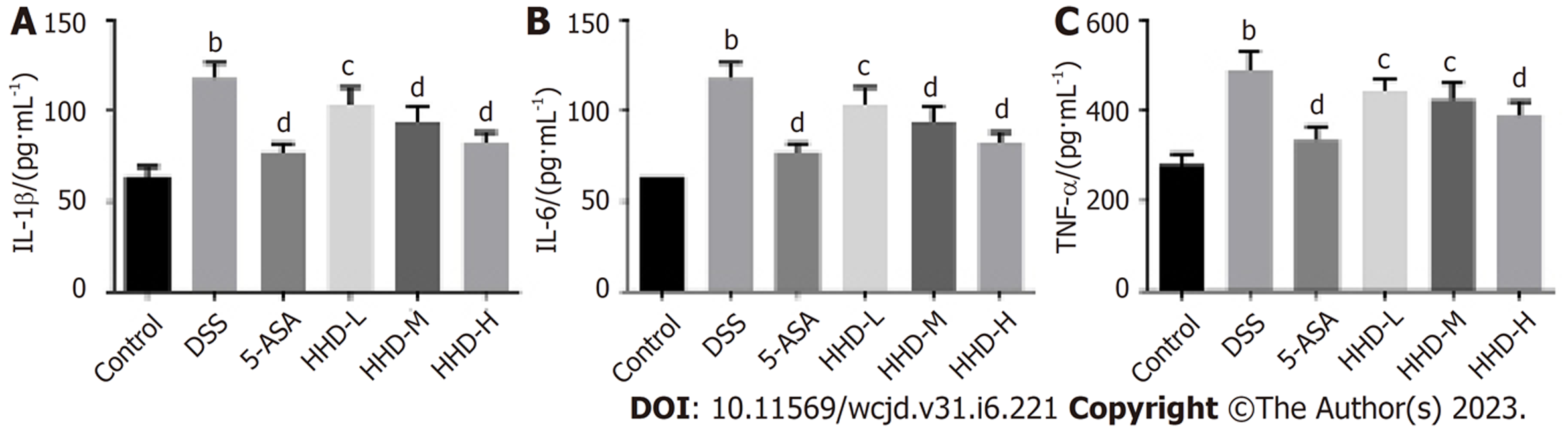
图4示, 与Control组相比, DSS组小鼠血清中IL-1β、IL-6和TNF-α的水平显著增高(P<0.01); 与DSS组相比, HHD各剂量组和5-ASA组血清IL-1β、IL-6和TNF-α均明显下降(P<0.05或P<0.01).
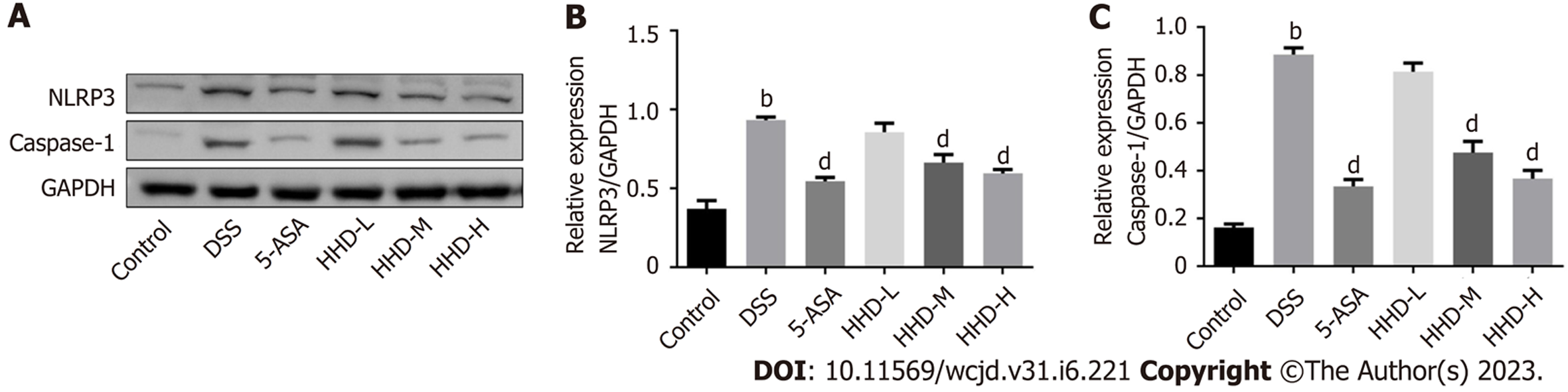
图5示, 与Control组相比, DSS组小鼠结肠组织中NLRP3、Caspase-1蛋白表达水平均显著增加(P<0.01); 与DSS组相比, HHD-M、HHD-H组及5-ASA组结肠组织NLRP3、Caspase-1蛋白表达水平显著降低(P<0.01), HHD-L组差异无统计学意义.
中医将溃疡性结肠炎归属于"久痢、泄泻、肠澼"等病范畴[16]. 众多医家认为本病在活动期的病因病机与湿热关系密切. 机体感受湿热之邪, 湿热壅滞大肠, 气血郁积不通, 内溃而成疡, 表现为腹痛; 湿热蕴结, 气血凝滞腐败, 脂膜血络受伤而发为脓血便; 湿热下注而表现为腹泻、里急后重不适[17]. 故UC活动期以大肠湿热证最为常见[18], 治则以清利大肠湿热为主, 辅以理气、活血之法. 黄连厚朴汤中黄连味苦性寒, 具有清热燥湿止痢之效, 厚朴味苦性温, 具有行气燥湿除满之功, 两药相伍, 寒热并用, 在增强燥湿之效的同时而降低黄连苦寒之性, 是治疗大肠湿热型UC常用药对[8]. 本实验结果显示, 相较于模型组, 黄连厚朴汤治疗后, 各剂量组小鼠DAI评分更低, 结肠长度更长, CMDI 评分更低, HE染色见隐窝结构有所恢复, 炎性细胞浸润程度和损伤深度得到改善, 组织病理学评分更低, 说明黄连厚朴汤能改善DSS诱导的UC小鼠肠道损伤症状, 具有治疗UC的潜力.
NLRP3炎症小体是由多个蛋白组成的复合物, 是炎症反应中的重要组成, 与UC等多种炎症性疾病发生有关. 已有研究表明[19], NLRP3炎症小体在促炎细胞因子的分泌和激活中起重要作用. 炎症状态下, NLRP3炎症小体一旦被激活, 首先诱导半胱氨酸天冬氨酸特异性蛋白酶1前体活化, 使其转换为具有活性的形式Caspase-l, 具有活性的Caspase-l再裂解其他前体炎症分子产生具有活性的炎性细胞因子, 如IL-1β和IL-18[20], 这些炎性细胞因子被证实为对诱发炎性肠病发病及导致其活动性加重等方面具有重要的意义[21]. IL-1β能通过自分泌或旁分泌刺激其他促炎细胞因子产生, 激活补体, 促进内皮-白细胞黏附分子表达,趋化中性粒细胞等进入肠道病变部位, 加重UC肠道炎症[22]; IL-18是细胞免疫的启动子, 一方面通过增强T细胞介导的炎症, 直接促进炎症期间杯状细胞障碍, 破坏黏膜屏障, 另一方面IL-18通过上调TNF-α和IL-6等炎症因子发挥促炎作用[23]; TNF-α作用于肠上皮细胞, 诱导趋化因子以及协助炎性细胞的浸润, 放大局部炎症级联反应, 引发肠上皮细胞的损伤与坏死[24]; IL-6过量表达, 促进辅助性T细胞17的分化, 导致辅助性T细胞17与调节性T细比例失衡, 加剧IL-1β、TNF-α等促炎细胞因子产生[25]; 研究证实, UC患者较正常人血清促炎细胞因子IL-1β、IL-6及TNF-α水平显著上升[26,27]. 动物实验研究发现, 参苓白术散、黄芩汤、消痈止痢汤通过降低UC小鼠血清中IL-1β、IL-6、TNF-α的水平[28-30]发挥治疗作用. 上述研究与本实验结果相符. 本实验模型组小鼠血清中促炎细胞因子IL-1β、IL-6及TNF-α水平显著高于正常组, 黄连厚朴汤干预后上述炎症因子水平明显下降. 提示, 黄连厚朴汤可降低促炎细胞因子IL-1β、IL-6及TNF-α的分泌水平, 从而减轻UC诱导的炎症反应. 越来越多的研究表明, 中药复方及单体成分能够通过调控NLRP3活化及其下游相关炎症因子分泌发挥治疗UC的作用, 如黄芩汤通过调节NLRP3/Caspase-1信号通路, 减少血清中IL-6、IL-1β、TNF-α的表达, 从而改善DSS小鼠的肠道损伤症状及肠黏膜的炎症浸润[29]; 健脾益肠散可有效抑制NLRP3炎症小体信号通路的激活, 进而调控促炎细胞因子IL-1β、IL-18的释放以缓解UC炎症反应[31]; 汉黄芩素治疗UC的作用机制与抑制NLRP3信号通路炎症反应, 抑制巨噬细胞分泌炎症因子, 减少炎症反应有关[19]. 本实验结果显示, DSS诱导的UC模型小鼠结肠组织NLRP3、Caspase-1蛋白表达较正常组明显上调, 说明UC模型小鼠存在NLRP3炎症小体信号通路的活化, 黄连厚朴汤干预后, 各剂量组小鼠结肠组织NLRP3、Caspase-1蛋白表达均有不同程度的下降, 其中中、高剂量组与模型组比较具有统计学差异, 提示抑制NLRP3炎症小体激活可能是黄连厚朴汤改善UC症状的重要作用机制之一.
综上所述, 本研究提示HHD可能通过抑制NLRP3炎性小体活化, 降低结肠组织中NLRP3与Caspase-1的蛋白表达, 减少血清中促炎细胞因子IL-1β、IL-6及TNF-α的分泌水平, 从而改善DSS诱导的UC小鼠症状, 发挥治疗作用.
黄连厚朴汤(Huanglian Houpo Decoction, HHD)为治疗伤寒所致大便自利不止的经典方剂. 现代药理研究证实HHD中的组成药物黄连、厚朴及其有效成分均能改善溃疡性结肠炎(ulcerative colitis, UC)模型动物炎症损伤. 当前研究发现, 核苷酸结合寡聚化结构域样受体蛋白3(nucleotide binding oligomerization domain-like receptor protein 3, NLRP3)炎症小体是治疗UC的潜在靶点, 但HHD治疗UC的作用机制是否与其调控NLRP3炎症小体信号通路相关, 还有待进一步研究.
本实验从NLRP3炎症小体角度出发, 探讨HHD的作用机制, 以期为临床更好地应用该方提供科学依据.
本实验通过观察HHD对葡聚糖硫酸钠(dextran sodium sulfate, DSS)诱导形成的UC模型小鼠中NLRP3炎症小体信号通路的影响, 探究HHD治疗UC的作用机制.
本实验构建了DSS诱导的UC小鼠模型, 并给予不同剂量的HHD治疗, 收集血清和结肠组织, 通过组织学、生化以及Western blot检测评估HHD对UC小鼠疾病活动指数(disease activity index, DAI)、结肠长度、结肠黏膜损伤指数(colon mucosa damage index, CMDI)、结肠组织病理变化、血清中炎症因子水平以及结肠组织NLRP3信号通路相关蛋白表达水平的影响.
HHD能降低UC模型小鼠的DAI和CMDI评分、恢复结肠长度、改善结肠组织病理变化、降低血清中促炎细胞因子白细胞介素1β(interleukin-1β, IL-1β)、白细胞介素6(interleukin-6, IL-6)及肿瘤坏死因子α(tumor necrosis factor, TNF-α)的表达以及下调结肠组织中NLRP3与半胱氨酸天冬氨酸蛋白水解酶1的蛋白表达.
HHD可能通过抑制NLRP3炎性小体活化, 降低血清中促炎细胞因子IL-1β、IL-6及TNF-α的分泌水平, 从而改善DSS诱导的UC小鼠症状, 发挥治疗作用.
本研究为HHD的临床应用提供了实验依据. 但本研究仅从整体实验观察了HHD对UC小鼠NLRP3炎症小体信号通路相关蛋白的影响, 今后应进一步开展细胞实验对其作用机制进行深入探讨.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | 夏 子健, 李 亚桐, 刘 晓露, 梅 志刚, 赵 旭, 方 凯歌, 付 烊. 槐绛方调控NLRP3/Caspase-1通路抗溃疡性结肠炎损伤的机制研究. 中草药. 2021;52:7221-7228. [DOI] |
| 2. | Rabbenou W, Ullman TA. Risk of Colon Cancer and Recommended Surveillance Strategies in Patients with Ulcerative Colitis. Gastroenterol Clin North Am. 2020;49:791-807. [PubMed] [DOI] |
| 3. | Olén O, Erichsen R, Sachs MC, Pedersen L, Halfvarson J, Askling J, Ekbom A, Sørensen HT, Ludvigsson JF. Colorectal cancer in ulcerative colitis: a Scandinavian population-based cohort study. Lancet. 2020;395:123-131. [PubMed] [DOI] |
| 4. | Zhen Y, Zhang H. NLRP3 Inflammasome and Inflammatory Bowel Disease. Front Immunol. 2019;10:276. [PubMed] [DOI] |
| 5. | Ranson N, Veldhuis M, Mitchell B, Fanning S, Cook AL, Kunde D, Eri R. NLRP3-Dependent and -Independent Processing of Interleukin (IL)-1β in Active Ulcerative Colitis. Int J Mol Sci. 2018;20. [PubMed] [DOI] |
| 7. | Akkol EK, Karpuz B, Sobarzo-Sánchez E, Khan H. A phytopharmacological overview of medicinal plants used for prophylactic and treatment of colitis. Food Chem Toxicol. 2020;144:111628. [PubMed] [DOI] |
| 10. | 杨 显娟, 付 尹, 王 佳俊, 王 建, 肖 琳萱, 徐 卓, 王 立映, 龚 道银. 黄连-厚朴配伍抑制PI3K/Akt信号通路改善TNBS诱导的大鼠溃疡性结肠炎研究. 中草药. 2021;52:4587-4597. [DOI] |
| 11. | 杨 显娟, 付 尹, 王 建, 李 红燕, 王 立映, 王 佳俊, 龚 道银. 黄连-厚朴配伍对溃疡性结肠炎模型大鼠的保护作用及对凋亡因子的影响. 中国实验方剂学杂志. 2020;26:83-91. [DOI] |
| 13. | Maruta K, Watanabe C, Hozumi H, Kurihara C, Furuhashi H, Takajo T, Okada Y, Shirakabe K, Higashiyama M, Komoto S, Tomita K, Nagao S, Ishizuka T, Miura S, Hokari R. Nicotine treatment ameliorates DSS-induced colitis by suppressing MAdCAM-1 expression and leukocyte recruitment. J Leukoc Biol. 2018;104:1013-1022. [PubMed] [DOI] |
| 15. | Shi J, Du P, Xie Q, Wang N, Li H, Smith EE, Li C, Liu F, Huo G, Li B. Protective effects of tryptophan-catabolizing Lactobacillus plantarum KLDS 1.0386 against dextran sodium sulfate-induced colitis in mice. Food Funct. 2020;11:10736-10747. [PubMed] [DOI] |
| 18. | 郑 安锐, 顾 园, 王 品发, 滕 小军, 胡 晓岚, 胡 起茂, 廖 艳林, 朱 尤庆, 薛 莎, 齐 云. 溃疡性结肠炎的中医证候与内镜分型及黏膜组织分期的相关性研究. 时珍国医国药. 2022;33:2209-2210. [DOI] |
| 19. | 陆 璐, 刘 宇婧, 李 瑗, 徐 汉辰, 季 光. 基于NLRP3相关炎症反应和肠道黏膜屏障功能探究汉黄芩素治疗溃疡性结肠炎小鼠的作用机制. 中华中医药杂志. 2022;37; 5992-5999. |
| 20. | 张 海明, 梁 凤霞, 杨 胜兰, 张 君丽, 袁 昌劲, 陈 瑞. 基于NLRP3炎症小体探讨中医药防治溃疡性结肠炎的机制. 中国中西医结合消化杂志. 2021;29; 524-528. [DOI] |
| 21. | Ma X, Di Q, Li X, Zhao X, Zhang R, Xiao Y, Li X, Wu H, Tang H, Quan J, Wu Z, Xiao W, Chen W. Munronoid I Ameliorates DSS-Induced Mouse Colitis by Inhibiting NLRP3 Inflammasome Activation and Pyroptosis Via Modulation of NLRP3. Front Immunol. 2022;13:853194. [PubMed] [DOI] |
| 22. | 刘 雨, 施 丽婕, 杨 洁, 耿 洁, 柴 士伟. 化瘀通阳方对溃疡性结肠炎大鼠血清IL-1β、IFN-γ表达的影响. 现代中西医结合杂志. 2021;30:2063-2067, 2122. [DOI] |
| 23. | 刘 慧泽, 吴 本升, 王 包晟, 段 正兰, 冯 泽宇, 施 国平, 陶 羽, 周 青, 蒋 峰, 陈 玉根. 黄葵敛疡汤通过抑制炎症小体NLRP3改善葡聚糖硫酸钠诱导的小鼠溃疡性结肠炎. 中华中医药学刊. 2022;40:146-151+279-283. [DOI] |
| 27. | 曾 微微, 麦 联任, 张 玲. 葛根芩连汤联合固肠止泻丸治疗溃疡性结肠炎的疗效及对血清IL-1β、IL-6、TNF-α水平影响. 中华中医药学刊. 2021;39:212-215. [DOI] |
| 28. | 韩 莹, 张 岩, 杨 德芳, 张 春蕾, 王 兴淼, 赵 晶, 季 顺欣. 真人养脏汤治疗溃疡性结肠炎的临床疗效及其对疾病活动指数评分和血清炎症因子的影响. 临床和实验医学杂志. 2019;18:936-939. [DOI] |
| 29. | 孙 娟, 蒋 晓娟, 王 亚东, 马 克龙, 李 姿慧, 王 天城, 汪 天明, 邵 菁, 汪 长中. 基于高通量转录组测序探讨参苓白术散缓解小鼠溃疡性结肠炎的作用机制. 中国中药杂志. 2022;47:6155-6163. [DOI] |