修回日期: 2023-09-14
接受日期: 2023-11-27
在线出版日期: 2023-12-08
结肠镜下息肉高频电切除术(endoscopic mucosal resection, EMR)是治疗结直肠息肉的常见方法. 手术后的禁食时间长短一直是临床关注的焦点, 然而目前对于禁食时间与出血、感染、穿孔发生之间的相关性研究相对不足.
探讨EMR术后禁食时间长短与出血、感染、穿孔发生的关系, 以提供术后患者禁食策略的指导.
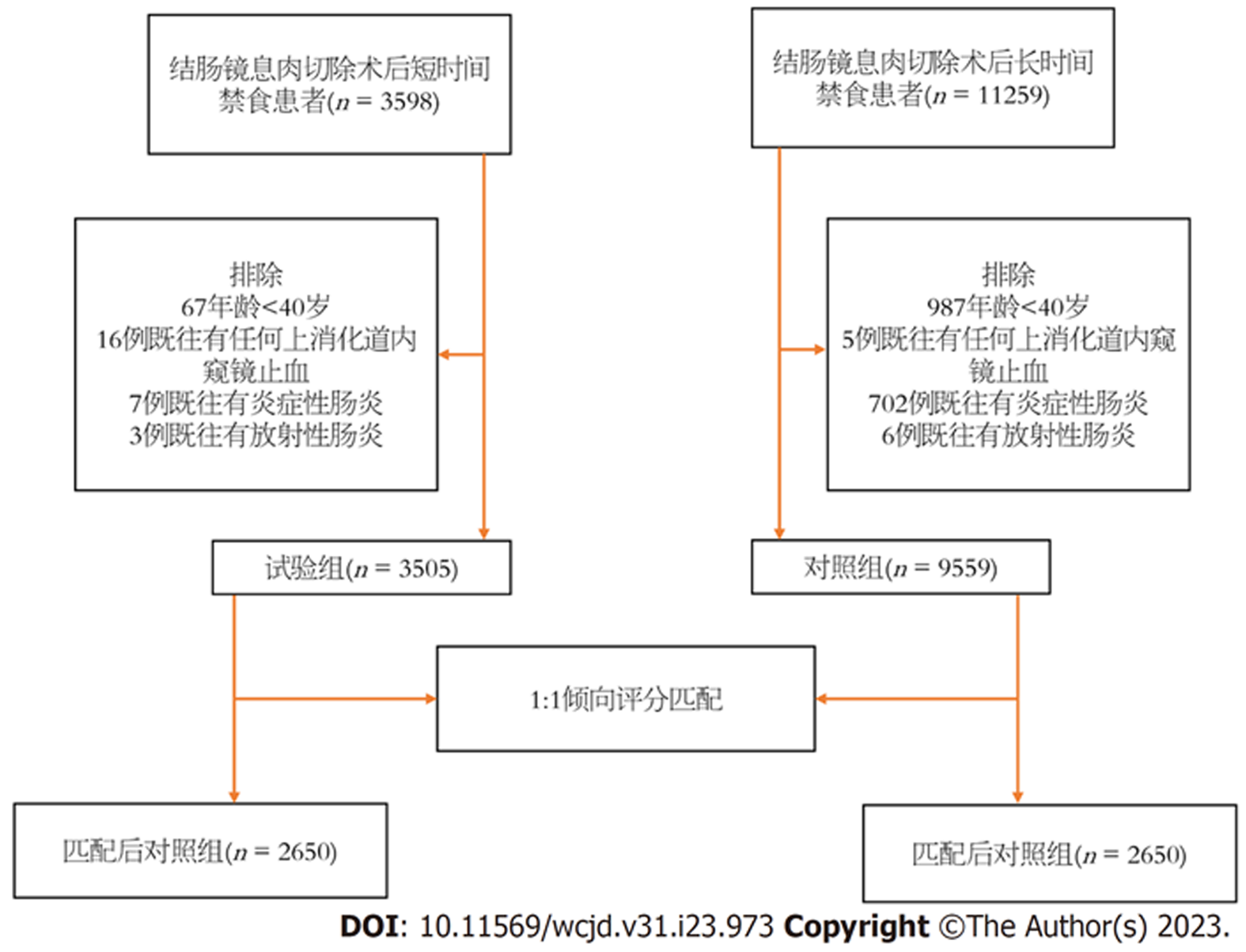
在2000-2023路桥区第二人民医院收治的14857例结直肠息肉患者队列中, 采用倾向评分匹配的病例对照研究设计, 评估40岁及以上成年人息肉切除术后出血和穿孔的相关风险; 3505例术后短时间禁食和9669例术后长时间禁食患者符合研究标准. 每组共匹配2560例患者进行进一步分析. 试验组术后禁食时间2 h, 对照组术后禁食时间24 h, 根据切口的大小、手术的效果逐渐将流质食物换成半流质食物、普通食物. 术后均随访1 mo, 记录两组患者的术后出血、感染和穿孔发生率.
在短时间禁食组中出血、感染或穿孔的出现率分别为0.64%, 0.07%和0.07%. 在长时间禁食组中出血、感染或穿孔的出现率分别为0.40%, 0.04%和0.04%. 在出血、感染和穿孔发生率方面, 两组之间没有显著差异.
术后禁食时间对于结肠镜下息肉高频电切除手术后的出血、感染和穿孔发生率没有显著影响. 对于选择禁食时间, 可以根据患者的具体情况和实际需要来制定策略. 然而, 需要注意的是, 这只是一项回顾性分析研究, 还需要更多的临床研究来进一步验证这一观察结果, 并探讨其他可能的影响因素.
核心提要: 结肠镜下息肉高频电切除术术后禁食时间短与长对出血、感染、穿孔发生率无显著影响. 研究通过倾向评分匹配病例对照研究设计, 发现术后禁食时间对并发症发生率无显著关联, 提示禁食策略可根据患者具体情况制定. 然而, 本研究还需更多临床研究验证观察结果, 探讨其他可能影响因素.
引文著录: 徐军斌. 结肠镜下息肉高频电切除术后禁食时间长短与出血、感染、穿孔发生的相关性研究. 世界华人消化杂志 2023; 31(23): 973-980
Revised: September 14, 2023
Accepted: November 27, 2023
Published online: December 8, 2023
Endoscopic mucosal resection (EMR) is a common method for treating colorectal polyps. The duration of fasting after the operation has been the focus of clinical attention. However, there is currently a lack of research on the correlation between fasting duration and the occurrence of bleeding, infection, and perforation.
To explore the relationship between fasting time and bleeding, infection, and perforation after colonoscopic electro-resection of polyps to provide guidance on fasting strategies for postoperative patients.
In a cohort of 14857 colorectal polyp patients admitted to the Second People's Hospital of Luqiao District from 2000 to 2023, a case-control study design with matching propensity scores was used to evaluate the risk of bleeding and perforation after polypectomy in adults aged 40 years and older; 3505 patients with short-term postoperative fasting and 9669 patients with prolonged postoperative fasting met the study criteria. A total of 2560 patients in each group were matched for further analysis. The postoperative fasting time of the experimental group was 2 h, and the postoperative fasting time of the control group was 24 h. The liquid food was gradually replaced with semi-liquid food and ordinary food according to the size of the incision and the effect of the operation. The postoperative follow-up duration was 1 mo, and the incidence of postoperative bleeding, infection, and perforation in both groups was recorded.
In the short fasting group, the rates of bleeding, infection, and perforation were 0.64%, 0.07%, and 0.07%, respectively. In the long fasting group, the rates of bleeding, infection, and perforation were 0.40%, 0.04%, and 0.04%, respectively. There was no significant difference between the two groups in terms of the rates of bleeding, infection, and perforation.
Based on these results, it can be preliminarily concluded that the duration of postoperative fasting may not have a significant effect on the incidence of bleeding, infection, and perforation after colonoscopic high-frequency electroresection of polyps. For choosing fasting time, strategies can be developed according to the specific situation and actual needs of the patient. However, it is important to note that this is only a retrospective study and more clinical studies are needed to further validate our findings and explore other possible influencing factors.
- Citation: Xu JB. Correlation between fasting time and bleeding, infection, and perforation after high-frequency electroresection of polyps under colonoscopy. Shijie Huaren Xiaohua Zazhi 2023; 31(23): 973-980
- URL: https://www.wjgnet.com/1009-3079/full/v31/i23/973.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i23.973
结肠息肉是一种在结肠内形成的良性肿瘤, 通常是由于结肠壁上的细胞过度生长和分裂而引起的, 包括腺瘤性息肉、管状腺瘤、绒毛状腺瘤等. 它们通常是无症状的, 只有在发展到较大或数目增多时才可能引起问题. 结肠息肉的主要风险是其中的一些可能会发展成为恶性肿瘤, 即结直肠癌. 因此, 及早发现和切除结肠息肉对预防结直肠癌的发生至关重要. 在消化内科领域, 结肠镜下息肉高频电切除术(endoscopic mucosal resection, EMR)是常见的治疗结肠息肉的方法之一[1,2]. 该手术通过利用高频电切技术, 能够有效地切除结肠内的息肉组织[3,4]. 术后禁食时间是手术后患者进食恢复的关键阶段, 对于术后患者的康复和并发症发生具有重要的影响[5].
在一般情况下, 结肠镜检查后并发症的比例差异很大. 结肠出血和穿孔是最严重的不良事件, 结肠镜检查后"出血"率为1.0%至6.1%[6], 结肠镜检查后"穿孔"率为0.03%至0.19%[7]. 了解影响术后出血、感染、穿孔发生风险的禁食时间长短将使临床医生能够为被视为高危患者制定更合适的术后监测计划[8]. 然而, 关于术后禁食时间与出血、感染、穿孔发生之间的相关性, 目前尚缺乏清晰的共识.
早期的研究表明, 延长禁食时间可以减少出血、感染和穿孔的风险, 因为较长的禁食时间可以使术后伤口更好地修复和愈合. 然而, 近年来一些研究却提出了相反的观点, 认为过长的禁食时间可能导致饥饿和营养不良, 增加患者出血、感染和穿孔的风险[9]. 因此, 本研究旨在探索EMR后禁食时间与出血、感染、穿孔发生之间的相关性. 通过系统地收集和分析患者的临床数据, 我们将评估不同禁食时间对并发症发生的影响. 研究结果有望为临床医生提供更加准确的饮食指导, 优化患者的康复和预防并发症的发生. 尽管该研究具有一定的局限性, 如样本容量有限、研究设计的限制等, 但我们相信通过深入探讨禁食时间与并发症之间的关系, 可以为结肠镜下手术后的护理提供更科学的依据, 进一步提高手术治疗的安全性和效果.
路桥区第二人民医院消化内科在2000-02/2023-04进行的结肠镜检查及治疗的患者13064例, 为了确定息肉切除术后长禁食时间患者与短禁食时间患者出血、感染、穿孔的发生率, 我们使用国际疾病分类第九版临床修改(ICD-9-CM)程序代码(4542、4543、4836)或NHI计费代码(49014C、49027C、74207C、72050B)对住院和门诊患者进行结肠镜息肉切除术干预. 在研究期间的第一次息肉切除术日期被定义为索引日期. 在研究期间(2000-2023), 年龄小于40岁、诊断为炎症性肠病(ICD-9 CM代码: 555, 556)或放射性肠炎(ICD-9 CM代码: 558.1)的患者被排除在外. 对于本研究的主要兴趣, 进一步的排除标准是在索引日期前30 d近期发生胃肠道出血事件(ICD-9 CM代码: 569.3, 578.1, 578.9), 接受下消化道内窥镜检查(NHI计费代码: 28017C, 49014C, 49023C, 49026C, 49027C, 72050B, 74207C)或任何上消化道内窥镜止血(NHI计费代码: 47043B, 47067B, 47078B)的患者.
息肉切除术后长禁食时间患者与短禁食时间患者按倾向评分(PS)1:1的比例进行匹配, 以尽量减少潜在的选择偏倚. 使用基于基线协变量的多变量Logistic回归计算个体患者的PS: 指数息肉切除术时的年龄、性别、高血压、高脂血症、Charlson合并症指数评分, 以及阿司匹林、类固醇、氯吡格雷、噻氯匹定和非甾体抗炎药(NSAIDs)的使用. 图1显示了研究设计的流程图. 结肠镜下病变部位为乙状结肠、升结肠、降结肠、横结肠、直肠、结肠, 在内镜下行息肉高频电切除术的患者纳入本研究, 仅行结肠镜检查未实施息肉高频电切术的患者予以排除. 其中符合标准的5300例大肠息肉行高频电切术的患者纳入本研究进行回顾性分析. 患者主诉症状包括便秘、腹痛、腹泻、便血或黏液. 内镜检查发现: 息肉直径0.2 cm-4.0 cm, 每例患者息肉个数从一枚至数十枚不等, 息肉形态有无蒂、亚蒂、长蒂及侧向发育型. 最大病变直径在1.0 cm-4.0 cm之间.
所有实验均按照《赫尔辛基宣言》进行, 涉及人类参与者的研究中进行的所有程序均按照伦理委员会的伦理标准进行. 由于本研究是回顾性研究, 使用并分析了回顾性数据, 因此放弃IRB书面知情同意.
1.2.1 术前准备工作: 这包括对所有患者进行血凝常规和心电图检查, 以评估患者的整体健康状况和手术风险. 此外, 患者需要提前停用抗凝类药物(如阿司匹林、波立维、华法林等), 停药时间至少为1 wk, 以避免手术过程中出血的风险. 在术前24 h, 患者需要采取流质饮食, 以准备清空结肠的需要. 术前4-6 h, 患者需要口服一定量的清肠剂, 通常是137.15 g爽剂溶于2 L温水中, 以帮助清洁结肠内的残留物. 而在术前3-4 h, 患者通常需要口服西甲硅油15 mL, 以润滑结肠, 有助于顺利进行结肠镜检查. 这些术前准备步骤旨在确保结肠镜检查手术可以在清晰的视野下进行, 并降低患者的手术风险.
1.2.2 手术过程: 在结肠镜检查手术过程中, 医生会根据息肉的大小、电切过程以及个人经验和技术水平来预防出血和穿孔, 并进行相应的止血处理, 如使用生理盐水喷洒、副肾素注射、高频电凝、氩气烧灼以及钛夹置放等方法, 以确保创面的止血和预防出血穿孔的处理. 这些措施旨在最大程度地降低手术风险, 保障患者的安全和手术的成功进行.
1.2.3 部分息肉结肠镜下高频电切除术前及术后处理情况: 在部分长蒂息肉的处理中, 为预防出血, 可以在高频电切除术前进行尼龙绳结扎, 并直接进行电切, 省去先进行电凝的步骤. 对于亚蒂息肉, 如果尼龙绳结扎困难, 内镜医师可选择使用圈套器进行高频电凝切除, 并在切除后进行预防出血处理. 对于广基扁平直径超过0.6 cm的息肉, 在进行高频电凝电切术前, 可以先进行息肉黏膜下注射术, 如有出血, 可以常规置放钛夹. 如果由于多种因素导致钛夹止血效果不佳且无法放置更多钛夹, 可以考虑联合使用尼龙绳结扎装置. 这些处理方法的选择可能受到息肉类型、位置、操作医师和内镜助手等因素的影响.
1.2.4 资料分析: 息肉切除术后出血被定义为住院或急诊科就诊时需要内镜止血手术或重复下消化道镜检查联合输血或血管造影干预进行处理的事件. 息肉切除术后穿孔被定义为需要住院或手术的症状和X线异常(即腹腔内自由空气)的存在. 息肉切除术后感染被定义为在结肠镜检查过程中或之后出现的与感染相关的并发症. 根据EMR术后禁食时间长短将患者分为试验组和对照组, 每组2650例. 试验组术后禁食时间2 h, 对照组术后禁食时间24 h, 根据切口的大小、手术的效果逐渐将流质食物换成半流质食物、普通食物. 息肉切除术后30 d内随访所有患者, 直至首次出现肠出血、感染或穿孔. 对所收集的结肠镜下息肉高频电切除手术资料进行整理、汇总, 结合禁食时间与出血、感染、穿孔发生的结果, 做相关分析.
统计学处理 为了对连续数据进行描述性统计, 我们通常使用平均值±标准差(mean±SD)的方式进行表示. 而对于分类数据, 则可以使用实际频率和百分比进行表示. 为了比较不同组之间的差异, 我们可以采用学生t检验来比较连续变量, 使用名义变量的列联表χ2分析. Deyo修改的CCI包括13种疾病, 根据它们与死亡率的关联进行加权. 得分越高, 预测结果越有可能导致死亡率或更高的资源使用.
在研究期间, 3505例短时间禁食患者和9559例长时间禁食患者符合研究标准. 在指数息肉切除术时, 短时间禁食患者比长时间禁食患者年龄更大(65.79岁±10.34岁 vs 61.21岁±11.18岁), 且合并症更多(表1). 共有2650名短时间禁食患者和2650名长时间禁食患者被匹配进行进一步分析. 一般来说, 在匹配的PS配对队列中, 短时间禁食组和长时间禁食组的基线特征相似. 表1列出了短时间禁食组和长时间禁食组匹配前后的人口统计信息.
| 匹配前 | 匹配后 | |||||
| 短时间禁食组(n = 3505), n(%) | 长时间禁食组(n = 9559), n(%) | SMD | 短时间禁食组(n = 2650), n(%) | 长时间禁食组(n = 2650), n(%) | SMD | |
| 年龄, 年(平均值±SD) | 65.79±10.34 | 61.21±11.18 | 0.42 | 65.12±10.46 | 65.95±11.00 | 0.08 |
| 年龄段 | ||||||
| 40-49 | 213(6.08) | 1616(16.91) | 185(6.98) | 209(7.89) | ||
| 50-59 | 878(25.05) | 3016(31.56) | 725(27.35) | 622(23.47) | ||
| 60-69 | 1159(33.07) | 2727(28.53) | 848(32.00) | 826(31.17) | ||
| ≥70 | 1253(35.75) | 2196(22.97) | 892(33.66) | 992(37.43) | ||
| 性别 | ||||||
| 男性 | 1896(54.10) | 6056(63.63) | 0.19 | 1475(55.64) | 1465(55.28) | 0.01 |
| 女性 | 1609(45.90) | 3502(36.64) | 0.19 | 1176(44.36) | 1185(44.72) | 0.01 |
| 实践背景 | ||||||
| 住院 | 1437(41.00) | 1201(12.56) | 854(32.22) | 503(18.98) | ||
| 门诊 | 2007(57.26) | 8334(87.18) | 1706(64.38) | 2156(81.36) | ||
| 基线并发症 | ||||||
| 急性心肌梗死 | 108(3.08) | 66(0.69) | 0.2 | 50(1.89) | 49(1.85) | 0 |
| 充血性心力衰竭 | 504(14.38) | 247(2.58) | 0.47 | 227(8.58) | 214(8.09) | 0.02 |
| 脑血管 | 516(14.72) | 655(6.58) | 0.26 | 319(12.05) | 336(12.69) | 0.02 |
| 痴呆 | 83(2.36) | 108(1.13) | 0.12 | 62(2.34) | 64(2.43) | 0.01 |
| 肺病 | 442(12.61) | 1076(11.25) | 0.03 | 324(12.22) | 341(12.88) | 0.02 |
| 结缔组织紊乱 | 61(1.74) | 79(0.82) | 0.08 | 40(1.53) | 41(1.55) | 0 |
| 消化性溃疡 | 1314(37.49) | 2164(22.63) | 0.33 | 887(33.46) | 908(34.25) | 0.02 |
| 肝脏疾病 | 486(13.87) | 931(9.74) | 0.11 | 334(12.62) | 346(34.25) | 0.01 |
| 糖尿病 | 1365(38.94) | 1371(14.34) | 0.53 | 688(25.95) | 676(25.52) | 0.01 |
| 截瘫 | 19(0.54) | 34(0.35) | 0.05 | 15(0.57) | 16(0.62) | 0.01 |
| 癌症 | 578(16. 49) | 704(7.37) | 0.28 | 392(14.79) | 403(15.22) | 0.01 |
| 高血压 | 2617(74.66) | 3521(36.83) | 0.67 | 1619(61.07) | 1702(61.22) | 0.07 |
| 高脂血 | 743(21.20) | 1865(19.51) | 0.06 | 551(20.78) | 577(21.77) | 0.02 |
| CCI的Deyo修饰 | ||||||
| 0 | 15(0.43) | 4647(48.61) | 16(0.60) | 718(27.09) | ||
| 1 | 7(0.20) | 2433(25.45) | 7(0.26) | 646(24.38) | ||
| 2 | 608(16.86) | 1182(12.36) | 656(24.75) | 505(19.06) | ||
| ≥3 | 2863(81.68) | 1066(11.15) | 1977(74.45) | 764(28.83) | ||
| 药物的使用 | ||||||
| 阿司匹林 | 1591(45.40) | 1712(17.91) | 0.62 | 983(37.10) | 1037(39.14) | 0.04 |
| 类固醇 | 575(16.40) | 1151(12.04) | 0.13 | 384(15.05) | 417(15.75) | 0.02 |
| 氯吡格雷 | 339(9.68) | 133(1.39) | 0.37 | 126(4.75) | 117(4.41) | 0.02 |
| 非甾体抗炎药 | 1207(34.43) | 4116(43.09) | 0.18 | 958(36.13) | 987(37.23) | 0.02 |
| 噻氯匹定 | 77(2.21) | 84(0.87) | 0.11 | 49(1.85) | 46(1.75) | 0.01 |
在试验组和对照组中, 息肉切除术后短时间禁食组的出血、感染或穿孔的总发生率高于长时间禁食组组(0.7% vs 0.40%). 表2总结了息肉切除术后短时间禁食组和长时间禁食组的出血、感染和穿孔发生率. 结肠镜下息肉高频电切除术后0.64%的短时间禁食组患者(17/2650)和0.40%的长时间禁食组患者(10/2650)最可能发生出血事件. 虽然感染率和穿孔率较低, 但短时间禁食组中0.07%的患者似乎在出院后发生感染或穿孔事件(2/2650), 长时间禁食组中0.04%的患者似乎在出院后发生感染或穿孔事件(2/2650). 出血、感染和穿孔均为非致死性. 短时间禁食组患者的平均住院时间(15.82 d±14.71 d)与长时间禁食组患者(14.59 d±13.76 d, aP<0.05)相似.
| 结果 | 短时间禁食组 | 长时间禁食组 | P值 |
| (n = 2650), n(%) | (n = 2650), n(%) | ||
| 出血 | 17(0.64) | 10(0.40) | 0.0788 |
| 感染 | 2(0.07) | 1(0.04) | 0.6249 |
| 穿孔 | 2(0.07) | 1(0.04) | 0.6249 |
| 出血、感染或穿孔 | 21(0.7) | 12(0.4) | 0.6249 |
| 总住院时间(d) | 15.82±14.71 | 14.59±13.76 | 0.4641 |
结肠镜检查是最常用的检查之一, 确保患者的安全无疑是首要条件[10]. 无论检查的适应症如何, 我们都应该将结肠镜检查后并发症的发生率降至最低. 为确保结肠镜检查的安全性, 医生应采取一系列预防措施和控制措施, 包括详细的术前评估、禁食指导、熟练的技术操作、设备和消毒措施以及对并发症的及时管理. 这些步骤可以帮助降低并发症的发生率, 保障患者的安全[11]. 一些研究表明, 结肠镜检查的频率与并发症风险之间存在关联. 其中一项研究发现[12], 结肠镜检查频率较低的人群与较高的人群相比, 发生并发症的几率更高. 这表明[13], 结肠镜医师的经验和手术量可能对检查的安全性和质量有重要影响.
目前, 对于结直肠手术后的禁食时间与出血、感染、穿孔发生的相关性尚未达成共识. 不同地区和医疗机构可能存在不同的指南和实践[14], 有研究建议, 术后禁食时间应根据患者的特定情况来确定, 对于一些低危患者, 可以在手术后立即开始饮食[15,16]. 相关研究通常通过回顾性或前瞻性分析患者的临床资料, 包括手术后禁食时间和出血、感染、穿孔等并发症的发生情况. 通过统计学方法和数据分析, 可以评估禁食时间与这些并发症之间的关联性. 然而, 由于临床研究存在多样性和潜在的偏倚, 目前尚无一致的结论[17,18]. 因此, 仍需要大规模、多中心的随机对照试验和研究, 以确立禁食时间与结直肠手术后并发症的最佳关联性和指导原则. 同时, 个体化的治疗策略和医生的临床经验也应该被考虑进来.
本研究旨在探索EMR后禁食时间长短与出血、感染、穿孔发生之间的相关性. 我们纳入了2000-02/2023-04结肠镜检查患者结肠镜检查后并发症的基于人群的研究. 试验组术后禁食时间2 h, 对照组术后禁食时间24 h, 根据切口的大小、手术的效果逐渐将流质食物换成半流质食物、普通食物. 术后均随访1 mo, 记录两组患者的术后出血、感染和穿孔发生率[19]. 分析结果显示, 禁食时间与术后出血、感染、穿孔发生之间不存在显著性差异. 实际上, 数据表明短时间禁食的情况下出血的风险似乎比长时间禁食更高. 这一结果需要进一步的研究和解释. 可能的解释之一是, 在术前短时间禁食的情况下, 患者可能更早地开始进食, 导致食物刺激肠道黏膜和切口, 增加了术后出血的风险. 然而, 这仅是推测性解释, 还需进行更深入的研究来确定具体原因. 其次, 对于禁食时间与感染的关系, 我们的研究结果显示禁食时间对感染的发生没有明显的影响. 研究认为较长的禁食时间可以降低感染风险, 因为它有助于伤口修复和免疫系统恢复, 从而减少感染的潜在机会. 感染的发生可能与其他因素, 如手术操作技术、个体免疫状况等有关. 因此, 进一步的研究仍然很有必要来深入了解禁食时间与感染之间的关系及其潜在的生理机制. 最后, 针对禁食时间与穿孔发生的相关性, 检查中短时间禁食组有2例穿孔并发症. 然而, 只有一例需要手术治疗: 小肠恶性淋巴瘤化疗后内镜检查后穿孔. 手术显示小肠淋巴瘤浸润区多处穿孔, 部分穿孔位于内窥镜未到达的区域. 这些发现暗示穿孔不是由内窥镜检查引起的, 而是由化疗引起的, 化疗有时会导致肿瘤坏死. 小肠肿瘤化疗后自发性穿孔的风险是众所周知的, 本例内镜的适应症应提前更彻底的考虑. 另一个并发症发生在双球囊内窥镜诊断为小肠克罗恩病的患者. 患者内镜检查后腹痛发热, 需禁食并给予抗生素治疗, 几天后症状消退, 无需开腹手术. 因此, 当在插入过程中观察到小肠内的脆弱病变, 如活动性溃疡时, 应避免进一步穿过病变插入内窥镜. 没有其他并发症的病例报道, 支持这种内镜检查方法的安全性. 我们的数据未显示出明确的关联. 禁食时间对穿孔风险的影响可能受到其他因素的干扰, 例如手术操作技术的熟练程度、息肉大小和位置等.
除了禁食时间以外, 饮食内容也可能对穿孔风险产生影响. 例如, 高脂肪或辛辣食物可能增加穿孔的风险. 穿孔的风险可能与个体的年龄和健康状况相关. 老年人和已有胃肠道疾病的人可能更容易出现穿孔. 某些药物如非甾体抗炎药(NSAIDs)和类固醇, 某些疾病如胃溃疡或胃食管反流病, 可能增加穿孔的风险[20]. 术后的饮食和休息对于结肠息肉电切术后的患者来说非常重要, 特别是要控制饮食, 避免剧烈活动, 尤其对于年轻患者更应注意[21]. 此外, 患者的营养状况也会对术后综合征产生影响, 因此在手术前需对患者的营养状态进行评估和调整. 不同的内镜下止血方法各有优缺点, 内镜医师应根据具体情况选择最合适的方法来预防术后出血并确保手术安全[22].
息肉切除的体积和技术难度增加确实会增加并发症的发生率[23]. 尤其是对于老年患者, 年龄和合并症会进一步增加手术风险. 然而, 通过荟萃分析发现, 尽管手术变得更加频繁和具有挑战性, 结肠镜检查后穿孔和死亡率趋于稳定, 甚至出血率有所下降[24]. 这可能是由于结肠镜检查设备的改进, 例如采用高清结肠镜, 以及技术方面的改进, 例如引入二氧化碳而不是空气注入. 此外, 更好的培训包括知识和技术技能也起到了积极的作用. 目前, 粘膜下生理盐水注射和夹持多用于预防或治疗出血或穿孔. 然而, 即使在经验丰富的结肠镜医师中, 内镜切除技术的培训和熟练程度也存在差异[25]. 为了优化常规手术中的息肉切除术的有效性和安全性, 欧洲胃肠内镜学会(ESGE)推荐了临床指南[26]. 同时, 内镜切除技术的系统培训也越来越多地实施, 包括动手培训和视频培训. 这些努力有助于传播实用技能, 提高结肠镜检查在常规临床实践中的安全性. 在全球范围内, 大多数结肠镜检查由胃肠病学家和外科医生进行. 客观测量的关键绩效指标显示, 相比于外科医生, 胃肠病学培训生和专科医生的绩效更高[27]. 因此, 在一些国家, 结肠镜检查可能仅限于委员会认证的胃肠病学家. 除了常见的并发症, 如果结肠镜检查由非胃肠病学家进行, 更容易发现间隔期癌. 而内窥镜医师的培训、手术量和经验差异可以部分解释这种结果的差异[28,29].
总体而言, EMR后禁食时间与出血、感染、穿孔发生之间不存在关联. 在结肠镜检查后, 短时间禁食后的出血、穿孔和感染的发生率有所上升. 这一结果很可能是由于短时间禁食后, 患者可能更早地开始进食, 消化系统可能没有足够的时间来完全恢复和稳定, 而食物的摄入可能刺激肠道黏膜和切口, 增加了术后出血的风险. 然而, 由于本研究的限制性特点, 如数据来源的局限性和回顾性设计的局限性等, 我们需要进一步的前瞻性研究来验证这些结果, 并更深入地探究禁食时间对术后并发症的影响机制. 这将有助于为临床医生提供更准确的饮食指导, 以最大程度地减少术后并发症的风险, 同时优化患者的康复过程.
结肠镜下息肉高频电切除术(endoscopic mucosal resec-tion, EMR)是治疗结直肠息肉的常见方法, 然而关于手术后禁食时间与并发症之间的关联性研究尚不充分.
本研究旨在探索EMR术后禁食时间长短与出血、感染、穿孔发生的关系, 以解决临床对于手术后禁食时间最佳安排的疑问, 并为患者术后恢复提供更科学的依据.
本研究的主要目标是明确EMR术后禁食时间与出血、感染、穿孔发生的相关性, 为临床提供指导意见, 促进患者术后恢复和减少并发症发生.
研究采用回顾性分析EMR患者的临床资料, 对手术后禁食时间、出血、感染、穿孔等因素进行统计分析, 并探讨它们之间的关联性和可能的影响因素.
研究结果表明不同禁食时间与出血、感染、穿孔发生之间存在一定的相关性, 为临床实践提供了一定的参考价值, 对于手术后禁食管理具有一定的临床指导意义.
本研究通过实际数据分析发现了不同禁食时间与EMR并发症之间的潜在关联, 为临床实践提供了一定的理论支持和指导意见.
未来的研究可以进一步扩大样本量, 采用多中心、前瞻性的研究设计, 以验证禁食时间对EMR术后并发症发生的影响, 并探索更精细的管理策略.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): D, D
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | 翟 春颖, 柯 小丽, 徐 耀华, 程 晓荷, 邱 宇, 王 雪萍. 结肠镜下高频电凝电切术与冷圈套切除术治疗结肠微小息肉的临床效果观察. 结直肠肛门外科. 2021;27:360-363. [DOI] |
| 7. | Reumkens A, Rondagh EJ, Bakker CM, Winkens B, Masclee AA, Sanduleanu S. Post-Colonoscopy Complications: A Systematic Review, Time Trends, and Meta-Analysis of Population-Based Studies. Am J Gastroenterol. 2016;111:1092-1101. [PubMed] [DOI] |
| 8. | Prabhakaran S, Kong JC, Chin M, Carne P, Farmer C, Skinner S, Warrier SK, Bell S. Predictive factors for distant recurrence of colorectal cancer in patients after curative resection for stage I-III colorectal cancer in Australia. Langenbecks Arch Surg. 2021;406:2789-2796. [PubMed] [DOI] |
| 10. | Basch CH, Basch CE, Zybert P, Wolf RL. Failure of Colonoscopy Knowledge to Predict Colonoscopy Uptake. J Community Health. 2016;41:1094-1099. [PubMed] [DOI] |
| 11. | Yang C, Sriranjan V, Abou-Setta AM, Poluha W, Walker JR, Singh H. Anxiety Associated with Colonoscopy and Flexible Sigmoidoscopy: A Systematic Review. Am J Gastroenterol. 2018;113:1810-1818. [PubMed] [DOI] |
| 13. | Zessner-Spitzenberg J, Jiricka L, Waldmann E, Rockenbauer LM, Cook J, Hinterberger A, Majcher B, Szymanska A, Asaturi A, Trauner M, Ferlitsch M. Polyp characteristics at screening colonoscopy and post-colonoscopy colorectal cancer mortality: a retrospective cohort study. Gastrointest Endosc. 2023;97:1109-1118.e2. [PubMed] [DOI] |
| 14. | 钟 鸣, 骆 洋. 腹腔镜结直肠手术中并发症的预防与处理. 中华腔镜外科杂志(电子版). 2017;10:343-346. [DOI] |
| 15. | Leung VWY, Baldini G, Liberman S, Charlebois P, Stein B, Feldman LS, Fiore JF, Lee L. Tolerating clear fluids diet on postoperative day 0 predicts early recovery of gastrointestinal function after laparoscopic colectomy. Surg Endosc. 2022;36:9262-9272. [PubMed] [DOI] |
| 16. | van Noort HHJ, Eskes AM, Vermeulen H, Besselink MG, Moeling M, Ubbink DT, Huisman-de Waal G, Witteman BJM. Fasting habits over a 10-year period: An observational study on adherence to preoperative fasting and postoperative restoration of oral intake in 2 Dutch hospitals. Surgery. 2021;170:532-540. [PubMed] [DOI] |
| 17. | Zhang J, Chen G, Li Z, Zhang P, Li X, Gan D, Cao X, Du H, Zhang J, Zhang L, Ye Y. Colonoscopic screening is associated with reduced Colorectal Cancer incidence and mortality: a systematic review and meta-analysis. J Cancer. 2020;11:5953-5970. [PubMed] [DOI] |
| 18. | Pilonis ND, Bugajski M, Wieszczy P, Franczyk R, Didkowska J, Wojciechowska U, Pisera M, Rupinski M, Regula J, Kaminski MF. Long-Term Colorectal Cancer Incidence and Mortality After a Single Negative Screening Colonoscopy. Ann Intern Med. 2020;173:81-91. [PubMed] [DOI] |
| 20. | Jagpal A, Curtis JR. Gastrointestinal Perforations with Biologics in Patients with Rheumatoid Arthritis: Implications for Clinicians. Drug Saf. 2018;41:545-553. [PubMed] [DOI] |
| 21. | Lee JH, Kedia P, Stavropoulos SN, Carr-Locke D. AGA Clinical Practice Update on Endoscopic Management of Perforations in Gastrointestinal Tract: Expert Review. Clin Gastroenterol Hepatol. 2021;19:2252-2261.e2. [PubMed] [DOI] |
| 22. | Park SK, Seo JY, Lee MG, Yang HJ, Jung YS, Choi KY, Kim H, Kim HO, Jung KU, Chun HK, Park DI. Prospective analysis of delayed colorectal post-polypectomy bleeding. Surg Endosc. 2018;32:3282-3289. [PubMed] [DOI] |
| 23. | Garg R, Singh A, Ahuja KR, Mohan BP, Ravi SJK, Shen B, Kirby DF, Regueiro M. Risks, time trends, and mortality of colonoscopy-induced perforation in hospitalized patients. J Gastroenterol Hepatol. 2020;35:1381-1386. [PubMed] [DOI] |
| 24. | Wieszczy P, Kaminski MF, Franczyk R, Loberg M, Kobiela J, Rupinska M, Kocot B, Rupinski M, Holme O, Wojciechowska U, Didkowska J, Ransohoff D, Bretthauer M, Kalager M, Regula J. Colorectal Cancer Incidence and Mortality After Removal of Adenomas During Screening Colonoscopies. Gastroenterology. 2020;158:875-883.e5. [PubMed] [DOI] |
| 26. | Ferlitsch M, Moss A, Hassan C, Bhandari P, Dumonceau JM, Paspatis G, Jover R, Langner C, Bronzwaer M, Nalankilli K, Fockens P, Hazzan R, Gralnek IM, Gschwantler M, Waldmann E, Jeschek P, Penz D, Heresbach D, Moons L, Lemmers A, Paraskeva K, Pohl J, Ponchon T, Regula J, Repici A, Rutter MD, Burgess NG, Bourke MJ. Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy. 2017;49:270-297. [PubMed] [DOI] |
| 27. | Joseph M, Jared V, Fadel N, Sajid J. Comparison of Interval Colon Cancer After Colonoscopies Done by Gastroenterologists and Nongastroenterologist. Am. J. Gastroenterol. 2016;111:S1279-90. [DOI] |
| 28. | Tate DJ, Argenziano ME, Anderson J, Bhandari P, Boškoski I, Bugajski M, Desomer L, Heitman SJ, Kashida H, Kriazhov V, Lee RRT, Lyutakov I, Pimentel-Nunes P, Rivero-Sánchez L, Thomas-Gibson S, Thorlacius H, Bourke MJ, Tham TC, Bisschops R. Curriculum for training in endoscopic mucosal resection in the colon: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement. Endoscopy. 2023;55:645-679. [PubMed] [DOI] |