修回日期: 2023-09-15
接受日期: 2023-09-18
在线出版日期: 2023-09-28
去分化脂肪肉瘤(dedifferentiated liposarcoma, DDLPS)是一种高级别侵袭性疾病, 好发于腹膜后, 其次为大腿和腹股沟处, 而发生在胰腺的DDLPS非常罕见.
本例患者因上腹部隐痛而行CT检查提示胰腺占位性病变, 性质不明.根据患者术前病史、查体、辅助检查, 考虑胰腺头颈部巨大占位性病变, 边界尚清, 存在手术指征, 于我院接受胰十二指肠切除术, 术后病理提示胰腺DDLPS, 术后3 mo患者复查提示肿瘤复发, 予达卡巴嗪联合表柔比星化学治疗后效果不佳, 18 mo后去世.
由于胰腺DDLPS通常对放化疗不明显, 因此, 目前治疗胰腺DDLPS最有效的治疗方法为显微镜下的阴性切除. 但由于发生于胰腺的脂肪肉瘤位置较深, 且临近周围许多器官, 这使得肿瘤很难完全被切除, 许多患者因此会发展为区域性复发性疾病.
核心提要: 胰腺去分化脂肪肉瘤非常罕见, 目前该类疾病最有效的治疗方法仍是显微镜下的阴性切除. 但由于胰腺的特殊位置加上肿瘤对放化疗的不敏感性, 使得该位置的肿瘤术后复发概率大大提升, 提高了该类疾病的治疗难度.
引文著录: 杨家立, 金延玲, 孙元水. 胰腺原发性去分化脂肪肉瘤: 案例报道和文献综述. 世界华人消化杂志 2023; 31(18): 791-796
Revised: September 15, 2023
Accepted: September 18, 2023
Published online: September 28, 2023
Dedifferentiated liposarcoma (DDLPS) is a high-grade invasive tumor that more commonly occurs in the retroperitoneum, followed by the thighs and groin. DDLPS in the pancreas is very rare.
A patient underwent CT examination due to hidden pain in the upper abdomen, which revealed a pancreatic space occupying lesion of unknown nature. Based on the patient's preoperative medical history, physical examination, and auxiliary examination, it was considered that there was a huge space occupying lesion in the head and neck of the pancreas, with clear boundaries and surgical indications. The patient underwent pancreaticoduodenectomy at our hospital, and the postoperative pathology revealed a DDLPS of the pancreas. Three months after the surgery, tumor recurrence occurred. Dacarbazine combined with epirubicin chemotherapy had a poor effect, and the patient passed away 18 mo later.
Due to the fact that DDLPS of the pancreas is usually not significantly responsive to radiotherapy and chemotherapy, the currently most effective treatment method for DDLPS of the pancreas is resection with negative margin under a microscope. However, due to the deep location of liposarcoma in the pancreas and its proximity to many surrounding organs, it is difficult to completely remove the tumor, and many patients may develop regional recurrence.
- Citation: Yang JL, Jin YL, Sun YS. Primary dedifferentiated liposarcoma of the pancreas: A case report and literature review. Shijie Huaren Xiaohua Zazhi 2023; 31(18): 791-796
- URL: https://www.wjgnet.com/1009-3079/full/v31/i18/791.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i18.791
脂肪肉瘤(liposarcoma, LPS)是由间充质细胞引起的一种罕见的异质性疾病, 是软组织肉瘤最常见的亚型之一, 约占所有软组织肉瘤的15%-20%[1,2]. 由于它们起源于成脂细胞和脂肪细胞, 因此可发生在身体的任何部位, 最常见的部位是四肢和腹膜后[3]. 去分化脂肪肉瘤(dedifferentiated liposarcoma, DDLPS)作为脂肪肉瘤常见的亚型之一[4], 其发生在胰腺是非常罕见, 仅占胰腺肿瘤的1%[5]. 目前, 国内外仅有少数研究报道了发生于胰腺的脂肪肉瘤. 本文通过报道于我院进行治疗的一例原发性胰腺去分化脂肪肉瘤的临床资料, 通过我们的报道和既往的文献研究回顾, 帮助了解原发性胰腺去分化脂肪肉瘤的诊治方法.
患者, 女, 60岁, 以"上腹部隐痛20余天"为主诉入院.
患者20 d前无明显诱因出现上腹隐痛, 呈持续性, 伴恶心, 无呕吐、无头晕头痛、无胸闷心悸、无腹泻、无高热寒战等不适, 1 d前于当地医院查CT提示上腹部占位, 考虑胰腺来源肿瘤, 胰腺腺泡细胞Ca?神经内分泌肿瘤?实性假乳头状瘤?今为求进一步治疗来我院就诊.
患者既往体健, 否认其他基础疾病.
无饮酒、吸烟史, 无放射物、毒物接触史, 家中无肿瘤病史.
神志清, 精神可, 口唇无发绀, 颈静脉无怒张, 甲状腺未及肿大, 皮肤巩膜无黄染. 心界不大, 心率84次/分, 心律齐, 未闻及明显病理性杂音. 双肺呼吸音清, 未闻及干湿性啰音. 腹软, 无压痛、反跳痛, 肝脾肋下未及. 双下肢无浮肿. 神经系统初步查体未见明显异常.
血常规: 红细胞: 93 g/L, 白细胞: 7.21×109/L, 血小板: 378×109/L, 轻度贫血. 生化: 白蛋白: 27.7 g/L, 碱性磷酸酶: 168 U/L, 低蛋白血症. 肿瘤标志物(CEA: 1.7 ug/L, CA-199: 5.1 U/mL, AFP: 0.6 ug/L)、免疫球蛋白G4(免疫球蛋白IGG4: 0.23 g/L)、凝血功能、大便常规、尿常规未见明显异常.
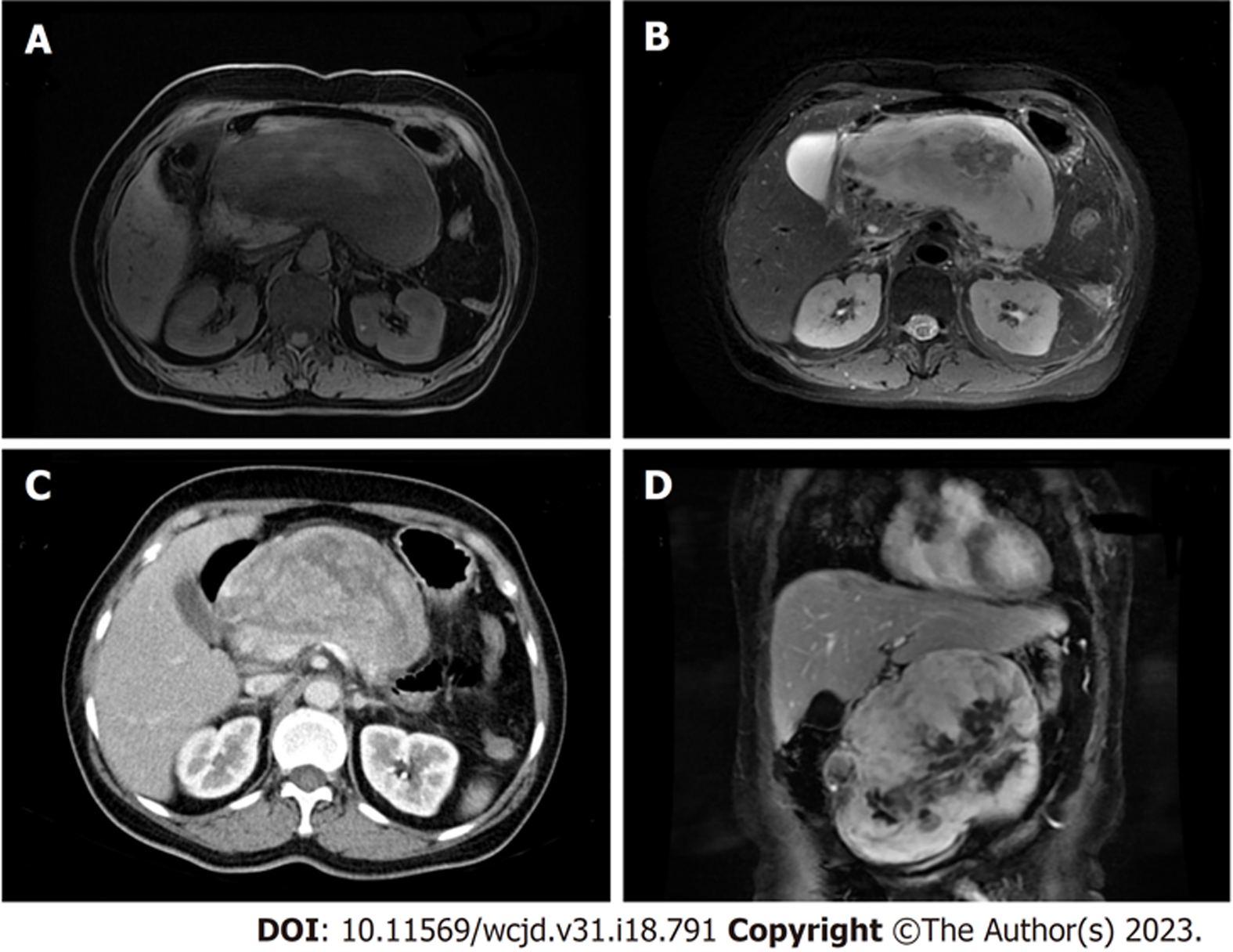
胰腺增强MRI: 胰体部前方肝胃间隙内见一巨大团块影, 大小约160 cm×60 cm×170 mm, 与胰腺分界不清, 可见包膜, 与腹腔其余 器官分界较清, 病灶边缘包绕部分腹腔干分支血管. 病灶呈T1等-稍低信号T2稍低-稍高混杂信号, DWI呈不均匀高信号, 增强扫描动脉期病灶边缘呈不均匀明显强化, 门脉期及静脉期持续渐进性强化, 病灶中心见不规则无强化区. 胰管未见明显扩张, 考虑为胰体部前方低度恶性肿瘤, 实性假乳头状瘤首先考虑, 肉瘤待排. 门静脉CTV: 门静脉主干直径约18 mm, 腔内未见明显充盈缺损, 局部呈受压性改变, 提示门脉高压可能(图1). PET/CT: 腹膜后胰腺前方肝胃间隙可见巨大囊实性软组织团块影, 实性为主, 可见包膜大小约16.2 cm×7.3 cm×14.6 cm, 放射性摄取不均匀增高, SUVmax约16.7, 局部可见放射性分布缺损区; 病灶与胰腺分界不清, 与临近腹腔干分布不清, 首先考虑恶性病变伴局部坏死, 胰腺来源可能, 肉瘤待排.
根据患者术前病史、查体、辅助检查, 考虑胰腺头颈部巨大占位性病变, 边界尚清, 存在手术指征, 于我院接受胰十二指肠切除术.
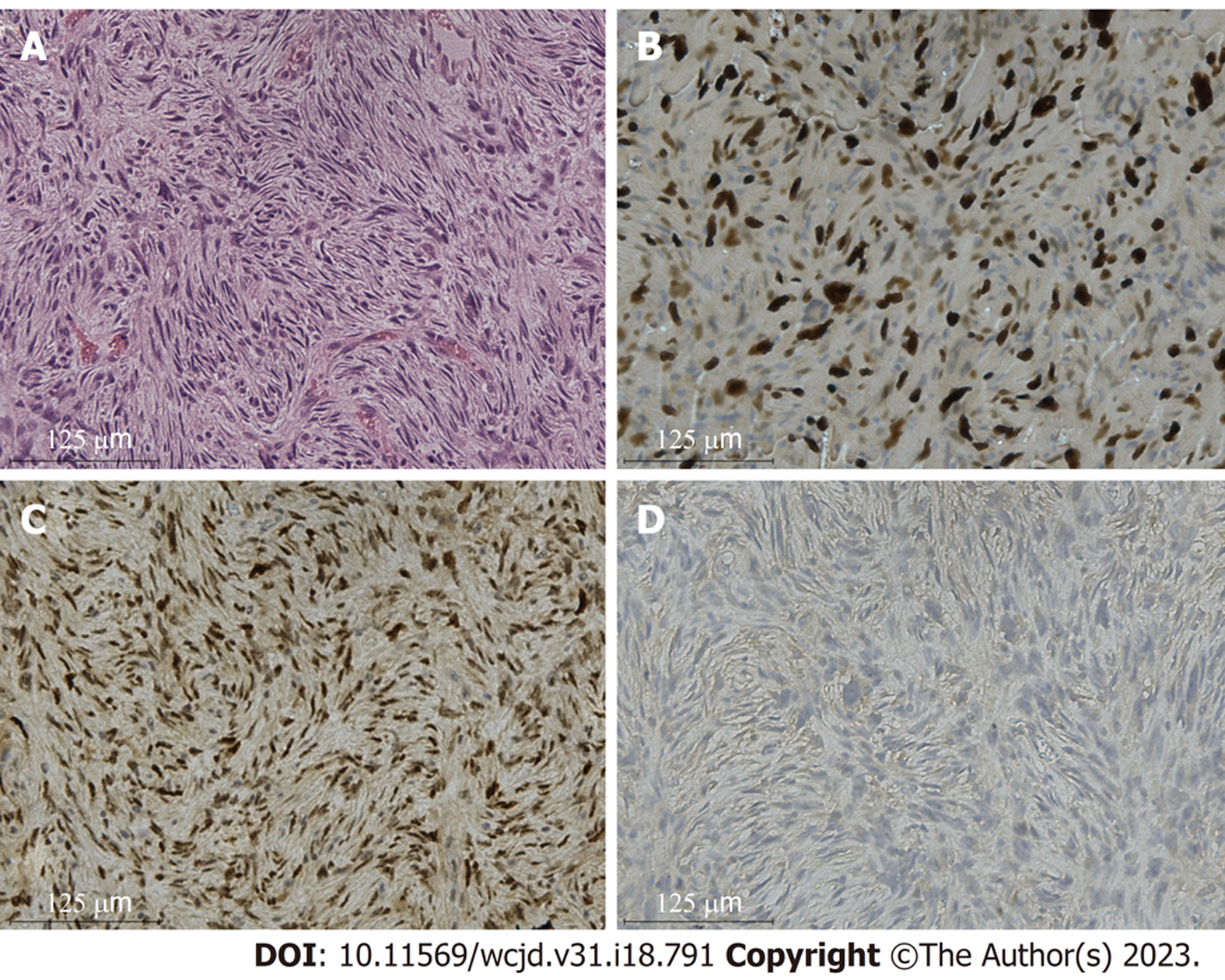
标本解剖: 肿瘤位于胰头部、颈部, 包膜完整, 质中, 大小约10 cm×15 cm×20 cm. 胆管直径约1.2 cm, 可及肝胆管切缘距十二指肠乳头约9 cm. 术中冰冻提示: 胰腺切缘阴性. 肿瘤定性: 梭形细胞肿瘤. 术后病理提示: 高级别肉瘤, 考虑为去分化脂肪肉瘤(去分化成分为多形性未分化肉瘤), 浸润性生长, 侵及胰腺实质, 大小14 cm×14 cm×5.5 cm, 核分裂像数10个/10 HPF , 免疫组化染色结果: Calponin(-)、CK5/6(-)、S-100(-)、SMA(-)、CK(Pan)(-)、CD34( +)、Ki67(+, 80%)、CD68(+)、CD163(+)、CD117(-)、DOG1(-)、Desmin(-)、CD35/CR1 (-)、CD23(-)、MDM2(+)、CD99(+)、CDK4(+). 分子检测结果: MDM2基因扩增(+), 支持去分化脂肪肉瘤(图2).
术后予抗炎、护肝、维持电解质平衡等对症治疗后, 于术后第31天出院, 未见明显胆漏、胰漏等并发症. 术后3 mo, 患者复查腹部CT提示肿瘤复发, 后予达卡巴嗪联合表柔比星6周期化学治疗, 18 mo后, 患者因该疾病去世.
软组织肉瘤是由间充质细胞引起的一组罕见的异质性疾病, 其中脂肪肉瘤是最常见的软组织肉瘤, 约占所有软组织肉瘤的15%-20%[1]. 目前, 世界卫生组织(WHO)主要将其分为4种: 高分化脂肪肉瘤(well-differentiated liposarcoma, WDLPS), DDLPS, 粘液样脂肪肉瘤(myxoid liposarcoma, MLPS)和多形性脂肪肉瘤(pleomorphic liposarcoma, PLPS), 其中, WDLPS和DDLPS共同占LPS的大多数[6]. 相比于WDLPS, DDLPS是一种高级别侵袭性疾病, 局部和转移性复发率高, 疾病特异性死亡率是WDLPS的6倍[7]. DDLPS最常见于中老年人, 表现为大而深的肿块, 最常见的部位为腹膜后, 其次为大腿和腹股沟处, 而发生在胰腺的DDLPS非常罕见[8], 对于发生于胰腺的DDLPS, 其最常见病变位置通常位于胰尾部[9]. 本文介绍了1例罕见的, 发生于胰头部的原发性去分化脂肪肉瘤.
由于胰腺脂肪肉瘤位置的的特殊性, 其早期常常没有明显的症状, 部分患者因肿瘤体积巨大而压迫周围组织出现腹部症状, 如腹胀、腹痛、恶心、呕吐等后被发现. 本文患者因持续性隐痛伴呕吐, 后于当地医院行CT检查后发现存在胰腺占位性病变. 在实验室检查包括酶值、肿瘤标志物均在正常值范围, 部分患者会因肿瘤压迫胰腺而表现出CA-199的轻度升高[5]. 在影像学检查方面, CT和MRI是诊断出胰腺占位性病变最常用的检查方法, 但特异度不高. 相比于其他类型脂肪肉瘤, DDLPS由于其脂肪细胞和非脂肪细胞元素比例的不同, 其在影像学上往往表现出不同的成像结果[10]. Hong等[11]根据DDLPS病灶内脂肪成分的多少, 分为4种类型, Ⅰ类: 主要脂肪中的非脂肪成分, Ⅱ类: 大块非脂肪内的局灶性脂肪成分, Ⅲ类: 明确的脂肪团和明确的非脂肪团, Ⅳ类: 两个主要含有非脂肪成分的物质. Ⅰ, Ⅲ类在影像诊断上, 与DDLPS定义相符, 比较容易诊断, 而Ⅱ, Ⅳ类由于其脂肪含量微乎其微, 在诊断上比较困难, 难以与其他软组织肿瘤相区分[12]. 在CT上, DDLPS通常表现为软组织密度、等密度或者液性密度影, 在MRI上, 其表现为T1WI上低密度或等密度, T2WI上混杂高低或中高信号影[12,13], 由于MRI在检出脂肪成分上较CT明显, 因此, 对于CT未显示脂肪而怀疑DDLPS的患者, 进行MRI检查有利于进一步明确诊断. 超声内镜在检测胰腺组织病变的敏感性非常高(94%-100%), 当放射学上难以确认肿块性质, 必要时可采用超声内镜引导下的穿刺活检(EUS-FNA)明确肿块性质[14]. 在本例中, 由于该患者胰腺肿瘤较大, 因此, 我们在CT基础上, 完善了胰腺增强MRI和门静脉CTV以明确肿瘤与周围血管的关系, 同时, 行PET/CT检查排除患者远处转移的可能.
在组织学上, DDLPS具有多种形态学表现, 常常容易与多形性未分化肉瘤、黏液纤维肉瘤、肌源性肉瘤等肿瘤相混淆[15]. 因此, 往往需要进一步的分子分析来明确诊断. 在分子层面, CDK4, MDM2, P16被认为在诊断DDLPS上最具敏感性和特异性[16]. 而目前该疾病检测的标准方法为通过使用荧光原位杂交(FISH), 使得DDLPS染色体区域12 q 13-15扩增, 而这些扩增会持续影响MDM2(100%)、CDK4(90%)[17]. 在本例中, 该患者的去分化成分为多形性未分化肉瘤, 因此, 为了与其相互鉴别, 我们进行了进一步的分子检测, 检测结果提示: MDM2基因扩增(+), 支持去分化脂肪肉瘤.
显微镜下的阴性切除是目前治疗脂肪肉瘤最唯一有效的措施[18], 但由于发生于胰腺的脂肪肉瘤位置通常较深, 且临近周围许多重要器官, 这使得肿瘤很难完全被切除, 许多患者因此会发展为区域性复发性疾病[19]. 这类手术的风险难度较大, 必须进行严密的术前评估, 必要时进行血管或三维重建判断血管情况, 对于巨大肿瘤, 需要充分显露肿瘤的位置, 为避免残留, 切除范围应包括周围足够的正常组织, 必要时联合临近器官联合切除, 以达到完全切除肿瘤的目的[20]. 然而, 即使采用这种方法, 这些肿瘤的预后也较差, 其5年生存率为36%-58%, 其死亡的主要原因为肿瘤的局部复发[21]. 由于DDLPS通常对放疗和化疗不敏感[1], 术前和术后的辅助治疗似乎对患者的总生存期没有显著的好处[8]. 近些年来, 曲贝替定、艾日布林, 靶向药物CDK4抑制剂, MDM2拮抗剂等靶向免疫抑制剂被发现在脂肪肉瘤中可能存在作用, 但由于其处于研究的早期, 疗效仍然不明确[22].
去分化脂肪肉瘤作为一种高级别侵袭性疾病, 局部转移复发率高[7], 因此, 定期的影像学检查对与术后患者至关重要. 目前, 根据肉瘤的分级, 高危患者建议前3-4年每2-3 mo随访一次, 低危患者每5 mo复查一次, MRI被推荐为复查首选, 与其他影像学相比, 使用MRI检测肿瘤的局部复发以及远处转移较其他敏感性更高, 更易早期发现复发[23].
综上所诉, 胰腺原发性去分化脂肪肉瘤比较罕见, 早期通常没有症状, 部分患者会因肿瘤体积较大产生腹部相关症状. CT, MRI作为其最常用的影像学检查, 可以为术前胰腺脂肪肉瘤的的诊断提供依据. 手术治疗是目前治疗胰腺去分化脂肪肉瘤唯一有效的治疗措施, 由于去分化脂肪肉瘤对放化疗不敏感, 术前、术后的辅助治疗并不会为患者总生存带来显著益处. 去分化脂肪肉瘤易发生局部转移, 定期随访检查至关重要.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Ducimetière F, Lurkin A, Ranchère-Vince D, Decouvelaere AV, Péoc'h M, Istier L, Chalabreysse P, Muller C, Alberti L, Bringuier PP, Scoazec JY, Schott AM, Bergeron C, Cellier D, Blay JY, Ray-Coquard I. Incidence of sarcoma histotypes and molecular subtypes in a prospective epidemiological study with central pathology review and molecular testing. PLoS One. 2011;6:e20294. [PubMed] [DOI] |
| 2. | Bray F, Ren JS, Masuyer E, Ferlay J. Global estimates of cancer prevalence for 27 sites in the adult population in 2008. Int J Cancer. 2013;132:1133-1145. [PubMed] [DOI] |
| 3. | Vos M, Boeve WC, van Ginhoven TM, Sleijfer S, Verhoef C, Grünhagen DJ. Impact of primary tumor location on outcome of liposarcoma patients, a retrospective cohort study. Eur J Surg Oncol. 2019;45:2437-2442. [PubMed] [DOI] |
| 4. | Lee ATJ, Thway K, Huang PH, Jones RL. Clinical and Molecular Spectrum of Liposarcoma. J Clin Oncol. 2018;36:151-159. [PubMed] [DOI] |
| 5. | Machado MC, Fonseca GM, de Meirelles LR, Zacchi FF, Bezerra RO. Primary liposarcoma of the pancreas: A review illustrated by findings from a recent case. Pancreatology. 2016;16:715-718. [PubMed] [DOI] |
| 6. | Creytens D. What's new in adipocytic neoplasia? Virchows Arch. 2020;476:29-39. [PubMed] [DOI] |
| 7. | Henricks WH, Chu YC, Goldblum JR, Weiss SW. Dedifferentiated liposarcoma: a clinicopathological analysis of 155 cases with a proposal for an expanded definition of dedifferentiation. Am J Surg Pathol. 1997;21:271-281. [PubMed] [DOI] |
| 8. | Wang GY, Lucas DR. Dedifferentiated Liposarcoma With Myofibroblastic Differentiation. Arch Pathol Lab Med. 2018;142:1159-1163. [PubMed] [DOI] |
| 10. | Tateishi U, Hasegawa T, Beppu Y, Satake M, Moriyama N. Primary dedifferentiated liposarcoma of the retroperitoneum. Prognostic significance of computed tomography and magnetic resonance imaging features. J Comput Assist Tomogr. 2003;27:799-804. [PubMed] [DOI] |
| 11. | Hong SH, Kim KA, Woo OH, Park CM, Kim CH, Kim MJ, Chung JJ, Han JK, Rha SE. Dedifferentiated liposarcoma of retroperitoneum: spectrum of imaging findings in 15 patients. Clin Imaging. 2010;34:203-210. [PubMed] [DOI] |
| 12. | Zhang JY, Yu XD, Song Y, Zhang HT, Chen Y, Ouyang H, Zhao XM. [Comparison of Imaging and Pathologic Findings of Retroperitoneal Dedifferentiated Liposarcoma]. Zhonghua Zhong Liu Za Zhi. 2019;41:223-228. [PubMed] [DOI] |
| 13. | O'Regan KN, Jagannathan J, Krajewski K, Zukotynski K, Souza F, Wagner AJ, Ramaiya N. Imaging of liposarcoma: classification, patterns of tumor recurrence, and response to treatment. AJR Am J Roentgenol. 2011;197:W37-W43. [PubMed] [DOI] |
| 14. | Fabbri C, Luigiano C, Collina G, Cennamo V, D'Imperio N, Jovine E. EUS-FNA diagnosis of single pancreatic metastasis of liposarcoma. Gastrointest Endosc. 2009;69:974-976. [PubMed] [DOI] |
| 15. | Kammerer-Jacquet SF, Thierry S, Cabillic F, Lannes M, Burtin F, Henno S, Dugay F, Bouzillé G, Rioux-Leclercq N, Belaud-Rotureau MA, Stock N. Differential diagnosis of atypical lipomatous tumor/well-differentiated liposarcoma and dedifferentiated liposarcoma: utility of p16 in combination with MDM2 and CDK4 immunohistochemistry. Hum Pathol. 2017;59:34-40. [PubMed] [DOI] |
| 16. | Thway K, Flora R, Shah C, Olmos D, Fisher C. Diagnostic utility of p16, CDK4, and MDM2 as an immunohistochemical panel in distinguishing well-differentiated and dedifferentiated liposarcomas from other adipocytic tumors. Am J Surg Pathol. 2012;36:462-469. [PubMed] [DOI] |
| 17. | Weaver J, Rao P, Goldblum JR, Joyce MJ, Turner SL, Lazar AJ, López-Terada D, Tubbs RR, Rubin BP. Can MDM2 analytical tests performed on core needle biopsy be relied upon to diagnose well-differentiated liposarcoma? Mod Pathol. 2010;23:1301-1306. [PubMed] [DOI] |
| 18. | Feki J, Lajnef M, Fourati M, Sakka D, Hassena RB, Slimen MH, Daoud J, Khanfir A. The management of retroperitoneal sarcoma: The experience of a single institution and a review of the literature. J Taibah Univ Med Sci. 2023;18:125-131. [PubMed] [DOI] |
| 19. | Masaki N, Onozawa M, Inoue T, Kurobe M, Kawai K, Miyazaki J. Clinical features of multiply recurrent retroperitoneal liposarcoma: A single-center experience. Asian J Surg. 2021;44:380-385. [PubMed] [DOI] |
| 21. | Lewis JJ, Leung D, Woodruff JM, Brennan MF. Retroperitoneal soft-tissue sarcoma: analysis of 500 patients treated and followed at a single institution. Ann Surg. 1998;228:355-365. [PubMed] [DOI] |
| 22. | McGovern Y, Zhou CD, Jones RL. Systemic Therapy in Metastatic or Unresectable Well-Differentiated/Dedifferentiated Liposarcoma. Front Oncol. 2017;7:292. [PubMed] [DOI] |
| 23. | Gronchi A, Miah AB, Dei Tos AP, Abecassis N, Bajpai J, Bauer S, Biagini R, Bielack S, Blay JY, Bolle S, Bonvalot S, Boukovinas I, Bovee JVMG, Boye K, Brennan B, Brodowicz T, Buonadonna A, De Álava E, Del Muro XG, Dufresne A, Eriksson M, Fagioli F, Fedenko A, Ferraresi V, Ferrari A, Frezza AM, Gasperoni S, Gelderblom H, Gouin F, Grignani G, Haas R, Hassan AB, Hecker-Nolting S, Hindi N, Hohenberger P, Joensuu H, Jones RL, Jungels C, Jutte P, Kager L, Kasper B, Kawai A, Kopeckova K, Krákorová DA, Le Cesne A, Le Grange F, Legius E, Leithner A, Lopez-Pousa A, Martin-Broto J, Merimsky O, Messiou C, Mir O, Montemurro M, Morland B, Morosi C, Palmerini E, Pantaleo MA, Piana R, Piperno-Neumann S, Reichardt P, Rutkowski P, Safwat AA, Sangalli C, Sbaraglia M, Scheipl S, Schöffski P, Sleijfer S, Strauss D, Strauss S, Sundby Hall K, Trama A, Unk M, van de Sande MAJ, van der Graaf WTA, van Houdt WJ, Frebourg T, Casali PG, Stacchiotti S; ESMO Guidelines Committee, EURACAN and GENTURIS. Electronic address: clinicalguidelines@esmo.org. Soft tissue and visceral sarcomas: ESMO-EURACAN-GENTURIS Clinical Practice Guidelines for diagnosis, treatment and follow-up(☆). Ann Oncol. 2021;32:1348-1365. [PubMed] [DOI] |