修回日期: 2023-08-21
接受日期: 2023-09-21
在线出版日期: 2023-09-28
直肠癌预后较差, 早期预测直肠癌根治性手术后复发转移对改善预后具有重要意义. 本研究同时整合多模态磁共振成像(magnetic resonance imaging, MRI)技术相关参数、肿瘤标志物、临床病理特征等多种影响因素,并建立列线图模型, 为临床制定干预措施提供依据.
探讨基于磁共振动态增强(dynamic contrast enhanced MRI, DCE-MRI)、磁共振扩散加权成像(diffusion-weighted imaging, DWI)定量参数及血清癌胚抗原(carcinoembryonic antigen, CEA)水平构建列线图模型, 分析该模型对直肠癌术后复发转移风险的预测价值, 以指导临床制定干预措施.
选取2019-03-01/2022-02-28于本院行腹腔镜辅助下直肠癌根治术的120例患者直肠癌为研究对象, 根据患者术后1年内复发转移情况分为复发转移组(n = 29), 无复发转移组(n = 91). 对比两组3.0T MRI多模态成像技术相关参数[表观扩散系数(apparent diffusion coefficient, ADC)、血管通透性常数(Transfer rate constant, Ktrans)、血液回流常数(Rate constant, Kep)、血管外细胞外间隙容积百分比(extravascular extracellular space volume fraction, Ve)]. 单因素、Lasso模型筛选术后复发转移相关预测因子, 采用Logistic回归分析术后复发转移的影响因素. 基于影响因素构建列线图模型, 评价该模型对术后复发转移的预测价值, 校准曲线、决策曲线分析(decision curve analysis, DCA)验证该模型校准度、临床效用性.
复发转移组ADC低于无复发转移组, Ktrans、Kep高于无复发转移组(P<0.05); 梗阻、分化程度、临床分期、淋巴结转移、术后CEA及ADC、Ktrans、Kep为术后复发转移的独立影响因素(P<0.05); 列线图模型预测术后复发转移的AUC高于ADC、Ktrans、Kep联合预测(P<0.05), 且具有良好校准度、临床效用性.
基于DCE-MRI、DWI定量参数及血清CEA水平构建列线图模型对直肠癌术后复发转移具有一定预测价值, 临床可针对高危因素制定干预措施, 有助于降低术后复发转移风险.
核心提要: 基于磁共振动态增强、磁共振扩散加权成像定量参数及血清癌胚抗原水平构建列线图模型, 对直肠癌术后复发转移具有一定预测价值, 有助于降低术后复发转移风险.
引文著录: 董伍真, 倪浩亮, 蔡成. 含DCE-MRI、DWI定量参数及血清CEA水平的列线图模型对直肠癌术后复发转移风险的预测价值. 世界华人消化杂志 2023; 31(18): 773-781
Revised: August 21, 2023
Accepted: September 21, 2023
Published online: September 28, 2023
The prognosis of rectal cancer is poor, and early prediction of recurrence and metastasis after radical surgery is of great significance for improving its prognosis. This study integrated multiple influencing factors such as multimodal magnetic resonance imaging (MRI) parameters, tumor markers, and clinicopathological features to develop a nomogram to provide a basis for the development of clinical intervention measures for this malignancy.
To develop a nomogram based on dynamic contrast enhanced MRI (DCE-MRI) and diffusion-weighted imaging (DWI) quantitative parameters and serum carcinoembryonic antigen (CEA) level, and to analyze the predictive value of this model for the risk of postoperative recurrence and metastasis of rectal cancer, so as to guide the development of clinical intervention measures for this malignancy.
A total of 120 patients who underwent laparoscopic-assisted radical resection of rectal cancer at our hospital from March 1, 2019 to February 28, 2022 were selected as research subjects. According to the presence of recurrence/metastasis within 1 year after surgery, the patients were divided into a recurrence/metastasis group (n = 29) and a no recurrence/metastasis group (n = 91). The relevant parameters [apparent diffusion coefficient (ADC), transfer rate constant (Ktrans), blood return constant (Kep), and extravascular extracellular space volume fraction (Ve)] of multimodal MRI imaging techniques were compared between the two groups to analyze their predictive value for postoperative recurrence/metastasis. Univariate analysis with Lasso model screening for predictive factors related to postoperative recurrence/metastasis was performed, and logistic regression analysis was used to analyze the influencing factors of postoperative recurrence/metastasis. A nomogram was developed based on the influencing factors identified, and the predictive value of the model for postoperative recurrence/metastasis was assessed. Calibration curve and decision curve analysis (DCA) were used to verify the calibration degree and clinical effectiveness of the model, respectively.
ADC in the recurrence/metastasis group was lower than that in the no recurrence/metastasis group, while Ktrans and Kep were higher than those in the no recurrence/metastasis group (P < 0.05). Obstruction, degree of differentiation, clinical stage, lymph node metastasis, postoperative CEA, ADC, Ktrans, and Kep were identified to be independent influencing factors on postoperative recurrence/metastasis (P < 0.05). The area under the curve of the nomogram was higher than that of ADC, Ktrans, and Kep combined (P < 0.05), and the nomogram had good calibration and clinical efficacy.
The nomogram developed based on DCE-MRI and DWI quantitative parameters and serum CEA level has appreciated predictive value for postoperative recurrence/metastasis of rectal cancer, and clinical intervention measures can be formulated according to these high risk factors to reduce the risk of postoperative recurrence/metastasis.
- Citation: Dong WZ, Ni HL, Cai C. Predictive value of a nomogram based on DCE-MRI and DWI quantitative parameters and serum CEA level for risk of postoperative recurrence/metastasis of rectal cancer. Shijie Huaren Xiaohua Zazhi 2023; 31(18): 773-781
- URL: https://www.wjgnet.com/1009-3079/full/v31/i18/773.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i18.773
我国直肠癌发病率、病死率逐年上升, 已严重威胁患者生命安全, 临床常采用根治性手术治疗, 但术后约有20%-60%患者发生复发转移, 导致预后较差[1]. 因而早期预测直肠癌根治性手术后复发转移对改善患者预后具有重要意义. 目前临床主要采用美国癌症联合委员会-TNM分期系统(AJC-TNM)、血清肿瘤标志物等预判复发转移, 其中AJC-TNM系统仅考虑肿瘤解剖学特性, 易忽视肿瘤分化程度等生物学特性, 而不同血清肿瘤新型标志物可能存在特异性低等问题, 因而需建立联合预测模型[2]. 多模态磁共振成像(magnetic resonance imaging, MRI)可直观显示肿瘤血流动力学信息、病灶形态学特征, 且在预防局部复发等方面具有一定应用优势[3,4]. 故而探究直肠癌术后复发转移与影像学特征相关性, 对直肠癌临床治疗方案制定具有一定参考价值. 既往研究表明列线图依据可纳入更多危险因素, 可评估个体发生结局事件的概率, 提高预测效果准确性[5,6]. 但同时整合多模态MRI成像技术相关参数、肿瘤标志物、临床病理特征等多种影响因素尚未见报道, 基于此, 本研究对比分析直肠癌术后复发转移者3.0T MRI多模态成像技术相关参数, 采用Lasso-Logistic回归分析术后复发转移的影响因素, 并建立列线图模型, 为临床早期制定干预措施提供依据.
选取2019-03-01/2022-02-28于本院行腹腔镜辅助下直肠癌根治术的120例直肠癌患者为研究对象, 其中男69例、女51例, 年龄53-67(60.32±3.19)岁, 体重指数20-28(24.15±1.78) kg/m2, 组织类型: 管状腺癌105例、粘液腺癌12例、印绒细胞癌3例; 分化程度: 低分化17例、中高分化103例. 本研究经本院伦理委员会批准. 纳入标准: 符合直肠癌诊断标准[7], 且经病理组织学证实; 首次就诊且未发生远处转移; 术前未接受放疗或辅助化疗者; 符合手术指征者; 根治性切除采用全直肠系膜切除术; 单一病灶; 美国东部肿瘤协作组评分≤2分; 美国麻醉医师协会分级为Ⅰ-Ⅱ级[8]; 签署知情同意书. 排除标准: 合并其他恶性肿瘤者; 既往直肠手术史者; MRI检查禁忌者; 非原发性直肠癌者; 伴有心肺功能障碍者; 腹腔出血或肿胀者; 预计生存期≤3 mo.
1.2.1 治疗方法与随访调查: 研究对象均行腹腔镜辅助下直肠癌根治术, 使用德国STORZ腹腔镜、内镜电视摄像系统与冷光源系统进行手术治疗, 采用静息复合麻醉, 在脐轮上缘置入腹腔镜, 设置辅助切口取出癌组织, 然后清除淋巴结、切除直肠系膜. 术后随访, 每3 mo随访1次, 统计术后1年内复发转移情况, 腹部超声、纤维结肠镜、病理检查等证实结肠肿瘤复发转移, 包括出现新直肠癌病灶、盆腔转移灶、远处转移灶[9].
1.2.2 收集临床资料: 以查阅病历方式收集临床资料, 包括性别、年龄、BMI、梗阻、肿瘤直径、组织类型、分化程度、浸润深度、临床分期[10]、淋巴结转移、手术时间、输血、术后辅助化疗、术后住院时间、术后癌胚抗原(carcinoembryonic antigen, CEA), 其中采用罗氏Cobas e601电化学发光分析仪检测术后首次常规体检时血清CEA水平, 判定CEA水平分界范围: <5.0 μg/L、≥5.0 μg/L[11].
1.2.3 3.0T MRI多模态成像技术检查: 研究对象治疗前接受3.0T MRI(Siemens Magnetom Verio)扫描仪扫描, 每期采集时间10 s, 共扫描40期. (1)MRI扫描部位轴位T1加权成像、矢状位T2加权成像, 层厚4 mm, 脉冲重复、回波时间分别为700 ms、11 ms, 层数24, 视野230 mm; 冠状压脂T2加权成像层厚4 nn, 脉冲重复、回波时间分别为4500 ms、85 ms, 层数20, 视野240 mm; (2)对比增强扫描前进行DWI扫描, 采用平面回波序列, 扫描参数: TR 7200 ms、TE 88 ms、层厚4 mm、层间距6 mm, 激励次数2, 视野340 mm, 矩阵192 mm×192 mm, b值分别为0、800 s/mm2; (3)DCE-MRI扫描T1容积内插体部(VIBE)横断位, 视野260 mm×260 mm, 层厚3.6 mm, 脉冲重复、回波时间分别为5.08 ms、1.74 ms, 矩阵138×192, 层间距3.6 mm×20%, 然后翻转角2°、15°序列, 以计算原始T1值; 以2.0 mL/s速率注射造影剂钆喷酸葡胺(北京北陆药业股份有限公司)0.1 mmol/kg, 然后以相同注射速率注入生理盐水20 mL, 采用翻转角15°的VIBE序列扫描35期, 9.3 s/期. 扫描结束后采用Siemens 3.0T MRI Verio工作站处理数据, 表观扩散系数(apparent diffusion coefficient, ADC): 依据动态增强图像确定病变位置, 以病变实性部分为研究区域, 并检测3个感兴趣区(ROI), 计算平均值. 采用4D tissue软件分析定量增强参数: 选取病变强化明显区域(3个)为ROI, 结合原始T1值, 参照Tolfs模型计算血管通透性常数(Ktrans)、血管外细胞外间隙容积百分比(Ve)、血液回流常数(Kep), 分别计算平均值. 由2位具有放射专科10年以上工作经验的副主任医师进行扫描操作分析数据, 并进行多模态参数的一致性检验.
统计学处理 采用SPSS 24.0分析数据, 计量资料以(mean±SD)表示, 组间比较采用t检验; 计数资料以n(%)表示, 采用χ2检验或Fisher确切概率法分析; 单因素、Lasso-Logistic回归分析术后复发转移的独立影响因素; 采用R4.0.3软件构建列线图风险预测模型; 绘制受试者工作特征曲线(receiver operator characteristic, ROC)并计算ROC下面积(area under the curve, AUC), 不同预测方案间比较采用Z检验; 采用Boostrap法进行1000次内部抽样验证列线图模型一致性, 以减少过度拟合偏差; 临床有效性验证通过决策曲线分析(decision curve analysis, DCA), 量化列线图模型在不同阈值概率下的净收益, 以P<0.05为差异有统计学意义.
120例直肠癌术后患者中, 术后1年经临床手术或实验室检查确诊出现29例复发转移, 其中局部复发9例, 远处转移18例, 局部复发伴转移2例. 局部复发: 盆腔复发6例、肠内复发3例; 远处转移: 肝转移8例、肺转移5例、骨转移4例、多发转移1例; 2例局部复发伴转移分别为盆腔复发伴肝转移, 肠内复发伴肝转移.
单因素分析可知, 梗阻、肿瘤直径、分化程度、临床分期、淋巴结转移、术后CEA及3.0T MRI多模态成像技术相关参数ADC、Ktrans、Kep均与直肠癌术后复发转移有关(P<0.05). 见表1.
| 因素 | 复发转移组(n = 29) | 无复发转移组(n = 91) | t/χ2 | P |
| 性别 | 0.020 | 0.889 | ||
| 男 | 17(58.62) | 52(57.14) | ||
| 女 | 12(41.38) | 39(42.86) | ||
| 年龄(岁) | 57.82±6.85 | 56.94±7.12 | 0.585 | 0.560 |
| BMI(kg/m2) | 23.94±2.25 | 23.59±2.41 | 0.692 | 0.491 |
| 梗阻 | 7.664 | 0.006 | ||
| 有 | 19(65.52) | 33(36.26) | ||
| 无 | 10(34.48) | 58(63.74) | ||
| 肿瘤直径(cm) | 8.74±2.22 | 6.25±1.59 | 6.635 | 0.000 |
| 组织类型 | 0.786 | 0.675 | ||
| 管状腺癌 | 24(82.76) | 81(89.01) | ||
| 粘液腺癌 | 4(13.79) | 8(8.79) | ||
| 印绒细胞癌 | 1(3.45) | 2(2.20) | ||
| 分化程度 | 5.664 | 0.017 | ||
| 中、高分化 | 21(72.41) | 82(90.11) | ||
| 低分化 | 8(27.59) | 9(9.89) | ||
| 临床分期 | 10.232 | 0.001 | ||
| Ⅰ-Ⅱ期 | 9(31.03) | 59(64.84) | ||
| Ⅲ期 | 20(68.97) | 32(35.16) | ||
| 神经血管侵犯 | 0.110 | 0.741 | ||
| 有 | 13(44.83) | 44(48.35) | ||
| 无 | 16(55.17) | 47(51.65) | ||
| 直肠系膜浸润深度 | 0.003 | 0.955 | ||
| T1-T2 | 2(6.90) | 6(6.59) | ||
| T3-T4 | 27(93.10) | 85(93.41) | ||
| 淋巴结转移 | 7.069 | 0.008 | ||
| 有 | 19(65.52) | 34(37.36) | ||
| 无 | 10(34.48) | 57(62.64) | ||
| 手术时间 | 0.468 | 0.494 | ||
| <120 min | 7(24.14) | 28(30.77) | ||
| ≥120 min | 22(75.86) | 63(69.23) | ||
| 输血 | 3.064 | 0.080 | ||
| 有 | 11(37.93) | 33(36.26) | ||
| 无 | 18(62.07) | 58(63.74) | ||
| 术后CEA | 8.950 | 0.003 | ||
| <5.0 μg/L | 10(34.48) | 60(65.93) | ||
| ≥5.0 μg/L | 19(65.52) | 31(34.07) | ||
| 术后辅助化疗 | 0.253 | 0.615 | ||
| 有 | 16(55.17) | 55(60.44) | ||
| 无 | 13(44.83) | 36(39.56) | ||
| 术后住院时间 | 1.343 | 0.246 | ||
| <14 d | 13(44.83) | 52(57.14) | ||
| ≥14 d | 16(55.17) | 39(42.86) | ||
| MRI多模态参数 | ||||
| ADC(×10-3 mm2/s) | 0.81±0.10 | 1.12±0.15 | 10.402 | 0.000 |
| Ktrans(min) | 0.45±0.08 | 0.37±0.06 | 5.745 | 0.000 |
| Kep(min) | 1.05±0.25 | 0.87±0.19 | 4.101 | 0.000 |
| Ve | 0.25±0.06 | 0.27±0.08 | 1.238 | 0.218 |
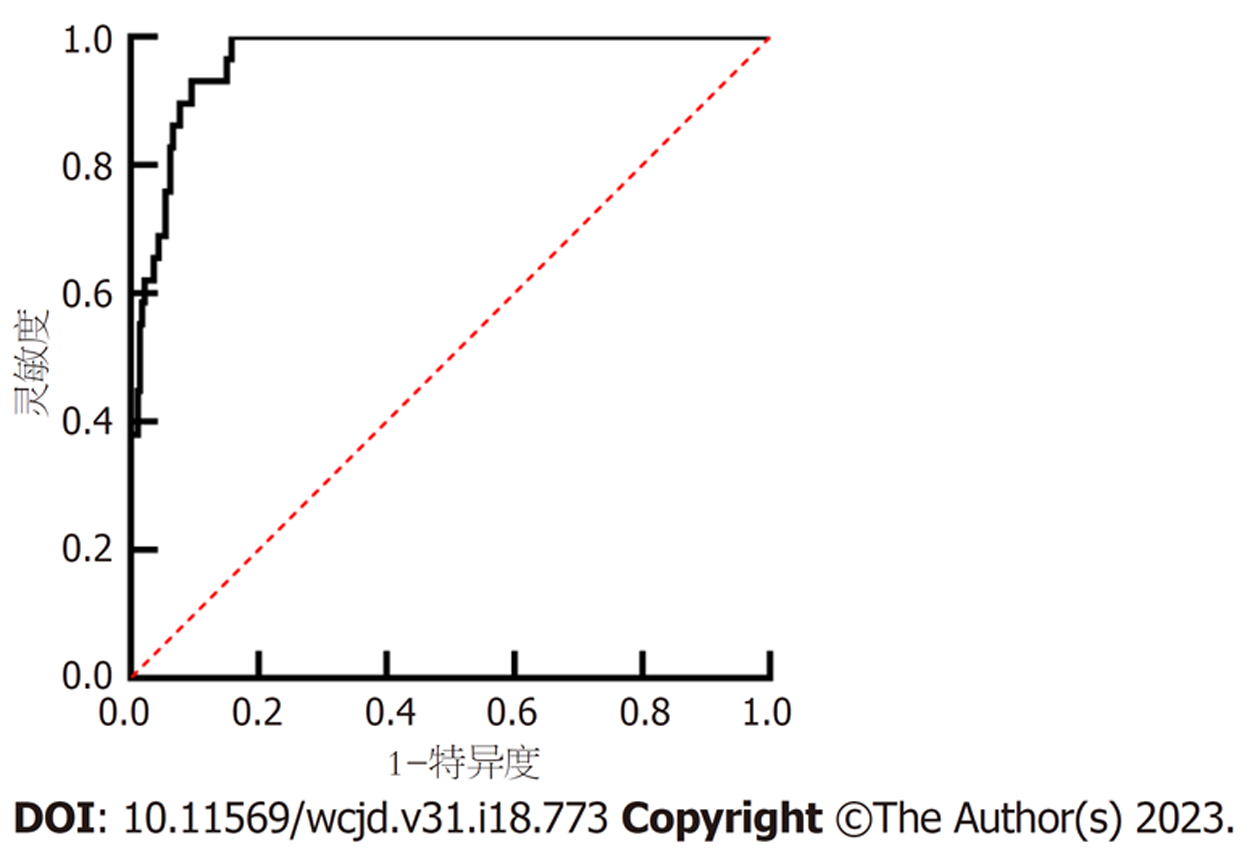
以直肠癌术后转移复发为阳性, 无转移复发为阴性, 绘制ADC、Ktrans、Kep联合预测直肠癌术后复发转移的ROC曲线, 结果可见, 联合预测AUC值为0.899(95%CI: 0.830-0.947), 敏感度为89.66%, 特异度为76.67%. 见图1.
2.4.1 直肠癌术后复发转移的相关因素的筛选: 本研究纳入120例行直肠癌手术患者(术后复发转移29例, 无复发转移91例), 单因素分析差异有统计学意义的9个因素经Lasso回归筛选出8个因素: 梗阻、分化程度、临床分期、淋巴结转移、术后CEA及ADC、Ktrans、Kep.
2.4.2 直肠癌术后复发转移的多因素Logistic回归分析: 以直肠癌术后复发转移与否为因变量(未发生 = 0, 发生 = 1), 单因素分析与Lasso回归筛选相吻合的8个变量作为自变量(赋值见表2), 进行多因素Logistic回归分析, 结果显示, 梗阻、分化程度、临床分期、淋巴结转移、术后CEA及ADC、Ktrans、Kep均为直肠癌术后复发转移的独立影响因素(P<0.05). 见表3.
| 变量 | 赋值情况 |
| 梗阻 | 无 = 0, 有 = 1 |
| 分化程度 | 低分化 = 1, 中、高分化 = 2 |
| 临床分期 | Ⅰ-Ⅱ期 = 1, Ⅲ期 = 2 |
| 淋巴结转移 | 无 = 0, 有 = 1 |
| 术后CEA | <5.0 μg/L = 1, ≥5.0 μg/L = 2 |
| ADC | 连续变量, 按实际值 |
| Ktrans | 连续变量, 按实际值 |
| Kep | 连续变量, 按实际值 |
| 因素 | 赋值情况 | β | S.E. | Wald χ2 | OR | 95%CI | P |
| 梗阻 | 无 = 0, 有 = 1 | 1.864 | 0.474 | 15.460 | 6.448 | 1.374-30.258 | <0.001 |
| 分化程度 | 低分化 = 1, 中、高分化 = 2 | -0.620 | 0.125 | 24.631 | 0.538 | 0.405-0.714 | <0.001 |
| 临床分期 | Ⅰ-Ⅱ期 = 1, Ⅲ期 = 2 | 2.170 | 0.392 | 30.632 | 8.754 | 1.859-41.226 | <0.001 |
| 淋巴结转移 | 无 = 0, 有 = 1 | 2.169 | 0.499 | 18.896 | 8.751 | 2.145-35.698 | <0.001 |
| 术后CEA | <5.0 μg/L = 1, ≥5.0 μg/L = 2 | 2.093 | 0.403 | 26.985 | 8.113 | 2.020-32.585 | <0.001 |
| ADC | 连续变量, 按实际值 | -0.684 | 0.154 | 19.704 | 0.505 | 0.372-0.685 | <0.001 |
| Ktrans | 连续变量, 按实际值 | 1.973 | 0.491 | 16.146 | 7.192 | 1.452-35.621 | <0.001 |
| Kep | 连续变量, 按实际值 | 1.905 | 0.425 | 20.099 | 6.722 | 1.374-32.884 | <0.001 |
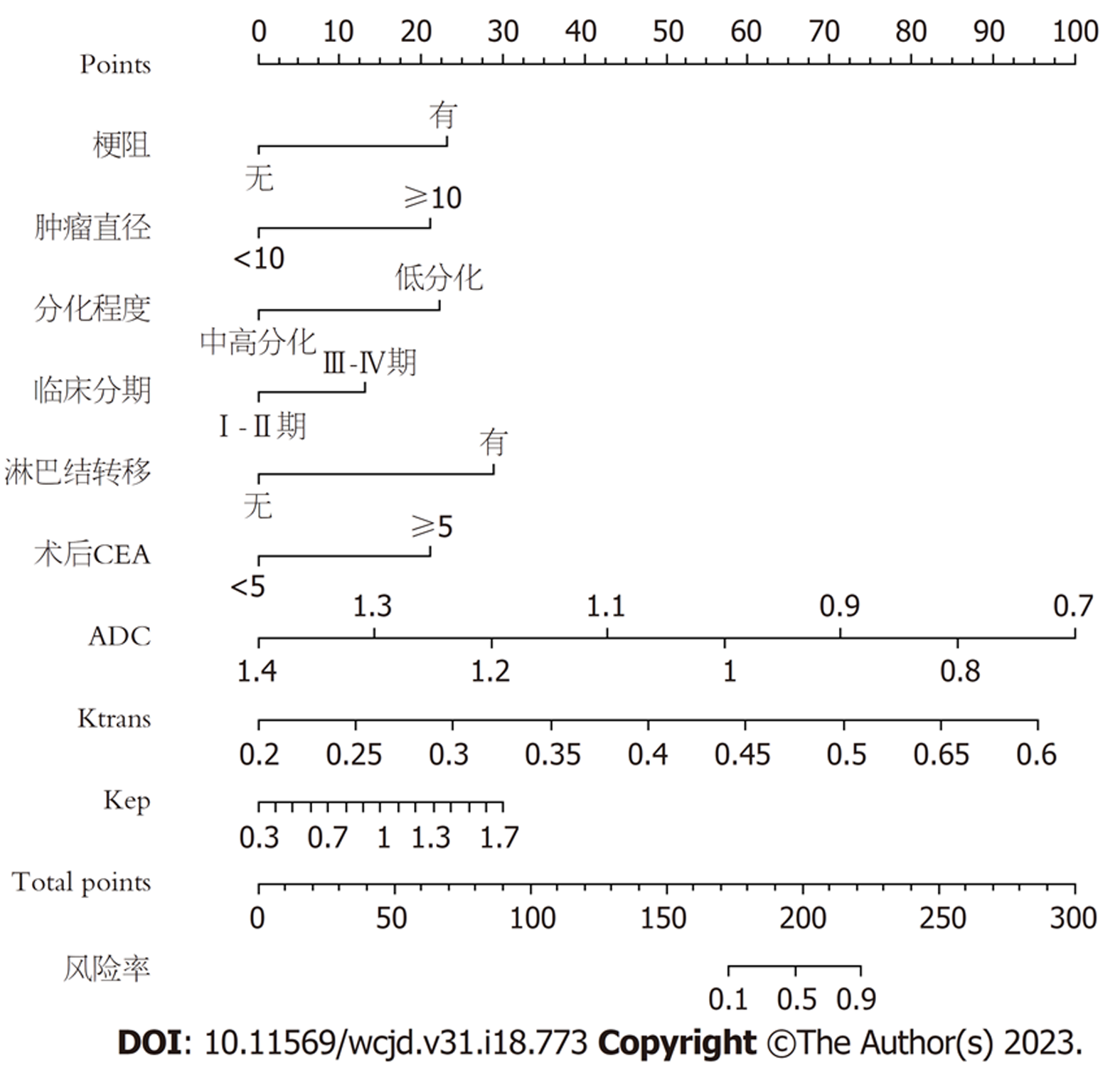
将2.3得出的独立影响因素进行整合, 构建预测直肠癌术后复发转移的列线图模型, 见图2.
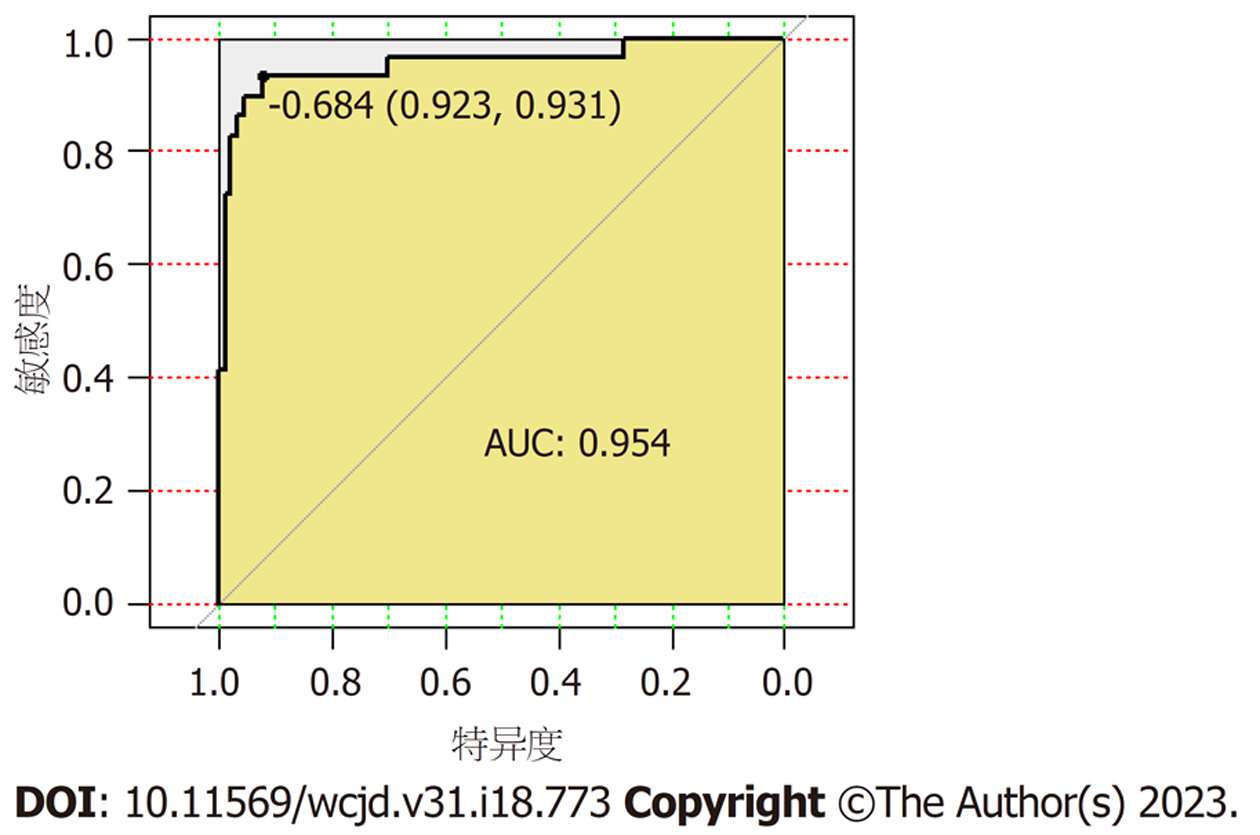
ROC曲线显示, 该模型AUC分别为0.954(95%CI: 0.901-1.000)明显高于上述3.0T DCE-MRI、DWI定量参数ADC、Ktrans、Kep联合预测AUC值, 见图3.
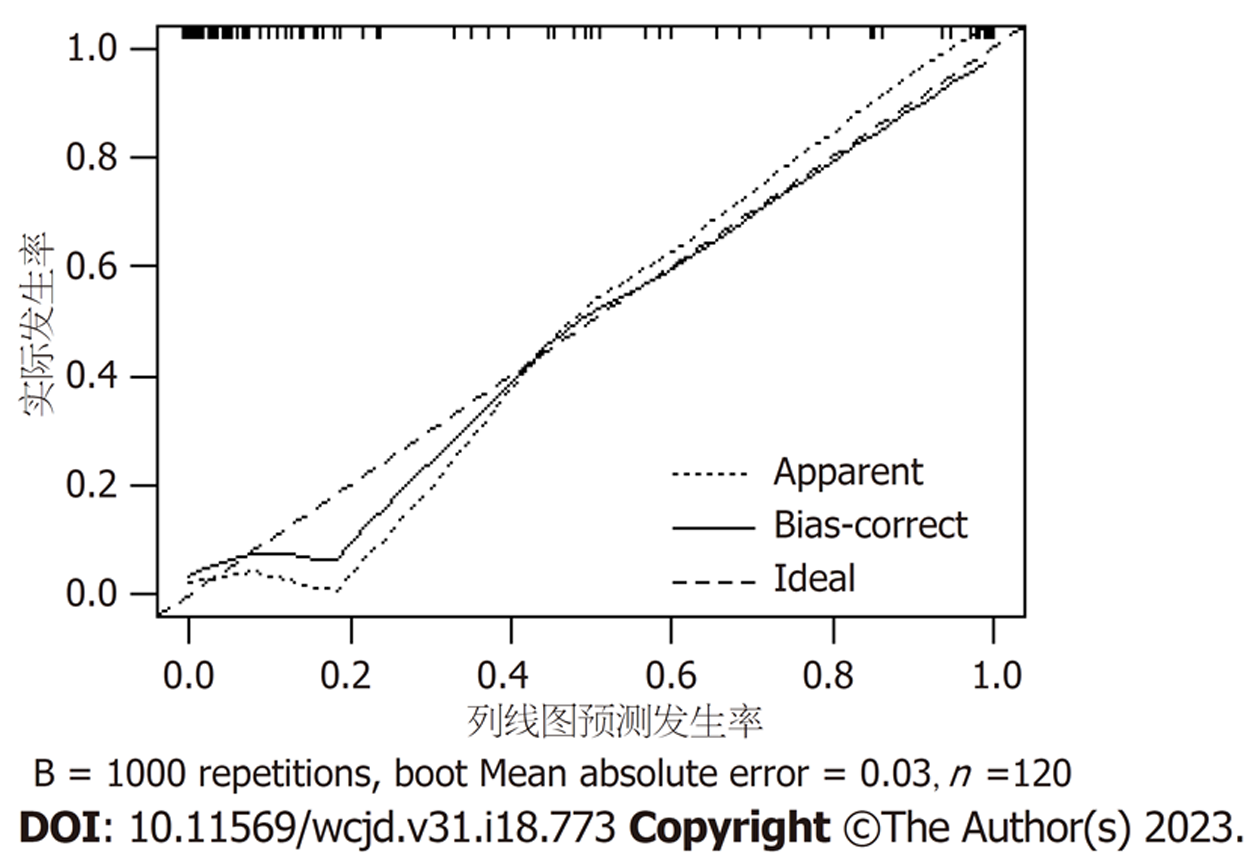
校准曲线显示, 该模型预测概率与实际概率关系的校准图, 见图4, 提示预测可靠性较高. 列线图模型经Boostrap法进行1000次内部抽样验证后, 得到模型预测值与实际观察值趋于45°斜线, 提示该模型校准度良好.
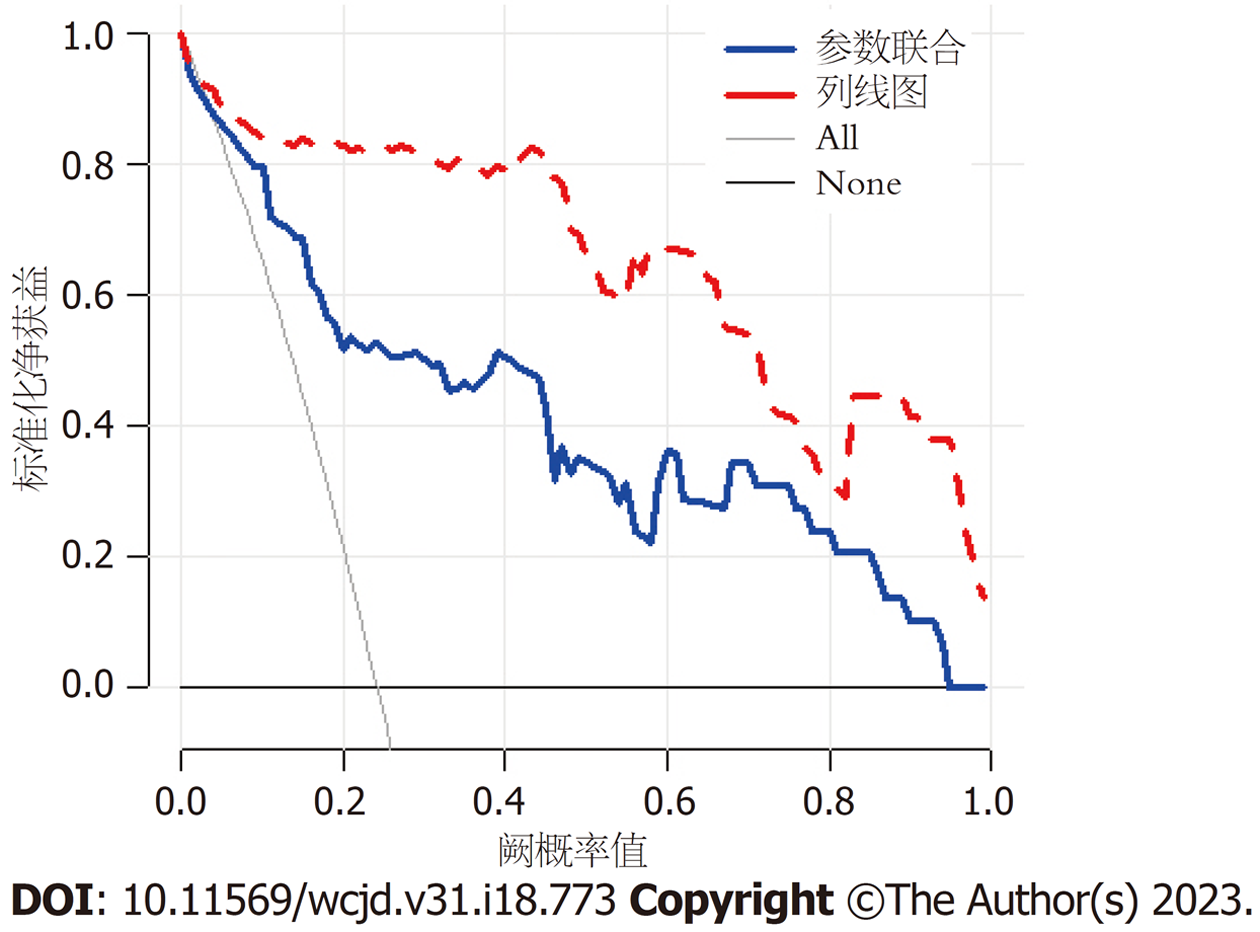
DCA曲线显示, 列线图模型相较于单纯DCE-MRI、DWI定量参数, 可获取更大的净获益, 见图5.
直肠癌细胞增殖能力增强, 癌细胞种植于其他粘膜、根治术清除不彻底均可导致陈旧病灶复发[12,13]. 本研究结果显示, 直肠癌术后复发转移率为24.17%, 这与既往研究报道结果相似[14], 提示临床急需建立早期预测直肠癌术后复发转移风险的预测模型.
3.0T MRI多模态成像技术可探测出体内水分子扩散运动变化情况, 并可反映肿瘤组织血流动力学情况[15,16]. ADC降低可能与巨噬细胞浸润、血管变化有关[17]. 本研究结果显示, 复发转移组ADC低于无复发转移组, 这可能是由于直肠癌细胞数量较多, 导致组织密度增加、细胞外间隙减小, 减弱水分子在组织内扩散能力, 进而降低ADC. Ktrans可反映内皮细胞间隙完整性, Kep升高表明肿瘤细胞增殖速度越快, 肿瘤细胞所需营养成分越多, 致使新生血管形成, 而Ktrans、Ve、Kep可定量评估病灶组织新生血管形成[18,19]. 本研究结果显示, 复发转移组Ktrans、Kep高于无复发转移组, 这与既往研究不同[20], 其原因在于本研究纳入研究对象均在术前进行3.0T MRI多模态成像技术检查, 致使Ktrans、Kep呈高表达状态. 由此推测Ktrans、Kep可能与复发转移密切相关, 可能作为预测复发转移的潜在指标.
Lasso可压缩部分回归系统, 保留子集选择、岭回归, Lasso-Logistic回归分析可解决多重共线性问题, 可选择某个哑变量化后的变量, 因而选择的变量对结果具有较好的解释性[21]. 本研究结果显示梗阻、分化程度、临床分期、淋巴结转移、术后CEA及ADC、Ktrans、Kep为直肠癌术后复发转移的独立影响因素. 癌组织血流速度快、内皮细胞间隙增宽可加快对比剂进出血管速度, 因而Ktrans、Kep升高, ADC降低[22]. 由此推测ADC、Ktrans、Kep异常变化可能提示临床分期增高、肿瘤侵袭能力增强、血管通透性增高. 梗阻可促使肠壁血液循环降低, 引发肠道穿孔, 致使癌细胞脱落并种植于腹腔内, 加之机体对有毒物质清除能力降低, 可激活癌细胞致使肿瘤复发转移[23]. 分化程度降低、临床分期越高、肿瘤入侵淋巴管可增加手术难度, 若术中未完全切除肿瘤或淋巴结, 可造成肿瘤复发转移[24]. CEA可促使肿瘤细胞向周围组织侵袭转移[25]. 临床工作者应重视上述影响因素, 并予以相应干预措施, 以降低术后复发转移风险. 相较于既往研究报道[26,27], 本研究探讨3.0T MRI多模态成像技术相关参数、临床病理特征及血清肿瘤标志物对术后复发转移的预测效能, 这也是本研究创新之处. 本研究基于独立影响因素构建列线图模型, 该模型预测术后复发转移的AUC为0.954, 显示出良好预测效能, 且具有良好区分度与一致性, 表明该模型个体化预测术后复发转移具有可靠性. 但这些结果并未充分说明该模型是否在临床实际中应用, 本研究进一步分析发现列线图模型相较于单纯3.0T MRI多模态成像技术相关参数, 可获取更大净获益, 这也是本研究创新之处, 提示基于3.0T MRI多模态成像技术相关参数建立预测术后复发转移的列线图模型, 可获得直肠癌患者术后复发转移的概率. 临床医师应鼓励高危人群定期接受结肠镜检查, 并予以化疗、药物辅助治疗.
综上所述, 梗阻、分化程度、临床分期、淋巴结转移、术后CEA及ADC、Ktrans、Kep为直肠癌术后复发转移的独立影响因素, 基于以上影响因素构建的列线图模型对复发转移具有一定预测效能. 但本研究仅探究术后1年复发风险, 受限于人力资源、科研经费、时间等, 样本量较小, 且未进行外部验证, 有待临床日后扩大样本量, 利用不同中心数据或新增病例做进一步验证.
直肠癌细胞增殖能力增强, 癌细胞种植于其他粘膜、根治术清除不彻底均可导致陈旧病灶复发, 临床急需建立早期预测直肠癌术后复发转移风险的预测模型.列线图依据可纳入更多危险因素, 可评估个体发生结局事件的概率, 提高预测效果准确性. 本研究同时整合多模态MRI成像技术相关参数、肿瘤标志物、临床病理特征等多种影响因素建立列线图模型, 为临床早期制定干预措施提供依据.
探讨基于磁共振动态增强(dynamic contrast enhanced MRI, DCE-MRI)、磁共振扩散加权成像(diffusion-weighted imaging, DWI)定量参数及血清癌胚抗原(carcinoembryonic antigen, CEA)水平构建列线图模型, 分析该模型对直肠癌术后复发转移风险的预测价值, 以指导临床制定干预措施.
本研究探讨3.0T MRI多模态成像技术相关参数、临床病理特征及血清肿瘤标志物对术后复发转移的预测效能.
选取2019-03-01/2022-02-28于本院行腹腔镜辅助下直肠癌根治术的120例患者直肠癌为研究对象, 根据患者术后1年内复发转移情况分为复发转移组(n = 29), 无复发转移组(n = 91). 单因素、Lasso模型筛选术后复发转移的影响因素. 基于影响因素构建列线图模型.
复发转移组ADC低于无复发转移组, Ktrans、Kep高于无复发转移组(P<0.05); 梗阻、分化程度、临床分期、淋巴结转移、术后CEA及ADC、Ktrans、Kep均为直肠癌术后复发转移的独立影响因素(P<0.05); 列线图模型预测术后复发转移的AUC高于ADC、Ktrans、Kep联合预测(P<0.05), 且具有良好校准度、临床效用性, 设计合理, 数据详实.
梗阻、分化程度、临床分期、淋巴结转移、术后CEA及ADC、Ktrans、Kep为直肠癌术后复发转移的独立影响因素, 基于以上影响因素构建的列线图模型对复发转移具有一定预测效能.
基于3.0T MRI多模态成像技术相关参数建立预测术后复发转移的列线图模型, 可获得直肠癌患者术后复发转移的概率. 设计合理, 数据详实, 值得推广继承和研究, 对临床具有指导意义. 临床医师应鼓励高危人群定期接受结肠镜检查, 并予以化疗、药物辅助治疗.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Fernandes MC, Gollub MJ, Brown G. The importance of MRI for rectal cancer evaluation. Surg Oncol. 2022;43:101739. [PubMed] [DOI] |
| 2. | Mizushima H, Sakimura Y, Nishimura A, Tawara H, Hayashi K, Kato K, Tsuji T, Yamamoto D, Kitamura H, Kadoya S, Bando H, Kurumaya H, Minato H. Solitary pleural metastasis in rectal cancer. Clin J Gastroenterol. 2022;15:164-170. [PubMed] [DOI] |
| 3. | Deal M, Bardet F, Walker PM, de la Vega MF, Cochet A, Cormier L, Bentellis I, Loffroy R. Three-dimensional nuclear magnetic resonance spectroscopy: a complementary tool to multiparametric magnetic resonance imaging in the identification of aggressive prostate cancer at 3.0T. Quant Imaging Med Surg. 2021;11:3749-3766. [PubMed] [DOI] |
| 4. | Delli Pizzi A, Cianci R, Genovesi D, Esposito G, Timpani M, Tavoletta A, Pulsone P, Basilico R, Gabrielli D, Rosa C, Caravatta L, Di Tommaso M, Caulo M, Filippone A. Performance of diffusion-weighted magnetic resonance imaging at 3.0T for early assessment of tumor response in locally advanced rectal cancer treated with preoperative chemoradiation therapy. Abdom Radiol (NY). 2018;43:2221-2230. [PubMed] [DOI] |
| 5. | Li T, Huang J, Lei P, Yang X, Chen Z, Chen P, Zhai J, Guo X, Wei H. A novel nomogram for anastomotic leakage after surgery for rectal cancer: a retrospective study. Peer J. 2022;10:e14437. [PubMed] [DOI] |
| 6. | Song J, Chen Z, Huang D, Wu Y, Lin Z, Chi P, Xu B. Nomogram Predicting Overall Survival of Resected Locally Advanced Rectal Cancer Patients with Neoadjuvant Chemoradiotherapy. Cancer Manag Res. 2020;12:7375-7382. [PubMed] [DOI] |
| 8. | Hawkins JL. American Society of Anesthesiologists' Practice Guidelines for Obstetric Anesthesia: update 2006. Int J Obstet Anesth. 2007;16:103-105. [PubMed] [DOI] |
| 10. | Weiser MR. AJCC 8th Edition: Colorectal Cancer. Ann Surg Oncol. 2018;25:1454-1455. [PubMed] [DOI] |
| 12. | Deng HY, Zhu XQ, Ding YY, Li JD, Yang J, Ke TF, Wang R, Chen Q, Hu J, Wang YY, Liao CD. Multislice spiral CT images combined with CEA and lymphocyte-to-neutrophil ratio predict recurrence and post-operative metastasis of rectal cancer. Mol Cell Probes. 2020;50:101502. [PubMed] [DOI] |
| 13. | Svensson Neufert R, Jörgren F, Buchwald P. Impact of rectal washout on recurrence and survival after anterior resection for rectal cancer. BJS Open. 2022;6. [PubMed] [DOI] |
| 14. | 陈 育洪, 程 黎阳, 陈 俊勇, 李 泽航, 王 乐霄. 腹腔镜辅助下右半结肠癌根治术后复发转移危险因素及风险列线图模型的建立. 贵州医科大学学报. 2021;46:840-845. [DOI] |
| 15. | Gao F, Shi B, Wang P, Wang C, Fang X, Dong J, Lin T. The Value of Intravoxel Incoherent Motion Diffusion-Weighted Magnetic Resonance Imaging Combined With Texture Analysis of Evaluating the Extramural Vascular Invasion in Rectal Adenocarcinoma. Front Oncol. 2022;12:813138. [PubMed] [DOI] |
| 16. | Xia Y, Wang L, Wu Z, Tan J, Fu M, Fu C, Pan Z, Zhu L, Yan F, Shen H, Ma Q, Cai G. Comparison of Computed and Acquired DWI in the Assessment of Rectal Cancer: Image Quality and Preoperative Staging. Front Oncol. 2022;12:788731. [PubMed] [DOI] |
| 17. | Cai C, Hu T, Gong J, Huang D, Liu F, Fu C, Tong T. Multiparametric MRI-based radiomics signature for preoperative estimation of tumor-stroma ratio in rectal cancer. Eur Radiol. 2021;31:3326-3335. [PubMed] [DOI] |
| 18. | Ciolina M, Caruso D, De Santis D, Zerunian M, Rengo M, Alfieri N, Musio D, De Felice F, Ciardi A, Tombolini V, Laghi A. Dynamic contrast-enhanced magnetic resonance imaging in locally advanced rectal cancer: role of perfusion parameters in the assessment of response to treatment. Radiol Med. 2019;124:331-338. [PubMed] [DOI] |
| 19. | Fang J, Sun W, Wu D, Pang P, Guo X, Yu C, Lu W, Tang G. Value of texture analysis based on dynamic contrast-enhanced magnetic resonance imaging in preoperative assessment of extramural venous invasion in rectal cancer. Insights Imaging. 2022;13:179. [PubMed] [DOI] |
| 20. | Chen Y, Yang X, Wen Z, Liu Y, Lu B, Yu S, Xiao X. Association between high-resolution MRI-detected extramural vascular invasion and tumour microcirculation estimated by dynamic contrast-enhanced MRI in rectal cancer: preliminary results. BMC Cancer. 2019;19:498. [PubMed] [DOI] |
| 21. | Li Z, Ma X, Shen F, Lu H, Xia Y, Lu J. Evaluating treatment response to neoadjuvant chemoradiotherapy in rectal cancer using various MRI-based radiomics models. BMC Med Imaging. 2021;21:30. [PubMed] [DOI] |
| 22. | Chen Y, Jiang Z, Guan X, Li H, Li C, Tang C, Lei Y, Dang Y, Song B, Long L. The value of multi-parameter diffusion and perfusion magnetic resonance imaging for evaluating epithelial-mesenchymal transition in rectal cancer. Eur J Radiol. 2022;150:110245. [PubMed] [DOI] |
| 23. | Biondo S, Gálvez A, Ramírez E, Frago R, Kreisler E. Emergency surgery for obstructing and perforated colon cancer: patterns of recurrence and prognostic factors. Tech Coloproctol. 2019;23:1141-1161. [PubMed] [DOI] |
| 24. | Morohashi H, Sakamoto Y, Miura T, Ichinohe D, Umemura K, Akaishi T, Sato K, Kuwata D, Yamazaki K, Wakiya T, Hakamada K. Effective dissection for rectal cancer with lateral lymph node metastasis based on prognostic factors and recurrence type. Int J Colorectal Dis. 2021;36:1251-1261. [PubMed] [DOI] |
| 25. | Lai IL, You JF, Chern YJ, Tsai WS, Chiang JM, Hsieh PS, Hung HY, Hsu YJ. The risk factors of local recurrence and distant metastasis on pT1/T2N0 mid-low rectal cancer after total mesorectal excision. World J Surg Oncol. 2021;19:116. [PubMed] [DOI] |