修回日期: 2023-06-21
接受日期: 2023-08-21
在线出版日期: 2023-08-28
IgG4相关性自身免疫性胰腺炎(IgG4 related autoim-mune pancreatitis, IgG4-AIP)是一种由自身免疫介导的胰腺炎, 该病的临床表现缺乏特异性, 鉴别诊断常有难度, 糖皮质激素对该疾病的治疗的指征及疗程仍存争议. 本研究希望通过分析疾病的临床特征提高疾病的认识和诊疗, 通过分析疾病复发的相关影响因素找出降低疾病复发率的治疗方案.
研究IgG4-AIP的临床特征及其治疗疗效、复发的影响因素.
回顾性分析46例确诊IgG4-AIP患者的临床资料特点及分析疾病复发的相关影响因素.
本研究中, 纳入的46例患者IgG4-AIP患者男女比例为10.5:1. IgG4-AIP最常见的临床表现为梗阻性黄疸. 52.1%的IgG4-AIP患者合并了胰外器官受累, 最常见的胰外器官为胆管. 91.3%的IgG4-AIP患者血清IgG4数值高于正常值. IgG4-AIP的影像学检查主要表现为胰腺弥漫肿胀或局部肿大, 伴胆胰管狭窄. 81.2%的IgG4-AIP患者通过超声内镜引导下胰腺穿刺活检获得病理学组织, 典型的IgG4-AIP病理学检查示胰腺纤维组织增生, 淋巴细胞、浆细胞浸润, 胰腺腺泡萎缩, 其中50%的IgG4-AIP患者病理免疫组化法示大量IgG4阳性浆细胞. 糖皮质激素治疗IgG4-AIP均有效, 但36.8%的患者治疗缓解后复发, 其中71.4%患者是停用糖皮质激素后复发. Logistic多因素回归分析示复发的危险因素是胰源性门脉高压和胰外器官受累, 小剂量糖皮质激素长期维持治疗可以预防复发.
IgG4-AIP的临床表现缺乏特异性,容易被误诊为胰腺癌. IgG4-AIP的主要表现为血清IgG4水平升高、胰腺弥漫肿胀或局部肿大伴胆胰管狭窄、多器官受累、IgG4阳性浆细胞浸润、组织纤维化、对糖皮质激素治疗有效. IgG4-AIP复发的危险因素是胰源性门脉高压和胰外器官受累, 小剂量糖皮质激素维持治疗可以预防复发.
核心提要: IgG4相关自身免疫性胰腺炎(IgG4 related autoimmune pancreatitis, IgG4-AIP)的临床表现缺乏特异性, 诊断时需要与胰腺癌相鉴别. 典型的IgG4-AIP病理组织中可以发现大量IgG4阳性浆细胞. 糖皮质激素治疗IgG4-AIP有效, 胰源性门脉高压和胰外器官受累是IgG4-AIP复发的危险因素, 小剂量糖皮质激素维持治疗可以预防复发.
引文著录: 曹卉, 曹仕琼, 高雨彤, 杜凡. IgG4相关自身免疫性胰腺炎的临床特征及复发的影响因素. 世界华人消化杂志 2023; 31(16): 677-687
Revised: June 21, 2023
Accepted: August 21, 2023
Published online: August 28, 2023
IgG4-associated autoimmune pancreatitis (IgG4-AIP) is a kind of autoimmune-mediated pancreatitis. The clinical manifestations of IgG4-AIP are not specific and the differential diagnosis is often difficult, and the indications and course of glucocorticoid treatment for the disease are still controversial. The aim of this study was to improve the understanding, diagnosis, and treatment of the disease by analyzing the clinical characteristics of the disease, and to reduce the recurrence rate of the disease by analyzing the factors related to its recurrence.
To investigate the clinical features, therapeutic efficacy, and recurrence of IgG4-AIP.
The clinical data of 46 patients with IgG4-AIP were analyzed retrospectively.
The male to female ratio of IgG4-AIP patients was 10.5:1. The most common clinical manifestation was obstructive jaundice. Approximately 52.1% of patients had extrapancreatic organ involvement, with the most commonly affected extrapancreatic organ being the bile duct. The vast majority (91.3%) of patients had higher serum IgG4 levels than normal. The imaging findings were diffuse swelling or local enlargement of the pancreas with stricture of the biliary and pancreatic ducts. The majority (81.2%) of patients underwent pancreatic biopsy under the guidance of endoscopic ultrasonography. Typical pathological findings included fibrous tissue proliferation, lymphocyte and plasma cell infiltration, and acinar atrophy of the pancreas. Half of the patients showed a large number of IgG4 positive plasma cells as revealed by immunohistochemistry. Glucocorticoids were effective for IgG4-AIP, but 36.8% of the patients relapsed after remission, and 71.4% relapsed after stopping glucocorticoids. Logistic regression analysis showed that the risk factors for recurrence were pancreatic portal hypertension and involvement of extra-pancreatic organs. Low-dose glucocorticoid maintenance therapy could prevent recurrence.
Due to the lack of specific clinical manifestation, IgG4-AIP is easily misdiagnosed as pancreatic cancer. The main manifestations of IgG4-AIP are increased serum IgG4 level, diffuse or local swelling of pancreas with biliopancreatic duct stricture, multiple organ involvement, IgG4 positive plasma cell infiltration, tissue fibrosis, and response to treatment with glucocorticoids. The risk factors for recurrence of IgG4-AIP are pancreatic portal hypertension and extrapancreatic organ involvement. Low-dose glucocorticoid maintenance therapy can prevent recurrence.
- Citation: Cao H, Cao SQ, Gao YT, Du F. Clinical features of IgG4-associated autoimmune pancreatitis and factors related to its recurrence. Shijie Huaren Xiaohua Zazhi 2023; 31(16): 677-687
- URL: https://www.wjgnet.com/1009-3079/full/v31/i16/677.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i16.677
自身免疫性胰腺炎(autoimmune pancreatitis, AIP)是一种由自身免疫介导的罕见胰腺炎. AIP的发病机制尚不完全清楚, 其临床表现也是非特异性的. AIP的国际共识诊断标准(international consensus diagnostic criteria, ICDC)把它分为两种亚型: 淋巴浆细胞性硬化性胰腺炎(lymphoplasmacytic sclerosing pancreatitis, LPSP)和特发性导管中心性胰腺炎(idiopathic duct-centric pancreatitis, IDCP). LPSP即IgG4相关自身免疫性胰腺炎(IgG4 related autoimmune pancreatitis, IgG4-AIP)是亚洲国家AIP的主要类型[1]. 目前认为IgG4-AIP是免疫球蛋白G4相关疾病(IgG4-RD)在胰腺的表现. IgG4-AIP的影像学表现多为胰腺肿大, 临床上易误诊为胰腺肿瘤性病变. IgG4-AIP缺乏国际上普遍认可的诊断标准, 在临床上仍有很多问题未解决. IgG4-AIP的鉴别诊断对于临床医生仍具有挑战性. 糖皮质激素治疗IgG4-AIP的指征及疗程仍存争议[2]. 糖皮质激素治疗后部分患者易出现复发, 对于其复发的影响因素及复发后治疗策略尚无明确的共识[3-5]. 因此, 本研究通过回顾性分析IgG4-AIP 的临床特征、确诊方法、治疗经过及部分复发病例的相关影响因素, 旨在提高对此类疾病的认识和诊疗, 降低其误诊率及复发率.
我们回顾性分析了2018-01/2022-01在武汉协和医院收治的46例确诊IgG4-AIP患者的临床资料. 根据ICDC标准, IgG4-AIP的诊断需综合6个方面, 分别是胰腺实质影像学、胰管影像学、血清学、胰外器官受累、组织学以及对糖皮质激素治疗的反应[2]. 纳入患者经武汉协和医院伦理委员会批准.
1.2.1 数据收集: (1)一般资料: 年龄、性别、年龄、平均病程、质量指数、吸烟史、饮酒史; (2)身体首发症状、临床表现、伴随疾病等; (3)辅助检查: 实验室检查: 免疫球蛋白G4(immunoglobulin G4, IgG4)、免疫球蛋白G(immunoglobulin G, IgG)、免疫球蛋白(globulin, GLB)、碱性磷酸酶(alkaline phosphatase, ALP)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase, GGT)、门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、丙氨酸氨基转移酶(alanine transaminase, ALT)、总胆红素(total bilirubin, TBIL)、淀粉酶(amylase, AMY)、糖类抗原199(carbohydrate antigen199, CA199)、抗核抗体(antinuclear antibody, ANA); 影像学检查: 电子计算机断层扫描(computed tomography, CT)、磁共振成像(magnetic resonance imaging, MRI)、磁共振胰胆管造影(magnetic resonance cholangiopancreatography, MRCP)、正电子发射断层显像/X线计算机体层成像(positron emission tomography/computed tomography, PET/CT、经内镜逆行胰胆管造影术(endoscopic retrograde cholangio-pancreatography, ERCP)、超声内镜检查术(endoscopic ultrasonography, EUS); 组织病理学检查. (1)AIP治疗方法: 本研究纳入患者均参照国际诊治指南进行规范性治疗. 糖皮质激素治疗方案包括两种, 方案一: 按常规糖皮质激素起始剂量40 mg/d, 治疗(2-4) wk后患者病情不同程度好转, 如血生化(肝功能、IgG、IgG4)水平下降、影像学(CT、MRCP、ERCP)好转、症状减轻或消失等, 根据情况每(1-2) wk递减5 mg/wk, 在(2-3) mo的时间内, 剂量逐渐减少到维持剂量, 通常为(5-10) mg/d. 方案二: 按常规糖皮质激素起始剂量40 mg/d, 持续4 wk, 然后逐渐减少5 mg/wk, 直到停止[6]; (2)临床疗效评定: 有效: 患者临床症状及体征较之前有明显减轻, 用药4 wk后AST、ALT、GGT、ALP、IgG4等化验水平下降50%, 或影像学提示胰腺、胰管、胆管等病变情况较前减轻. 无效: 患者临床症状及体征未见明显好转或治疗过程中病情加重.
统计学处理 采用SPSS 16.0统计学软件对数据计量资料以mean±SD或中位数(四分位数间距)表示, 计数资料以例数和百分率表示. 在分析影响因素时, 用Logistic多因素回归模型进行分析.
46例患者中男性42例(91.3%), 女性4例(8.7%), 男女比例为10.5:1; 平均年龄(56.8±12.5)岁; 平均病程(21.6±5.8) mo; 身体质量指数: (22.7±4.7) kg/m2; 有吸烟史患者14例(30.4%); 有饮酒史患者12例(26.0%).
临床表现以梗阻性黄疸最为常见为32例(69.5%). 其余常见症状依次为: 上腹痛31例(67.3%), 腹胀28例(60.8%), 纳差27例(58.6%), 乏力26例(56.5%), 体重下降24例(52.1%), 15例(32.6%)患者合并糖尿病; 14例(30.4%)患者合并胰源性门脉高压; 6例(13.0%)患者合并胃底静脉曲张; 24例(52.1%)患者合并了胰外器官受累, 最常见的胰外为胆管受累16例(34.7%), 淋巴结受累11例(23.9%), 肝脏受累6例(13.0%), 肺脏受累4例(8.7%), 前列腺受累3例(6.5%), 腮腺受累3例(6.5%), 舌下腺受累2例(4.3%), 颌下腺受累1例(2.2%), 肾脏受累1例(2.2%)(表1).
| 项目 | 例数 | 占比(%) | |
| 性别 | 男 | 42 | 91.3 |
| 女 | 4 | 8.7 | |
| 吸烟 | 14 | 30.4 | |
| 饮酒 | 12 | 26 | |
| 临床症状 | 梗阻性黄疸 | 32 | 69.5 |
| 上腹痛 | 31 | 67.3 | |
| 腹胀 | 28 | 60.8 | |
| 纳差 | 27 | 58.6 | |
| 乏力 | 26 | 56.5 | |
| 体重下降 | 24 | 52.1 | |
| 合并症 | 糖尿病 | 15 | 32.6 |
| 胰源性门脉高压 | 14 | 30.4 | |
| 胃底静脉曲张 | 6 | 13.0 | |
| 胰外器官受累 | 胰外器官受累总例数 | 24 | 52.1 |
| 胆管 | 16 | 34.7 | |
| 淋巴结 | 11 | 23.9 | |
| 肝脏 | 6 | 13.0 | |
| 肺脏 | 4 | 8.7 | |
| 前列腺 | 3 | 6.5 | |
| 腮腺 | 3 | 6.5 | |
| 舌下腺 | 2 | 4.3 | |
| 颌下腺 | 1 | 2.2 | |
| 肾脏 | 1 | 2.2 |
42例(91.3%)血清IgG4数值高于正常值, 34例(73.9%)血清IgG4数值高于正常值2倍以上, 平均值为(9.3±6.3) g/L; 18例完善IgG检查的患者中9例(50.0%)升高, 平均值为(16.0±5.3) g/L; 44例完善GLB检查的患者中22例(50.0%)升高; 26例(56.5%)ALP升高; 28例 (60.8%)GGT升高; 29例(63.0%)ALT升高; 24例(52.1%)AST升高; 45例完善TBIL检查的患者中30例(66.6%)升高; 35例完善AMY检查的患者中13例(37.1%)升高; 33例完善CA199检查的患者中7例(21.2%)升高(表2). 20例完善ANA检查的患者中7例(35.0%)阳性.
| 检验项目 | mean±SD/中位数(四分位数间距) | 正常值 | 阳性率(%) |
| IgG4(g/L) | 9.3±6.3 | 0.02-2.00 | 91.3 |
| IgG(g/L) | 16.0±5.3 | 7.0-16.0 | 50.0 |
| GLB(g/L) | 29.7±5.9 | 20.0-30.0 | 50.0 |
| ALP(U/L) | 229.3±192.9 | 50.0-135.0 | 56.5 |
| GGT(U/L) | 206.0(29.0-502.5) | 7.0-45.0 | 60.8 |
| ALT(U/L) | 54.0(22.8-175.0) | 7.0-40.0 | 63.0 |
| AST(U/L) | 56.0(21.8-111.8) | 13.0-35.0 | 52.1 |
| TBIL(umol/L) | 24.4(11.6-91.4) | 3.4-17.1 | 66.6 |
| AMY(U/L) | 66.0(31.3-204.5) | 35.0-135.0 | 37.1 |
| CA199(U/ML) | 16.3(6.4-61.0) | 0-37.0 | 21.2 |
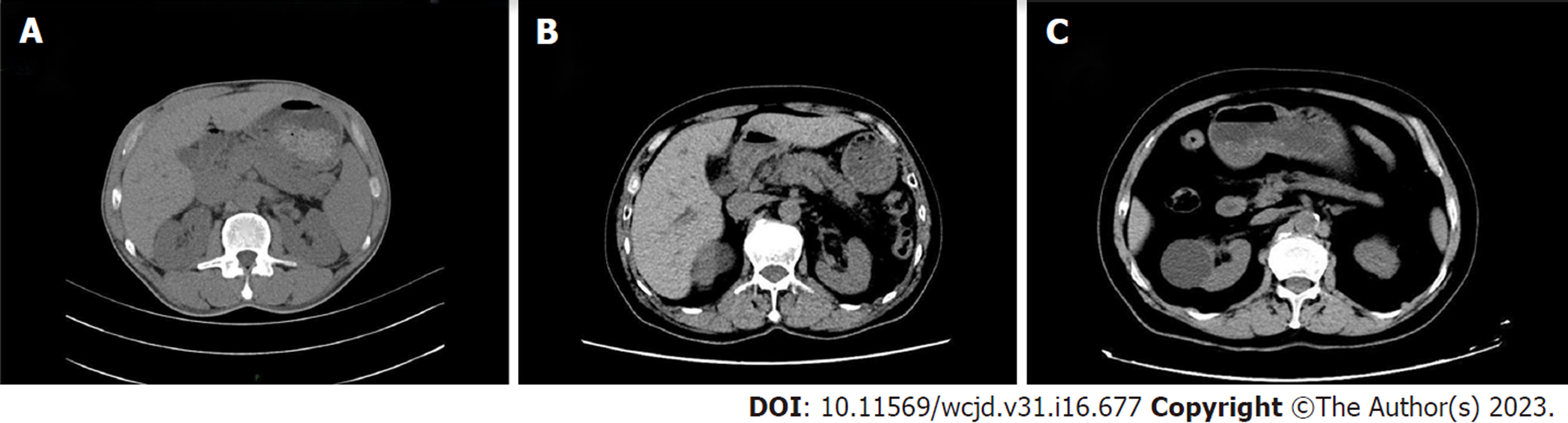
CT/MRI/MRCP: 44例患者行CT/MRI/MRCP检查. 胰腺的典型表现包括胰腺实质弥漫性肿胀, 呈腊肠状23例(52.3%); 胰腺实质局灶肿大19例(43.2%), 其中胰头肿大12例(27.3%), 胰体、胰尾肿大7例(15.9%); 胰腺萎缩2例(4.5%)(图1). 胰管多发狭窄, 粗细欠均匀, 串珠样改变5例(11.3%), 胰管扩张11例(25.0%), 胆总管狭窄15例(34.1%), 肝内外胆管扩张6例(13.6%), 腹膜后纤维化1例(2.3%), 胰源性门脉高压14例(31.8%).
PET/CT: 8例患者行PET-CT检查, 其中5例(62.5%)患者胰腺肿胀, 代谢弥散异常增高; 3例(37.5%)患者胰头明显肿大, 密度弥漫性减低, 代谢弥散增高; 1例(12.5%)患者肺门、肝门、肝胃间隙、胰腺、肠系膜腹膜后、双侧髂内外大淋巴结增大、腮腺、舌下腺、肺小叶间隔代谢增高.
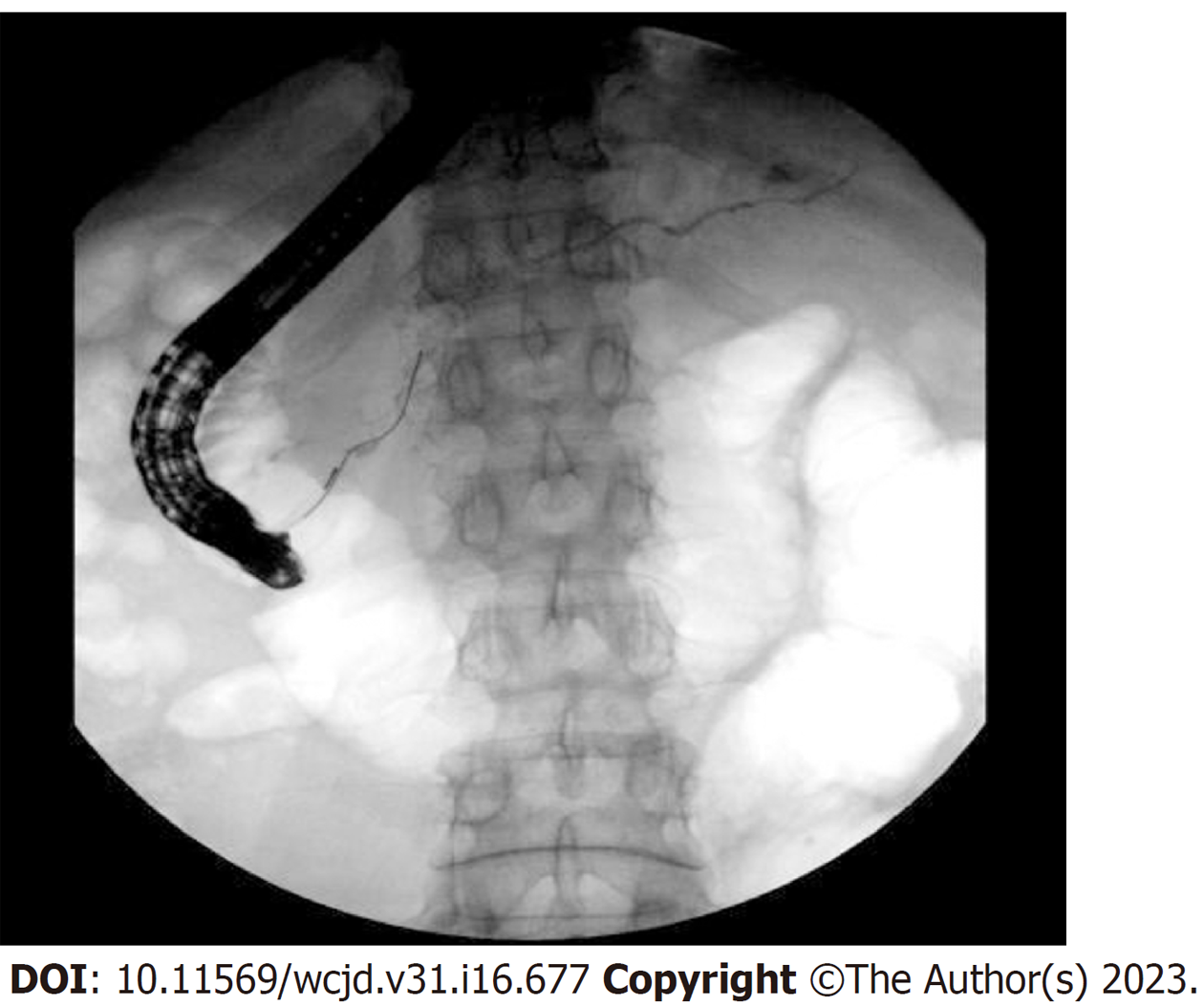
ERCP: 16例患者行ERCP检查, 12例(75%)患者有胆总管狭窄, 6例(37.5%)患者有胰管狭窄(图2).
EUS: 33例患者行EUS检查, 表现为胰腺弥漫性肿胀, 低回声改变24例(72.7%); 局限性低回声病灶8例(24.4%), 其中胰头局限性低回声病灶4例, 胰体局限性低回声病灶1例, 胰尾局限性低回声病灶1例; 胰腺萎缩1例(3.0%). 胆总管管壁增厚, 呈三明治样改变10例; 胰管扩张7例(表3).
| 项目 | 例数 | 占比(%) |
| CT、MRI、MRCP | 44 | |
| 胰腺实质弥漫性肿胀 | 23 | 52.3 |
| 胰腺实质局灶肿大 | 19 | 43.2 |
| 胰头 | 12 | 27.3 |
| 胰体尾 | 7 | 15.9 |
| 胰腺萎缩 | 2 | 4.5 |
| 胰管多发狭窄 | 5 | 11.3 |
| 胰管扩张 | 11 | 25 |
| 胆总管狭窄 | 15 | 34.1 |
| 肝内外胆管扩张 | 6 | 13.6 |
| 腹膜后纤维化 | 1 | 2.3 |
| 胰源性门脉高压 | 14 | 31.8 |
| PET-CT | 8 | |
| 胰腺肿胀, 代谢弥散异常增高 | 5 | 62.5 |
| 胰头明显肿大, 代谢弥散增高 | 3 | 37.5 |
| 肺门、肝门、肝胃间隙、胰腺、肠系膜腹膜后、双侧髂内外大淋巴结增大、腮腺、舌下腺、肺小叶间隔代谢增高 | 1 | 12.5 |
| ERCP | 16 | |
| 胆总管狭窄 | 12 | 75.0 |
| 胰管狭窄 | 6 | 37.5 |
| EUS | 33 | |
| 胰腺弥漫性低回声 | 24 | 72.7 |
| 局限性低回声病灶 | 8 | 24.2 |
| 胰头 | 4 | 12.1 |
| 胰体 | 1 | 3.0 |
| 胰尾 | 1 | 3.0 |
| 胰腺萎缩 | 1 | 3.0 |
| 胆总管狭窄 | 10 | 30.3 |
| 胰管扩张 | 7 | 21.2 |
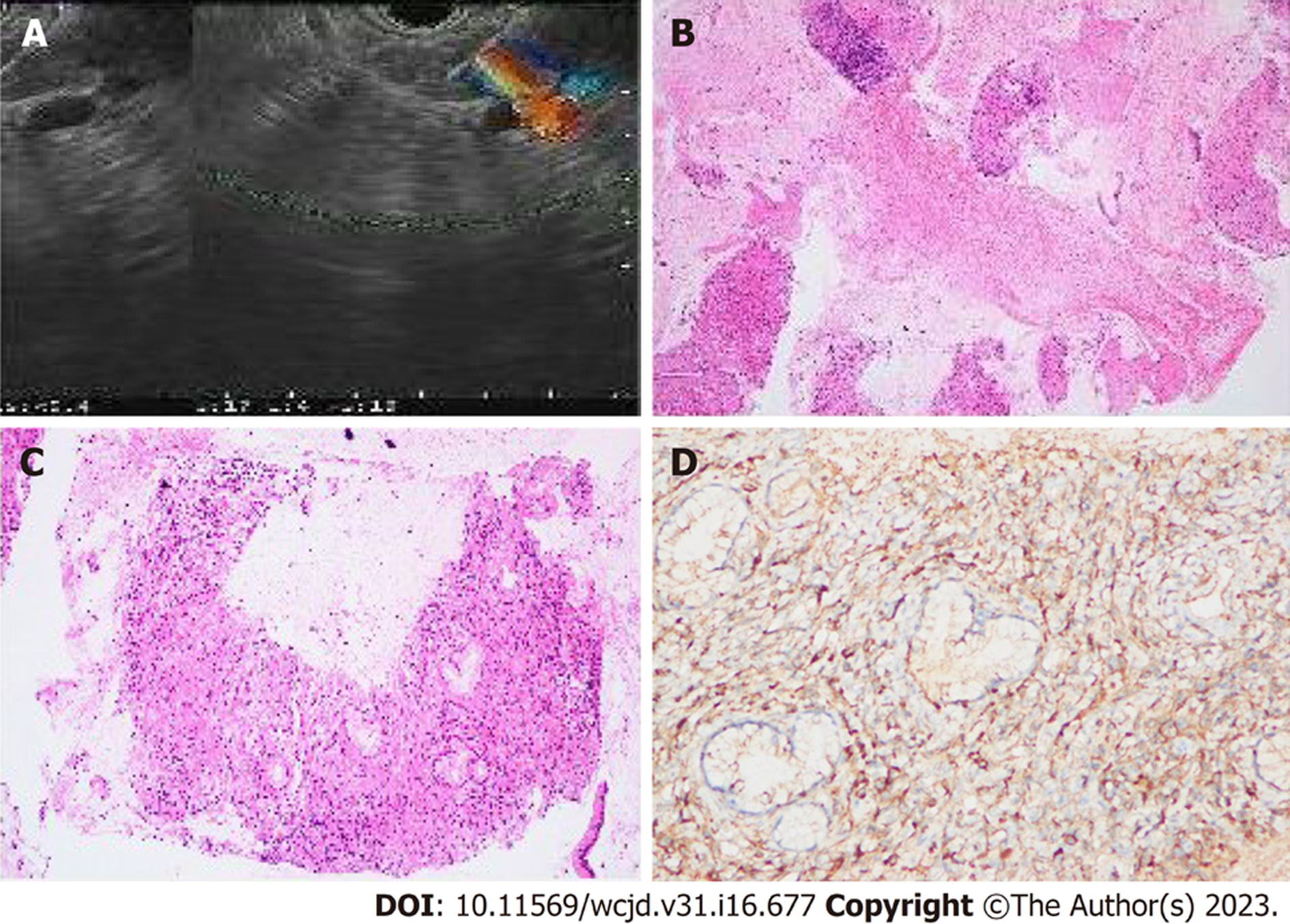
共31例患者获得胰腺组织病理学检查, 25例(80.6%)患者行超声内镜引导下胰腺穿刺活检(endoscopic ultrasound-guided fine-needle aspiration biopsy, EUS-FNA), 5例(16.1%)患者行胰腺切除手术, 1例(3.2%)患者行剖腹探查术中胰腺穿刺术(表4). 另外, 1例患者行经皮肝脏穿刺术获得肝脏组织病理学检查. 28例(90.3%)患者胰腺组织病理示淋巴细胞、浆细胞浸润, 20例(64.5%)患者胰腺组织病理示纤维组织增生, 9例(29%)患者胰腺组织病理示胰腺腺泡萎缩(图3), 16例(51.6%)患者胰腺组织病理免疫组化示大量IgG4阳性浆细胞(大于10个每高倍镜视野), 2例(6.5%)患者胰腺组织病理示闭塞性静脉炎(表5). 1例肝脏穿刺患者表现为纤维组织增生, 淋巴细胞浸润, 大量IgG4阳性细胞(大于10个每高倍镜视野).
| 项目 | 例数 | 占比(%) |
| EUS-FNA | 25 | 80.6 |
| 胰腺切除手术 | 5 | 16.1 |
| 胰腺穿刺术 | 1 | 3.2 |
| 项目 | 例数 | 占比(%) |
| 淋巴细胞、浆细胞浸润 | 28 | 90.3 |
| 纤维组织增生 | 20 | 64.5 |
| 胰腺腺泡萎缩 | 9 | 29.0 |
| 大量IgG4阳性浆细胞 | 16 | 51.6 |
| 闭塞性静脉炎 | 2 | 6.5 |
38例(82.6%)患者接受了糖皮质激素治疗, 其中, 24例(52.2%)患者接受单纯糖皮质激素治疗, 6例(13.0%)患者接受糖皮质激素及ERCP胆管支架置入术, 2例(4.4%)患者接受糖皮质激素及ERCP胰管支架及胆管支架置入术, 1例(2.2%)患者接受糖皮质激素及经皮肝穿刺胆道引流术(percutaneous transhepatic cholangial drainage, PTCD), 1例(2.2%)患者接受糖皮质激素及PTCD及ERCP胆管支架置入术治疗, 3例(10.9%)患者接受糖皮质激素及胰腺切除手术, 1例(2.2%)患者接受糖皮质激素及免疫抑制剂治疗. 38例患者糖皮质激素治疗后均获得临床缓解. 29例患者病情好转后停用糖皮质激素, 9例患者接受糖皮质激素长期小剂量维持治疗. 另外, 3例(6.5%)患者接受单纯ERCP胰管支架及胆管支架置入术, 1例(2.2%)患者接受单纯ERCP胰管支架置入术, 2例(4.4%)患者接受单纯胰腺切除手术, 1例(2.2%)患者接受保肝、减黄治疗, 1例(2.2%)患者未接受治疗(表6).
| 项目 | 例数 | 占比(%) | |
| 糖皮质激素治疗 | 38 | 82.6 | |
| 单纯糖皮质激素 | 24 | 52.2 | |
| 糖皮质激素+ERCP胆管支架置入 | 6 | 13.0 | |
| 糖皮质激素+ERCP胰管支架及胆管支架置入 | 2 | 4.4 | |
| 糖皮质激素+PTCD | 1 | 2.2 | |
| 糖皮质激素+PTCD+ERCP胆管支架置入 | 1 | 2.2 | |
| 糖皮质激素+胰腺切除手术 | 3 | 6.5 | |
| 糖皮质激素+免疫抑制剂 | 1 | 2.2 | |
| ERCP胰管支架及胆管支架置入 | 3 | 6.5 | |
| ERCP胰管支架置入 | 1 | 2.2 | |
| 单纯胰腺切除手术 | 2 | 4.4 | |
| 保肝、减黄治疗 | 1 | 2.2 | |
| 未治疗 | 1 | 2.2 |
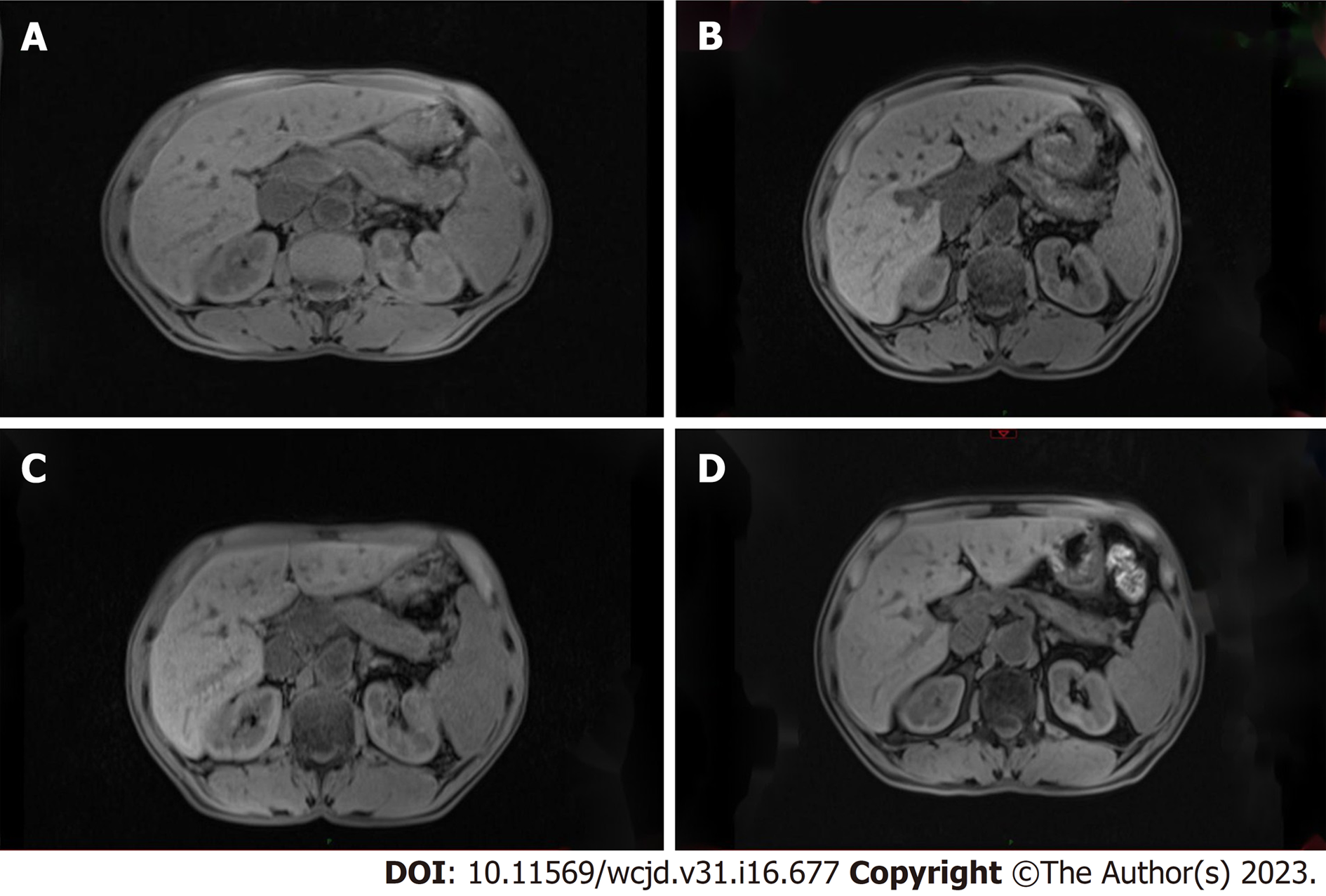
38例糖皮质激素治疗诱导缓解的患者中有14例(36.8%)患者复发, 其中10例(71.4%)患者在减停糖皮质激素后复发, 患者停用激素后至复发的时长在(1-22) mo之间, 另外4例(28.6%)患者在小剂量激素维持治疗期间复发. 复发表现分别为: 5例复发黄疸, 3例复发急性胰腺炎, 2例复发腹痛, 2例复发腹胀, 1例胰腺外器官复发(腮腺、舌下腺、淋巴结肿大, 肺小叶间隔), 1例患者复发IgG4明显升高. 复发患者13例(92.8%)再次应用糖皮质激素治疗或糖皮质激素加量治疗, 1例(7.2%)患者加用免疫抑制剂, 均再次达到缓解(图4).
我们将影响因素包括梗阻性黄疸、体重下降、腹痛、糖尿病、胰外器官受累、硬化性胆管炎、胰源性门脉高压、急性胰腺炎、自身免疫性肝病、血清IgG4大于2倍、弥漫型、局灶型、小剂量糖皮质激素维持治疗纳入建立Logistic 回归模型, 回归过程采用逐步后退法, 以进行自变量的选择和剔除, 结果显示胰源性门脉高压(OR: 7.399, 95%CI: 1.279-42.788, P<0.05)、胰外器官受累(OR: 6.264, 95%CI: 1.144-34.304, P<0.05)、小剂量糖皮质激素维持治疗(OR: 0.199, 95%CI: 0.035-1.132, P<0.05)被保留入回归模型中(表7).
| 分组影响因素 | OR | 95%CI | P |
| 胰源性门脉高压 | 7.399 | 1.279-42.788 | 0.025 |
| 胰外器官受累 | 6.264 | 1.144-34.304 | 0.034 |
| 小剂量糖皮质激素维持治疗 | 0.199 | 0.035-1.132 | 0.043 |
AIP是一种临床罕见疾病. 1961年有研究发表了第一例关于AIP的报告[7]. 2001年日本首次发现一部分AIP患者IgG4水平升高, 认为其中一种是IgG4相关性AIP[8]. 近年来越来越多关于IgG4-AIP的研究出现, 中国是胰腺疾病高发地区, 有相对较多的IgG4-AIP 患者. 2008年中国发表了第一篇关于AIP的临床研究报告[9]. 在以往中国、日本、意大利的研究中男性患者分别占86.2%、74.6%、66.9%, 患者的平均年龄分别为55.7岁、68.1岁、62.5岁[10-12]. 本研究中男性患者的比例为91.3%高于日本、意大利及以往中国的研究结果. 本研究中患者平均年龄56.8岁, 较日本和意大利患者更年轻, 与以往中国的研究结果相似. 与之前的研究类似, 本研究中最常见的临床表现为梗阻性黄疸(69.5%)、上腹痛(67.3%)、腹胀(60.8%)、纳差(58.6%)、乏力(56.5%)、体重下降(52.1%)[10-12].
2012年中国的研究显示IgG4-AIP的合并症以慢性胆囊炎(47.22%)和糖尿病(16.67%)最常见[10]. 日本研究报告显示在AIP患者最常见的合并症是糖尿病(43%-68%)[13,14]. 本研究中最常见的合并症也是糖尿病(32.6%), 同时发现合并胰源性门脉高压(30.4%)和胃底静脉曲张(13%)的患者也较多. 意大利研究显示胰外最常见受累器官依次是胆管(39.6%)、唾液腺(7.5%)、肾(11.3%)、淋巴结(9.4%)、腹膜后纤维化(1.9%)、肺(7.5%)[12]. 本研究中常见胰外受累器官为胆管(34.7%)、淋巴结(23.9%)、肝脏(13.0%)、唾液腺(13.0%)、肺脏(8.7%)、前列腺(6.5%)、肾脏(2.2%).
血清学检查对IgG4-AIP的诊断及治疗后随访的复查具有重要临床意义. IgG4是IgG4-AIP的重要诊断依据之一, 在中国的研究中84.21%患者血清IgG4水平大于2倍正常上限, 日本的研究结果示84.5%患者血清IgG4水平升高, 58.5%患者IgG升高, 32.6%患者ANA呈阳性[11,15]. 本研究中73.9%患者血清IgG4水平显著升高且均大于2倍正常上限, 50%患者IgG升高, 35%患者%ANA呈阳性.
影像学检查(CT/MRI/MRCP)在IgG4-AIP的诊断中同样起着重要作用. 40%-60%患者可以见到IgG4-AIP的影像学典型特征, 为胰腺实质弥漫性增大[1]. 本研究中52.3%患者表现为胰腺实质弥漫性增大, 与以往研究结果结果类似. 本研究中43.2%患者表现为胰腺实质局灶肿大. 在另一项中国的研究中41.6%患者表现为胰腺实质局灶肿大. 局灶型IgG4-AIP患者容易被误诊为胰腺癌, 从而行胰腺切除手术[16,17]. 胰管多发狭窄也是诊断IgG4-AIP的重要依据, 可以用来鉴别IgG4-AIP和胰腺癌. 在以往的研究16.0%患者胰管狭窄伴明显的上游扩张(管腔宽度>5 mm)[18]. 45.5%的IgG4-AIP患者胰管扩张[10]. 在我们的研究中, 11.3%的患者显示胰管多发狭窄, 25%的患者胰管扩张. 全身PET/CT有助于检查IgG4-AIP相关的胰外器官受累的情况, 并监测疾病的活动, 但对鉴别胰腺恶性肿瘤与IgG4-AIP并无根本性作用[19]. 本研究中患者PET/CT表现为患者胰腺代谢弥散异常增高与胰腺癌的表现并无差别, 但发现1例患者肺门、肝门、肝胃间隙、肠系膜腹膜后、双侧髂内外大淋巴结增大、腮腺、舌下腺、肺小叶间隔代谢增高, 应考虑IgG4-AIP胰外器官受累表现. ERCP提示大约80-90%的IgG4-AIP患者表现为胆总管不同程度的狭窄[20]. 本研究中75%患者有胆总管狭窄, 上游胆管扩张的胆管受累典型改变. 尽管ERCP可以准确检查出AIP胆管的特征性改变, 但是ERCP通常只适用于需要介入治疗胰胆管梗阻的病例[21]. AIP的EUS检查典型特征为胰腺弥漫性低回声改变, 胰腺局灶性低回声肿块, 胰腺萎缩[22]. 本研究中72.7%的患者EUS检查表现为胰腺弥漫性低回声改变, 24.2%的患者表现为局灶性低回声肿块, 3.0%的患者表现为胰腺萎缩. EUS的优势是兼有诊断及穿刺活检的作用, EUS-FNA是获得胰腺组织病理学的常用及重要手段[23].
胰腺组织学获取方式多样, 包括EUS-FNA、手术切除活检、经皮胰腺穿刺活检、ERCP活检等方式. EUS-FNA是一种检测胰腺肿块高度敏感的方法, 及时检查有时可以避免不必要的胰腺外科手术[16,17]. 本研究中80.6%的患者采用EUS-FNA的方式获得胰腺组织. 本研究中90.3%患者病理示淋巴细胞、浆细胞浸润, 51.6%患者示大量IgG4阳性浆细胞(大于10个每高倍镜视野), 64.5%患者病理示纤维组织增生, 6.5%患者病理示闭塞性静脉炎. 有研究表明在慢性胰腺炎和胰腺癌中也可见少量的IgG4阳性细胞, 而大量的IgG4阳性细胞浸润是IgG4-AIP所特有的[24].
IgG4-AIP的主要治疗药物是糖皮质激素. 根据来自10个国家的1064例AIP患者的大型多中心研究发现, 99% IgG4-AIP患者用糖皮质激素治疗后可达到临床缓解, 71% IgG4-AIP伴黄疸患者需要短期内置入胰胆道支架. IgG4-AIP患者接受糖皮质激素治疗后的复发率高达31%. 对于复发病例重新开始用糖皮质激素治疗或者加用免疫抑制剂治疗, 如硫唑嘌呤可以有效地诱导缓解[3,25]. 本研究中82.6%患者接受了糖皮质激素治疗, 均达到临床缓解. 28.3% IgG4-AIP伴黄疸患者需要置入胰胆道支架. 36.8%患者接受糖皮质激素治疗后出现复发, 同样呈高复发性. 大多数(71.4%)是在停用糖皮质激素后复发. 92.8%复发患者重新或者加量使用糖皮质激素治疗, 7.2%复发患者加用免疫抑制剂治疗, 可再次达到缓解.
我们研究发现Logistic多因素回归分析示复发的危险因素是胰源性门脉高压和胰外器官受累, 小剂量糖皮质激素维持治疗可以预防复发. 一项2019年的Meta分析研究发现血清IgG4水平续升高、胰外器官受累是IgG4-AIP复发的危险因素. 糖皮质激素维持治疗超过1年可以降低复发的风险[26]. 日本多项研究表明血清IgG4水平持续升高、胰腺弥漫增大、硬化性胆管炎伴梗阻性黄疸可能是IgG4-AIP复发的影响因素. 糖皮质激素维持治疗IgG4-AIP患者的复发率明显低于糖皮质激素治疗后停药IgG4-AIP患者的复发率[25,27,28]. 有日本专家建议使用低剂量(2.5-7.5) mg/d糖皮质激素至少维持治疗3年, 但目前维持治疗的时间仍然存在争议[6]. 本研究中患者停用激素后至复发的时长在(1-22) mo之间, 那么我们建议低剂量的糖皮质激素至少需维持22 mo.
总之, IgG4-AIP是一种IgG4相关性疾病, 它的临床表现缺乏特异性, 临床上有时容易被误诊为胰腺癌. IgG4-AIP的主要血清学特点为IgG4升高. IgG4-AIP的影像学检查主要表现为胰腺弥漫肿胀或局部肿大, 伴胆胰管狭窄. IgG4-AIP患者可通过EUS-FNA的方式安全有效地获得组织病理. 典型的IgG4-AIP病理学检查示胰腺纤维组织增生, 淋巴细胞、浆细胞浸润, 胰腺腺泡萎缩病理改变, 免疫组化法示大量IgG4阳性浆细胞. 糖皮质激素治疗IgG4-AIP有效, 但在停药后容易复发. Logistic多因素回归分析示复发的危险因素是胰源性门脉高压和胰外器官受累, 小剂量糖皮质激素维持治疗可以预防复发. 因此, 我们建议对有复发危险因素的患者进行小剂量糖皮质激素维持治疗.
但本研究仍具有一定局限性. 首先, 本研究纳入的少部分IgG4-AIP病例未获得病理结果, IgG4水平1-2倍正常上线可能会与其他类型 AIP病例出现混淆; 其次, 本研究对纳入的IgG4-AIP病例最低随访时间12 mo, 这可能导致存在没有足够时间检测到复发的病例; 最后, 本研究对纳入IgG4-AIP病例数量有限可能会影响部分研究结果. 在今后的工作中, 我们将继续优化队列, 扩大样本量, 延长随访时间, 获得更多更可靠的临床资料, 以期对这一类疾病的诊治获得更多的临床经验.
IgG4相关性自身免疫性胰腺炎(IgG4 related autoimmune pancreatitis, IgG4-AIP)与组织/血清IgG4升高密切相关, 被认为是IgG4相关性疾病的胰腺表现. 目前对该疾病的认识仍然不足. 总结我国IgG4-AIP的临床特征及治疗预后, 对疾病的早期诊断及治疗具有重要意义.
本研究收集确诊IgG4-AIP患者的临床资料, 分析疾病的临床特征, 探索疾病复发的危险因素, 以提高对IgG4-AIP的全面认识, 为疾病的诊疗提供帮助.
通过回顾性分析IgG4-AIP的临床特征、确诊方法、治疗经过及部分复发病例的相关影响因素, 旨在加强对疾病的了解, 可以为医生提供诊断依据, 对于制定治疗计划和预测预后也具有指导意义.
本研究分析了IgG4-AIP的临床表现、组织病理学、胰腺影像学结果、治疗方案、复发的危险因素. 计量资料以mean±SD或中位数(四分位数间距)表示, 计数资料以例数和百分率表示. 在分析影响因素时, 用Logistic多因素回归模型进行分析.
本研究达到实验目的. 研究发现IgG4-AIP患者男性患者较女性多, 梗阻性黄疸为IgG4-AIP最常见的临床表现,最常见的胰外受累器官为胆管, 大多数IgG4-AIP患者血清IgG4数值高于正常值. 胰腺的影像学典型表现包括胰腺实质弥漫性肿胀、胰腺实质局灶肿大、胰腺萎缩. 超声内镜引导下胰腺穿刺活检是最常用获取胰腺病理组织的方式. 胰腺组织病理免疫组化示大量IgG4阳性浆细胞. 糖皮质激素是治疗IgG4-AIP的主要药物, 糖皮质激素治疗缓解后复发的危险因素是胰源性门脉高压和胰外器官受累, 小剂量糖皮质激素维持治疗可以预防疾病复发.
IgG4-AIP的临床表现缺乏特异性, 易与胰腺癌相混淆, EUS-FNA的方式获得胰腺组织病理活检是鉴别诊断的关键. 糖皮质激素治疗IgG4-AIP有显著效果, 但在停药后容易复发. 复发的危险因素是胰源性门脉高压和胰外器官受累, 小剂量糖皮质激素维持治疗可以预防复发. 因此, 我们建议对有复发危险因素的患者进行小剂量糖皮质激素维持治疗. 我们建议小剂量糖皮质激素至少需维持22 mo.
本研究为单中心研究, 所纳入的样本量有限, 并不是100%病例获得组织学样本,随访时间不够长这可能导致存在没有足够时间检测到复发的病例. 在今后的工作中, 我们将继续优化队列, 扩大样本量, 延长随访时间, 获得更多更可靠的临床资料, 以期对这一类疾病的诊治获得更多的临床经验.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C, C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Omiyale AO. Autoimmune pancreatitis. Gland Surg. 2016;5:318-326. [PubMed] [DOI] |
| 2. | Shimosegawa T, Chari ST, Frulloni L, Kamisawa T, Kawa S, Mino-Kenudson M, Kim MH, Klöppel G, Lerch MM, Löhr M, Notohara K, Okazaki K, Schneider A, Zhang L; International Association of Pancreatology. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology. Pancreas. 2011;40:352-358. [PubMed] [DOI] |
| 3. | Hart PA, Kamisawa T, Brugge WR, Chung JB, Culver EL, Czakó L, Frulloni L, Go VL, Gress TM, Kim MH, Kawa S, Lee KT, Lerch MM, Liao WC, Löhr M, Okazaki K, Ryu JK, Schleinitz N, Shimizu K, Shimosegawa T, Soetikno R, Webster G, Yadav D, Zen Y, Chari ST. Long-term outcomes of autoimmune pancreatitis: a multicentre, international analysis. Gut. 2013;62:1771-1776. [PubMed] [DOI] |
| 4. | Okazaki K, Chari ST, Frulloni L, Lerch MM, Kamisawa T, Kawa S, Kim MH, Lévy P, Masamune A, Webster G, Shimosegawa T. International consensus for the treatment of autoimmune pancreatitis. Pancreatology. 2017;17:1-6. [PubMed] [DOI] |
| 5. | Kubota K, Watanabe S, Uchiyama T, Kato S, Sekino Y, Suzuki K, Mawatari H, Iida H, Endo H, Fujita K, Yoneda M, Takahashi H, Kirikoshi H, Kobayashi N, Saito S, Sugimori K, Hisatomi K, Matsuhashi N, Sato H, Tanida E, Sakaguchi T, Fujisawa N, Nakajima A. Factors predictive of relapse and spontaneous remission of autoimmune pancreatitis patients treated/not treated with corticosteroids. J Gastroenterol. 2011;46:834-842. [PubMed] [DOI] |
| 6. | Okazaki K, Kawa S, Kamisawa T, Ikeura T, Itoi T, Ito T, Inui K, Irisawa A, Uchida K, Ohara H, Kubota K, Kodama Y, Shimizu K, Tonozuka R, Nakazawa T, Nishino T, Notohara K, Fujinaga Y, Masamune A, Yamamoto H, Watanabe T, Nishiyama T, Kawano M, Shiratori K, Shimosegawa T, Takeyama Y; Members of the Research Committee for IgG4-related Disease supported by the Ministry of Health, Labour, Welfare of Japan, Japan Pancreas Society. Amendment of the Japanese consensus guidelines for autoimmune pancreatitis, 2020. J Gastroenterol. 2022;57:225-245. [PubMed] [DOI] |
| 7. | SARLES H, SARLES JC, MURATORE R, GUIEN C. Chronic inflammatory sclerosis of the pancreas--an autonomous pancreatic disease? Am J Dig Dis. 1961;6:688-698. [PubMed] [DOI] |
| 8. | Hamano H, Kawa S, Horiuchi A, Unno H, Furuya N, Akamatsu T, Fukushima M, Nikaido T, Nakayama K, Usuda N, Kiyosawa K. High serum IgG4 concentrations in patients with sclerosing pancreatitis. N Engl J Med. 2001;344:732-738. [PubMed] [DOI] |
| 9. | Song Y, Liu QD, Zhou NX, Zhang WZ, Wang DJ. Diagnosis and management of autoimmune pancreatitis: experience from China. World J Gastroenterol. 2008;14:601-606. [PubMed] [DOI] |
| 10. | Zhang X, Zhang X, Li W, Jiang L, Zhang X, Guo Y, Wang X. Clinical analysis of 36 cases of autoimmune pancreatitis in China. PLoS One. 2012;7:e44808. [PubMed] [DOI] |
| 11. | Masamune A, Kikuta K, Hamada S, Tsuji I, Takeyama Y, Shimosegawa T, Okazaki K; Collaborators. Nationwide epidemiological survey of autoimmune pancreatitis in Japan in 2016. J Gastroenterol. 2020;55:462-470. [PubMed] [DOI] |
| 12. | Barresi L, Tacelli M, Crinò SF, Attili F, Petrone MC, De Nucci G, Carrara S, Manfredi G, Capurso G, De Angelis CG, Crocellà L, Fantin A, Dore MF, Garribba AT, Tarantino I, De Pretis N, Pagliari D, Rossi G, Manes G, Preatoni P, Barbuscio I, Tuzzolino F, Traina M, Frulloni L, Costamagna G, Arcidiacono PG, Buscarini E, Pezzilli R; Italian Association of Hospital Gastroenterologists and Endoscopists (AIGO), Italian Association for the Study of the Pancreas (AISP). Multicentric Italian survey on daily practice for autoimmune pancreatitis: Clinical data, diagnosis, treatment, and evolution toward pancreatic insufficiency. United European Gastroenterol J. 2020;8:705-715. [PubMed] [DOI] |
| 13. | Okazaki K, Uchida K, Chiba T. Recent concept of autoimmune-related pancreatitis. J Gastroenterol. 2001;36:293-302. [PubMed] [DOI] |
| 14. | Okazaki K. Autoimmune pancreatitis: etiology, pathogenesis, clinical findings and treatment. The Japanese experience. JOP. 2005;6:89-96. [PubMed] |
| 15. | 王 苗苗, 王 亚丹, 李 莉, 吴 静, 魏 南, 王 沧海, 郭 春梅, 宿 慧, 刘 红. 自身免疫性胰腺炎19例临床特征分析并文献回顾. 世界华人消化杂志. 2021;29:1230-1236. [DOI] |
| 16. | Eloubeidi MA, Chen VK, Eltoum IA, Jhala D, Chhieng DC, Jhala N, Vickers SM, Wilcox CM. Endoscopic ultrasound-guided fine needle aspiration biopsy of patients with suspected pancreatic cancer: diagnostic accuracy and acute and 30-day complications. Am J Gastroenterol. 2003;98:2663-2668. [PubMed] [DOI] |
| 17. | Eloubeidi MA, Jhala D, Chhieng DC, Chen VK, Eltoum I, Vickers S, Mel Wilcox C, Jhala N. Yield of endoscopic ultrasound-guided fine-needle aspiration biopsy in patients with suspected pancreatic carcinoma. Cancer. 2003;99:285-292. [PubMed] [DOI] |
| 18. | Xin L, He YX, Zhu XF, Zhang QH, Hu LH, Zou DW, Jin ZD, Chang XJ, Zheng JM, Zuo CJ, Shao CW, Jin G, Liao Z, Li ZS. Diagnosis and treatment of autoimmune pancreatitis: experience with 100 patients. Hepatobiliary Pancreat Dis Int. 2014;13:642-648. [PubMed] [DOI] |
| 19. | Nakajo M, Jinnouchi S, Fukukura Y, Tanabe H, Tateno R, Nakajo M. The efficacy of whole-body FDG-PET or PET/CT for autoimmune pancreatitis and associated extrapancreatic autoimmune lesions. Eur J Nucl Med Mol Imaging. 2007;34:2088-2095. [PubMed] [DOI] |
| 20. | Horiuchi A, Kawa S, Hamano H, Hayama M, Ota H, Kiyosawa K. ERCP features in 27 patients with autoimmune pancreatitis. Gastrointest Endosc. 2002;55:494-499. [PubMed] [DOI] |
| 21. | Kamisawa T, Tu Y, Egawa N, Tsuruta K, Okamoto A, Kodama M, Kamata N. Can MRCP replace ERCP for the diagnosis of autoimmune pancreatitis? Abdom Imaging. 2009;34:381-384. [PubMed] [DOI] |
| 22. | Farrell JJ, Garber J, Sahani D, Brugge WR. EUS findings in patients with autoimmune pancreatitis. Gastrointest Endosc. 2004;60:927-936. [PubMed] [DOI] |
| 23. | Levy MJ, Reddy RP, Wiersema MJ, Smyrk TC, Clain JE, Harewood GC, Pearson RK, Rajan E, Topazian MD, Yusuf TE, Chari ST, Petersen BT. EUS-guided trucut biopsy in establishing autoimmune pancreatitis as the cause of obstructive jaundice. Gastrointest Endosc. 2005;61:467-472. [PubMed] [DOI] |
| 24. | Jani N, Buxbaum J. Autoimmune pancreatitis and cholangitis. World J Gastrointest Pharmacol Ther. 2015;6:199-206. [PubMed] [DOI] |
| 25. | Kamisawa T, Shimosegawa T, Okazaki K, Nishino T, Watanabe H, Kanno A, Okumura F, Nishikawa T, Kobayashi K, Ichiya T, Takatori H, Yamakita K, Kubota K, Hamano H, Okamura K, Hirano K, Ito T, Ko SB, Omata M. Standard steroid treatment for autoimmune pancreatitis. Gut. 2009;58:1504-1507. [PubMed] [DOI] |
| 26. | Tacelli M, Celsa C, Magro B, Barresi L, Guastella S, Capurso G, Frulloni L, Cabibbo G, Cammà C. Risk Factors for Rate of Relapse and Effects of Steroid Maintenance Therapy in Patients With Autoimmune Pancreatitis: Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2019;17:1061-1072.e8. [PubMed] [DOI] |
| 27. | Nishimori I, Tamakoshi A, Otsuki M; Research Committee on Intractable Diseases of the Pancreas, Ministry of Health, Labour, and Welfare of Japan. Prevalence of autoimmune pancreatitis in Japan from a nationwide survey in 2002. J Gastroenterol. 2007;42 Suppl 18:6-8. [PubMed] [DOI] |
| 28. | Ito T, Nishimori I, Inoue N, Kawabe K, Gibo J, Arita Y, Okazaki K, Takayanagi R, Otsuki M. Treatment for autoimmune pancreatitis: consensus on the treatment for patients with autoimmune pancreatitis in Japan. J Gastroenterol. 2007;42 Suppl 18:50-58. [PubMed] [DOI] |