修回日期: 2023-07-23
接受日期: 2023-08-03
在线出版日期: 2023-08-08
结直肠癌是我国高发恶性肿瘤之一, 化疗时晚期结直肠癌患者的主要治疗方式, 对会带来毒副反应, 降低患者生活质量. 因患者毒副反应的发生与其免疫等因素相关, 联合注射用卡瑞利珠单抗治疗方案是否能通过影响程序性细胞死亡蛋白1(programmed cell death protein 1, PD-1)/程序性死亡配体1(programmed death ligand 1, PD-L1)信号通路对患者病情产生积极影响的研究具有重要意义.
探讨注射用卡瑞利珠单抗改善晚期结直肠癌免疫功能的可能机制, 并分析其对PD-1/PD-L1信号通路的调控作用.
采用前瞻性随机对照组研究, 选取2019-01/2021-10本院收治的127例晚期结直肠癌患者为研究对象, 采用电脑随机数字法分为对照组(n = 63)、研究组(n = 64). 对照组予以奥沙利铂+卡培他滨, 研究组予以奥沙利铂+卡培他滨+注射用卡瑞利珠单抗治疗. 统计两组疗效、毒副反应、生存状况及治疗前后PD-1/PD-L1信号通路、肿瘤标志物[糖类抗原125(carbohydrate antigen 125, CA125)、糖类抗原242(carbohydrate antigen 242, CA242)、胸苷激酶1(thymidine kinase 1, TK1)、癌胚抗原(carcinoembryonic antigen, CEA)]、营养状态指标[白蛋白(albumin, ALB)、血红蛋白(hemoglobin, HGB)、前白蛋白(prealbumin, PA)、转铁蛋白(transferrin, TF)、主观全面评定量表(patient-generated subjective global assessment, PG-SGA)].
治疗4个周期后, 研究组疾病控制率高于对照组(P<0.05); 治疗4个周期后研究组PD-1、PD-L1 mRNA和蛋白水平低于对照组(P<0.05); 治疗4个周期后研究组血清ALB、TF、PA水平及PG-SGA评分高于对照组(P<0.05); 治疗4个周期后研究组血清CA125、CA242、TK1、CEA低于对照组(P<0.05); 两组毒副反应发生率、生存率比较差异无统计学意义.
注射用卡瑞利珠单抗联合奥沙利铂、卡培他滨治疗晚期结直肠癌可提高疾病控制率, 可能通过抑制PD-1/PD-L1信号通路活化, 减小化疗药物对机体营养状态的影响, 进而改善机体免疫功能, 且具有一定安全性.
核心提要: 本文探究奥沙利铂、卡培他滨联合卡瑞利珠单抗对晚期结直肠癌患者疾病进展的影响. 研究结果发现, 联合卡瑞利珠单抗可改善晚期结直肠癌患者营养状态, 提升身体体能, 其作用机制可能是通过介导程序性细胞死亡蛋白1(programmed cell death protein 1, PD-1)/程序性死亡配体1(programmed death ligand 1, PD-L1)信号通路, 进而调节PD-1、PD-L1表达水平, 发挥改善免疫、抑制癌细胞增殖的作用.
引文著录: 杜海旭, 洪春霞, 喻彤. 卡瑞利珠单抗对晚期结直肠癌免疫功能及PD-1/PD-L1信号通路的近期疗效. 世界华人消化杂志 2023; 31(15): 647-654
Revised: July 23, 2023
Accepted: August 3, 2023
Published online: August 8, 2023
Colorectal cancer is one of the most prevalent malignant tumours in China, and chemotherapy is the main treatment modality for patients with advanced colorectal cancer, which results in toxic side effects and reduces patients' quality of life. Since the occurrence of toxic side effects is related to patients' immunity and other factors, it is important to study whether the combined injection of carrilizumab with chemotherapy can positively affect patients' conditions by influencing the programmed cell death protein 1 (PD-1)/programmed death ligand 1 (PD-L1) signalling pathway.
To investigate the possible mechanism of carrilizumab for injection to improve immune function in advanced colorectal cancer, and to analyze its regulatory effect on the PD-1/ PD-L1 signaling pathway.
A prospective randomised controlled study (RCT) was performed to include 127 patients with advanced colorectal cancer admitted to our hospital from January 2019 to October 2021, and they were divided into a control group (n = 63) and a study group (n = 64) using the computerised random number method. The control group was given oxaliplatin + capecitabine, and the study group was given oxaliplatin + capecitabine + carrilizumab for injection. The therapeutic effect, toxicity and side effects, survival status, PD-1/PD-L1 signaling pathway, tumor markers [carbohydrate antigen 125 (CA125), carbohydrate antigen 242 (CA242), thymidine kinase 1 (TK1), and carcinoembryonic antigen (CEA)], and nutritional status indicators [albumin (ALB), hemoglobin (HGB), prealbumin (PA), transferrin (TF), and patient-generated subjective global assessment (PG-SGA)] before and after treatment were compared between the two groups.
After four cycles of treatment, the disease control rate of the study group was higher than that of the control group (P < 0.05); the mRNA and protein levels of PD-1 and PD-L1 in the study group were lower than those in the control group (P < 0.05); serum ALB, PA, and TF levels and PG-SGA scores in the study group were higher than those in the control group (P < 0.05); and serum CA125, CA242, TK1, and CEA in the study group were lower than those in the control group (P < 0.05). There was no significant difference in the incidence of toxic and side effects or survival rate between the two groups (P > 0.05).
Camrelizumab for injection combined with oxaliplatin and capecitabine in the treatment of advanced colorectal cancer can improve the disease control rate, may reduce the impact of chemotherapy drugs on the nutritional status of the body by inhibiting the activation of PD-1/PD-L1 signal pathway, thus improving the immune function of the body, and has good safety.
- Citation: Du HX, Hong CX, Yu T. Carrilizumab for treatment of advanced colorectal cancer: Short-term efficacy and impact on immune function and PD-1/PD-L1 signaling pathway. Shijie Huaren Xiaohua Zazhi 2023; 31(15): 647-654
- URL: https://www.wjgnet.com/1009-3079/full/v31/i15/647.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i15.647
结直肠癌早期症状较为隐匿导致其确诊时已处于晚期(相当一部分病人确诊时已属进展期). 临床常采用化疗进行治疗, 对于化疗约有50%患者存在原发性耐药, 且治疗难度较大[1,2]. 目前临床常采用的奥沙利铂联合卡培他滨联合治疗晚期结直肠癌, 虽一定程度上可杀伤肿瘤细胞、淋巴免疫细胞, 但也会损害机体免疫功能[3,4]. 因而寻找新型干预方案成为临床研究重点. 卡瑞利珠单抗属于程序性细胞死亡蛋白1(programmed cell death protein 1, PD-1)单克隆抗体, 可靶向结合T细胞、B淋巴细胞, 阻断其与癌细胞之间的相互作用, 抑制PD-1介导的T细胞免疫抑制作用, 进而发挥抗肿瘤作用[5]. PD-1/程序性死亡配体1(programmed death ligand 1, PD-L1)信号通路可调节机体免疫反应, 促进肿瘤细胞逃避免疫监视[6]. 目前卡瑞利珠单抗调节晚期结直肠癌患者免疫功能的作用机制尚未完全明确, 基于此, 本研究主要探讨注射用卡瑞利珠单抗对PD-1/PD-L1信号通路的调控作用, 分析其对营养状态指标、肿瘤标志物及生存状况的影响, 为临床治疗提供科学指导.
采用前瞻性随机对照组研究, 选取2019-01/2021-10本院收治的127例晚期结直肠癌患者为研究对象, 采用电脑随机数字法分为对照组63例、研究组64例. 对照组: 男44例、女19例, 年龄54-63(58.64±1.36)岁, 体质量指数(身体质量指数)21-24(22.28±0.28) kg/m2, 原发部位: 左半结直肠25例、右半结直肠38例; 病理分化程度: 低分化27例、中分化26例、高分化10例. 研究组: 男46例、女18例, 年龄54-64(59.01±1.45)岁, 体质量指数20-24(22.19±0.42) kg/m2, 原发部位: 左半结直肠28例、右半结直肠36例; 病理分化程度: 低分化32例、中分化21例、高分化11例. 两组临床资料均衡可比(P>0.05). 本研究经本院伦理委员会批准.
纳入标准: 符合结直肠癌诊断标准[7], 初诊者且经病理检查确诊; TNM分期为Ⅳ期[8]; 初诊者; 既往接受奥沙利铂联合卡培他滨化疗方案+西妥昔单抗; 存在MSI-H; Karnofsky功能状态评分≥70分; 预期生存时间≥6 mo; 邻近组织器官无受累; 体能状态量表(ECOG)体质状况评分为0-1分; 心电图无明显异常; 签署知情同意书. 排除标准: 合并血液循环系统功能障碍者; 合并严重感染性疾病、自身免疫性疾病者; 既往接受抗PD-1/PD-L1单抗治疗; 既往遗传性或获得性出血病史者; 需长期服用皮质类激素治疗者; 伴有胃肠道出血、胸腔积液者.
对照组予以奥沙利铂(哈药集团生物工程有限公司, 国药准字H20133094)+卡培他滨(江苏恒瑞医药股份有限公司, 国药准字H20133365)治疗: 第1 d静脉滴注奥沙利铂130 mg/m2, 于2 h内滴注完毕; 第1-14 d口服卡培他滨1000 mg/m2, 2次/d, 以3 wk为1个周期, 共治疗4个周期[9]. 研究组予以奥沙利铂+卡培他滨+注射用卡瑞利珠单抗(苏州盛迪亚生物医药有限公司, 国药准字S20190027)治疗. 注射用卡瑞利珠单抗200 mg/次, 首次间隔4 wk后, 随后每2 wk给药1次, 以3 wk为1个周期, 共治疗4个周期, 奥沙利铂+卡培他滨治疗方案同对照组. 治疗4个周期结束后, 两组均采用注射用卡瑞利珠单抗维持治疗, 直至疾病进展或出现不可耐受毒性.
1.3.1 临床疗效[10]: 治疗4个周期后评价疗效, 完全缓解(complete slow release, CR): 靶病灶消失、无新靶病灶出现, 维持时间≥4 wk; 部分缓解(partial remission, PR): 靶病灶最大径之和减少≥30%, 维持时间≥4 wk; 疾病稳定(disease stability, SD): 靶病灶最大径之和减少<30%或增加<20%; 疾病进展(disease progression, PD): 不符合上述标准; 疾病控制率(disease control rate, DCR)为CR、PR、SD比例之和. 客观缓解率(objective remission rate, ORR)为CR、PR比例之和. 以DCR作为疗效判定依据.
1.3.2 实时荧光定量PCR(qRT-PCR)检测血清PD-1、PD-L1 mRNA表达水平: 采集治疗前、治疗4个周期后两组研究对象外肘静脉血5 mL, 采用淋巴细胞分离液分离单个核细胞, 参照Trizol试剂(美国Invitrogen公司)提取细胞总RNA, 按照反转录试剂盒(北京天根生化公司)将RNA反转录合成cDNA, 采用SYBR Green染料法进行定量(北京天根生化公司), 以GAPDH为内参, 使用StepOnePlus实时荧光定量PCR仪(美国Applied Biosystems公司)检测PD-1、PD-L1 mRNA表达水平. PD-1正向引物5'-ATCTCACCGCTCGTTTCCT-3', 反向引物5'-CACTGCAAACCT CGGTGATG-3'; PD-L1正向引物5'-GGTAATCCGTTTCCCTTGA-3', 反向引物5'-CCTAAT TTATGAGCCTATC-3'; GAPDH正向引物5'-GGAGCGAGATCCCTCCAAAA T-3', 反向引物5'-GGCTGTTGTCATACTTCTCATGG-3', 引物购自上海生工公司.
1.3.3 免疫组化法检测PD-1、PD-L1蛋白水平: 采用活检技术取癌组织标本并制备石蜡切片, 脱水后在柠檬酸盐溶液中20 min, 滴加3%过氧化氢溶液后反应25 min(37 ℃), 滴加山羊血清反应15 min, 分别加入PD-1(稀释比1:150)、PD-L1一抗(稀释比1:200), 4 ℃冰箱中孵育过夜, 加入二抗辣根过氧化物酶标记山羊抗兔IgG, 37 ℃下反应2 h, 滴加DAB显色液, 清洗后采用苏木素复染, 滴加二甲苯进行透明处理, 用中性树脂进行封片, 显微镜下观察阳性细胞(棕色圆圈状), 采用Image-Pro Plus6.0图像分析软件分析阳性部位, 采用光密度值作为蛋白表达水平, 所有抗体购自美国Abcam公司.
1.4.1 比较两组治疗前后营养状态指标: 分别于治疗前、治疗4个周期后采集两组研究对象空腹静脉血10 mL, 分为2份(5 mL/份), 3300 r/min转速离心10 min分离上清液, 采用酶联免疫法(enzyme-linked immunoassay, ELISA)检测血清白蛋白(albumin, ALB)、血红蛋白(hemoglobin, HGB)、前白蛋白(prealbumin, PA)、转铁蛋白(transferrin, TF)水平, 美国Epitope Diagnostics公司提供检测试剂盒. 主观全面评定量表(patient-generated subjective global assessment, PG-SGA)包括自评内容(0-5分)、医疗测评(0-9分), 分值与营养状况呈负相关[11].
1.4.2 比较两组治疗前后肿瘤标志物水平: 采用化学发光免疫法检测两组治疗前、治疗4个周期后血清糖类抗原125(carbohydrate antigen 125, CA125)、糖类抗原242(carbohydrate antigen 242, CA242)、胸苷激酶1(thymidine kinase 1, TK1)、癌胚抗原(carcinoembryonic antigen, CEA)水平(上海酶联生物).
1.4.3 比较两组治疗后毒副反应: 比较两组治疗毒副反应[12], 依据毒性分级标准评价毒副反应, 分为Ⅰ、Ⅱ、Ⅲ、Ⅳ级, 级别与毒副反应严重程度呈正相关[13].
1.4.4 比较两组生存情况: 两组治疗结束后均接受为期1年门诊或电话随访, 统计两组生存情况.
统计学处理 采用SPSS 25.0软件进行统计学分析, 计量资料采用(mean±SD)表示, 两组间比较采用独立样本t检验; 计数资料采用n(%)表示, 采用χ2检验; 采用Kaplan-Meier生存曲线进行生存分析, 组间比较采用Log-rank检验, 以P<0.05为差异有统计学意义.
治疗4个周期后, 研究组DCR高于对照组(P<0.05). 见表1.
| 组别 | CR | PR | SD | PD | DCR | ORR |
| 研究组(n = 64) | 1(1.56) | 13(20.31) | 21(32.81) | 29(45.31) | 35(54.69) | 14(21.88) |
| 对照组(n = 63) | 0(0.00) | 10(15.87) | 13(20.63) | 40(63.49) | 23(36.51) | 10(15.87) |
| χ2 | 4.229 | 0.746 | ||||
| P | 0.040 | 0.388 |
治疗前两组PD-1/PD-L1信号通路比较mRNA及蛋白表达情况差异无统计学意义; 治疗4个周期后研究组PD-1、PD-L1 mRNA和蛋白均低于对照组(P<0.05). 见表2.
| 时间 | 组别 | PD-1 | PD-L1 | ||
| mRNA | 蛋白 | mRNA | 蛋白 | ||
| 治疗前 | 研究组(n = 64) | 0.85±0.24 | 0.80±0.20 | 0.96±0.31 | 0.73±0.27 |
| 对照组(n = 63) | 0.88±0.21 | 0.82±0.22 | 0.94±0.34 | 0.76±0.25 | |
| t | 0.749 | 0.536 | 0.346 | 0.649 | |
| P | 0.455 | 0.593 | 0.730 | 0.517 | |
| 治疗4个周期后 | 研究组(n = 64) | 0.78±0.34 | 0.71±0.25 | 0.88±0.32 | 0.68±0.24 |
| 对照组(n = 63) | 0.96±0.33 | 0.86±0.23 | 1.05±0.35 | 0.87±0.29 | |
| t | 3.027 | 3.517 | 2.857 | 4.025 | |
| P | 0.003 | 0.001 | 0.005 | 0.000 | |
治疗4个周期后研究组血清ALB、TF、PA水平及PG-SGA评分高于对照组(P<0.05). 见表3.
| 时间 | 组别 | ALB(g/L) | TF(g/L) | PA(g/L) | PG-SGA(分) |
| 治疗前 | 研究组(n = 64) | 35.52±4.41 | 2.50±0.41 | 270.02±68.68 | 7.10±0.56 |
| 对照组(n = 63) | 34.70±5.54 | 2.63±0.33 | 269.79±73.72 | 6.89±0.73 | |
| t | 0.924 | 1.967 | 0.018 | 1.821 | |
| P | 0.357 | 0.051 | 0.986 | 0.071 | |
| 治疗4个周期后 | 研究组(n = 64) | 33.89±4.46 | 2.56±0.38 | 250.51±63.38 | 6.65±0.51 |
| 对照组(n = 63) | 29.31±4.02 | 1.89±0.31 | 182.26±45.52 | 6.12±0.58 | |
| t | 6.076 | 10.878 | 6.961 | 5.471 | |
| P | 0.000 | 0.000 | 0.000 | 0.000 |
治疗4个周期后研究组血清CA125、CA242、TK1、CEA均低于对照组(P<0.05). 见表4.
| 时间 | 组别 | CA125(U/mL) | CA242(IU/mL) | TK1(pmol/L) | CEA(ng/mL) |
| 治疗前 | 研究组(n = 64) | 36.70±4.48 | 78.78±6.69 | 3.22±0.48 | 230.28±33.43 |
| 对照组(n = 63) | 37.56±3.95 | 76.95±7.42 | 3.35±0.41 | 228.98±35.76 | |
| t | 1.147 | 1.460 | 1.640 | 0.212 | |
| P | 0.254 | 0.147 | 0.104 | 0.833 | |
| 治疗4个周期后 | 研究组(n = 64) | 21.22±3.56 | 42.42±4.47 | 1.20±0.23 | 112.25±16.63 |
| 对照组(n = 63) | 25.64±3.78 | 48.51±5.36 | 1.98±0.30 | 167.74±23.34 | |
| t | 6.785 | 6.958 | 16.459 | 15.449 | |
| P | 0.000 | 0.000 | 0.000 | 0.000 |
两组毒副反应发生率比较差异无统计学意义. 见表5.
| 组别 | 神经毒性 | 手足综合征 | 胃肠道反应 | 骨髓抑制 | 反应性毛细血管增生症 | |||||
| Ⅰ-Ⅱ | Ⅲ-Ⅳ | Ⅰ-Ⅱ | Ⅲ-Ⅳ | Ⅰ-Ⅱ | Ⅲ-Ⅳ | Ⅰ-Ⅱ | Ⅲ-Ⅳ | Ⅰ-Ⅱ | Ⅲ-Ⅳ | |
| 研究组(n = 64) | 3(4.69) | 1(1.56) | 2(3.13) | 0(0.00) | 5(7.81) | 6(9.38) | 8(12.50) | 7(10.94) | 8(12.50) | 5(7.81) |
| 对照组(n = 63) | 5(7.94) | 4(6.35) | 7(11.11) | 3(4.76) | 10(15.87) | 9(14.29) | 12(19.05) | 9(14.28) | 12(19.05) | 8(12.70) |
| χ2 | 0.568 | 1.923 | 3.075 | 3.121 | 1.980 | 0.735 | 1.026 | 0.323 | 1.026 | 0.825 |
| P | 0.451 | 0.165 | 0.079 | 0.077 | 0.159 | 0.391 | 0.311 | 0.570 | 0.311 | 0.364 |
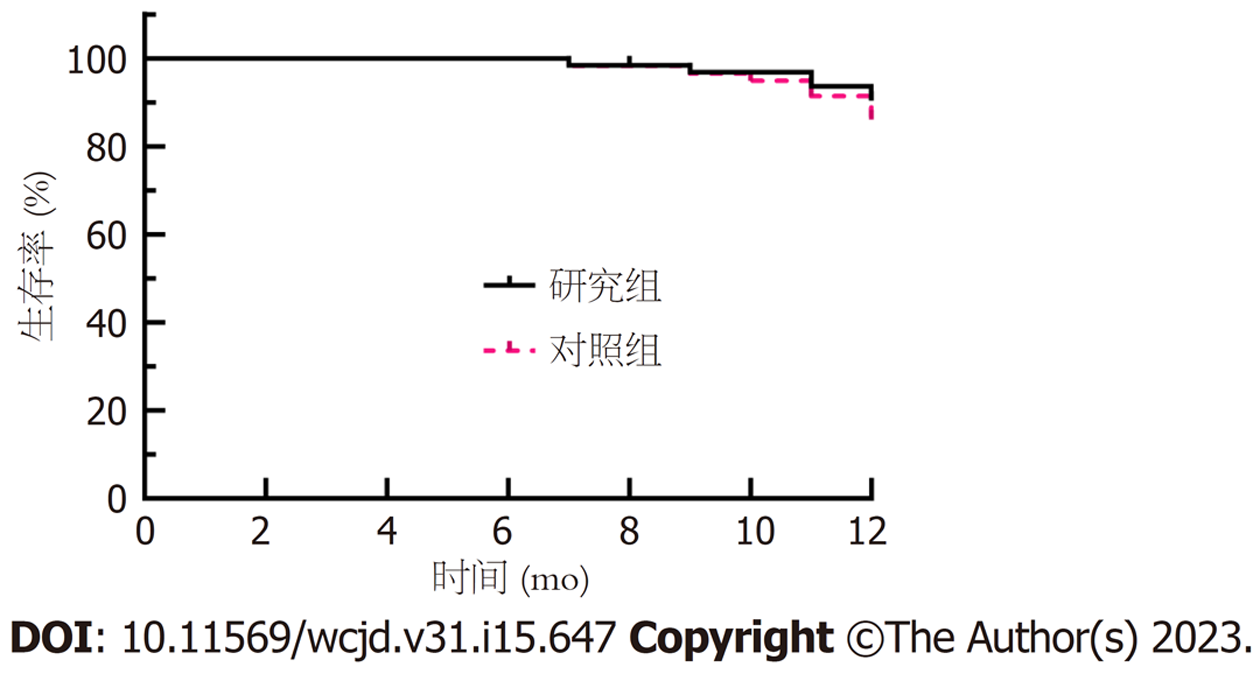
两组均接受为期1年门诊或电话随访, 研究组和对照组分别失访4例、3例, 生存率分别为90.00%(54/60)、86.67%(52/60), 组间比较差异无统计学意义(χ2 = 0.323, P = 0.570). 见图1.
结直肠癌发生机制可能与机体免疫功能失调有关, 化疗可杀伤肿瘤细胞, 还可杀伤淋巴细胞, 以此降低机体免疫功能, 而免疫系统的状况与治疗获益、预后密切相关[14,15].
奥沙利铂可促使烷化结合物生成, 破坏DNA复制过程, 引起DNA损伤, 促进肿瘤细胞凋亡, 进而杀灭肿瘤细胞, 并可刺激T细胞产生, 增强肿瘤细胞免疫原性表达; 卡培他滨可干扰蛋白质合成, 抑制细胞分化, 增强T细胞, 但单药化疗存在较大局限性[16,17]. 卡瑞利珠单抗可进肿瘤组织微环境、抗肿瘤效应改善, 并可增强对PD-1/PD-L1抑制剂的免疫应答, 调节机体免疫功能[18-20]. 但关于其具体作用机制仍需进一步探究. 本研究结果显示, 治疗4个周期后研究组DCR高于对照组, 提示在奥沙利铂+卡培他滨基础上联合注射用卡瑞利珠单抗, 可提高临床疗效. 分析原因为奥沙利铂、卡培他滨可诱导免疫原性细胞凋亡, 卡瑞利珠单抗可通过调节免疫机制, 抑制肿瘤生长, 增强机体细胞免疫功能, 联合应用可发挥协同增效作用. PD-1、PD-L1在肿瘤细胞中呈高表达, 可降低机体免疫应答, 激活T细胞介导免疫应答, 阻断肿瘤细胞免疫逃逸, 抑制PD-1可提高化疗敏感性[21,22]. PD-1、PD-L1可降低T淋巴细胞免疫杀伤功能, 降低机体免疫水平, 促进肿瘤生长和侵袭, 可能作为抗肿瘤免疫应答的潜在机制[23,24]. 本研究结果显示, 研究组治疗4个周期后PD-1、PD-L1 mRNA和蛋白均低于对照组, 提示奥沙利铂+卡培他滨+注射用卡瑞利珠单抗联合治疗可能通过抑制PD-1/PD-L1信号通路活化, 改善机体免疫功能. 由此推测卡瑞利珠单抗可作用于PD-1/PD-L1信号通路, 启动肿瘤细胞免疫监视, 维持T细胞动态平衡、免疫微环境稳态, 恢复免疫细胞抗肿瘤作用, 减弱结直肠癌免疫逃逸, 抑制癌细胞增殖, 增强淋巴细胞免疫活性, 进而提高免疫功能.
晚期结直肠癌患者恶病质消耗、胃肠功能减退, 可引起营养不良, 而ALB、TF、PA水平及PG-SGA评分属于营养状态指标, 且与免疫功能密切相关[25,26]. 本研究结果显示, 研究组治疗4个周期后血清ALB、TF、PA水平及PG-SGA评分高于对照组, 提示卡瑞利珠单抗对机体营养状态的影响较小. 分析其可能为奥沙利铂+卡培他滨治疗后各指标较治疗前变化更为异常, 加用注射用卡瑞利珠单抗可调节肠道功能, 促进营养物质吸收, 减弱化疗药物对机体营养状态的不利作用. CA125、CA242、TK1、CEA属于肿瘤标志物, 其在结直肠癌中呈高表达, 且与肿瘤转移风险呈正相关[27-29]. 本研究结果显示, 研究组治疗4个周期后血清CA125、CA242、TK1、CEA水平低于对照组, 提示卡瑞利珠单抗联合奥沙利铂+卡培他滨协同抗肿瘤作用更显著, 可减少肿瘤负荷, 因而治疗后肿瘤标志物水平下降程度更为明显. 既往研究显示卡瑞利珠单抗治疗后可能发生不良反应, 但大部分具有可逆性[30]. 本研究分析不同治疗方案安全性, 结果发现两组毒副反应发生率、生存率比较差异无统计学意义, 提示在奥沙利铂+卡培他滨基础上, 加用卡瑞利珠单抗治疗后, 生存率并未提高, 不良反应并未增加, 这可能与本研究纳入样本量较少有关.
综上所述, 注射用卡瑞利珠单抗联合奥沙利铂、卡培他滨治疗晚期结直肠癌近期临床疗效确切, 可能通过与抑制PD-1/PD-L1信号通路活化, 减小化疗药物对营.
晚期结直肠癌是常见癌症, 化疗是一线治疗方案, 但会对患者免疫功能造成不良影响. 卡瑞利珠单抗是程序性死亡受体1(programmed cell death protein 1, PD-1)抑制剂中的一种, 其联合化疗的方案是目前新型治疗方案之一.
关于联合卡瑞利珠单抗治疗是否能通过调节通路改善晚期结直肠患者的治疗效果及身体状态的研究报道较少. 本研究结果有助于为卡瑞利珠单抗治疗方案的选择提供数据支持.
证实卡瑞利珠单抗可通过调控PD-1/程序性死亡配体1(programmed death ligand 1, PD-L1)通路影响机体免疫功能, 进而对患者病情及身体状态产生积极影响, 以期为卡瑞利珠单抗的临床应用提出理论依据.
本研究区以本院收治的127例晚期结直肠癌患者为研究对象, 通过观察并记录治疗前、治疗后患者病灶改善情况、毒副反应、全面评定量表评分, 并采用实时荧光定量PCR测定PD-1、PD-L1 mRNA表达水平, 采用免疫组化法检测PD-1、PD-L1蛋白水平, 采用酶联免疫法检测血清白蛋白、血红蛋白、前白蛋白、转铁蛋白水平, 采用化学发光免疫法检测糖类抗原125、糖类抗原242、胸苷激酶、癌胚抗原水平, 同时门诊或电话随访1年, 证实化疗联合卡瑞利珠单抗的应用效果.
经卡瑞利珠单抗联合化疗治疗后, 患者肿瘤标志物水平得以降低, 营养水平得以提升, 生理状态得以改善. 明确卡瑞利珠单抗联合化疗方案的良好治疗效果.
本研究证实了联合卡瑞利珠单抗治疗可提升疾病控制率, 阐明了卡瑞利珠单抗可通过影响PD-1/PD-L1通路发挥改善机体免疫及影响状态的作用.
未来还需开展大样本量研究, 并进行长期乃至终生随访机制明确联合治疗的远期疗效, 观察该方案是否能显著延长患者生活期限、改善生活质量. 此外, 今后可继续开展动物实验深入探究免疫功能与毒副反应及癌细胞增殖的具体调控机制.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): D, D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Li J, Ma X, Chakravarti D, Shalapour S, DePinho RA. Genetic and biological hallmarks of colorectal cancer. Genes Dev. 2021;35:787-820. [PubMed] [DOI] |
| 2. | Lin JF, Hu PS, Wang YY, Tan YT, Yu K, Liao K, Wu QN, Li T, Meng Q, Lin JZ, Liu ZX, Pu HY, Ju HQ, Xu RH, Qiu MZ. Phosphorylated NFS1 weakens oxaliplatin-based chemosensitivity of colorectal cancer by preventing PANoptosis. Signal Transduct Target Ther. 2022;7:54. [PubMed] [DOI] |
| 3. | Zhang X, Wu T, Cai X, Dong J, Xia C, Zhou Y, Ding R, Yang R, Tan J, Zhang L, Zhang Y, Wang Y, Dong C, Li Y. Neoadjuvant Immunotherapy for MSI-H/dMMR Locally Advanced Colorectal Cancer: New Strategies and Unveiled Opportunities. Front Immunol. 2022;13:795972. [PubMed] [DOI] |
| 4. | Boku N, Ryu MH, Kato K, Chung HC, Minashi K, Lee KW, Cho H, Kang WK, Komatsu Y, Tsuda M, Yamaguchi K, Hara H, Fumita S, Azuma M, Chen LT, Kang YK. Safety and efficacy of nivolumab in combination with S-1/capecitabine plus oxaliplatin in patients with previously untreated, unresectable, advanced, or recurrent gastric/gastroesophageal junction cancer: interim results of a randomized, phase II trial (ATTRACTION-4). Ann Oncol. 2019;30:250-258. [PubMed] [DOI] |
| 5. | Lin Z, Cai M, Zhang P, Li G, Liu T, Li X, Cai K, Nie X, Wang J, Liu J, Liu H, Zhang W, Gao J, Wu C, Wang L, Fan J, Zhang L, Wang Z, Hou Z, Ma C, Yang K, Wu G, Tao K, Zhang T. Phase II, single-arm trial of preoperative short-course radiotherapy followed by chemotherapy and camrelizumab in locally advanced rectal cancer. J Immunother Cancer. 2021;9. [PubMed] [DOI] |
| 6. | Payandeh Z, Khalili S, Somi MH, Mard-Soltani M, Baghbanzadeh A, Hajiasgharzadeh K, Samadi N, Baradaran B. PD-1/PD-L1-dependent immune response in colorectal cancer. J Cell Physiol. 2020;235:5461-5475. [PubMed] [DOI] |
| 8. | Shida D, Kanemitsu Y, Hamaguchi T, Shimada Y. Introducing the eighth edition of the tumor-node-metastasis classification as relevant to colorectal cancer, anal cancer and appendiceal cancer: a comparison study with the seventh edition of the tumor-node-metastasis and the Japanese Classification of Colorectal, Appendiceal, and Anal Carcinoma. Jpn J Clin Oncol. 2019;49:321-328. [PubMed] [DOI] |
| 10. | 任 秀宝, 于 津浦. 肿瘤免疫治疗疗效评价的新标准. 中国肿瘤生物治疗杂志. 2011;18:351-354. [DOI] |
| 11. | Zhang Z, Wan Z, Zhu Y, Zhang L, Zhang L, Wan H. Prevalence of malnutrition comparing NRS2002, MUST, and PG-SGA with the GLIM criteria in adults with cancer: A multi-center study. Nutrition. 2021;83:111072. [PubMed] [DOI] |
| 12. | Kawasumi K, Kawano Y, Kujirai A, Mano Y, Matsui R, Maeda-Minami A, Yamamoto Y, Negishi K, Shimada S, Yamaguchi M, Nagata M, Aoyama T. Risk Factors Associated With Unplanned Acute Care in Outpatient Chemotherapy With Oral Anticancer Drugs as Monotherapy or Combination Therapy With Injectable Anticancer Drugs. Anticancer Res. 2021;41:5827-5834. [PubMed] [DOI] |
| 13. | Trotti A, Colevas AD, Setser A, Rusch V, Jaques D, Budach V, Langer C, Murphy B, Cumberlin R, Coleman CN, Rubin P. CTCAE v3.0: development of a comprehensive grading system for the adverse effects of cancer treatment. Semin Radiat Oncol. 2003;13:176-181. [PubMed] [DOI] |
| 14. | Lin A, Zhang J, Luo P. Crosstalk Between the MSI Status and Tumor Microenvironment in Colorectal Cancer. Front Immunol. 2020;11:2039. [PubMed] [DOI] |
| 15. | Sahin IH, Akce M, Alese O, Shaib W, Lesinski GB, El-Rayes B, Wu C. Immune checkpoint inhibitors for the treatment of MSI-H/MMR-D colorectal cancer and a perspective on resistance mechanisms. Br J Cancer. 2019;121:809-818. [PubMed] [DOI] |
| 16. | Al-Batran SE, Homann N, Pauligk C, Goetze TO, Meiler J, Kasper S, Kopp HG, Mayer F, Haag GM, Luley K, Lindig U, Schmiegel W, Pohl M, Stoehlmacher J, Folprecht G, Probst S, Prasnikar N, Fischbach W, Mahlberg R, Trojan J, Koenigsmann M, Martens UM, Thuss-Patience P, Egger M, Block A, Heinemann V, Illerhaus G, Moehler M, Schenk M, Kullmann F, Behringer DM, Heike M, Pink D, Teschendorf C, Löhr C, Bernhard H, Schuch G, Rethwisch V, von Weikersthal LF, Hartmann JT, Kneba M, Daum S, Schulmann K, Weniger J, Belle S, Gaiser T, Oduncu FS, Güntner M, Hozaeel W, Reichart A, Jäger E, Kraus T, Mönig S, Bechstein WO, Schuler M, Schmalenberg H, Hofheinz RD; FLOT4-AIO Investigators. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. Lancet. 2019;393:1948-1957. [PubMed] [DOI] |
| 17. | Hall PS, Swinson D, Cairns DA, Waters JS, Petty R, Allmark C, Ruddock S, Falk S, Wadsley J, Roy R, Tillett T, Nicoll J, Cummins S, Mano J, Grumett S, Stokes Z, Kamposioras KV, Chatterjee A, Garcia A, Waddell T, Guptal K, Maisey N, Khan M, Dent J, Lord S, Crossley A, Katona E, Marshall H, Grabsch HI, Velikova G, Ow PL, Handforth C, Howard H, Seymour MT; GO2 Trial Investigators. Efficacy of Reduced-Intensity Chemotherapy With Oxaliplatin and Capecitabine on Quality of Life and Cancer Control Among Older and Frail Patients With Advanced Gastroesophageal Cancer: The GO2 Phase 3 Randomized Clinical Trial. JAMA Oncol. 2021;7:869-877. [PubMed] [DOI] |
| 18. | Chen X, Wu X, Wu H, Gu Y, Shao Y, Shao Q, Zhu F, Li X, Qian X, Hu J, Zhao F, Mao W, Sun J, Wang J, Han G, Li C, Xia Y, Seesaha PK, Zhu D, Li H, Zhang J, Wang G, Wang X, Li X, Shu Y. Camrelizumab plus gemcitabine and oxaliplatin (GEMOX) in patients with advanced biliary tract cancer: a single-arm, open-label, phase II trial. J Immunother Cancer. 2020;8. [PubMed] [DOI] |
| 19. | Liu J, Wang Y, Tian Z, Lin Y, Li H, Zhu Z, Liu Q, Su S, Zeng Y, Jia W, Yang Y, Xu S, Yao H, Jiang W, Song E. Multicenter phase II trial of Camrelizumab combined with Apatinib and Eribulin in heavily pretreated patients with advanced triple-negative breast cancer. Nat Commun. 2022;13:3011. [PubMed] [DOI] |
| 20. | Liu J, Liu Q, Li Y, Li Q, Su F, Yao H, Su S, Wang Q, Jin L, Wang Y, Lau WY, Jiang Z, Song E. Efficacy and safety of camrelizumab combined with apatinib in advanced triple-negative breast cancer: an open-label phase II trial. J Immunother Cancer. 2020;8. [PubMed] [DOI] |
| 21. | Yaghoubi N, Soltani A, Ghazvini K, Hassanian SM, Hashemy SI. PD-1/ PD-L1 blockade as a novel treatment for colorectal cancer. Biomed Pharmacother. 2019;110:312-318. [PubMed] [DOI] |
| 22. | Liu C, Liu R, Wang B, Lian J, Yao Y, Sun H, Zhang C, Fang L, Guan X, Shi J, Han S, Zhan F, Luo S, Yao Y, Zheng T, Zhang Y. Blocking IL-17A enhances tumor response to anti-PD-1 immunotherapy in microsatellite stable colorectal cancer. J Immunother Cancer. 2021;9. [PubMed] [DOI] |
| 23. | Hsieh RC, Krishnan S, Wu RC, Boda AR, Liu A, Winkler M, Hsu WH, Lin SH, Hung MC, Chan LC, Bhanu KR, Srinivasamani A, De Azevedo RA, Chou YC, DePinho RA, Gubin M, Vilar E, Chen CH, Slay R, Jayaprakash P, Hegde SM, Hartley G, Lea ST, Prasad R, Morrow B, Couillault CA, Steiner M, Wang CC, Venkatesulu BP, Taniguchi C, Kim YSB, Chen J, Rudqvist NP, Curran MA. ATR-mediated CD47 and PD-L1 up-regulation restricts radiotherapy-induced immune priming and abscopal responses in colorectal cancer. Sci Immunol. 2022;7:eabl9330. [PubMed] [DOI] |
| 24. | Oliveira AF, Bretes L, Furtado I. Review of PD-1/PD-L1 Inhibitors in Metastatic dMMR/MSI-H Colorectal Cancer. Front Oncol. 2019;9:396. [PubMed] [DOI] |
| 25. | Xu M, Liu Y, Xue T, Ye Q, Xiang J, Liu L, Yan B. Prognostic Implication of Preoperative Serum Albumin to Carcinoembryonic Antigen Ratio in Colorectal Cancer Patients. Technol Cancer Res Treat. 2022;21:15330338221078645. [PubMed] [DOI] |
| 26. | Seufferlein T, Ettrich TJ, Menzler S, Messmann H, Kleber G, Zipprich A, Frank-Gleich S, Algül H, Metter K, Odemar F, Heuer T, Hügle U, Behrens R, Berger AW, Scholl C, Schneider KL, Perkhofer L, Rohlmann F, Muche R, Stingl JC. Green Tea Extract to Prevent Colorectal Adenomas, Results of a Randomized, Placebo-Controlled Clinical Trial. Am J Gastroenterol. 2022;117:884-894. [PubMed] [DOI] |
| 27. | Björkman K, Mustonen H, Kaprio T, Kekki H, Pettersson K, Haglund C, Böckelman C. CA125: A superior prognostic biomarker for colorectal cancer compared to CEA, CA19-9 or CA242. Tumour Biol. 2021;43:57-70. [PubMed] [DOI] |
| 28. | Luo H, Shen K, Li B, Li R, Wang Z, Xie Z. Clinical significance and diagnostic value of serum NSE, CEA, CA19-9, CA125 and CA242 levels in colorectal cancer. Oncol Lett. 2020;20:742-750. [PubMed] [DOI] |
| 29. | Wang A, Shang Y, Ni J, Wang W, Wang C, Li G, Chen SZ. Thymidine Kinase 1 Mediates the Synergistic Antitumor Activity of Ubenimex and Celecoxib via Regulation of Cell Cycle in Colorectal Cancer. J Pharmacol Exp Ther. 2022;382:188-198. [PubMed] [DOI] |
| 30. | Ren S, Chen J, Xu X, Jiang T, Cheng Y, Chen G, Pan Y, Fang Y, Wang Q, Huang Y, Yao W, Wang R, Li X, Zhang W, Zhang Y, Hu S, Guo R, Shi J, Wang Z, Cao P, Wang D, Fang J, Luo H, Geng Y, Xing C, Lv D, Zhang Y, Yu J, Cang S, Yang Z, Shi W, Zou J, Zhou C; CameL-sq Study Group. Camrelizumab Plus Carboplatin and Paclitaxel as First-Line Treatment for Advanced Squamous NSCLC (CameL-Sq): A Phase 3 Trial. J Thorac Oncol. 2022;17:544-557. [PubMed] [DOI] |