修回日期: 2023-06-07
接受日期: 2023-07-20
在线出版日期: 2023-07-28
胰腺腺癌(pancreatic adenocarcinoma, PCa)是一种高度侵袭性的恶性肿瘤, 具有早期死亡的高风险(生存时间≤3 mo). 因此, 建立有效的列线图来预测转移性胰腺腺癌(metastatic pancreatic adenocarcinoma, mPCa)患者早期死亡的概率具有相当重要的意义.
构建并验证mPCa患者早期死亡的预测列线图模型.
提取SEER数据库中2010-2015年符合条件的18603例mPCa患者, 按7:3比例随机分为训练集和验证集, 对训练集进行单因素及多因素Logistics回归分析确定早期死亡危险因素, 从而进一步构建列线图, 在训练集和验证集中通过受试者工作特征曲线(receiver operating characteristic curve, ROC)、校准曲线对列线图效能进行验证, 使用决策曲线分析(decision curve analysis, DCA)评估列线图临床实用性.
年龄、性别、肿瘤原发部位、肿瘤分化程度、T分期、N分期、脑转移、骨转移、肝转移、肺转移、手术、放疗、化疗是mPCa患者早期死亡的独立危险因素, 基于这些变量构建了列线图. 训练集和验证集ROC曲线下面积分别是0.810(95%CI: 0.802-0.811)、0.802(95%CI: 0.790-0.813), 提示列线图有良好的区分度, 校准曲线在训练集和验证集中均有较好的校准度, DCA结果表明, 与TNM分期相比, 列线图在预测早期死亡方面有更好的临床净效益.
所构建的列线图对于mPCa患者的早期死亡具有良好的预测能力, 有助于临床医生对mPCa患者实施个体化治疗方案.
核心提要: 根据SEER数据库提供的大样本量数据, 确定了转移性胰腺腺癌患者早期死亡的危险因素, 并进一步开发预测列线图, 帮助临床医生识别早期死亡的危险因素和概率, 制定更精确的个体化治疗计划, 从而提高患者的生存概率和生活质量.
引文著录: 钟佳俊, 叶艳清. 基于SEER数据库转移性胰腺腺癌患者早期死亡预测列线图模型构建和验证. 世界华人消化杂志 2023; 31(14): 577-588
Revised: June 7, 2023
Accepted: July 20, 2023
Published online: July 28, 2023
Pancreatic adenocarcinoma is a highly aggressive malignancy that presents a considerable risk of early death (survival time ≤ 3 mo). As such, it is of great significance to develop an effective nomogram for predicting the likelihood of early death in patients with metastatic pancreatic adenocarcinoma.
To construct and validate a predictive nomogram model for early death in patients with metastatic pancreatic adenocar-cinoma.
We extracted data from the SEER database of 18603 eligible patients with metastatic pancreatic adenocarcinoma from 2010 to 2015, and randomly divided them into training and validation cohorts in a 7:3 ratio. Univariate and multivariate logistic regression analyses were performed on the training cohort to identify the risk factors for early death, based on which a nomogram was constructed. The performance of the nomogram was verified by receiver operating characteristic (ROC) curve and calibration curve analyses in both the training and validation cohorts. The clinical practicability of the nomogram was evaluated by decision curve analysis (DCA).
Age, sex, primary site, grade, T stage, N stage, brain metastasis, bone metastasis, liver metastasis, lung metastasis, surgery, radiotherapy, and chemotherapy were identified as independent risk factors for early death in patients with metastatic pancreatic adenocarcinoma. Based on these variables, a nomogram was constructed. The areas under the ROC curves of the nomogram in the training and validation cohorts were 0.810 (95% confidence interval [CI]: 0.802-0.811) and 0.802 (95%CI: 0.790-0.813), respectively, indicating good discrimination. The calibration curves showed good calibration degrees in both cohorts, and the DCA results demonstrated that the nomogram had better clinical net benefit in predicting early mortality compared with TNM stage.
The constructed nomogram has good predictive ability for early death in patients with metastatic pancreatic adeno-carcinoma. This will help clinicians develop individualized treatment plans for these patients.
- Citation: Zhong JJ, Ye YQ. Construction and validation of a nomogram model for predicting early death in patients with metastatic pancreatic adenocarcinoma based on SEER database. Shijie Huaren Xiaohua Zazhi 2023; 31(14): 577-588
- URL: https://www.wjgnet.com/1009-3079/full/v31/i14/577.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i14.577
胰腺癌是一种高度侵袭性的恶性肿瘤, 居世界癌症死亡原因第三位[1], 胰腺癌在无症状癌症中排名第一, 其中胰腺腺癌(pancreatic adenocarcinoma, PCa)占原发性胰腺癌的90%以上[2]. 胰腺癌早期症状隐匿, 侵袭性高, 超过50%的PCa患者在晚期才被诊断, 其5年生存率不到8%[3]. 化疗一直是转移性胰腺腺癌(metastatic pancreatic adenocarcinoma, mPCa)一线治疗方案[4], mPCa患者在没有化疗的情况下只有2 mo-4 mo的中位预期寿命[5], 然而mPCa患者即使接受积极治疗, 其中位总生存期(overall survival, OS)仍短于12 mo[6]. 因此mPCa患者预后差, 容易发生早期死亡(通常定义为初始诊断后3 mo内死亡[7]). 然而, 迄今为止, 关于影响mPCa患者早期死亡因素的研究较少. 因此, 开发列线图以指导临床医生识别患者早期死亡的危险因素并实施个体化治疗具有重要意义. 本研究以SEER数据库中诊断为mPCa的患者为研究对象, 探讨早期死亡的危险因素, 并构建列线图预测早期死亡(≤3 mo)的概率.
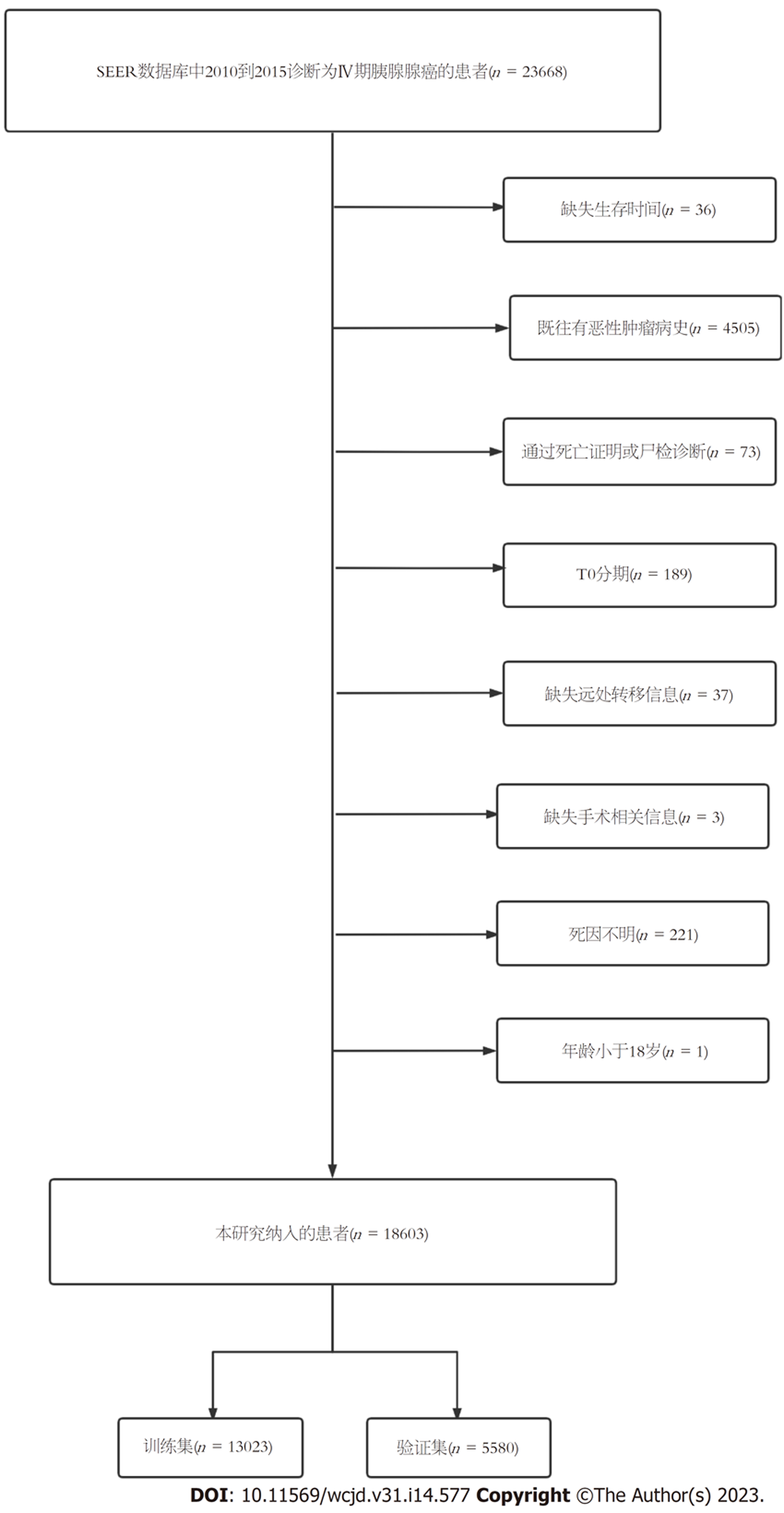
使用SEER*Stat(版本8.4.0.1)从SEER数据库中提取2010-2015年诊断为Ⅳ期PCa患者的数据. 纳入标准: (1)肿瘤部位代码: C25.0-C25.3和C25.7-C25.9; (2)组织学代码8140/3、8480/3、8481/3、8500/3和8521/3[根据国际肿瘤疾病分类第三版(ICD-O-3)]. 排除标准: (1)既往有恶性肿瘤病史; (2)通过死亡证明或尸检诊断; (3)种族信息不明; (4)T0分期患者; (5)远处转移相关信息缺失; (6)手术相关信息缺失; (7)死因不明; (8)年龄小于18岁. 筛选流程见图1. 最终共有18603例mPCa患者纳入研究, 按照7:3比例随机分为训练集和验证集, 训练集用来分析早期死亡的危险因素并建立列线图, 验证集用来验证模型的准确性. 该研究获得了美国国家癌症研究所(参考编号18558-Nov2021)对SEER计划中存储的研究数据的分析授权.
收集以下人口统计学和临床特征: 诊断年龄、种族、性别、肿瘤原发部位、肿瘤分化程度、T分期(AJCC第7版)、N分期(AJCC第7版)、骨转移、脑转移、肝转移、肺转移、手术、放疗、化疗、死因和生存时间.
统计学处理 计数资料由数量和百分比(n, %)描述. 训练集和验证集各因素之间比较采用χ2检验. 利用单变量和多变量Logistic回归模型来识别与Ⅳ期PCa患者早期死亡独立危险因素, 进而构建列线图. 在训练集和验证集中绘制受试者工作特征曲线(receiver operating characteristic curve, ROC)和校准曲线对列线图的效能进行验证. 决策曲线分析(decision curve analysis, DCA)用于评估模型的临床可用性. 所有统计学分析均使用R软件(版本4.2.1)进行. P<0.05被认为具有统计学意义.
共有18603例mPCa纳入研究, 10230名患者早期死亡(因PCa死亡9767例, 其他原因死亡463例). 大部分早期死亡出现在男性(54.5%)、白人(78.6%)和年龄在65岁至79岁(44.5%)之间的患者中. 胰头(31.5%)是胰腺癌患者早期死亡的最常见肿瘤原发位置. 除未知分化等级(81.2%)外, 低分化/未分化mPCa与良好/中度分化mPCa的早期死亡率分别为11.4%和7.4%. 早期死亡患者最常见的转移部位是肝脏(78.5%). 在治疗方面, 大多数早期死亡患者没有接受手术治疗(99.2%), 只有少数患者接受放疗(3.2%)或化疗(31.0%). 入选病例按照7:3的比例随机分组, 13023名患者被随机分配为训练集, 5580名患者被随机分配为验证集, 两组患者在年龄、种族、性别、原发部位、分化程度、T分期(AJCC第7版)、N分期(AJCC第7版)、骨转移、脑转移、肝转移、肺转移、手术、放疗、化疗方面比较, 差异均无统计学意义, 训练集和验证集的随机分组具有可比性. 表1显示mPCa患者早期死亡的发生率, 表2总结了训练集、验证集中mPCa患者的人口统计学和临床特征.
| 特征 | 所有患者(n = 18603) | 非早期死亡(n = 8373) | 早期死亡(n = 10230) | P |
| 年龄(岁) | ||||
| <50 | 1082(5.8) | 668(8.0) | 414(4.0) | <0.001 |
| 50-64 | 6666(35.8) | 3459(41.3) | 3207(31.3) | |
| 65-79 | 8041(43.2) | 3493(41.7) | 4548(44.5) | |
| ≥80 | 2814(15.1) | 753(9.0) | 2061(20.1) | |
| 性别(%) | ||||
| 女性 | 8596(46.2) | 3940(47.1) | 4656(45.5) | 0.036 |
| 男性 | 10007(53.8) | 4433(52.9) | 5574(54.5) | |
| 种族(%) | ||||
| 白种人 | 14745(79.3) | 6703(80.1) | 8042(78.6) | 0.015 |
| 黑种人 | 2300(12.4) | 971(11.6) | 1329(13.0) | |
| 其他 | 1558(8.4) | 699(8.3) | 859(8.4) | |
| 肿瘤位置(%) | ||||
| 胰头 | 6531(35.1) | 3312(39.6) | 3219(31.5) | <0.001 |
| 胰体 | 2998(16.1) | 1492(17.8) | 1506(14.7) | |
| 胰尾 | 3852(20.7) | 1581(18.9) | 2271(22.2) | |
| 其他 | 5222(28.1) | 1988(23.7) | 3234(31.6) | |
| 分化程度(%) | ||||
| 高/中等分化 | 1810(9.7) | 1048(12.5) | 762(7.4) | <0.001 |
| 低/未分化 | 2023(10.9) | 859(10.3) | 1164(11.4) | |
| 未知 | 14770(79.4) | 6466(77.2) | 8304(81.2) | |
| T分期(%) | ||||
| T1 | 460(2.5) | 228(2.7) | 232(2.3) | <0.001 |
| T2 | 4558(24.5) | 2000(23.9) | 2558(25.0) | |
| T3 | 5055(27.2) | 2570(30.7) | 2485(24.3) | |
| T4 | 3570(19.2) | 1811(21.6) | 1759(17.2) | |
| TX | 4960(26.7) | 1764(21.1) | 3196(31.2) | |
| N分期(%) | ||||
| N0 | 9073(48.8) | 4156(49.6) | 4917(48.1) | <0.001 |
| N1 | 6015(32.3) | 2953(35.3) | 3062(29.9) | |
| NX | 3515(18.9) | 1264(15.1) | 2251(22.0) | |
| 骨转移(%) | ||||
| 否 | 16500(88.7) | 7585(90.6) | 8915(87.1) | <0.001 |
| 是 | 1294 (7.0) | 482 (5.8) | 812 (7.9) | |
| 未知 | 809 (4.3) | 306 (3.7) | 503 (4.9) | |
| 脑转移(%) | ||||
| 否 | 17622(94.7) | 8026(95.9) | 9596(93.8) | <0.001 |
| 是 | 112(0.6) | 24(0.3) | 88(0.9) | |
| 未知 | 869(4.7) | 323(3.9) | 546(5.3) | |
| 肝转移(%) | ||||
| 否 | 4354(23.4) | 2378(28.4) | 1976(19.3) | <0.001 |
| 是 | 13879(74.6) | 5850(69.9) | 8029(78.5) | |
| 未知 | 370(2.0) | 145(1.7) | 225(2.2) | |
| 肺转移(%) | ||||
| 否 | 13827(74.3) | 6467(77.2) | 7360(71.9) | <0.001 |
| 是 | 3846(20.7) | 1549(18.5) | 2297(22.5) | |
| 未知 | 930(5.0) | 357(4.3) | 573(5.6) | |
| 手术(%) | ||||
| 否 | 18179(97.7) | 8029(95.9) | 10150(99.2) | <0.001 |
| 是 | 424(2.3) | 344(4.1) | 80(0.8) | |
| 放疗(%) | ||||
| 否/未知 | 17668(95.0) | 7769(92.8) | 9899(96.8) | <0.001 |
| 是 | 935(5.0) | 604(7.2) | 331(3.2) | |
| 化疗(%) | ||||
| 否/未知 | 8594(46.2) | 1534(18.3) | 7060(69.0) | <0.001 |
| 是 | 10009(53.8) | 6839(81.7) | 3170(31.0) | |
| 死因(%) | ||||
| 胰腺癌 | 17826(95.8) | 8059(96.2) | 9767(95.5) | 0.009 |
| 其他原因 | 777(4.2) | 314(3.8) | 463(4.5) |
| 特征 | 训练集(n = 13023) | 验证集(n = 5580) | P |
| 年龄 (岁) | 0.671 | ||
| <50 | 774(5.9) | 308(5.5) | |
| 50-64 | 4650(35.7) | 2016(36.1) | |
| 65-79 | 5621(43.2) | 2420(43.4) | |
| ≥80 | 1978(15.2) | 836(15.0) | |
| 性别(%) | 0.813 | ||
| 女性 | 6025(46.3) | 2571(46.1) | |
| 男性 | 6998(53.7) | 3009(53.9) | |
| 种族(%) | 0.194 | ||
| 白种人 | 10293(79.0) | 4452(79.8) | |
| 黑种人 | 1608(12.3) | 692(12.4) | |
| 其他 | 1122(8.6) | 436(7.8) | |
| 肿瘤位置(%) | 0.844 | ||
| 胰头 | 4583(35.2) | 1948(34.9) | |
| 胰体 | 2093(16.1) | 905(16.2) | |
| 胰尾 | 2712(20.8) | 1140(20.4) | |
| 其他 | 3635(27.9) | 1587(28.4) | |
| 分化程度(%) | 0.382 | ||
| 高/中等分化 | 1279(9.8) | 531(9.5) | |
| 低/未分化 | 1391(10.7) | 632(11.3) | |
| 未知 | 10353(79.5) | 4417(79.2) | |
| T分期(%) | 0.621 | ||
| T1 | 328(2.5) | 132(2.4) | |
| T2 | 3198(24.6) | 1360(24.4) | |
| T3 | 3504(26.9) | 1551(27.8) | |
| T4 | 2527(19.4) | 1043(18.7) | |
| TX | 3466(26.6) | 1494(26.8) | |
| N分期(%) | 0.667 | ||
| N0 | 6377(49.0) | 2696(48.3) | |
| N1 | 4203(32.3) | 1812(32.5) | |
| NX | 2443(18.8) | 1072(19.2) | |
| 骨转移(%) | 0.771 | ||
| 否 | 11538(88.6) | 4962(88.9) | |
| 是 | 917(7.0) | 377(6.8) | |
| 未知 | 568(4.4) | 241(4.3) | |
| 脑转移(%) | 0.753 | ||
| 否 | 12336(94.7) | 5286(94.7) | |
| 是 | 75(0.6) | 37(0.7) | |
| 未知 | 612(4.7) | 257(4.6) | |
| 肝转移(%) | 0.126 | ||
| 否 | 2997(23.0) | 1357(24.3) | |
| 是 | 9760(74.9) | 4119(73.8) | |
| 未知 | 266(2.0) | 104(1.9) | |
| 肺转移(%) | 0.34 | ||
| 否 | 9661(74.2) | 4166(74.7) | |
| 是 | 2691(20.7) | 1155(20.7) | |
| 未知 | 671(5.2) | 259(4.6) | |
| 手术(%) | 0.056 | ||
| 否 | 12744(97.9) | 5435(97.4) | |
| 是 | 279(2.1) | 145(2.6) | |
| 放疗(%) | 0.795 | ||
| 否/未知 | 12372(95.0) | 5296(94.9) | |
| 是 | 651(5.0) | 284(5.1) | |
| 化疗(%) | 0.98 | ||
| 否/未知 | 6017(46.2) | 2577(46.2) | |
| 是 | 7006(53.8) | 3003(53.8) | |
| 早期死亡(%) | 0.686 | ||
| 否 | 5854(44.9) | 2519(45.1) | |
| 是 | 7169(55.1) | 3061(54.9) |
训练集中单因素和多因素Logistic回归分析结果显示, 年龄、性别、原发肿瘤部位、分化程度、T分期、N分期、骨转移、脑转移、肝转移、肺转移、手术、放疗、化疗是mPCa患者早期死亡的独立危险因素, 见表3.
| 特征 | 单因素分析 | 多因素分析 | ||
| OR(95%CI) | P | OR(95%CI) | P | |
| 年龄(岁) | ||||
| <50 | 1 | 1 | ||
| 50-64 | 1.440(1.234, 1.683) | <0.001 | 1.237(1.033, 1.483) | 0.021 |
| 65-79 | 1.973(1.693, 2.302) | <0.001 | 1.524(1.274, 1.825) | <0.001 |
| ≥80 | 4.289(3.601, 5.116) | <0.001 | 2.137(1.739, 2.630) | <0.001 |
| 性别(%) | ||||
| 女性 | 1 | 1 | ||
| 男性 | 1.076(1.004, 1.153) | 0.038 | 1.188(1.093, 1.293) | <0.001 |
| 种族(%) | ||||
| 白种人 | 1 | 1 | ||
| 黑种人 | 1.189(1.069, 1.323) | 0.001 | 1.135(0.999, 1.291) | 0.052 |
| 其他 | 1.066(0.942, 1.207) | 0.311 | 0.902(0.776, 1.048) | 0.178 |
| 肿瘤位置(%) | ||||
| 胰头 | 1 | 1 | ||
| 胰体 | 1.061(0.957, 1.176) | 0.263 | 1.169(1.032, 1.323) | 0.014 |
| 胰尾 | 1.443(1.312, 1.589) | <0.001 | 1.511(1.347, 1.696) | <0.001 |
| 其他 | 1.693(1.550, 1.851) | <0.001 | 1.480(1.326, 1.651) | <0.001 |
| 分化程度(%) | ||||
| 高/中等分化 | 1 | 1 | ||
| 低/未分化 | 1.754(1.505, 2.046) | <0.001 | 1.655(1.376, 1.991) | <0.001 |
| 未知 | 1.652(1.470, 1.858) | <0.001 | 1.334(1.156, 1.540) | <0.001 |
| T分期(%) | ||||
| T1 | 1 | 1 | ||
| T2 | 1.214(0.967, 1.524) | 0.095 | 1.352(1.030, 1.774) | 0.030 |
| T3 | 0.899(0.716, 1.127) | 0.354 | 1.172(0.894, 1.536) | 0.251 |
| T4 | 0.926(0.736, 1.166) | 0.515 | 1.158(0.879, 1.525) | 0.298 |
| TX | 1.789(1.425, 2.246) | <0.001 | 1.553(1.181, 2.043) | 0.002 |
| N分期(%) | ||||
| N0 | 1 | 1 | ||
| N1 | 0.865(0.800, 0.935) | <0.001 | 1.038(0.944, 1.142) | 0.438 |
| NX | 1.540(1.398, 1.696) | <0.001 | 1.164(1.031, 1.314) | 0.014 |
| 骨转移(%) | ||||
| 否 | 1 | 1 | ||
| 是 | 1.372(1.196, 1.576) | <0.001 | 1.600(1.347, 1.904) | <0.001 |
| 未知 | 1.578(1.324, 1.885) | <0.001 | 0.989(0.661, 1.480) | 0.959 |
| 脑转移(%) | ||||
| 否 | 1 | 1 | ||
| 是 | 2.654(1.594, 4.641) | <0.001 | 2.863(1.539, 5.514) | 0.001 |
| 未知 | 1.593(1.345, 1.892) | <0.001 | 0.892(0.607, 1.315) | 0.562 |
| 肝转移(%) | ||||
| 否 | 1 | 1 | ||
| 是 | 1.660(1.529, 1.803) | <0.001 | 1.889(1.706, 2.093) | <0.001 |
| 未知 | 2.217(1.712, 2.889) | <0.001 | 1.789(1.249, 2.569) | 0.002 |
| 肺转移(%) | ||||
| 否 | 1 | 1 | ||
| 是 | 1.350(1.238, 1.473) | <0.001 | 1.332(1.197, 1.482) | <0.001 |
| 未知 | 1.585(1.348, 1.867) | <0.001 | 1.047(0.804, 1.363) | 0.734 |
| 手术(%) | ||||
| 否 | 1 | 1 | ||
| 是 | 0.203(0.150, 0.270) | <0.001 | 0.258(0.181, 0.362) | <0.001 |
| 放疗(%) | ||||
| 否/未知 | 1 | 1 | ||
| 是 | 0.390(0.329, 0.460) | <0.001 | 0.522(0.423, 0.642) | <0.001 |
| 化疗(%) | ||||
| 否/未知 | 1 | 1 | ||
| 是 | 0.098(0.090, 0.107) | <0.001 | 0.105(0.096, 0.114) | <0.001 |
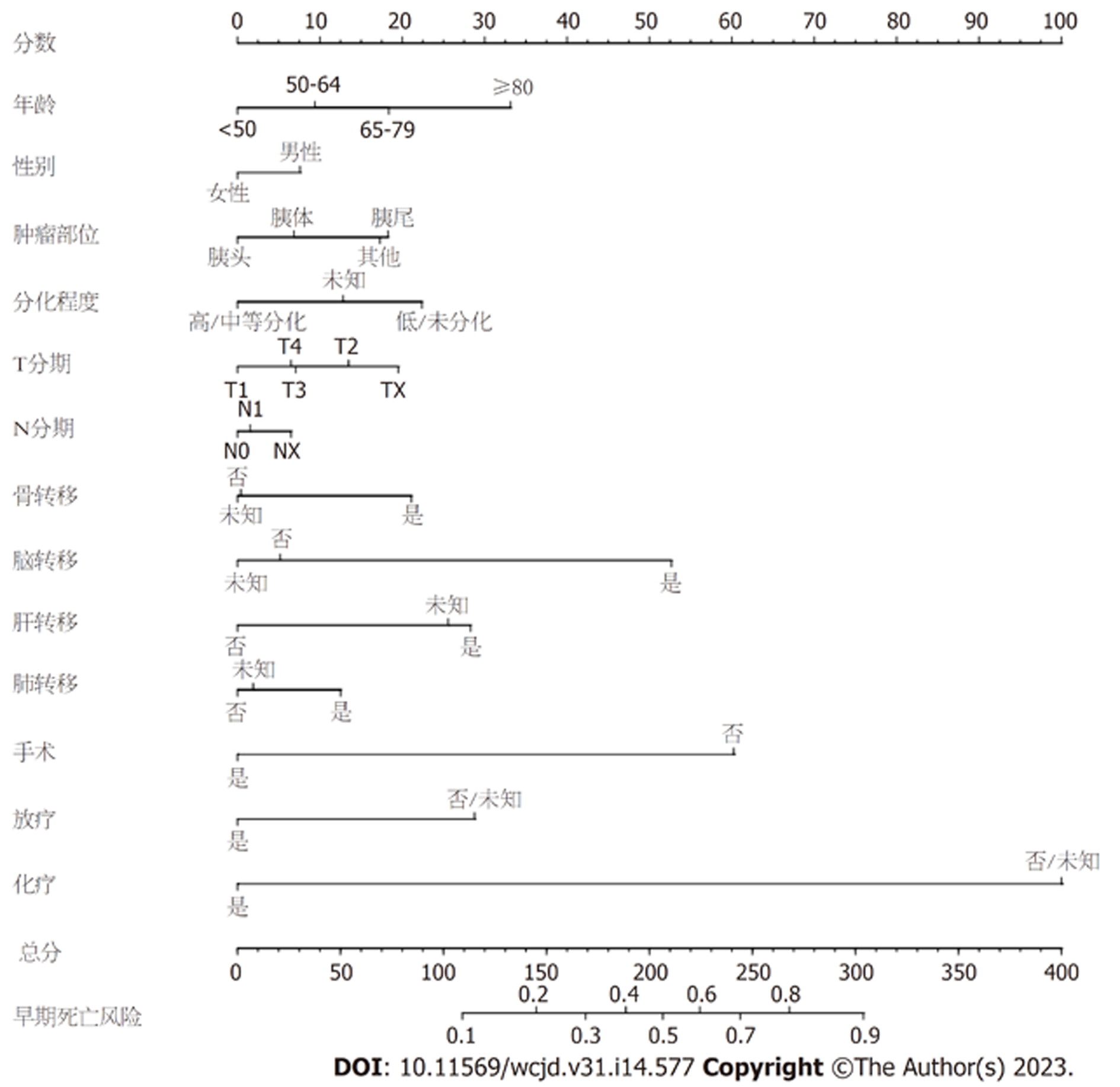
基于多因素Logistics回归分析确定的独立危险因素, 构建了预测mPCa患者早期死亡的列线图(图2). 列线图显示化疗是mPCa患者早期死亡最重要的影响因素, 其次是手术、脑转移、年龄和放疗. 在列线图中, 可以通过将每个影响因素的分值相加来获得总分, 然后可以估计早期死亡的概率. 例如: 一名女性在70岁时被诊断为胰头癌和肝转移, 中等分化, 仅接受过化疗, 使用该列线图预测的早期死亡概率约为24%.
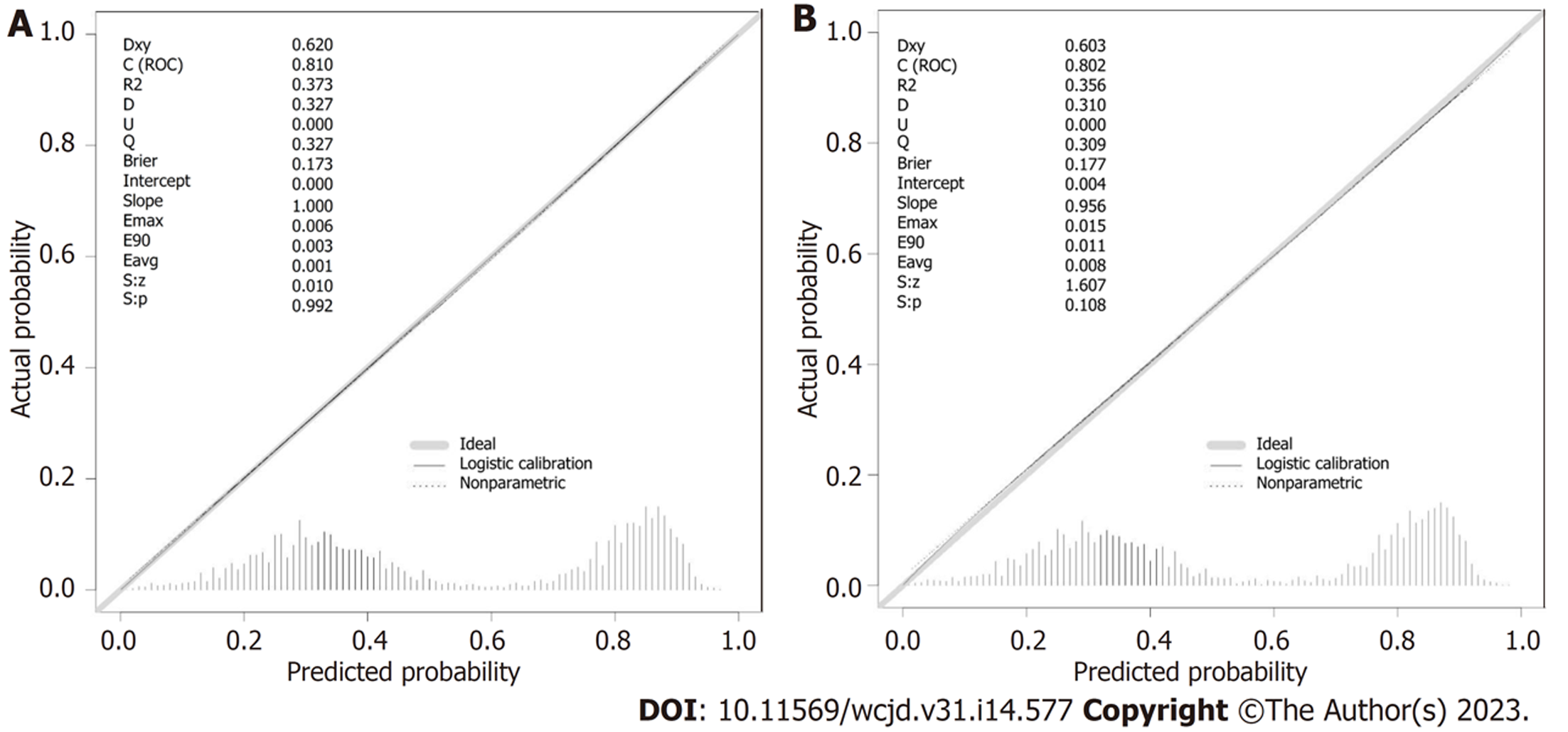
使用校准曲线评估模型的校准度. 在本研究中, 如图3A和B所示, 训练集和验证集的校准曲线与45°对角线的吻合度较高, 表明模型预测的mPCa早期死亡的概率与患者实际早期死亡概率相符, 表明模型有良好的校准度.
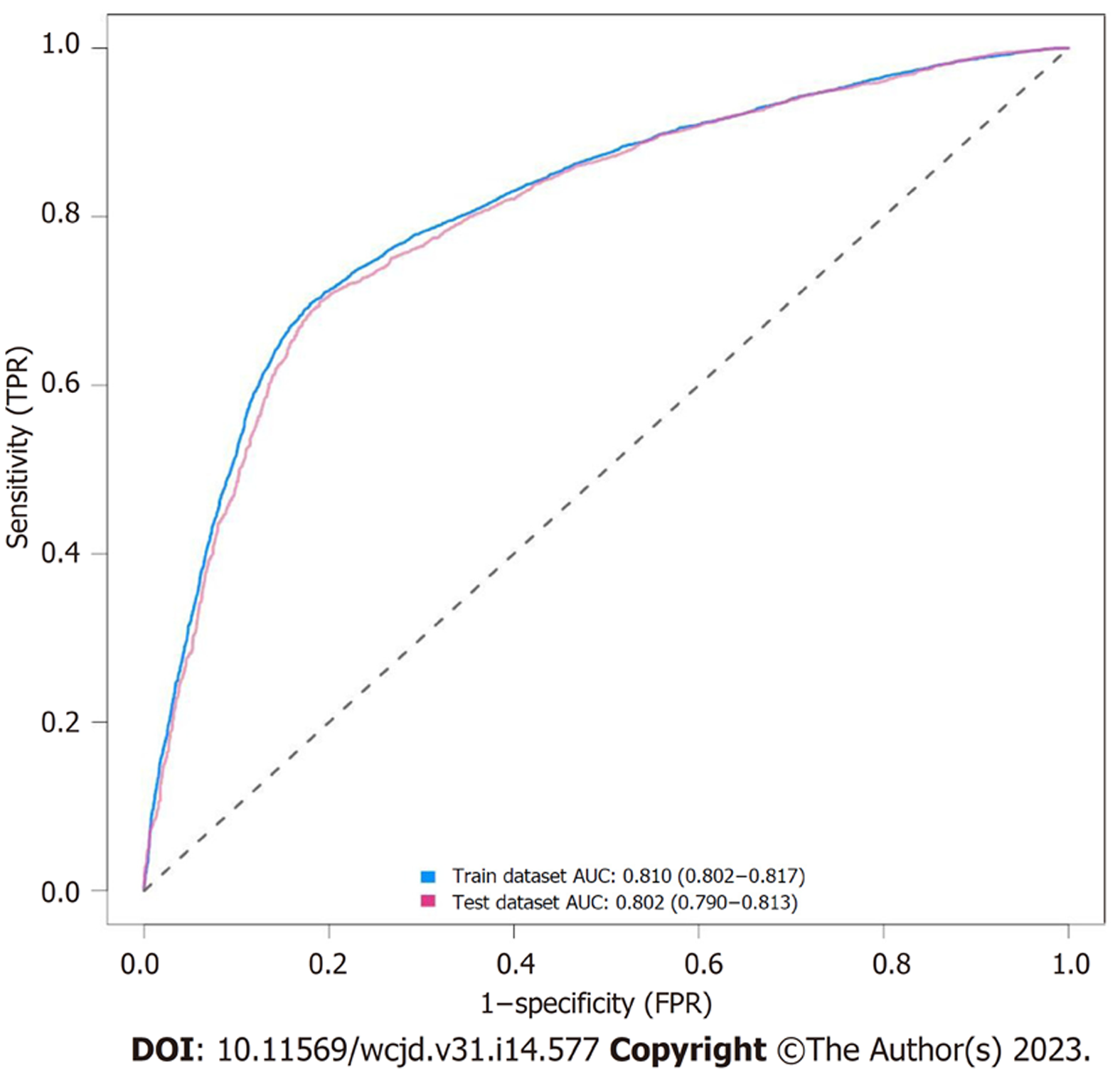
使用ROC曲线评估模型的区分度. 图4所示, 训练集的ROC曲线下面积AUC为0.810(95%CI: 0.802-0.817), 验证集的ROC曲线下面积AUC为0.802(95%CI: 0.790-0.813), 表明模型具有良好的区分度.
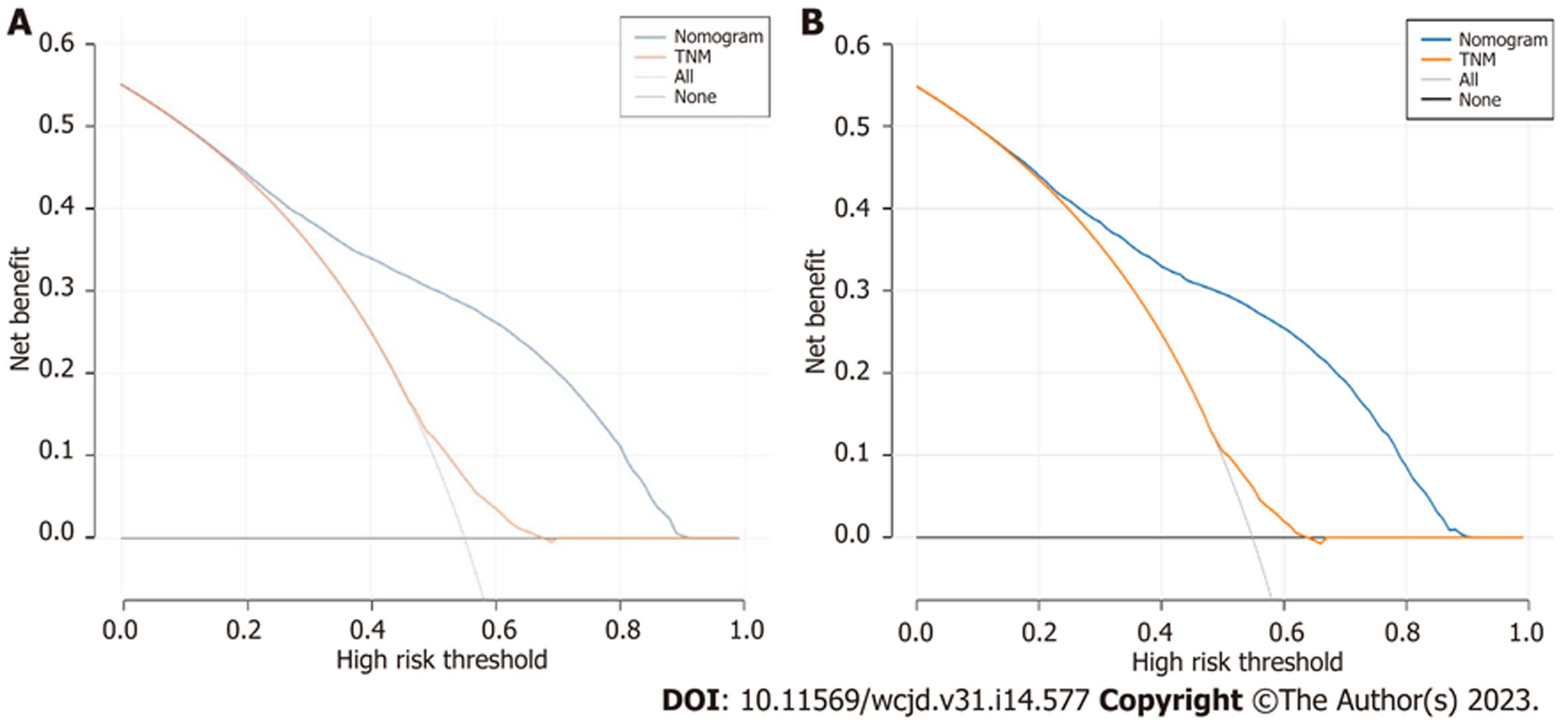
使用DCA评估模型的临床适用性. 图5A和B所示, 在训练集中预测早期死亡的最有利阈值概率为0.1-0.9. 正如有利的阈值概率所证明的那样, 它表明列线图可以帮助临床医生准确地评估mPCa患者的早期死亡. 并且与TNM分期相比, 本研究中的列线图模型在预测早期死亡方面有更高的临床净收益.
胰腺癌是最致命的恶性肿瘤之一. 据统计, 2020年全球新发胰腺癌病例超过49万例, 并且有46万例胰腺癌患者死亡[8], 随着医疗水平的进步, 大多数癌症的的存活率得到了明显的提高, 但胰腺癌的存活率却一直没有明显的改善[9]. 早期诊断或者发现新的治疗方案是改善胰腺癌预后的理想方法. Valeria Tonini和Manuel Zanni回顾并总结了所有关于胰腺癌风险因素和筛查方式的最新研究、包括液体活检在内的新实验室测试、新的成像方法以及人工智能和机器学习的可能应用, 然而遗憾的是直到2022年胰腺癌预后并没有得到明显的改善[10]. 手术切除是唯一可能治愈PCa的治疗方法[10], 然而超过50%的胰腺癌患者在诊断时就属于晚期, 因此失去了手术彻底治愈的机会[11]. 对于无手术机会的mPCa患者, 目前一线治疗有以下三种选择: 吉西他滨单药治疗, FOLFIRINOX方案以及吉西他滨加白蛋白-纳米颗粒结合紫杉醇(nab-紫杉醇)的组合[12]. 有许多Ⅲ期试验证明了吉西他滨的有效性, 其1年总生存率为18%-20%, 中位OS约为6 mo[13,14]. 而没有接受化疗的mPCa患者中位生存期约2 mo-4 mo[5]. Ⅲ期MPACT试验对吉西他滨加nab-紫杉醇与吉西他滨单药进行了比较. 该试验显示, 与单药治疗相比, 吉西他滨加nab-紫杉醇治疗的患者中位生存期显著改善(8.5 mo:6.7 mo; HR: 0.72; P<0.001)[15]. FOLFIRINOX方案中5-FU、伊立替康和奥沙利铂的组合是mPCa治疗的里程碑. 在PRODIGE 4组试验中, 该联合方案与吉西他滨单药治疗相比, 中位生存期得到改善(11.1 mo:6.8 mo; HR: 0.57; P<0.001)[13]. 然而与其他癌症相比, mPCa一线治疗的方案对中位生存期的改善并不令人满意[16]. 根据本研究中从SEER数据库提取的数据得知, 超过50%的mPCa患者发生了早期死亡, 然而大多数关于PCa预后的研究都集中在患者的长期生存[17,18]和可切除PCa早期死亡的相关危险因素[19,20], 关于mPCa患者早期死亡的研究还很少, 因此, 在这项研究中, 我们基于mPCa患者早期死亡的独立危险因素建立了预测列线图, 以预测mPCa患者是早期死亡的概率.
本研究通过单因素和多因素Logistic回归分析发现, 多个人口统计学特征和临床因素是mPCa早期死亡的危险因素, 包括年龄、性别、肿瘤部位、分化程度、T分期、N分期、骨转移、脑转移、肝转移、肺转移、手术、放疗、化疗. 与传统TNM分期一样, 肿瘤患者的预后与肿瘤浸润、淋巴结转移和远处转移密切相关[20]. 在本研究中, 高龄、男性有更大的早期死亡风险, 这与以往的研究一致[21], 而且老年患者通常基础状况较差, 伴随多种慢性疾病, 如高血压、糖尿病、冠心病等, 对治疗耐受差, 且更容易出现各种并发症, 各种因素导致老年患者生存时间减少. 在临床因素方面, 化疗是影响mPCa患者早期死亡最重要的危险因素, 接受化疗的mPCa患者早期死亡风险明显降低, 有研究表明使用FOLFIRINO方案或吉西他滨/NAB-紫杉醇化疗方案可显著提升2 mo-4 mo的总生存期[22], 但这些化疗方案具有很强的细胞毒性, 并且耐药性较高, 导致mPCa患者长期生存率仍然很低[23], 需要进一步开发新型抗癌药, 以较小毒性提供疗效. 手术对改善mPCa的早期死亡也有重要影响, 目前有一些研究强调了手术在晚期, 特别是在孤立性远处转移性胰腺癌中的获益[24,25]. 然而, 在我们的研究中接受手术的患者数量很少, 根据患者的临床状况设定严格的mPCa手术适应症可能更为谨慎. 因此, 需要大型前瞻性试验来揭示手术对mPCa的价值.
在我们的研究中, 列线图是根据SEER数据库中大量样本数构建的, 这表明结果是客观和稳定的. 训练集和验证集的AUC分别为0.810和0.802, 表明列线图在辨别和准确性方面表现良好. 为了进一步明确列线图所能带来的临床获益, 我们绘制了DCA曲线, 一种用于检查诊断测试和预测模型效率的高级工具[26], 结果表明, 列线图在预测效率和临床应用方面表现良好, 而且此模型相对于TNM分期能为患者带来更高的临床益处. 作为回顾性研究, 我们的研究有不可避免的局限性: (1)SEER数据库中缺乏一些可能与早期死亡有关的潜在危险因素, 如患者既往史、BMI、不良习惯(吸烟、饮酒史)、并发症、放化疗具体方式等; (2)这是一项回顾性研究, 删减数据引起的选择偏倚是不可避免的, 需要前瞻性研究进一步论证; (3)尽管内部验证表明列线图模型具有良好的预测能力, 但仍需要多中心和大样本量数据进行外部验证以避免过度拟合.
总之, 基于SEER数据库提供的大样本量数据, 确定了转移性胰腺腺癌患者早期死亡的危险因素, 并制定了列线图. 内部验证结果表明, 列线图具有良好的区分度和准确度, 相比TNM分期能带来更高的临床获益. 列线图可以帮助肿瘤学家和临床医生更快、更准确地识别早期死亡的危险因素和概率, 从而制定更精确的个体化治疗计划, 从而提高患者的生存概率和生活质量.
胰腺腺癌是一种高度致命的恶性肿瘤, 病死率较高, 且临床实际工作中超过50%的患者在晚期被诊断, 生存期有限, 早期死亡风险大, 目前关于晚期胰腺腺癌患者的短期生存研究较少, 本研究通过构建晚期胰腺腺癌患者早期死亡预测列线图模型, 有助于在临床上为患者制定更精确的个体化治疗.
探究影响晚期胰腺腺癌患者早期死亡的危险因素并构建预测列线图, 帮助临床医生识别早期死亡高危患者, 从而准确选择个体化的治疗方案.
对SEER数据库提供的大样本量数据进行统计分析确定晚期胰腺腺癌患者早期死亡的独立危险因素, 构建晚期胰腺腺癌患者早期死亡预测列线图, 并验证了其效能及临床的适用性.
研究中将所入选的晚期胰腺腺癌病例按照7:3的比例随机分为训练集和验证集, 对验证集进行单变量和多变量Logistic回归分析来识别晚期胰腺腺癌患者早期死亡的独立危险因素, 进而构建列线图. 基于训练集和验证集绘制ROC曲线和校准曲线对列线图的效能进行验证. 绘制决策曲线分析(decision curve analysis, DCA)用于评估列线图的临床可用性.
研究结果表明年龄、性别、肿瘤部位、肿瘤分化程度、T分期、N分期、骨转移、脑转移、肝转移、肺转移、手术、放疗、化疗是晚期胰腺腺癌患者早期死亡的独立危险因素, 所开发的胰腺腺癌患者早期死亡预测列线图经过内部验证后结果表明其在辨别和准确性方面表现良好, 对临床抗肿瘤治疗提供个体化方案具有一定指导作用.
基于SEER数据库提供的大样本量, 确定了晚期胰腺腺癌患者早期死亡的危险因素, 其中化疗是影响晚期胰腺腺癌患者早期死亡最重要的影响因素, 其次是手术治疗, 表明手术在晚期胰腺腺癌尤其是孤立性远处转移性胰腺腺癌中可能获益, 未来可能还需要大型前瞻性实验来揭示手术对晚期胰腺腺癌的价值. DCA模型结果亡显示与TNM分期相比, 本研究中的列线图模型在预测早期死方面有更高的临床净收益. 列线图具有显著较高的准确性, 可以帮助肿瘤学家和临床医生更快、更准确地识别早期死亡的危险因素和概率, 制定更精确的个体化治疗计划, 从而提高患者的生存概率和生活质量.
未来进一步研究可吸取经验, 多中心纳入病例, 进行大样本量研究进行外部验证避免过度拟合, 进一步证明列线图良好的预测能力.
学科分类: 胃肠病学和肝病学
手稿来源地: 江西省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Siegel RL, Miller KD, Wagle NS, Jemal A. Cancer statistics, 2023. CA Cancer J Clin. 2023;73:17-48. [PubMed] [DOI] |
| 2. | Evan T, Wang VM, Behrens A. The roles of intratumour heterogeneity in the biology and treatment of pancreatic ductal adenocarcinoma. Oncogene. 2022;41:4686-4695. [PubMed] [DOI] |
| 3. | Grossberg AJ, Chu LC, Deig CR, Fishman EK, Hwang WL, Maitra A, Marks DL, Mehta A, Nabavizadeh N, Simeone DM, Weekes CD, Thomas CR. Multidisciplinary standards of care and recent progress in pancreatic ductal adenocarcinoma. CA Cancer J Clin. 2020;70:375-403. [PubMed] [DOI] |
| 4. | Zhang H, Dong H, Pan Z, Du X, Liu S, Xu W, Zhang Y. Risk factors and predictive nomograms for early death of patients with pancreatic cancer liver metastasis: A large cohort study based on the SEER database and Chinese population. Front Oncol. 2022;12:998445. [PubMed] [DOI] |
| 5. | Bond-Smith G, Banga N, Hammond TM, Imber CJ. Pancreatic adenocarcinoma. BMJ. 2012;344:e2476. [PubMed] [DOI] |
| 6. | Yasmeen S, Arshad F, Shaukat S, Badar F, Kazmi SAS, Ahmad U. Efficacy of Chemotherapy for Locally Advanced and Metastatic Pancreatic Cancer: A Real-life Experience and Outcome from a Tertiary Care Centre. J Cancer Allied Spec. 2021;7:e409. [PubMed] [DOI] |
| 7. | Zhu Y, Fang X, Wang L, Zhang T, Yu D. A Predictive Nomogram for Early Death of Metastatic Gastric Cancer: A Retrospective Study in the SEER Database and China. J Cancer. 2020;11:5527-5535. [PubMed] [DOI] |
| 8. | Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71:209-249. [PubMed] [DOI] |
| 9. | Ansari D, Tingstedt B, Andersson B, Holmquist F, Sturesson C, Williamsson C, Sasor A, Borg D, Bauden M, Andersson R. Pancreatic cancer: yesterday, today and tomorrow. Future Oncol. 2016;12:1929-1946. [PubMed] [DOI] |
| 10. | Tonini V, Zanni M. Early diagnosis of pancreatic cancer: What strategies to avoid a foretold catastrophe. World J Gastroenterol. 2022;28:4235-4248. [PubMed] [DOI] |
| 11. | Wang Y, Hu GF, Zhang QQ, Tang N, Guo J, Liu LY, Han X, Wang X, Wang ZH. Efficacy and safety of gemcitabine plus erlotinib for locally advanced or metastatic pancreatic cancer: a systematic review and meta-analysis. Drug Des Devel Ther. 2016;10:1961-1972. [PubMed] [DOI] |
| 12. | Ettrich TJ, Seufferlein T. Systemic Therapy for Metastatic Pancreatic Cancer. Curr Treat Options Oncol. 2021;22:106. [PubMed] [DOI] |
| 13. | Conroy T, Desseigne F, Ychou M, Bouché O, Guimbaud R, Bécouarn Y, Adenis A, Raoul JL, Gourgou-Bourgade S, de la Fouchardière C, Bennouna J, Bachet JB, Khemissa-Akouz F, Péré-Vergé D, Delbaldo C, Assenat E, Chauffert B, Michel P, Montoto-Grillot C, Ducreux M; Groupe Tumeurs Digestives of Unicancer; PRODIGE Intergroup. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med. 2011;364:1817-1825. [PubMed] [DOI] |
| 14. | Von Hoff DD, Ervin T, Arena FP, Chiorean EG, Infante J, Moore M, Seay T, Tjulandin SA, Ma WW, Saleh MN, Harris M, Reni M, Dowden S, Laheru D, Bahary N, Ramanathan RK, Tabernero J, Hidalgo M, Goldstein D, Van Cutsem E, Wei X, Iglesias J, Renschler MF. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med. 2013;369:1691-1703. [PubMed] [DOI] |
| 15. | Goldstein D, El-Maraghi RH, Hammel P, Heinemann V, Kunzmann V, Sastre J, Scheithauer W, Siena S, Tabernero J, Teixeira L, Tortora G, Van Laethem JL, Young R, Penenberg DN, Lu B, Romano A, Von Hoff DD. nab-Paclitaxel plus gemcitabine for metastatic pancreatic cancer: long-term survival from a phase III trial. J Natl Cancer Inst. 2015;107. [PubMed] [DOI] |
| 16. | Ducreux M, Seufferlein T, Van Laethem JL, Laurent-Puig P, Smolenschi C, Malka D, Boige V, Hollebecque A, Conroy T. Systemic treatment of pancreatic cancer revisited. Semin Oncol. 2019;46:28-38. [PubMed] [DOI] |
| 17. | Song W, Miao DL, Chen L. Nomogram for predicting survival in patients with pancreatic cancer. Onco Targets Ther. 2018;11:539-545. [PubMed] [DOI] |
| 18. | Liu JH, Wang SF, Li BR, Zhu X. Development and validation of an individualized nomogram for predicting pancreatic adenocarcinoma-specific survival: a SEER population analysis of 5,805 patients. Eur Rev Med Pharmacol Sci. 2020;24:10483-10495. [PubMed] [DOI] |
| 19. | Balzano G, Dugnani E, Crippa S, Scavini M, Pasquale V, Aleotti F, Liberati D, Gandolfi A, Belfiori G, Reni M, Doglioni C, Ruffo G, Marmorale C, Falconi M, Piemonti L. A preoperative score to predict early death after pancreatic cancer resection. Dig Liver Dis. 2017;49:1050-1056. [PubMed] [DOI] |
| 20. | Sohal DP, Shrotriya S, Glass KT, Pelley RJ, McNamara MJ, Estfan B, Shapiro M, Wey J, Chalikonda S, Morris-Stiff G, Walsh RM, Khorana AA. Predicting early mortality in resectable pancreatic adenocarcinoma: A cohort study. Cancer. 2015;121:1779-1784. [PubMed] [DOI] |
| 21. | Nipp R, Tramontano AC, Kong CY, Pandharipande P, Dowling EC, Schrag D, Hur C. Disparities in cancer outcomes across age, sex, and race/ethnicity among patients with pancreatic cancer. Cancer Med. 2018;7:525-535. [PubMed] [DOI] |
| 22. | Ng SSW, Dawson LA. Inflammatory Cytokines and Radiotherapy in Pancreatic Ductal Adenocarcinoma. Biomedicines. 2022;10. [PubMed] [DOI] |
| 23. | Adel N. Current treatment landscape and emerging therapies for pancreatic cancer. Am J Manag Care. 2019;25:S3-S10. [PubMed] |
| 24. | Wang L, Yang L, Chen L, Chen Z. Do Patients Diagnosed with Metastatic Pancreatic Cancer Benefit from Primary Tumor Surgery? A Propensity-Adjusted, Population-Based Surveillance, Epidemiology and End Results (SEER) Analysis. Med Sci Monit. 2019;25:8230-8241. [PubMed] [DOI] |
| 25. | De Simoni O, Scarpa M, Tonello M, Pilati P, Tolin F, Spolverato Y, Gruppo M. Oligometastatic Pancreatic Cancer to the Liver in the Era of Neoadjuvant Chemotherapy: Which Role for Conversion Surgery? A Systematic Review and Meta-Analysis. Cancers (Basel). 2020;12. [PubMed] [DOI] |
| 26. | Vickers AJ, van Calster B, Steyerberg EW. A simple, step-by-step guide to interpreting decision curve analysis. Diagn Progn Res. 2019;3:18. [PubMed] [DOI] |