修回日期: 2023-05-06
接受日期: 2023-05-18
在线出版日期: 2023-05-28
最近的研究已经表明了环状RNA(circular RNA, circRNA)在包括结直肠癌在内的多种癌症进展中的重要调节因子的作用. 然而, circCLK3的生物学功能及其调控结直肠癌进展的潜在机制尚不清楚.
探究circCLK3对结直肠癌SW620细胞增殖、迁移及侵袭的影响和潜在的分子机制.
收集本院47例结直肠癌组织及癌旁组织, qRT-PCR法检测circCLK3、miR-654-5p的表达; 体外培养SW620细胞并分为: si-circCLK3组、pcDNA-circCLK3组、miR-654-5p组、si-circCLK3+anti-miR-654-5p组及相应的对照组(si-NC组、pcDNA组、miR-NC组、si-circCLK3+anti-miR-NC组); 采用CCK8、克隆形成实验、划痕实验与Transwell实验分析细胞增殖、迁移及侵袭; 采用双荧光素酶报告分析circCLK3与miR-654-5p的靶向关系; 采用Western blot检测基质金属蛋白酶(matrix metalloproteinase, MMP)-2、MMP-9蛋白表达.
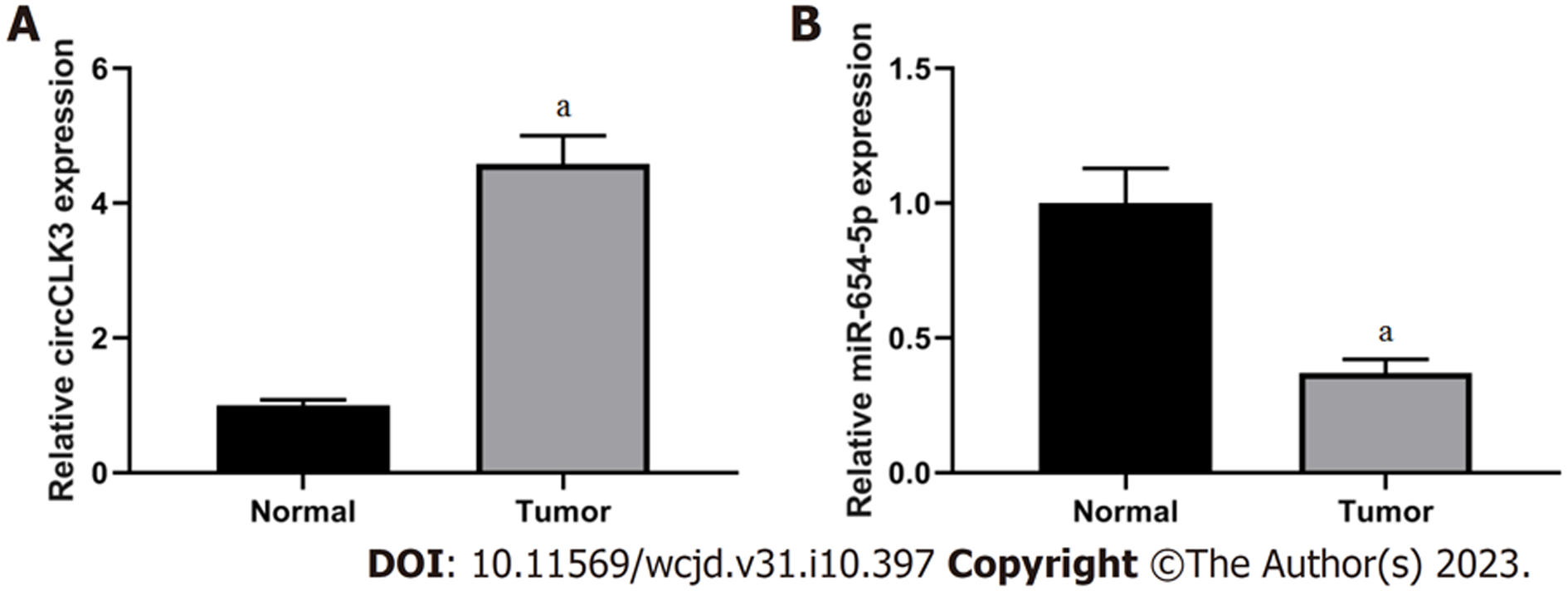
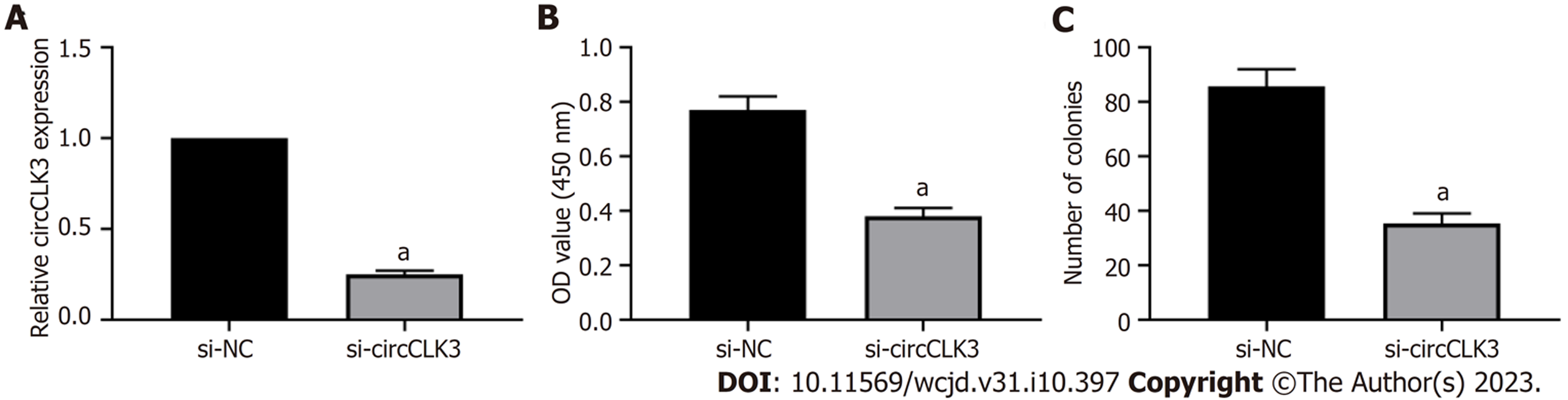
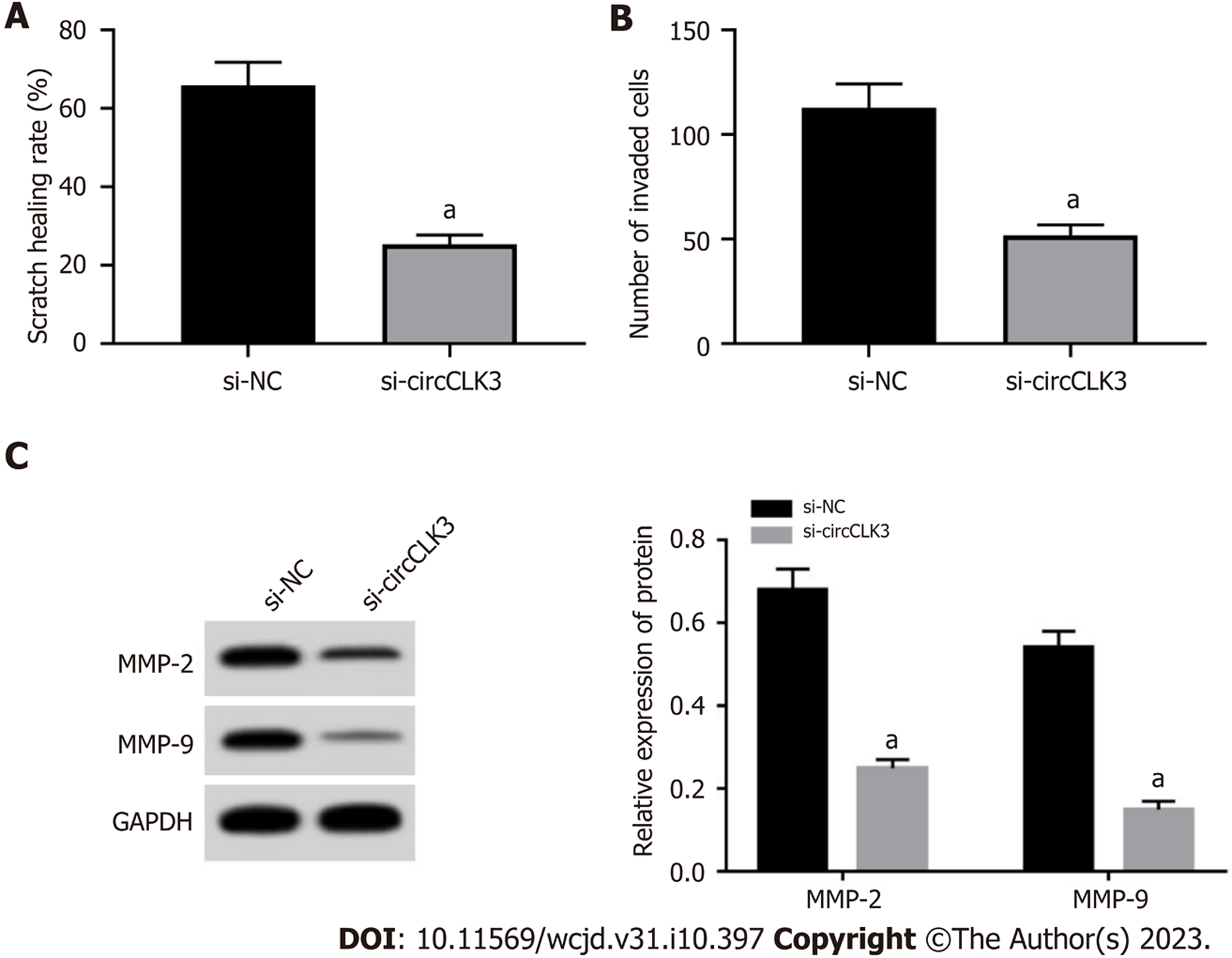
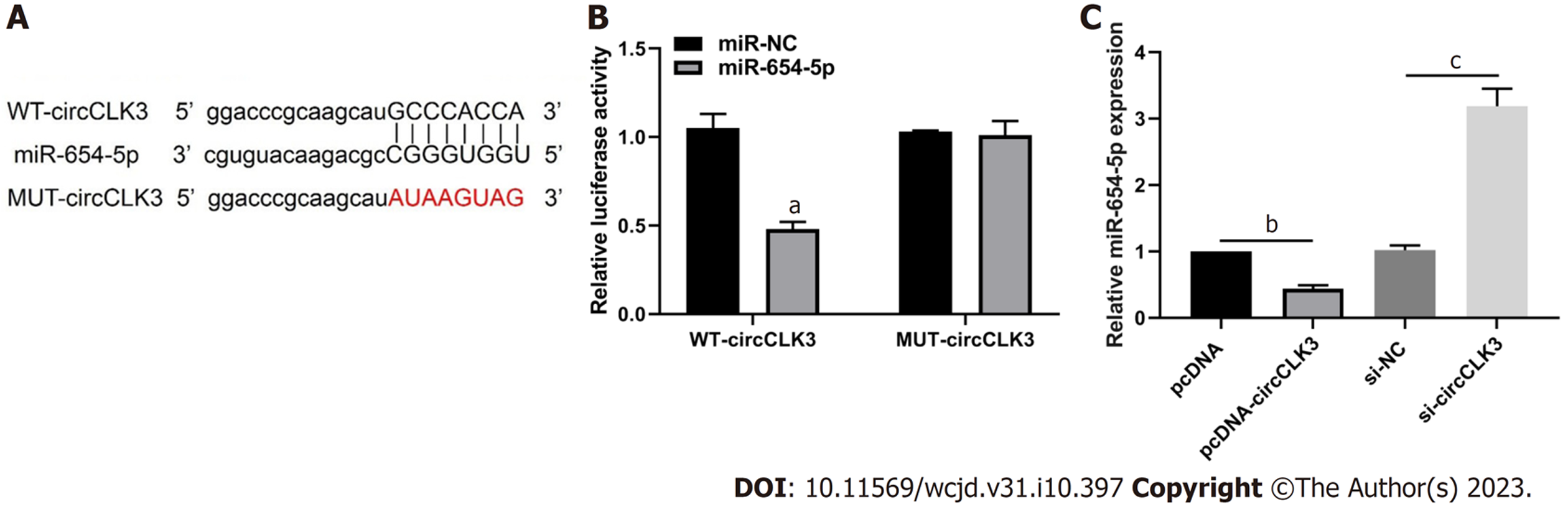
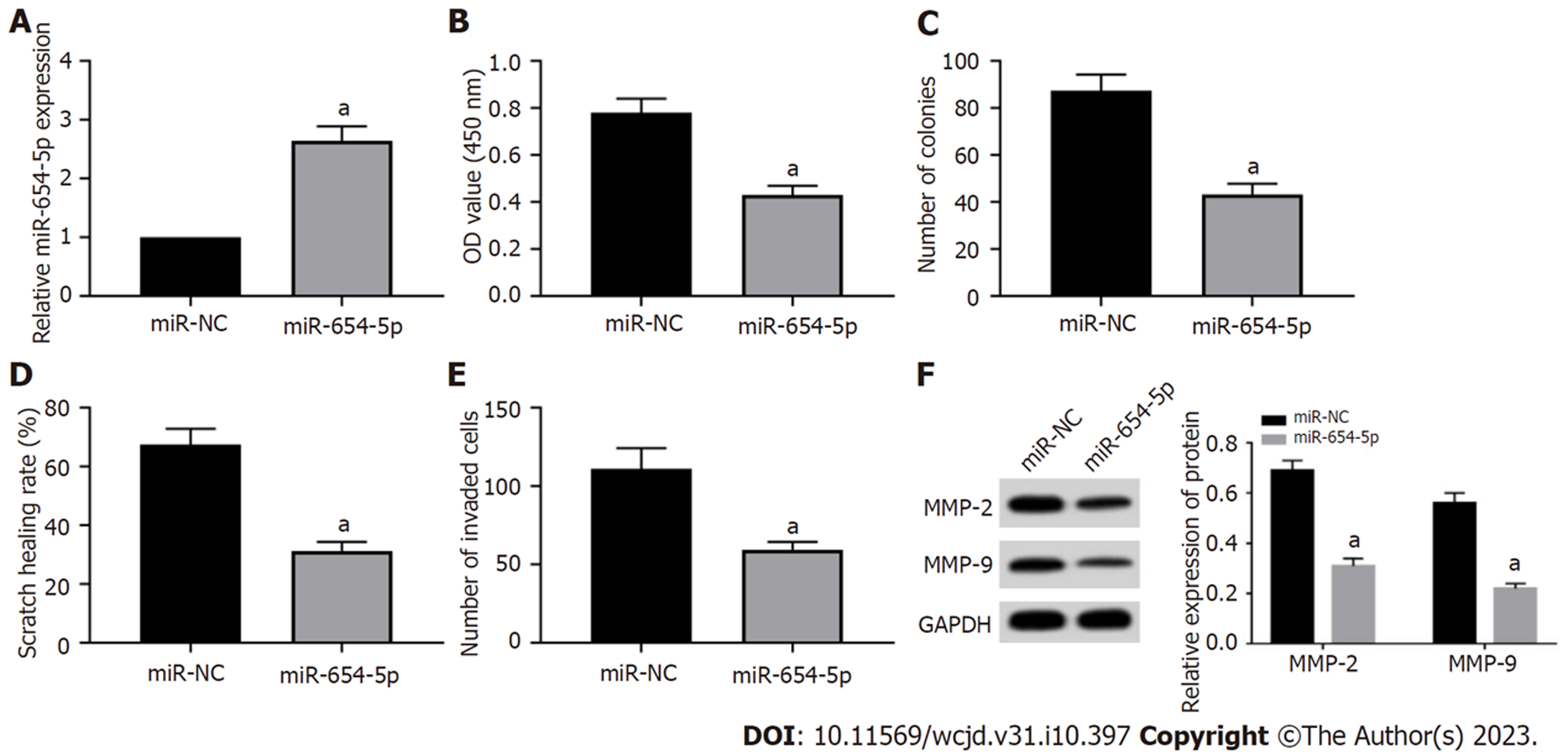
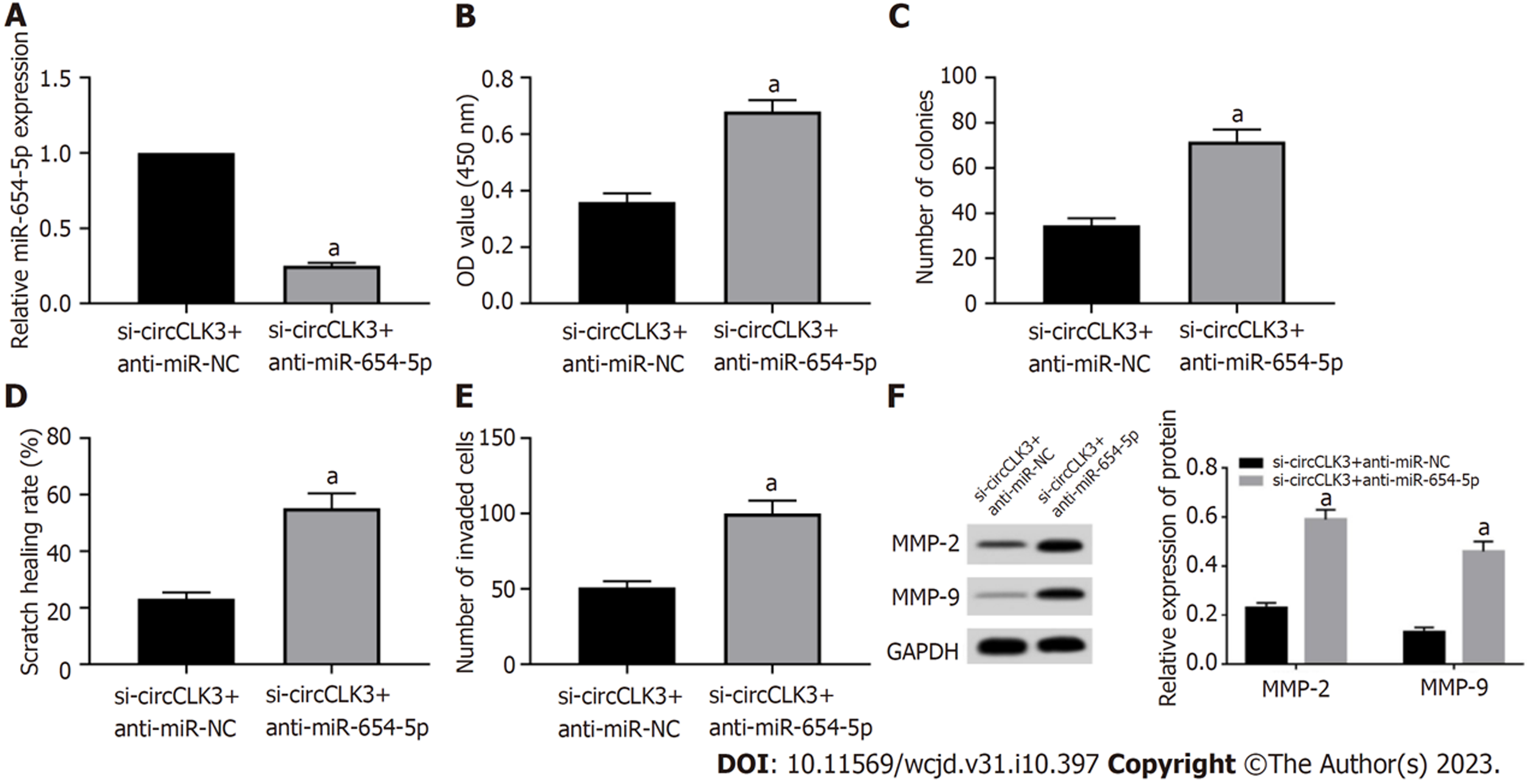
circCLK3在结直肠癌组织中高表达(P<0.05), 而miR-654-5p低表达(P<0.05); si-circCLK3可以降低细胞活力、划痕愈合率、MMP-2和MMP-9蛋白表达、克隆形成数和侵袭细胞数(P<0.05); circCLK3可负向调控miR-654-5p的表达; miR-654-5p抑制细胞活力、划痕愈合率、MMP-2和MMP-9蛋白表达、克隆形成数和侵袭细胞数(P<0.05); 另外, si-circCLK3+anti-miR-654-5p可以促进细胞活力、划痕愈合率、MMP-2和MMP-9蛋白表达、克隆形成数和侵袭细胞数(P<0.05).
circCLK3靶向miR-654-5p促进结直肠癌细胞增殖、迁移及侵袭.
核心提要: 我们的研究展示了circCLK3在结直肠癌组织和细胞SW620中显著高表达. 功能分析表明了circCLK3下调可以抑制结直肠癌细胞SW620的增殖, 迁移, 和侵袭通过靶向miR-654-5p.
引文著录: 姜丽琴, 郭赟. circCLK3通过靶向miR-654-5p促进结直肠癌细胞增殖、迁移及侵袭的机制研究. 世界华人消化杂志 2023; 31(10): 397-403
Revised: May 6, 2023
Accepted: May 18, 2023
Published online: May 28, 2023
Recent studies have investigated the role of circular RNAs (circRNAs) as significant regulatory factors in the progression of multiple cancers, containing colorectal cancer (CRC). Nevertheless, the biological functions of circCLK3 in CRC and the underlying mechanisms by which it regulates CRC progression remain unclear.
To clarify the mechanism of circCLK3 regulating colorectal cancer SW620 cell proliferation, migration, and invasion.
CRC tissues and adjacent tissues were collected, and the expression of circCLK3 and miR-654-5p was detected by qRT-PCR. SW620 cells were cultured in vitro and divided into the following groups: si-circCLK3 group, pcDNA-circCLK3 group, miR-654-5p group, si-circCLK3 + anti-miR-654-5p group, and corresponding negative control groups (si-NC group, pcDNA group, miR-NC group, and si-circCLK3 + anti-miR-NC group). CCK8 assay, colony formation test, scratch test, and Transwell test were used to detect cell proliferation, migration, and invasion. The interaction between circCLK3 and miR-654-5p was confirmed by dual-luciferase reporter assay. The protein expression of MMP-2 and MMP-9 was detected by Western blot.
circCLK3 expression was increased (P < 0.05), while miR-654-5p expression was decreased (P < 0.05) in CRC tissues. Cell viability, scratch healing rate, the protein levels of matrix metalloproteinase-2 (MMP-2) and MMP-9, the number of cell clones formed, and the number of invasive cells were decreased (P < 0.05) in the si-circCLK3 group. circCLK3 could negatively regulate the expression of miR-654-5p. Cell viability, scratch healing rate, the protein levels of MMP-2 and MMP-9, the number of cell clones formed and the number of invasive cells were decreased (P < 0.05) in the miR-654-5p group. Cell viability, scratch healing rate, the protein levels of MMP-2 and MMP-9, the number of cell clones formed, and the number of invasive cells were increased (P < 0.05) in the si-circCLK3 + anti-miR-654-5p group.
circCLK3 promotes CRC cell proliferation, migration, and invasion by targeting miR-654-5p.
- Citation: Jiang LQ, Guo Y. circCLK3 regulates colorectal cancer SW620 cell proliferation, migration, and invasion by targeting miR-654-5p. Shijie Huaren Xiaohua Zazhi 2023; 31(10): 397-403
- URL: https://www.wjgnet.com/1009-3079/full/v31/i10/397.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i10.397
结直肠癌是全球癌症相关死亡的主要原因之一, 特别是远处肿瘤扩散患者的生存率较低[1,2], 因而探究影响其发展的分子机制对于结直肠癌的治疗有重要意义. 环状RNA(circular RNA, circRNA)有微小RNA(microRNA, miRNA)的反应元件并可竞争结合miRNA从而影响蛋白表达. 研究显示[3,4], 很多circRNA在结直肠癌组织中异常表达, 并参与调控了癌细胞的恶性表型. circCLK3被发现在舌鳞癌组织中高表达, 且其敲低可降低癌细胞的增殖和转移[5]. 但circCLK3在结直肠癌中表达及其可能作用机制尚未可知. StarBase预测显示circCLK3与miR-654-5p能够通过结合位点结合. 研究表明[6], miR-654-5p在结直肠癌细胞中低表达, 且其过表达可降低癌细胞的增殖和转移. 但circCLK3是否可通过竞争性结合miR-654-5p而参与结直肠癌的发展尚不清楚. 因此, 我们探究circCLK3是否靶向miR-654-5p而调控结直肠癌细胞增殖、迁移及侵袭.
从本院招募47例结直肠癌患者, 患者年龄在19岁-70岁之间, 男性28例, 女性19例, 已发生远处肿瘤转移的患者是24例. 收集癌组织及癌旁组织并保存于-80 ℃. 本研究获得了病人或其亲属的知情同意, 且符合《世界医学协会赫尔辛基宣言》相关要求. 本研究经我院伦理委员会批准, 审查文件号: 2023002.
人结直肠癌细胞SW620购自美国ATCC; DMEM培养基、胎牛血清与胰蛋白酶购自美国Thermo Fisher; Lipofectamine2000、Trizol试剂、反转录、荧光定量PCR试剂盒购自美国Invitrogen; 质粒与寡核苷酸由上海吉玛合成; CCK8试剂盒与双荧光素酶检测试剂盒购自上海碧云天; Transwell小室、Matrigel基质胶购自美国BD; 兔抗人基质金属蛋白酶(matrix metalloproteinase, MMP)-2、MMP-9、GAPDH与二抗购自美国Abcam.
1.2.1 细胞转染: SW620细胞培养于含10%胎牛血清的DMEM并置于37 ℃、50 mL/L CO2培养箱. 根据Lipofectamine2000说明书将si-circCLK3、pcDNA-circCLK3、miR-654-5p mimics、anti-miR-654-5p及相应的对照(si-NC、pcDNA、miR-NC、anti-miR-NC)转染入细胞.
1.2.2 qRT-PCR: 总RNA用Trizol试剂提取, 然后反转录合成cDNA. 以cDNA为模板进行qRT-PCR. 采用2-ΔΔCt法计算相对表达量并以GAPDH或U6为内参.
1.2.3 CCK8: 细胞接种于96孔板培养48 h, 然后与CCK8溶液孵育. 酶标仪检测在450 nm处的光密度(OD)值.
1.2.4 克隆形成实验: 细胞接种于6孔板培养14 d. 细胞菌落用甲醇固定和结晶紫染色, 然后在显微镜下统计克隆形成数.
1.2.5 划痕实验: 细胞接种于6孔板, 待细胞长满时用20 μL枪头画出一条笔直的道痕, 然后清洗后于显微镜下拍照(0 h). 将培养板放入培养箱内继续培养24 h, 然后用ImageJ软件分析划痕愈合率.
1.2.6 Transwell: 细胞接种于预包被Matrigel基质胶的上室, 下室加入完全培养基. 48 h后, 细胞经多聚甲醛固定和结晶紫染色, 在显微镜下统计侵袭细胞数.
1.2.7 双荧光素酶报告实验: 由美国Promega公司构建完成含有circCLK3与miR-654-5p结合位点的野生型载体WT-circCLK3以及含有其突变位点的突变型载体MUT-circCLK3. SW620细胞共转染miR-NC/miR-654-5p mimics和WT-circCLK3/MUT-circCLK3, 于48 h后检测相对荧光素酶活性.
1.2.8 Western blot: 总蛋白用RIPA裂解液提取, 经SDS-PAGE电泳, 然后转移至PVDF膜上. 膜用脱脂牛奶封闭, 然后与anti-MMP-2(1:1000)、anti-MMP-9(1:1000)与anti-GAPDH(1:2000)孵育. 经二抗(1:3000)孵育后, 用ECL显示蛋白条带并用Quantity One软件进行灰度分析.
统计学处理 数据用SPSS21.0软件分析, 以(mean±SD)表示. 独立样本t检验及单因素方差分析进行组间比较, 以P<0.05为差异具有统计学意义.
分析显示circCLK3在结直肠癌组织中高表达(P<0.001), 而miR-654-5p低表达(P<0.001), 见图1.
结果显示, si-circCLK3可以抑制细胞活力和克隆形成数(P<0.001), 见图2.
si-circCLK3可以抑制划痕愈合率(P<0.001)、MMP-2和MMP-9水平(P<0.001)、侵袭细胞数(P = 0.002), 见图3.
软件分析结果显示circCLK3可以与miR-654-5p互补结合. 双荧光素酶分析结果显示miR-654-5p可以抑制WT-circCLK3的荧光素酶活性降低(P<0.001)而不影响MUT-circCLK3的荧光素酶活性. 此外, pcDNA-circCLK3可以抑制miR-654-5p的表达(P<0.001), 而si-circCLK3可以促进miR-654-5p的表达(P<0.001), 见图4.
miR-654-5p可以抑制细胞活力(P = 0.002)、划痕愈合率(P = 0.001)、MMP-2和MMP-9水平(P<0.001)、克隆形成数(P = 0.002)和侵袭细胞数(P = 0.007), 见图5.
si-circCLK3+anti-miR-654-5p可以促进细胞活力(P = 0.001)、划痕愈合率(P = 0.001)、MMP-2和MMP-9水平(P<0.001)、克隆形成数(P = 0.001)、侵袭细胞数((P = 0.002), 见图6.
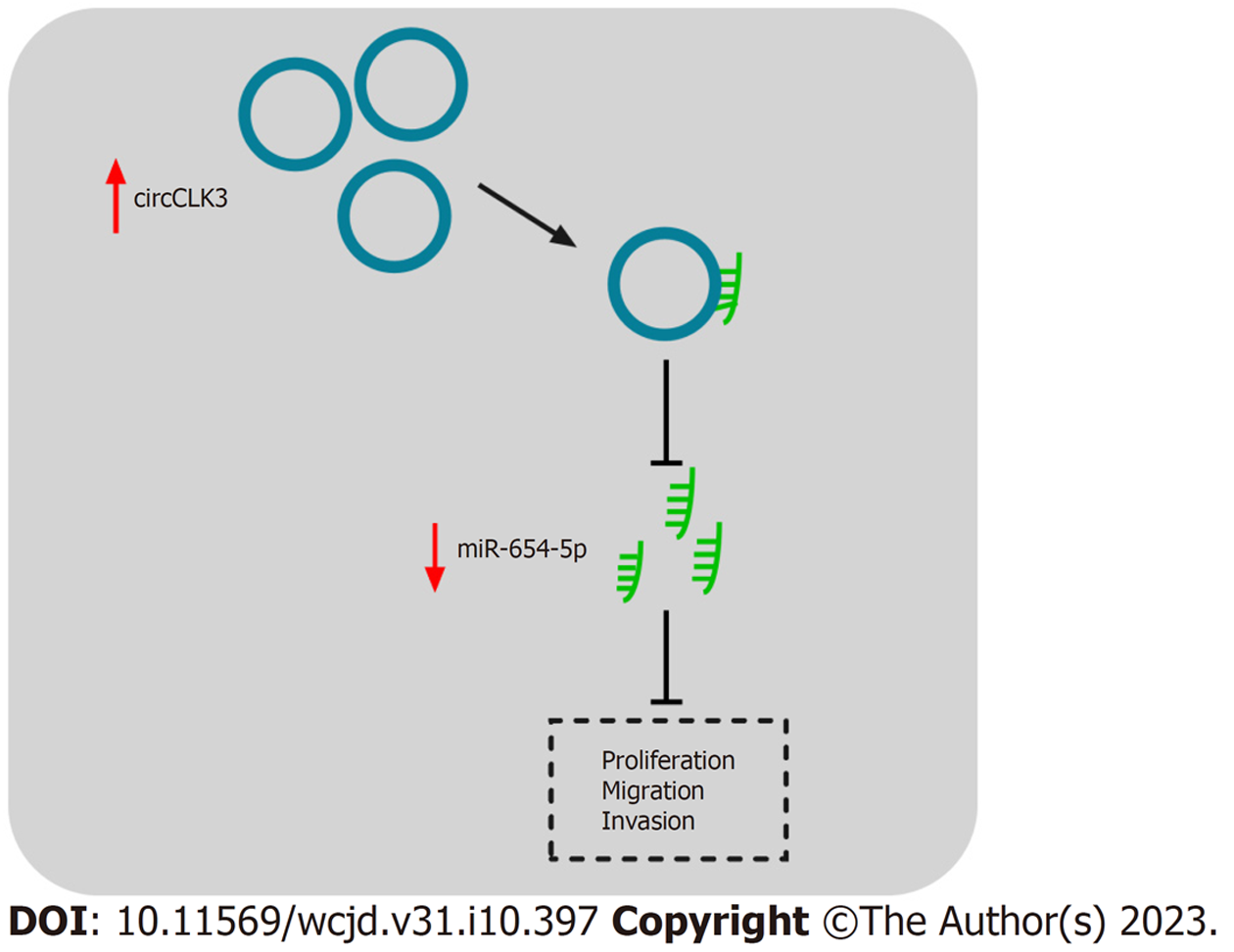
circCLK3在结直肠癌细胞中上调表达, miR-654-5p下调表达, miR-654-5p抑制结直肠癌细胞的增殖、迁移和侵袭, circCLK3通过海绵miR-654-5p降低miR-654-5p的水平促进结直肠癌的增殖、迁移和侵袭, 作用示意图见图7.
先前的研究已经表明circRNA是由3'端与5'端以共价键结合形成的一类闭合环状RNA分子, 并具有结构稳性与组织特异性等特点. 目前研究已证实circRNA参与了结直肠癌细胞增殖和转移的调控[7,8]. 另外, 大量的circRNA可作为结肠癌靶向治疗的相关靶点, 并通过靶向miRNA而正向调控靶基因的表达进而调控结直肠癌的发展[9,10].
circCLK3在宫颈癌组织中高表达, 下调其表达可抑制宫颈癌细胞的增殖和转移通过靶向miR-320a/FoxM1途径[11]. circCLK3通过充当miR-455-5p的海绵分子而下调PARVA, 进而促进舌鳞状细胞癌增殖, 迁移, 和侵袭[5]. 但circCLK3在结直肠癌进程中的作用尚未研究. 本研究发现, circCLK3在结直肠癌组织中高表达, 且其敲低可抑制癌细胞增殖. 这表明circCLK3具有促进结直肠癌细胞增殖的作用. MMP-2和MMP-9是基质金属蛋白酶, 被发现在结直肠癌中表达上调并促进细胞转移[12,13]. 本研究发现, circCLK3敲低可抑制细胞迁移及侵袭, 并降低MMP-2和MMP-9表达, 表明示circCLK3可以促进结直肠癌细胞迁移及侵袭.
为进一步探究circCLK3在结直肠癌发生发展过程中的作用机制, 本研究证实circCLK3与miR-654-5p存在靶向调控作用, circCLK3可靶向结合miR-654-5p. 既往的报道显示, miR-654-5p在乳腺癌中低表达, 其过表达可降低癌细胞的生长和侵袭能力[14]. 另外, 上调miR-654-5p可抑制骨肉瘤细胞的增殖和转移[15], 并降低卵巢癌细胞的生长能力[16,17]. 此外, miR-654-5p已经被报道在结肠癌患者中是高表达, 并且它的高表达是结肠癌患者不良的预后标志物[18]. 这可能是因为肿瘤的发生事一类极其复杂的生物学过程, 一些病例可能是因子的上调, 一些病例可能就是下调. 本研究中发现, miR-654-5p在结直肠癌组织中低表达, 其过表达可抑制结直肠癌细胞增殖和转移. 另外, anti-miR-654-5p可拮抗si-circCLK3对癌细胞增殖和转移的抑制作用, 表明circCLK3靶向miR-654-5p而促进结直肠癌发展.
综上所述, circCLK3在结直肠癌SW620细胞中上调, miR-654-5p表达下调, 干扰circCLK3可通过靶向miR-654-5p抑制结直肠癌细胞的增殖、迁移及侵袭. 这些结果意味着靶向抑制circCLK3可能是治疗结直肠癌的有效举措, 但这些研究只局限于体外的实验, 关于circCLK3在体内是如何作用于结直肠癌以及相关的作用机制仍有待继续研究.
先前的研究证实了环状RNA在包括结直肠癌在内的多种恶性肿瘤进展中发挥了重要调节因子作用. 然而, circCLK3的功能和潜在的调控机制在结直肠癌进展尚不清楚.
探索circCLK3是否可以调控结直肠癌的进展, 为临床治疗结直肠癌提供有效靶点.
以miR-654-5p为切入点探索circCLK3在结直肠癌中的作用和机制, 这可能是CRC的治疗靶点.
qRT-PCR法检测circCLK3、miR-654-5p在结直肠癌组织及癌旁组织的表达; 采用CCK8、克隆形成实验、划痕实验与Transwell实验分析细胞增殖、迁移及侵袭; 采用双荧光素酶报告分析circCLK3与miR-654-5p的靶向关系; 采用Western blot检测基质金属蛋白酶(matrix metalloproteinase, MMP)-2、MMP-9蛋白表达.
我们实验结果证实了circCLK3在结直肠癌中的作用和潜在的机制. 数据展示了circCLK3在结直肠癌组织中高表达, 而miR-654-5p低表达;功能实验验证 si-circCLK3可以降低细胞活力、划痕愈合率、MMP-2和MMP-9蛋白表达、克隆形成数和侵袭细胞数; circCLK3可负向调控miR-654-5p的表达; miR-654-5p抑制细胞活力、划痕愈合率、MMP-2和MMP-9蛋白表达、克隆形成数和侵袭细胞数; 另外, si-circCLK3+anti-miR-654-5p可以促进细胞活力、划痕愈合率、MMP-2和MMP-9蛋白表达、克隆形成数和侵袭细胞数.
这次研究揭示了circCLK3在结直肠癌组织和细胞中上调, 干扰circCLK3通过促进miR-654-5p表达来抑制结直肠癌细胞增殖、迁移及侵袭. 因此, 我们认为circCLK3/miR-654-5p轴可能对调节结直肠癌进展至关重要, 并且可能是结直肠癌的治疗靶点.
本研究了circCLK3/miR-654-5p轴可以调控结直肠癌生物恶性行为, 为临床治疗CRC提供有效靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Siegel RL, Miller KD, Wagle NS, Jemal A. Cancer statistics, 2023. CA Cancer J Clin. 2023;73:17-48. [PubMed] [DOI] |
| 2. | Dekker E, Tanis PJ, Vleugels JLA, Kasi PM, Wallace MB. Colorectal cancer. Lancet. 2019;394:1467-1480. [PubMed] [DOI] |
| 3. | Li C, Zhou H. Circular RNA hsa_circRNA_102209 promotes the growth and metastasis of colorectal cancer through miR-761-mediated Ras and Rab interactor 1 signaling. Cancer Med. 2020;9:6710-6725. [PubMed] [DOI] |
| 4. | Deng Q, Wang CJ, Hao R, Yang QY. Circ_0001982 accelerates the progression of colorectal cancer via sponging microRNA-144. Eur Rev Med Pharmacol Sci. 2021;25:2458. [PubMed] [DOI] |
| 5. | Yu H, Yu Z, Wang X, Wang D. Circular RNA circCLK3 promotes the progression of tongue squamous cell carcinoma via miR-455-5p/PARVA axis. Biotechnol Appl Biochem. 2022;69:431-441. [PubMed] [DOI] |
| 6. | Huang F, Wu X, Wei M, Guo H, Li H, Shao Z, Wu Y, Pu J. miR-654-5p Targets HAX-1 to Regulate the Malignancy Behaviors of Colorectal Cancer Cells. Biomed Res Int. 2020;2020:4914707. [PubMed] [DOI] |
| 7. | Li Y, Zang H, Zhang X, Huang G. circ_0136666 Facilitates the Progression of Colorectal Cancer via miR-383/CREB1 Axis. Cancer Manag Res. 2020;12:6795-6806. [PubMed] [DOI] |
| 8. | Wang X, Chen Y, Liu W, Liu T, Sun D. Hsa_circ_0128846 promotes tumorigenesis of colorectal cancer by sponging hsa-miR-1184 and releasing AJUBA and inactivating Hippo/YAP signalling. J Cell Mol Med. 2020;24:9908-9924. [PubMed] [DOI] |
| 9. | Li H, Jin X, Liu B, Zhang P, Chen W, Li Q. CircRNA CBL.11 suppresses cell proliferation by sponging miR-6778-5p in colorectal cancer. BMC Cancer. 2019;19:826. [PubMed] [DOI] |
| 10. | Li Z, Yao H, Wang S, Li G, Gu X. CircTADA2A suppresses the progression of colorectal cancer via miR-374a-3p/KLF14 axis. J Exp Clin Cancer Res. 2020;39:160. [PubMed] [DOI] |
| 11. | Hong H, Zhu H, Zhao S, Wang K, Zhang N, Tian Y, Li Y, Wang Y, Lv X, Wei T, Liu Y, Fan S, Liu Y, Li Y, Cai A, Jin S, Qin Q, Li H. The novel circCLK3/miR-320a/FoxM1 axis promotes cervical cancer progression. Cell Death Dis. 2019;10:950. [PubMed] [DOI] |
| 12. | Zhang L, Zhang Y, Zhu H, Sun X, Wang X, Wu P, Xu X. Overexpression of miR-301a-3p promotes colorectal cancer cell proliferation and metastasis by targeting deleted in liver cancer-1 and runt-related transcription factor 3. J Cell Biochem. 2019;120:6078-6089. [PubMed] [DOI] |
| 13. | Zhou T, Wu L, Wang Q, Jiang Z, Li Y, Ma N, Chen W, Hou Z, Gan W, Chen S. MicroRNA-128 targeting RPN2 inhibits cell proliferation and migration through the Akt-p53-cyclin pathway in colorectal cancer cells. Oncol Lett. 2018;16:6940-6949. [PubMed] [DOI] |
| 14. | Tan YY, Xu XY, Wang JF, Zhang CW, Zhang SC. MiR-654-5p attenuates breast cancer progression by targeting EPSTI1. Am J Cancer Res. 2016;6:522-532. [PubMed] |
| 15. | Xu XZ, Song H, Zhao Y, Zhang L. MiR-654-5p regulated cell progression and tumor growth through targeting SIRT6 in osteosarcoma. Eur Rev Med Pharmacol Sci. 2020;24:3517-3525. [PubMed] [DOI] |
| 16. | Li ZY, Wang XL, Dang Y, Zhu XZ, Zhang YH, Cai BX, Zheng L. Long non-coding RNA UCA1 promotes the progression of paclitaxel resistance in ovarian cancer by regulating the miR-654-5p/SIK2 axis. Eur Rev Med Pharmacol Sci. 2020;24:591-603. [PubMed] [DOI] |
| 17. | Majem B, Parrilla A, Jiménez C, Suárez-Cabrera L, Barber M, Marín A, Castellví J, Tamayo G, Moreno-Bueno G, Ponce J, Matias-Guiu X, Alameda F, Romero I, Sánchez JL, Pérez-Benavente A, Moran S, Esteller M, Reventós J, Rigau M, Gil-Moreno A, Segura MF, Santamaría A. MicroRNA-654-5p suppresses ovarian cancer development impacting on MYC, WNT and AKT pathways. Oncogene. 2019;38:6035-6050. [PubMed] [DOI] |
| 18. | Li P, Cai JX, Han F, Wang J, Zhou JJ, Shen KW, Wang LH. Expression and significance of miR-654-5p and miR-376b-3p in patients with colon cancer. World J Gastrointest Oncol. 2020;12:492-502. [PubMed] [DOI] |