修回日期: 2022-01-20
接受日期: 2022-03-26
在线出版日期: 2022-04-08
circRNA在结直肠癌(colorectal cancer, CRC)组织、细胞系和血浆中异常表达, 与CRC临床恶性特征密切相关, 但CRC中环状RNA VANGL1(circular RNA VANGL1, circ_VANGL1)的表达及其功能机制仍不清楚. 假设circ_VANGL1通过微小RNA(microRNA, miR)-493-5p/脆性X相关基因1(fragile X-related gene 1, FXR1)轴影响CRC细胞的增殖、迁移和侵袭.
探讨circ_VANGL1调控miR-493-5p/FXR1对CRC细胞增殖、迁移和侵袭的影响.
Western blot检测FXR1在CRC组织和癌旁组织中表达. RT-qPCR检测circ_VANGL1和miR-493-5p表达. 体外培养CRC细胞Caco-2, 将其分为si-circ_VANGL1组、si-NC组、miR-NC组、miR-493-5p mimic组、si-circ_VANGL1+miR-493-5p Inhibitor组. 细胞计数试剂盒(cell counting kit-8, CCK-8)和克隆形成实验评估Caco-2增殖能力. Transwell实验评估Caco-2迁移和侵袭能力. 双荧光素酶报告实验检测RNAs(circ_VANGL1和miR-493-5p、miR-493-5p和FXR1)之间的相互作用.
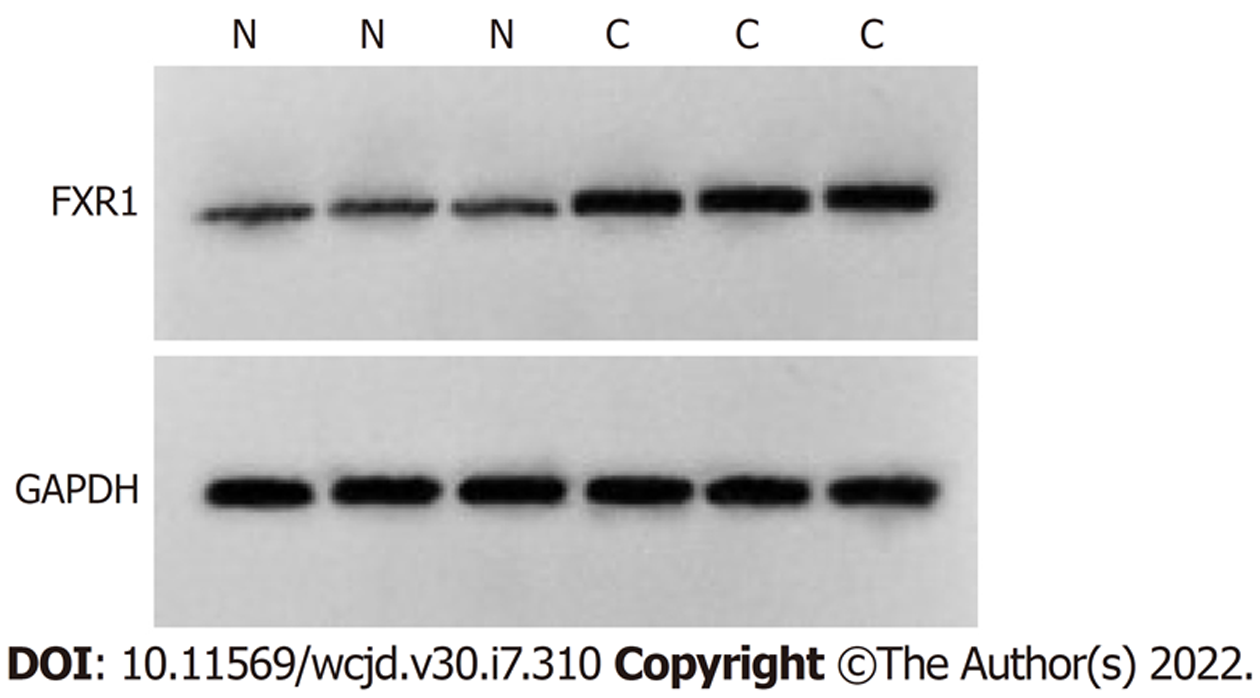
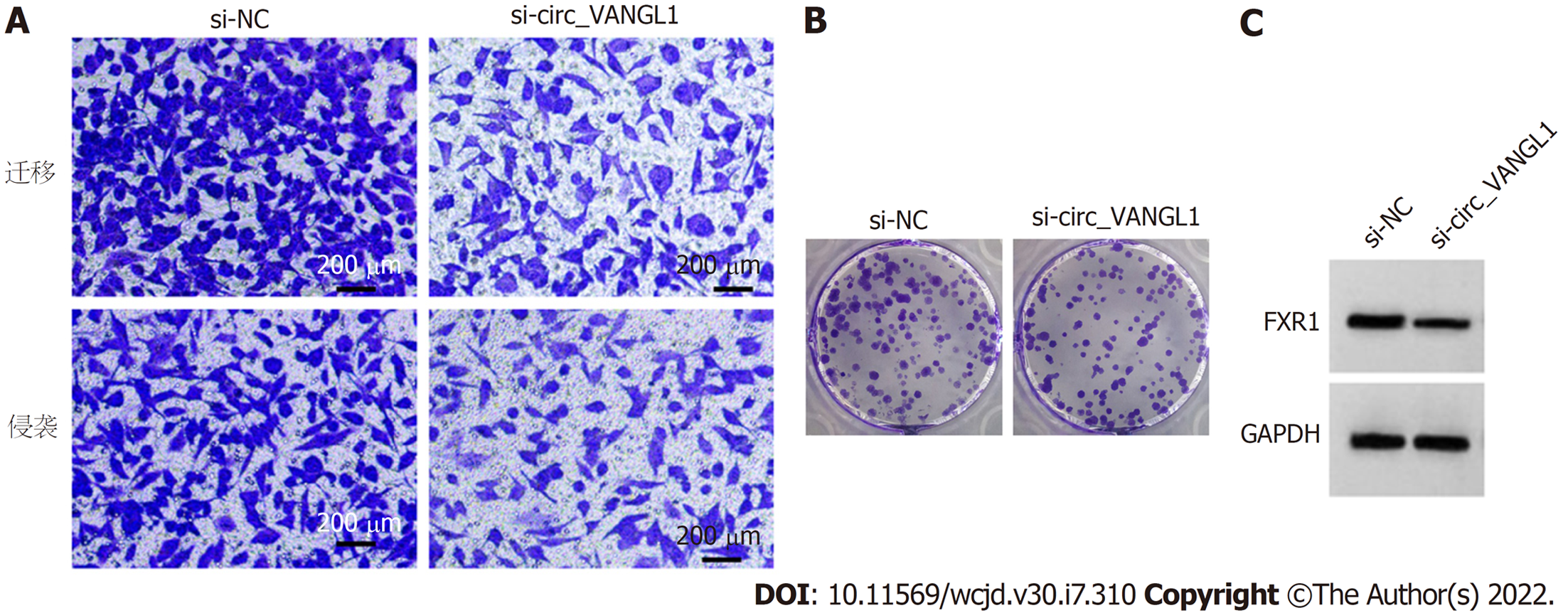
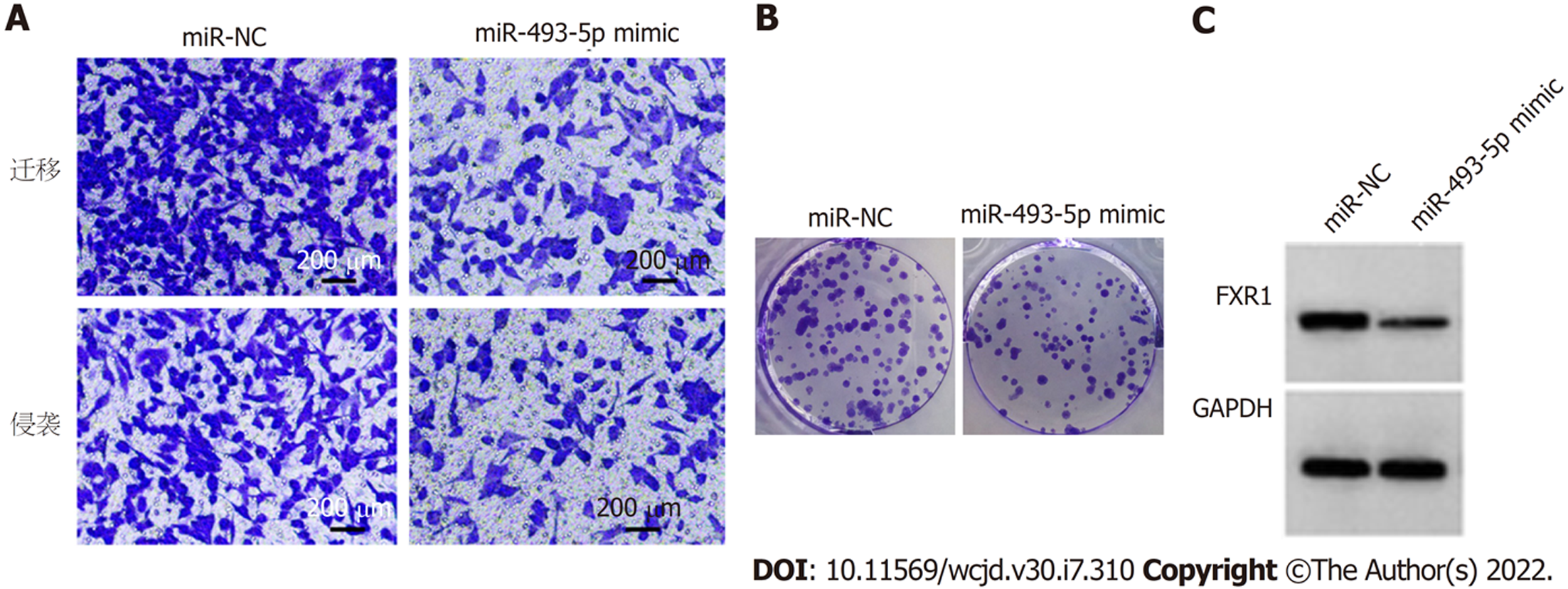
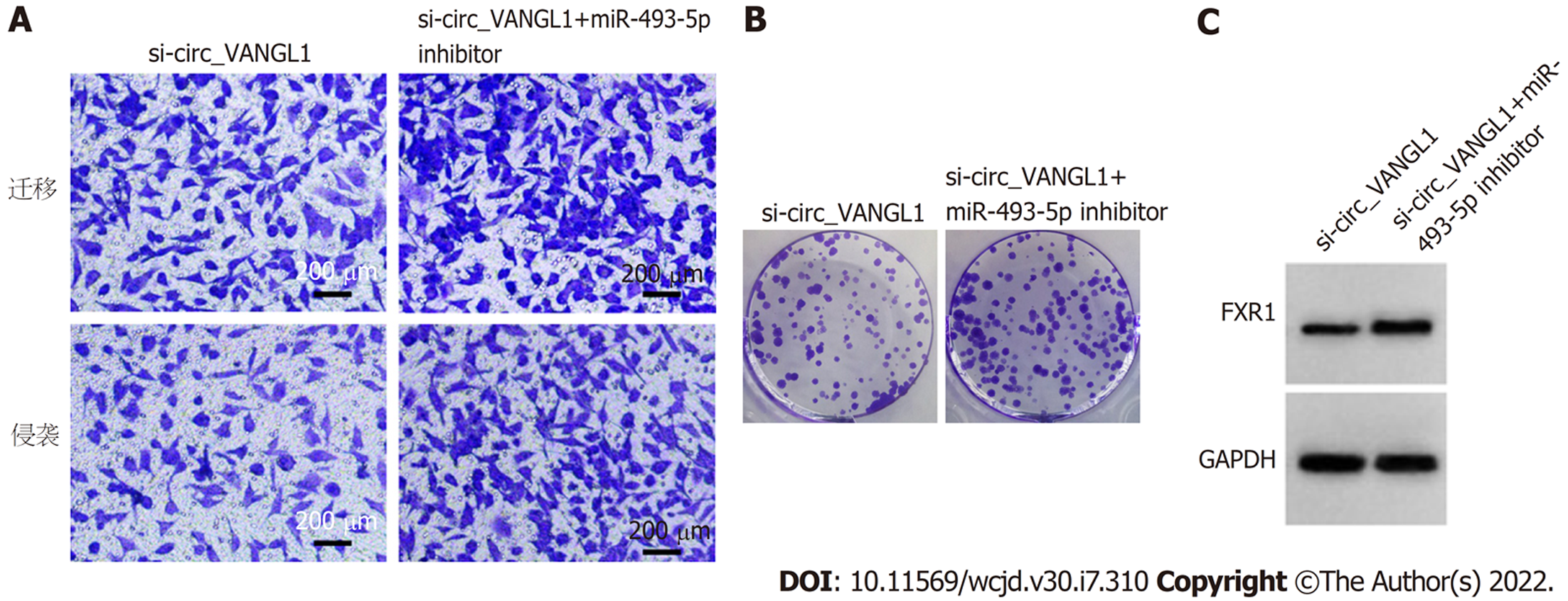
与癌旁组织比较, CRC组织中circ_VANGL1相对水平、FXR1蛋白表达显著升高(P<0.05), miR-493-5p相对水平显著降低(P<0.05). 与si-NC组比较, si-circ_VANGL1组Caco-2细胞抑制率、miR-493-5p相对水平显著升高(P<0.05), FXR1蛋白表达、克隆形成数、迁移数、侵袭数显著降低(P<0.05). 与miR-NC组比较, miR-493-5p mimic组Caco-2细胞抑制率显著升高(P<0.05), FXR1蛋白表达、克隆形成数、迁移数、侵袭数显著降低(P<0.05). circ_VANGL1直接与miR-493-5p结合. 与si-circ_VANGL1组比较, si-circ_VANGL1+miR-493-5p Inhibitor组Caco-2细胞抑制率显著降低(P<0.05), FXR1蛋白表达、克隆形成数、迁移数、侵袭数显著升高(P<0.05).
沉默circ_VANGL1通过靶向miR-493-5p/FXR1轴抑制CRC细胞增殖、迁移和侵袭.
核心提要: 本研究首次揭示了CRC组织中circ_VANGL1相对水平升高, circ_VANGL1在CRC细胞增殖和转移中具有致癌作用, 沉默circ_VANGL1通过靶向miR-493-5p/FXR1轴抑制CRC细胞增殖、迁移和侵袭.
引文著录: 朱丽燕, 占路娟, 卢吉英. Circ_VANGL1调控miR-493-5p/FXR1影响结直肠癌细胞增殖、迁移和侵袭. 世界华人消化杂志 2022; 30(7): 310-317
Revised: January 20, 2022
Accepted: March 26, 2022
Published online: April 8, 2022
CircRNAs are abnormally expressed in colorectal cancer (CRC) tissues, cell lines, and plasma, and are closely related to the clinical malignant characteristics of CRC. However, the expression and functional mechanism of circ_VANGL1 in CRC are still unclear. We hypothesized that circ_VANGL1 affects the proliferation, migration, and invasion of CRC cells by regulating the miR-493-5p/fragile X-related gene 1 (FXR1) axis.
To investigate the effect of circ_VANGL1 on the prolife-ration, migration, and invasion of CRC cells and the possible mechanism involved.
Western blot was used to detect the expression of FXR1 in CRC tissues and adjacent tissues. RT-qPCR was performed to detect the expression of circ_VANGL1 and miR-493-5p. CRC cells Caco-2 were cultured in vitro and divided into si-circ_VANGL1 group, si-NC group, miR-NC group, miR-493-5p mimic group, and si-circ_VANGL1 + miR-493-5p inhibitor group. CCK-8 and clone formation assays were performed to evaluate the proliferation ability of Caco-2 cells. Transwell assay was employed to evaluate the migration and invasion ability of Caco-2 cells. Dual luciferase reporter assay was used to detect the interaction between RNAs (circ_VANGL1 and miR-493-5p, miR-493-5p, and FXR1).
Compared with tumor adjacent tissues, the relative expression levels of circ_VANGL1 and FXR1 protein in CRC tissue were significantly increased (P < 0.05), but the relative level of miR-493-5p was significantly decreased (P < 0.05). Compared with the si-NC group, the inhibition rate of Caco-2 cells and the relative level of miR-493-5p in the si-circ_VANGL1 group were significantly increased (P < 0.05), but the expression of FXR1 protein, the number of colonies formed, and the migration and invasion ability were significantly reduced (P < 0.05). Compared with the miR-NC group, the inhibition rate of Caco-2 cells in the miR-493-5p mimic group was significantly increased (P < 0.05), but the expression of FXR1 protein, the number of colonies formed, and the migration and invasion ability were significantly reduced (P < 0.05). Circ_VANGL1 directly bound to miR-493-5p. Compared with the si-circ_VANGL1 group, the inhibition rate of Caco-2 cells in the si-circ_VANGL1 + miR-493-5p inhibitor group was significantly reduced (P < 0.05), but the expression of FXR1 protein, the number of colonies formed, and the migration and invasion ability were significantly increased (P < 0.05).
Silencing circ_VANGL1 inhibits the proliferation, migration, and invasion of CRC cells by regulating the miR-493-5p/FXR1 axis.
- Citation: Zhu LY, Zhan LJ, Lu JY. Circ_VANGL1 affects proliferation, migration, and invasion of colorectal cancer cells by regulating miR-493-5p/FXR1 axis. Shijie Huaren Xiaohua Zazhi 2022; 30(7): 310-317
- URL: https://www.wjgnet.com/1009-3079/full/v30/i7/310.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i7.310
结直肠癌(colorectal cancer, CRC)是癌症相关死亡的主要原因之一, 预测显示, 到2030年CRC年新增病例将超过220万例, 年死亡病将超过110万例[1]. CRC患者预后不良与肿瘤转移有关[2]. 因此, 明确CRC转移机制对于开发新的治疗策略、改善CRC患者预后意义重大. 环状RNA(circular RNA, circRNA)是非编码RNA家族成员, 具有闭环结构, 缺少5'端和3'端. circRNA表达异常与CRC等多种癌症的发生和发展密切相关[3]. 资料显示, 环状RNA VANGL1(circRNA VANGL1, circ_VANGL1)在膀胱癌中表达升高, 其高表达与患者预后不良以及癌细胞异常增殖和侵袭有关[4]. 靶基因预测显示, 微小RNA(microRNA, miR)-493-5p是circ_VANGL1的潜在靶点. miR-493-5p在CRC中表达水平降低, miR-493-5p的上调可降低CRC细胞恶性增殖和迁移能力[5]. 靶基因预测还显示, 脆性X相关基因1(fragile X-related gene 1, FXR1)是miR-493-5p的潜在靶点. 此前研究表明[6], FXR1高表达与CRC患者预后差相关, 它可增强CRC细胞增殖、侵袭能力, 发挥肿瘤启动子作用. 基于上述文献, 本研究以miR-493-5p、FXR1为切入点, 探讨circ_VANGL1在CRC中的作用和分子机制.
1.1.1 组织来源: CRC组织和对应癌旁组织为2017-06/2019-06在我院接受手术治疗的29例CRC患者的组织样本. 其中, 男性18例, 女性11例, 年龄45-75岁, 中位年龄64岁. 入组患者术前均未接受化疗或放疗, 且将急性或慢性感染、其他原发恶性肿瘤患者排除在外. 本研究经我院伦理委员会批准, 并获得每位患者的知情同意. CRC组织样本在液氮中冷冻, 并在-80 ℃保存备用.
1.1.2 细胞和试剂: CRC细胞Caco-2购自美国ATCC; SYBR Green PCR Master Mix试剂盒购自大连Takara公司; TaqMan miRNA逆转录试剂盒、M-MLV逆转录酶购自北京百奥莱博生物公司; 放射免疫沉淀测定(radio-immunoprecipitation assay, RIPA)裂解液、聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜、化学发光检测试剂盒购自北京康为世纪生物公司; 细胞计数试剂盒(cell counting kit-8, CCK-8)、磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)兔多抗(ab9485)、FXR1兔多抗(ab155124)、山羊抗兔IgG抗体(ab205718)购自中国Abcam公司; Transwell室(24孔)购自美国Corning公司; 重组荧光素酶报告载体购自广州锐博生物公司.
1.2.1 RT-qPCR检测CRC组织circ_VANGL1和miR-493-5p表达: 为检测circ_VANGL1表达用M-MLV逆转录酶合成cDNA. 为检测miR-493-5p表达用TaqMan miRNA逆转录试剂盒合成cDNA. 采用SYBR Green PCR Master Mix试剂盒进行RT-qPCR检测组织样品中circ_VANGL1和miR-493-5p表达. 2-△△Ct法计算相对表达量. GAPDH为circ_VANGL1的内参, U6为miR-493-5p的内参. 引物序列: circ_VANGL1上游5′-CTACAGCC TGGGACACCTGAG-3′, 下游5′-CCTCTGCCGTCTTTATTG-3′; GAPDH上游5′-GGTATCGTGGAAGGACTCATGAC-3′, 下游5′-ATGCCAGTGAGCTTCCCGT-3′; miR-493-5p上游5′-TCCTACGGAGAGGCTCAG-3′, 下游5′-TCCTCGTAGTCCAACACG-3′; U6上游5′-CTCGCTTC GGCAGCACA-3, 下游5′-AACGCTTCACGAATTTGCGT-3′.
1.2.2 Western blot检测CRC组织FXR1蛋白表达: RIPA裂解液提取CRC组织和癌旁组织样本中总蛋白. 取50 μg变性蛋白上样到10%凝胶上进行聚丙烯酰胺凝胶电泳, 随后湿转到PVDF膜上. 膜用5%脱脂牛奶封闭后, 分别进行一抗反应、二抗反应. 向PVDF膜滴加化学发光溶液显影. GAPDH作为内参, 应用Image J软件分析FXR1蛋白相对表达量.
1.2.3 细胞培养和实验分组: Caco-2细胞在37 ℃、含95%空气、含5% CO2的培养箱中, 用含10%胎牛血清和1%青链霉素混合液的DMEM培养基培养. 取1×104个第3代对数期Caco-2细胞接种24孔板. 将脂质体Lip2000、待转染序列分别溶于50 μL无血清培养, 孵育5 min后将Lip2000与待转染序列混匀, 并在室温静置20 min. 当细胞50%汇合时, 弃去培养液, 加入100 μL混合物和400 μL无血清培养基, 孵育6 h更换为500 μL含10%胎牛血清DMEM培养基. 收集转染48 h Caco-2细胞, RT-qPCR检测细胞中circ_VANGL1和/或miR-493-5p相对水平. 根据转染序列不同, Caco-2细胞分为si-circ_VANGL1组、si-NC组、miR-NC组、miR-493-5p mimic组、si-circ_VANGL1+miR-493-5p Inhibitor组.
1.2.4 CCK-8和克隆形成实验检测细胞增殖: CCK-8实验: 每组取5×103个Caco-2细胞接种96孔板, 培养48 h后弃去培养基, 每孔加入90 μL DMEM培养基和10 μL CCK-8试剂, 继续孵育2.5 h. 酶标仪测定450 nm处吸光度(A)值. 抑制率 = (1-A实验/A对照)×100%.
克隆形成实验: 每组取4×102个Caco-2细胞接种到6孔板, 晃动平板使细胞均匀分散. 培养箱孵育约2 w直到现细胞克隆. 取出6孔板, 弃去培养液. 磷酸盐缓冲液小心漂洗2次, 室温下用甲醇固定20 min, 用0.1%结晶紫染色20 min. 显微镜下拍照, 计数大于50个细胞的克隆数.
1.2.5 Transwell实验检测细胞迁移和侵袭: 每组取1×105个Caco-2细胞悬浮在200 μL无血清培养基中, 并接种到Transwell装置上室. Transwell装置下室加入500 μL含有20%胎牛血清的完全培养基作为Caco-2转移的化学诱导剂. 将Transwell装置放入培养箱孵24 h. 取出Transwell装置, 用棉签将上室擦去上室非迁移细胞, 用甲醇固定膜下表面迁移细胞, 0.1%结晶紫染色后, 置于倒置显微镜下拍照, 随机选择5个视野计数染色数, 以平均值表示细胞迁移数量. 侵袭测定时先用基质胶包被Transwell装置上室膜, 其与步骤同迁移检测.
1.2.6 双荧光素酶报告实验: 将包含miR-493-5p结合位点的circ_VANGL1或FXR1-3'-非编码区(3'-untranslated region, 3'-UTR)野生型(wild type, WT)序列以及不含miR-493-5p结合位点的circ_VANGL1或FXR1-3'-UTR突变型(mutant type, MUT)序列克隆到双荧光素酶报告基因pmirGLO载体中, 构建成重组载体WT-circ_VANGL1、WT-FXR1、MUT-circ_VANGL1、MUT-FXR1. 将上述重组载体分别与miR-493-5p mimic或miR-NC共转染Caco-2细胞. 转染48 h裂解细胞, 双荧光素酶报告物检测系统评估Caco-2细胞相对荧光素酶活性.
统计学处理 用SPSS 20.0进行统计分析, 数据以mean±SD表示. 两组数据的差异采用独立样本t检验分析, 多组间的数据差异采用单因素方差分析和LSD-t检验. P<0.05为差异有统计学意义.
CRC组织中circ_ VANGL1相对水平、FXR1蛋白表达显著高于癌旁组织(P<0.05), miR-493-5p相对水平显著低于癌旁组织(P<0.05). 见图1和表1.
转染si-circ_VANGL1后Caco-2细胞circ_VANGL1相对水平显著低于si-NC组(P<0.05), 表明转染si-circ_VANGL1可抑制circ_VANGL1表达. 与si-NC组比较, si-circ_VANGL1组Caco-2细胞miR-493-5p相对水平、抑制率显著升高(P<0.05), FXR1蛋白表达、克隆形成数、迁移数、侵袭数显著降低(P<0.05). 见图2和表2.
Starbase预测到circ_VANGL1和miR-493-5p存在互补序列, 见图3. 与miR-NC和WT-circ_VANGL1共转染比较, miR-493-5p mimic和WT-circ_VANGL1共转染后细胞相对荧光素酶活性显著降低(P<0.05), 与miR-NC和MUT-circ_VANGL1共转染比较, miR-493-5p mimic和MUT-circ_VANGL1共转染后细胞相对荧光素酶活性差异不显著, 见表3.
| 分组 | WT-circ_VANGL1 | MUT-circ_VANGL1 |
| miR-NC | 1.02±0.12 | 1.00±0.13 |
| miR-493-5p | 0.45±0.04b | 0.98±0.08 |
| t | 13.519 | 0.393 |
| P | <0.001 | 0.699 |
转染miR-493-5p mimic后Caco-2细胞miR-493-5p相对水平显著高于miR-NC组(P<0.05), 表明转染miR-493-5p mimic可促进miR-493-5p表达. 与miR-NC组比较, miR-493-5p mimic组Caco-2细胞抑制率显著升高(P<0.05), FXR1蛋白表达、克隆形成数、迁移数、侵袭数显著降低(P<0.05). 见图4和表4.
Targetscan预测到miR-493-5p和FXR1-3'-UTR存在互补序列, 见图5. 与miR-NC和WT-FXR1共转染比较, miR-493-5p mimic和WT-FXR1共转染后细胞相对荧光素酶活性显著降低(P<0.05), 与miR-NC和MUT-FXR1共转染比较, miR-493-5p mimic和MUT-circ_FXR1共转染后细胞相对荧光素酶活性差异不显著, 见表5.
| 分组 | WT-FXR1 | MUT-FXR1 |
| miR-NC | 0.99±0.10 | 1.04±0.12 |
| miR-493-5p | 0.31±0.03b | 1.00±0.10 |
| t | 19.450 | 0.768 |
| P | <0.001 | 0.454 |
与si-circ_VANGL1组比较, si-circ_VANGL1+miR-493-5p Inhibitor组Caco-2细胞miR-493-5p相对水平、抑制率显著降低, FXR1蛋白表达、克隆形成数、迁移数、侵袭数显著升高(P<0.05), 见图6和表6.
越来越多的证据表明, circRNA在CRC组织、细胞系和血浆中异常表达, 与结直肠癌的临床恶性特征密切相关[7], 如hsa_circ_0005273[8], circRNA_0000392[9]. 然而CRC中circ_VANGL1的表达及潜在功能仍然未知. circ_VANGL1在人非小细胞肺癌(non-small cell lung cancer, NSCLC)中表达增加, 其高表达与NSCLC患者总生存期缩短、较差的临床病理特征相关, 且circ_VANGL1通过与miR-195相互作用促进NSCLC细胞增殖和其迁移, 加速NSCLC进展[10]. circ_VANGL1在膀胱癌中表达上调, circ_VANGL1沉默通过调节miR-1184/胰岛素样生长因子结合蛋白2分子轴抑制膀胱癌细胞恶性生物学行为[11,12]. 胃癌中circ_VANGL1表达增加, 慢病毒载体介导的circ_VANGL1下调可激活线粒体凋亡通路, 诱导胃癌细胞凋亡[13]. 本研究首次揭示了CRC组织中circ_VANGL1相对水平升高, 提示circ_VANGL1可能在CRC进展中发挥促癌作用. 功能实验显示, 沉默circ_VANGL1表达可降低Caco-2细胞增殖、克隆形成、迁移和侵袭能力, 表明circ_VANGL1在CRC细胞增殖和转移中具有致癌作用.
目前研究认为circ_VANGL1可作为miRNA"海绵"抑制miRNA对其靶mRNA表达的调节作用, 进而参与调控细胞生物学过程和疾病进展, 例如circ_VANGL1通过靶向miR-217上调核心结合因子α1表达能够调控成骨分化和骨质疏松进展[14]. 本研究证实circ_VANGL1可靶向负调控miR-493-5p. 研究表明miR-493-5p靶向DKK2可抑制CRC细胞有氧糖酵解和血管生成[15]. miR-493-5p通过靶向FUT4能够减弱人乳腺癌的侵袭性和致瘤性[16]. 长链非编码RNA NR2F1-AS1充当miR-493-5p的"分子海绵"上调整合素β1的表达促进NSCLC发生和转移[17]. 本研究发现CRC组织中miR-493-5p表达降低, 转染miR-493-5p mimic过表达miR-493-5p可降低Caco-2细胞增殖、克隆形成、迁移和侵袭能力, 这与Cui等[5]报道吻合. FXR1是脊椎动物中高度保守的胞浆RNA结合蛋白, 其肿瘤发生中作用已被研究. FXR1在胶质瘤中表达增加, 下调FXR1可抑制胶质瘤进展[18]. 前列腺癌细胞中FXR1表达缺失与细胞增殖、迁移、侵袭能力的减弱有关[19]. FXR1通过与circ_0000079相互作用降低NSCLC细胞的侵袭性和耐药性[20]. 本研究发现CRC组织中FXR1蛋白表达增加, 并证实FXR1为miR-493-5p的直接靶点. 由于沉默circ_VANGL1表达、过表达miR-493-5p均可下调FXR1蛋白表达、抑制CRC细胞恶性生物学行为, 本研究推测在CRC中存在circ_VANGL1/miR-493-5p/FXR1调控途径. 为证实沉默circ_VANGL1在CRC中的抗癌作用依赖于上调miR-493-5p/FXR1轴, 本研究将si-circ_VANGL1和miR-493-5p Inhibitor共转染Caco-2细胞, 结果显示, 抑制miR-493-5p表达显著减弱沉默circ_VANGL1对FXR1蛋白表达的抑制作用以及对Caco-2细胞的抗增殖、抗迁移和抗侵袭作用, 这表明circ_VANGL1至少通过调控miR-493-5p/FXR1轴在CRC中发挥作用.
总之, CRC组织中circ_VANGL1和FXR1蛋白表达上调, miR-493-5p表达下调. 沉默circ_VANGL1通过调控miR-493-5p/FXR1轴抑制CRC细胞增殖、迁移和侵袭. 因此, 靶向抑制circ_VANGL1/miR-493-5p/FXR1途径有可能成为CRC治疗的新方向.
结直肠癌(colorectal cancer, CRC)已逐渐成为全球人类健康和生命最致命的威胁之一. 尽管有报道表明circRNA与CRC的进展和转移有关, 但在这些过程中, circRNA的生物学功能仍然很大程度上未知, 包括circ_VANGL1.
探讨circ_VANGL1在CRC中的表达情况, 以及是否通过调控miR-493-5p/FXR1轴影响CRC细胞增殖、迁移和侵袭. 这对于明确CRC转移机制对于开发新的治疗策略、改善CRC患者预后意义重大.
确定circ_VANGL1在CRC中的表达, 并阐明circ_VANGL1是否通过调控miR-493-5p/FXR1轴影响CRC细胞增殖、迁移和侵袭.
采用RT-qPCR检测CRC组织中circ_VANGL1表达, 采用细胞计数试剂盒(cell counting kit-8, CCK-8)、克隆形成实验、Transwell实验评估沉默circ_VANGL1对Caco-2增殖能力、迁移和侵袭能力的影响. 双荧光素酶报告实验检测miR-493-5p和circ_VANGL1、FXR1之间的靶向关系.
研究达到实验目标, 本研究首次发现CRC组织中circ_VANGL1表达增强, 而沉默circ_VANGL1表达使CRC Caco-2细胞的增殖、克隆形成、迁移和侵袭能力被抑制. 此外, circ_VANGL1通过充当miR-493-5p的分子海绵, 调控Caco-2细胞中FXR1的表达.
circ_VANGL1通过靶向miR-493-5p调节CRC细胞中FXR1的表达, 来促进细胞增殖和转移, 作为致癌circRNA促进CRC进展.
因此, 靶向抑制circ_VANGL1/miR-493-5p/FXR1途径有可能成为CRC治疗的新方向. 未来将进一步利用动物模型探讨circ_VANGL1/miR-493-5p/FXR1在CRC中的功能.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Arnold M, Sierra MS, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global patterns and trends in colorectal cancer incidence and mortality. Gut. 2017;66:683-691. [PubMed] [DOI] |
| 2. | Abedi P, Bayat A, Ghasemzadeh S, Raad M, Pashaiefar H, Ahmadvand M. Upregulated miR-410 is linked to poor prognosis in colorectal cancer. Br J Biomed Sci. 2020;77:118-122. [PubMed] [DOI] |
| 3. | Zhang HD, Jiang LH, Sun DW, Hou JC, Ji ZL. CircRNA: a novel type of biomarker for cancer. Breast Cancer. 2018;25:1-7. [PubMed] [DOI] |
| 4. | Zeng Z, Zhou W, Duan L, Zhang J, Lu X, Jin L, Yu Y. Circular RNA circ-VANGL1 as a competing endogenous RNA contributes to bladder cancer progression by regulating miR-605-3p/VANGL1 pathway. J Cell Physiol. 2019;234:3887-3896. [PubMed] [DOI] |
| 5. | Cui FC, Chen Y, Wu XY, Hu M, Qin WS. MicroRNA-493-5p suppresses colorectal cancer progression via the PI3K-Akt-FoxO3a signaling pathway. Eur Rev Med Pharmacol Sci. 2020;24:4212-4223. [PubMed] [DOI] |
| 6. | Jin X, Zhai B, Fang T, Guo X, Xu L. FXR1 is elevated in colorectal cancer and acts as an oncogene. Tumour Biol. 2016;37:2683-2690. [PubMed] [DOI] |
| 7. | Zeng K, Wang S. Circular RNAs: The crucial regulatory molecules in colorectal cancer. Pathol Res Pract. 2020;216:152861. [PubMed] [DOI] |
| 8. | Yang H, Li X, Meng Q, Sun H, Wu S, Hu W, Liu G, Li X, Yang Y, Chen R. CircPTK2 (hsa_circ_0005273) as a novel therapeutic target for metastatic colorectal cancer. Mol Cancer. 2020;19:13. [PubMed] [DOI] |
| 9. | Xu H, Liu Y, Cheng P, Wang C, Liu Y, Zhou W, Xu Y, Ji G. CircRNA_0000392 promotes colorectal cancer progression through the miR-193a-5p/PIK3R3/AKT axis. J Exp Clin Cancer Res. 2020;39:283. [PubMed] [DOI] |
| 10. | Wang L, Ma H, Kong W, Liu B, Zhang X. Up-regulated circular RNA VANGL1 contributes to progression of non-small cell lung cancer through inhibition of miR-195 and activation of Bcl-2. Biosci Rep. 2019;39. [PubMed] [DOI] |
| 11. | Yang D, Qian H, Fang Z, Xu A, Zhao S, Liu B, Li D. Silencing circular RNA VANGL1 inhibits progression of bladder cancer by regulating miR-1184/IGFBP2 axis. Cancer Med. 2020;9:700-710. [PubMed] [DOI] |
| 12. | Wang S, Fu S, Chen Q, Liu Y, Li Z, Sun T. Prognostic Role of Circular RNAs Expression in Bladder Carcinoma: A Meta-Analysis. Genet Test Mol Biomarkers. 2020;24:692-700. [PubMed] [DOI] |
| 13. | 谢 津璧, 王 善娟, 郭 润生, 张 丽航, 刘 艳丽. 环状RNA-VANGL1对胃癌细胞增殖和凋亡的作用及机制研究. 同济大学学报(医学版). 2019;40:281-287. [DOI] |
| 14. | Yang L, Zeng Z, Kang N, Yang JC, Wei X, Hai Y. Circ-VANGL1 promotes the progression of osteoporosis by absorbing miRNA-217 to regulate RUNX2 expression. Eur Rev Med Pharmacol Sci. 2019;23:949-957. [PubMed] [DOI] |
| 15. | Deng F, Zhou R, Lin C, Yang S, Wang H, Li W, Zheng K, Lin W, Li X, Yao X, Pan M, Zhao L. Tumor-secreted dickkopf2 accelerates aerobic glycolysis and promotes angiogenesis in colorectal cancer. Theranostics. 2019;9:1001-1014. [PubMed] [DOI] |
| 16. | Zhao L, Feng X, Song X, Zhou H, Zhao Y, Cheng L, Jia L. miR-493-5p attenuates the invasiveness and tumorigenicity in human breast cancer by targeting FUT4. Oncol Rep. 2016;36:1007-1015. [PubMed] [DOI] |
| 17. | Zhang C, Wu S, Song R, Liu C. Long noncoding RNA NR2F1-AS1 promotes the malignancy of non-small cell lung cancer via sponging microRNA-493-5p and thereby increasing ITGB1 expression. Aging (Albany NY). 2020;13:7660-7675. [PubMed] [DOI] |
| 18. | Cao S, Zheng J, Liu X, Liu Y, Ruan X, Ma J, Liu L, Wang D, Yang C, Cai H, Li Z, Feng Z, Xue Y. FXR1 promotes the malignant biological behavior of glioma cells via stabilizing MIR17HG. J Exp Clin Cancer Res. 2019;38:37. [PubMed] [DOI] |
| 19. | Cao H, Gao R, Yu C, Chen L, Feng Y. The RNA-binding protein FXR1 modulates prostate cancer progression by regulating FBXO4. Funct Integr Genomics. 2019;19:487-496. [PubMed] [DOI] |
| 20. | Chen C, Zhang M, Zhang Y. Circ_0000079 Decoys the RNA-Binding Protein FXR1 to Interrupt Formation of the FXR1/PRCKI Complex and Decline Their Mediated Cell Invasion and Drug Resistance in NSCLC. Cell Transplant. 2020;29:963689720961070. [PubMed] [DOI] |