修回日期: 2022-01-17
接受日期: 2022-02-27
在线出版日期: 2022-03-08
牵牛子可用于便秘的治疗,而其主要的药理活性成分-牵牛子提取物(pharbitis nil extract, PN)对功能性便秘(functional constipation, FC)的具体的药理作用及机制并不清楚.
研究PN对FC大鼠便秘症状、小肠动力、结肠肌电活动、结肠组织形态、肠道菌群以及神经递质的影响.
采用盐酸洛哌丁胺(loperamide, Lop)灌胃法构建FC大鼠模型, 并给予PN进行治疗. 观察并记录大鼠给药6 h内粪便粒数、粪便含水率、小肠推进率和结肠肌电活动;聚合酶链反应变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis, PCR-DGGE)法检测大鼠肠道菌群的变化情况; 苏木精-伊红(hematoxylin-eosin, H&E)染色检测大鼠结肠组织的形态学变化; 酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)检测大鼠结肠中P物质(substance P, SP)、血管活性肠肽(vasoactive intestinal peptide, VIP)和5-羟色胺(5-hydroxytryptamine, 5-HT)的表达水平.
PN可显著增加FC大鼠6 h内的粪便粒数和粪便含水量; 增快肠道墨汁推进率; 降低结肠肌电频率和振幅变异程度. H&E结果显示, PN可改善Lop所致的结肠组织形态学改变. PCR-DGGE的检测结果显示, PN可调整FC大鼠肠道内拟杆菌门和疣微菌门的表达, 升高乳杆菌科以及双歧杆菌科的表达丰度. ELISA结果显示, PN可显著上调FC大鼠结肠组织中SP和5-HT的表达, 下调VIP的表达水平.
PN可缓解Lop所致的FC并改善肠道菌群和肠神经系统.
核心提要: 牵牛子提取物可缓解洛哌丁胺所致的功能性便秘大鼠的便秘症状, 促进便秘大鼠的肠道蠕动, 降低结肠肌电活动, 并改善结肠组织形态、肠道菌群失衡和肠神经系统失调.
引文著录: 陈肖敏, 王煦, 陈苗苗. 牵牛子提取物改善洛哌丁胺所致的大鼠功能性便秘和肠道菌群失调. 世界华人消化杂志 2022; 30(5): 223-229
Revised: January 17, 2022
Accepted: February 27, 2022
Published online: March 8, 2022
Semen pharbitidis can be used for the treatment of constipation; however, the specific pharmacological effect and mechanism of its main pharmacological active ingredient pharbitis nil extract (PN) on functional constipation (FC) are still not clear.
To investigate the regulatory effect of PN on constipation symptoms, intestinal motility, colonic myoelectric activity, colonic tissue morphology, intestinal microflora and neurotransmitters in FC rats.
A rat model of FC was established by intragastric administ-ration of loperamide (Lop) and then treated with PN. The number of fecal pellets within 6 h, fecal water content, intestinal transit rate, and colonic myoelectric activity were observed and recorded. The alteration of intestinal flora was measured by polymerase chain reaction-denaturing gradient gel electrophoresis (PCR-DGGE). Hematoxylin-eosin (H&E) staining was used to detect the morphological changes of colon tissues. The expression levels of vasoactive intestinal peptide (VIP), substance P (SP), and 5-hydroxytryptamine (5-HT) were determined by enzyme linked immunosorbent assay (ELISA).
PN could significantly increase the fecal pellet count and water content within 6 h, accelerate the intestinal ink propelling rate, and decrease the frequency and amplitude variation of colon myoelectric activity in FC rats. H&E staining showed that PN improved the colon histological changes induced by Lop. PCR-DGGE demonstrated that PN rectified the abundance of Bacteroidetes and Verrucomicrobia and increased the abundance of Lactobacillaceae and Bifidobacteriaceae in FC rats. ELISA showed that PN significantly increased the SP and 5-HT expression and decreased the expression of VIP in colon tissues of FC rats.
PN alleviates FC caused by Lop and improves intestinal microflora and intestinal nervous system.
- Citation: Chen XM, Wang X, Chen MM. Pharbitis nil extract ameliorates functional constipation and intestinal microflora disorder induced by loperamide in rats. Shijie Huaren Xiaohua Zazhi 2022; 30(5): 223-229
- URL: https://www.wjgnet.com/1009-3079/full/v30/i5/223.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i5.223
功能性便秘(functional constipation, FC)是一种常见的慢性胃肠功能紊乱性疾病, 主要是指排除全身及胃肠道器质性病变而引发的排便次数减少、排便困难以及便不尽感等为主要表现的一种消化系统多发病[1]. 便秘不仅会导致肛裂、痔疮等肛周病变的发生, 严重影响患者的生活质量及身心健康[2]. 甚至有研究[3,4]提示, 长期慢性便秘可诱发心血管事件, 增加肠癌等疾病的发病风险. 肠道微生态以及脑肠轴等胃肠病学新概念为探究FC的病因和治疗手段提供了新的思路. 且研究证实肠道菌群紊乱与FC的发生发展互为因果, 便秘人群中普遍存在肠道菌群失调, 表现为有益菌数量减少, 有害菌数量增多; 有害菌的大量繁殖又会进一步破坏肠粘膜的保护功能, 加重便秘[5-7]. 中医的整体观念与肠道的微生态平衡在理论上有着异曲同工之妙, 都是强调整体性和动态平衡; 故中医中药在治疗便秘上有着独特的优势且中药材中的一些生物活性成分被证实可防治便秘[8,9]. 牵牛子是旋花科植物裂叶牵牛或圆叶牵牛的干燥成熟种子, 常用于治疗二便不通、虫积腹痛以及水肿胀满等[10]. 药理作用研究显示, 牵牛子具有抑菌泻下、抗炎、抑制肿瘤细胞生长等多种作用[11,12]. 为研究牵牛子对功能性便秘的是否具有治疗作用, 本研究采用大鼠洛哌丁胺(loperamide, Lop)致便秘模型观察牵牛子提取物(pharbitis nil extract, PN)对功能性便秘症状、肠道菌群平衡和肠神经系统的影响.
BL-420S生物机能实验系统(成都泰盟科技有限公司), 电热恒温干燥箱(南京苏恩瑞干燥设备有限公司), JY-SPCT水平琼脂糖凝胶电泳仪(北京君意东方电泳设备有限公司), JY04S-3C凝胶成像系统(辽宁赛亚斯科技有限公司), Axioplan 2 imaging E显微镜(德国Carl Zeiss AG公司), ELx808酶标仪(美国Bio-Tek公司).
血管活性肠肽(vasoactive intestinal peptide, VIP)、P物质(substance P, SP)和5-羟色胺(5-hydroxytryptamine, 5-HT)酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)检测试剂盒(南京建成生物工程研究所), 苏木精-伊红(hematoxylin-eosin, H&E)染色试剂盒(广州赖德生物技术有限公司), E.Z.N.A.® Stool DNA试剂盒(美国Omega Bio-tek公司), 盐酸洛哌丁胺胶囊(西安杨森制药有限公司).
实验动物及分组处理: 35只SPF级雄性SD大鼠(200 g±20 g)购自浙江维通利华实验动物技术有限公司[SCXK(浙)2019-0001]. 实验动物均饲养在SPF级动物房内, 室温(23±1) ℃, 湿度65%-75%, 12 h光暗循环. 适应性饲养7 d后, 将其按照随机数表法分为对照组(每天灌胃等体积的生理盐水, Ctrl, 11只), 模型组(3 mg·kg-1·d-1 Lop灌胃两周, Lop, 12只)和实验组(在Lop灌胃的第2周起, 增加1.5 g·kg-1·d-1 PN灌胃, Lop+PN, 12只).
(1)排便实验: 给药方案结束后, 将各组大鼠置于代谢笼中自由活动6 h, 收集并记录6 h内大鼠粪便颗粒的数量. 称取并记录粪便重量(湿重), 而后将粪便于60 ℃干燥12 h后再次称重(干重). 粪便含水量 = (湿重-干重)/湿重×100%.
(2)小肠推进率检测(墨汁推进法): 给药方案结束后, 各组大鼠均灌胃墨汁2 mL, 6 h后麻醉处死大鼠, 打开腹腔, 取出上至幽门下至回盲部的肠管, 平置于桌面上轻轻拉成, 测量墨汁推进长度(cm)和小肠的总长度(cm). 墨汁推进率 = 墨汁推进长度/小肠总长度×100%.
(3)结肠肌电检测: 各组大鼠麻醉后取仰卧位固定于鼠台上, 腹部局部消毒备皮后, 沿腹部正中线做纵行切口, 充分暴露回盲部. 将银丝电极的一端放置于距盲肠2 cm处的结肠平滑肌肌层内; 另一端置于距离0.5 cm处, 之后缝合固定. 将导线接入生物机能实验系统进行结肠肌电测定. 系统参数设置: 标准电压2 mv·cm-1, 高频滤波10 Hz, 时间常数3 s, 连续记录1 h. 实验结果以3 min为一个时间段, 统计慢波频率和振幅的均数、标准差及变异系数. 频率变异系数=频率标准差/频率均值×100%; 振幅变异系数=振幅标准差/振幅均值×100%.
(4)肠道微生态实验: 各组大鼠处死后, 经无菌容器收集盲肠内粪便, 并依据E.Z.N.A.® Stool DNA试剂盒说明书提取粪便DNA, 之后用1%琼脂糖凝胶电泳检测所提DNA的浓度及纯度. 以所提的DNA为模板, 选择16S rDNA V3V4可变区序列作为靶标进行扩增和测序. 之后再进行变性梯度凝胶电泳(denatured gradient gel electrophoresis, DGGE), 并经凝胶成像系统鉴定和分析粪便样本中微生物菌群的组成和差异. 引物为带有barcode的通用上游(338F)和下游(806R)引物. PCR反应条件为: 94 ℃ 30 s, 55 ℃ 30 s; 72 ℃ 30 s, 共30个循环. 反应结束后用1%琼脂糖凝胶电泳检测并回收聚合酶链反应(polymerase chain reaction, PCR)产物, 并送样品至广州永诺生物科技有限公司进行测序和分析.
(5)H&E染色: 麻醉后处死各组大鼠, 打开腹腔并解剖分离结肠组织. 取一部分经PBS清洗后置于4%福尔马林缓冲液中固定24 h, 脱水透明后, 石蜡包埋大鼠结肠组织, 并将组织切为5 μm厚的石蜡切片. 所得切片烤片后置于二甲苯中脱蜡, 并经梯度乙醇至水化处理. 然后按照H&E染色试剂盒说明书步骤, 对切片先后进行苏木精和伊红染液染色. 最后常规进行脱水、透明及封片后, 于显微镜下观察结肠组织的形态学特征.
(6)ELISA: 取各组大鼠结肠组织加冰生理盐水后, 于冰上用匀浆器匀浆, 1500 rpm、4 ℃离心15 min, 收集上清液, 依据试剂盒操作说明书检测组织中VIP、SP和5-HT的含量.
统计学处理 数据以平均数±标准差(mean±SD)表示, 使用GraphPad Prism 9.2软件进行统计学分析. 多组数据间比较采用单因素方差分析(one-way ANOWA). P<0.05认为差异有统计学意义.
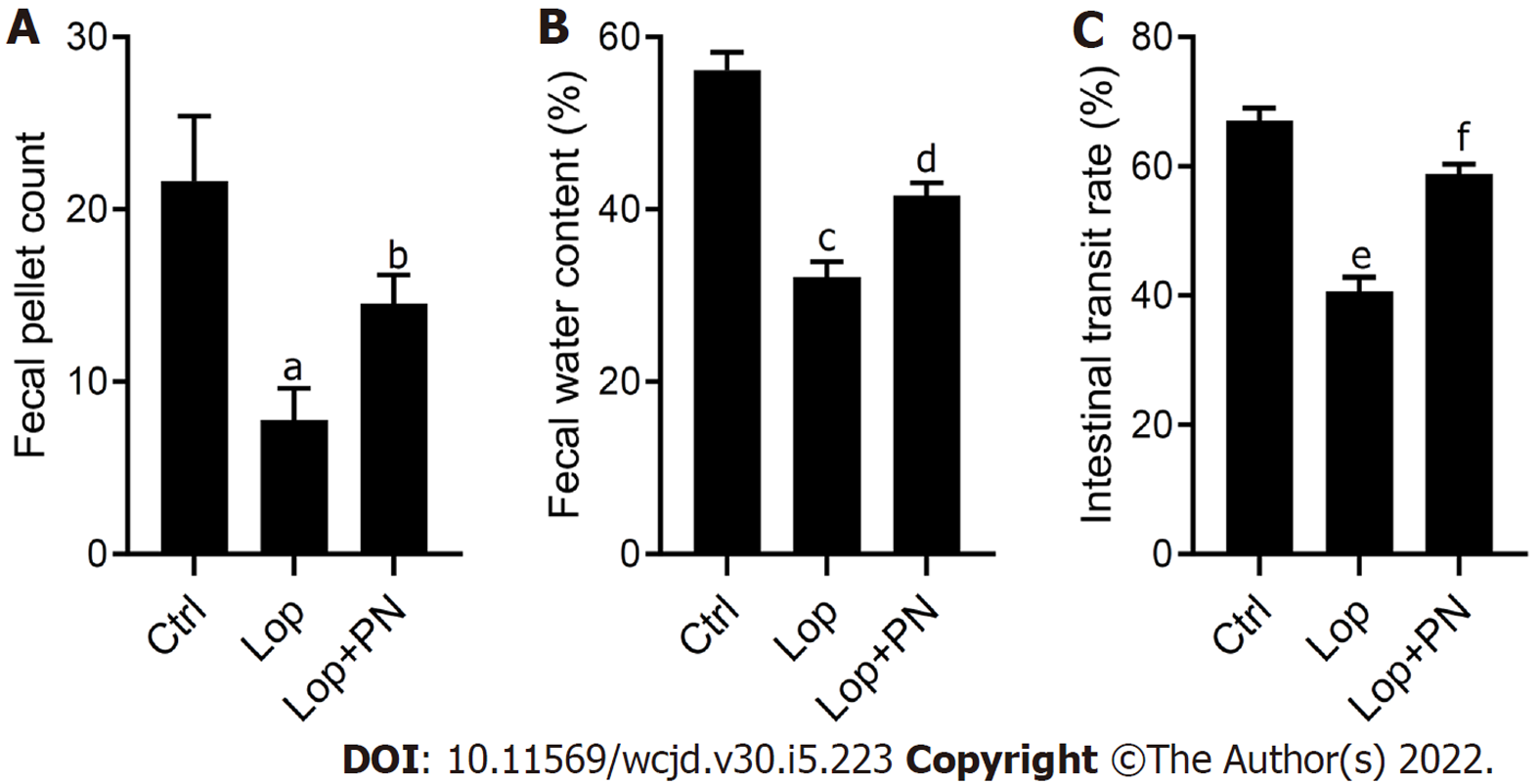
在排便观察的6 h内, 与对照组比较, Lop组大鼠的粪便粒数(图1A)、粪便含水率(图1B)和小肠推进率(图1C)均显著降低(P<0.05); 与Lop组比较, Lop+PN组大鼠粪便粒数(图1A)、粪便含水率(图1B)和小肠推进率(图1C)则显著升高(P<0.05). 结肠肌电检测结果显示(表1)显示, 与对照组比较, Lop组大鼠结肠慢波频率显著减慢, 同时频率和振幅的变异系数均显著升高; 与Lop组比较, 灌服PN显著增快结肠慢波频率,降低频率和振幅的变异系数.
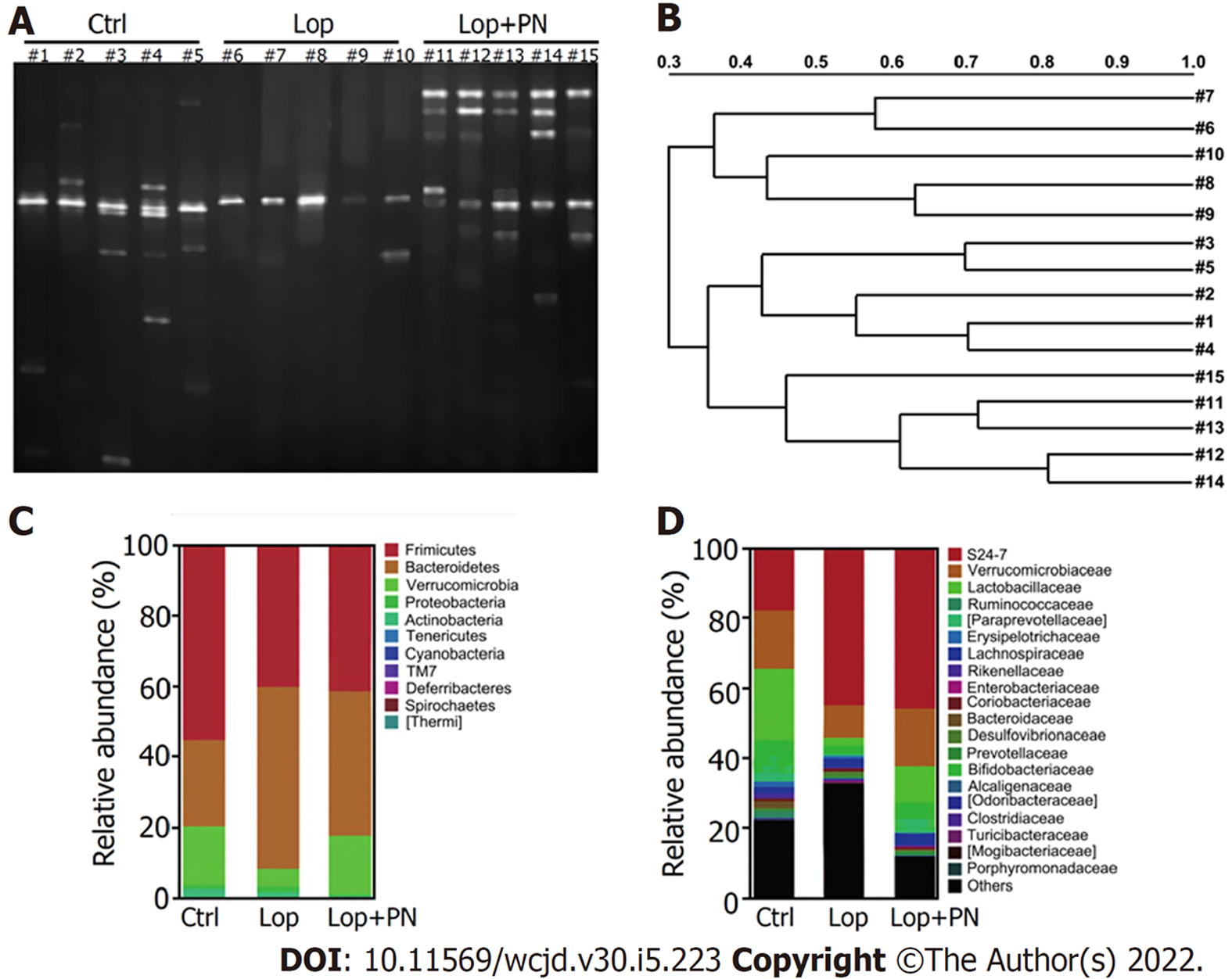
各组大鼠粪便的PCR-DGGE菌群指纹图谱和相似性聚类分析结果如图2所示, DGGE图中每个泳道中不同条带代表了不同的菌群, 条带的亮度则可以反映菌群含量. 指纹图谱的结果显示(图2A), 相较于Ctrl组, Lop组大鼠肠道菌群种类显著减少, 而灌服PN可部分恢复肠道菌群的多样性. 相似性聚类分析的结果显示(图2B), Lop组大鼠的肠道菌群单独归为一类, 而Ctrl组和Lop+PN组归为一类; 说明灌服PN之后, 大鼠的肠道菌群结构与功能性便秘组之间存在显著差异. 16S rDNA测序结果显示, 各组大鼠的肠道菌群基本是由四个菌门组成(图2C), 相较于Ctrl组, Lop组大鼠的拟杆菌门的表达丰度升高, 而厚壁菌门和疣微菌门的表达丰度降低; 灌服PN后, 拟杆菌门和疣微菌门的丰度有一定程度的恢复. 从科分类水平分析(图2D), 相较于Lop组, 灌服PN可显著增加大鼠肠道内乳杆菌科和双歧杆菌科的表达丰度.
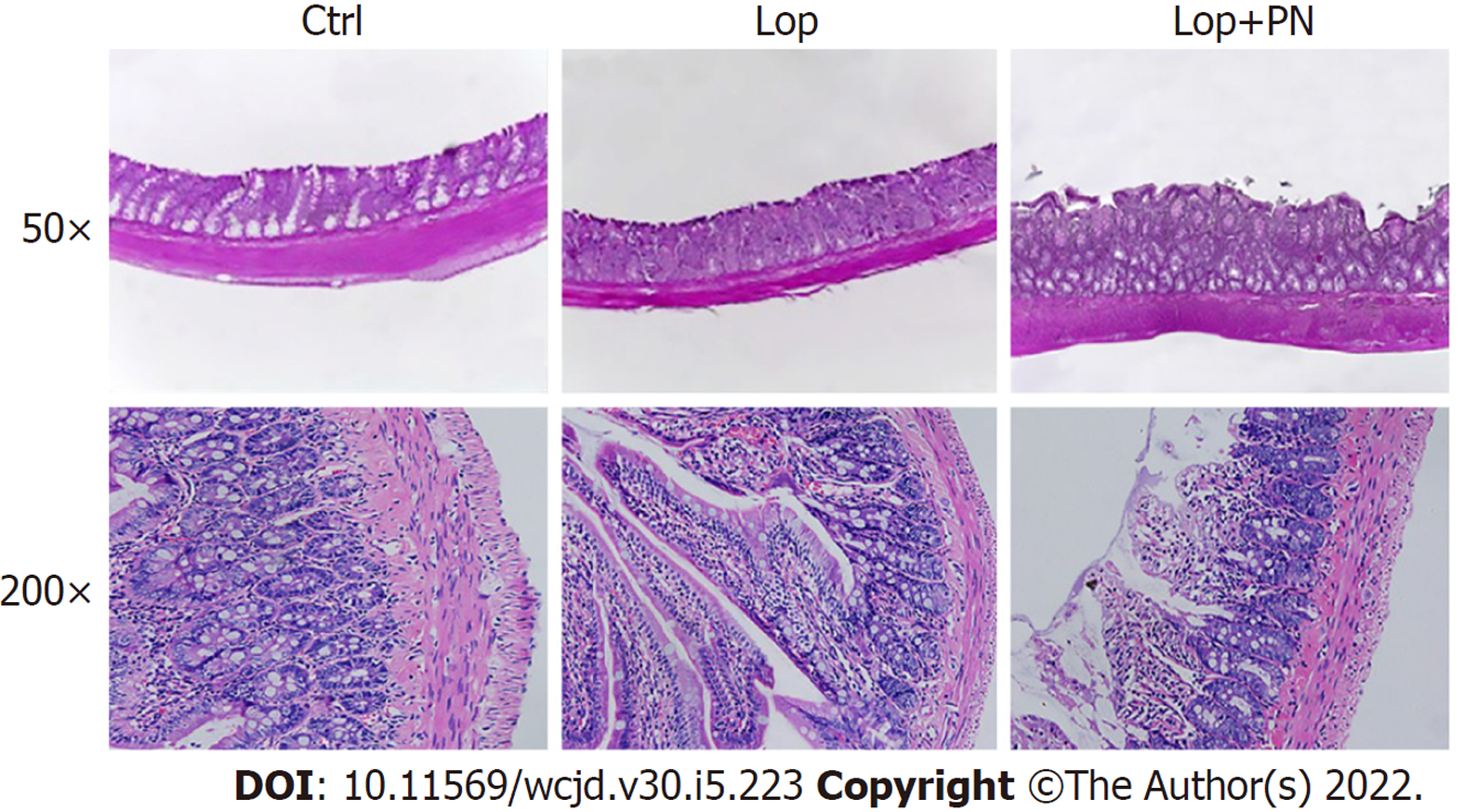
H&E染色(图3)结果显示, 与对照组相比, Lop组大鼠结肠肌层明显变薄, 肠绒毛排列紊乱, 杯状细胞数量减少; 灌服PN可显著改善这一变化, 肌层增厚且肠绒毛排列趋向正常, 杯状细胞数量也有一定程度的恢复.
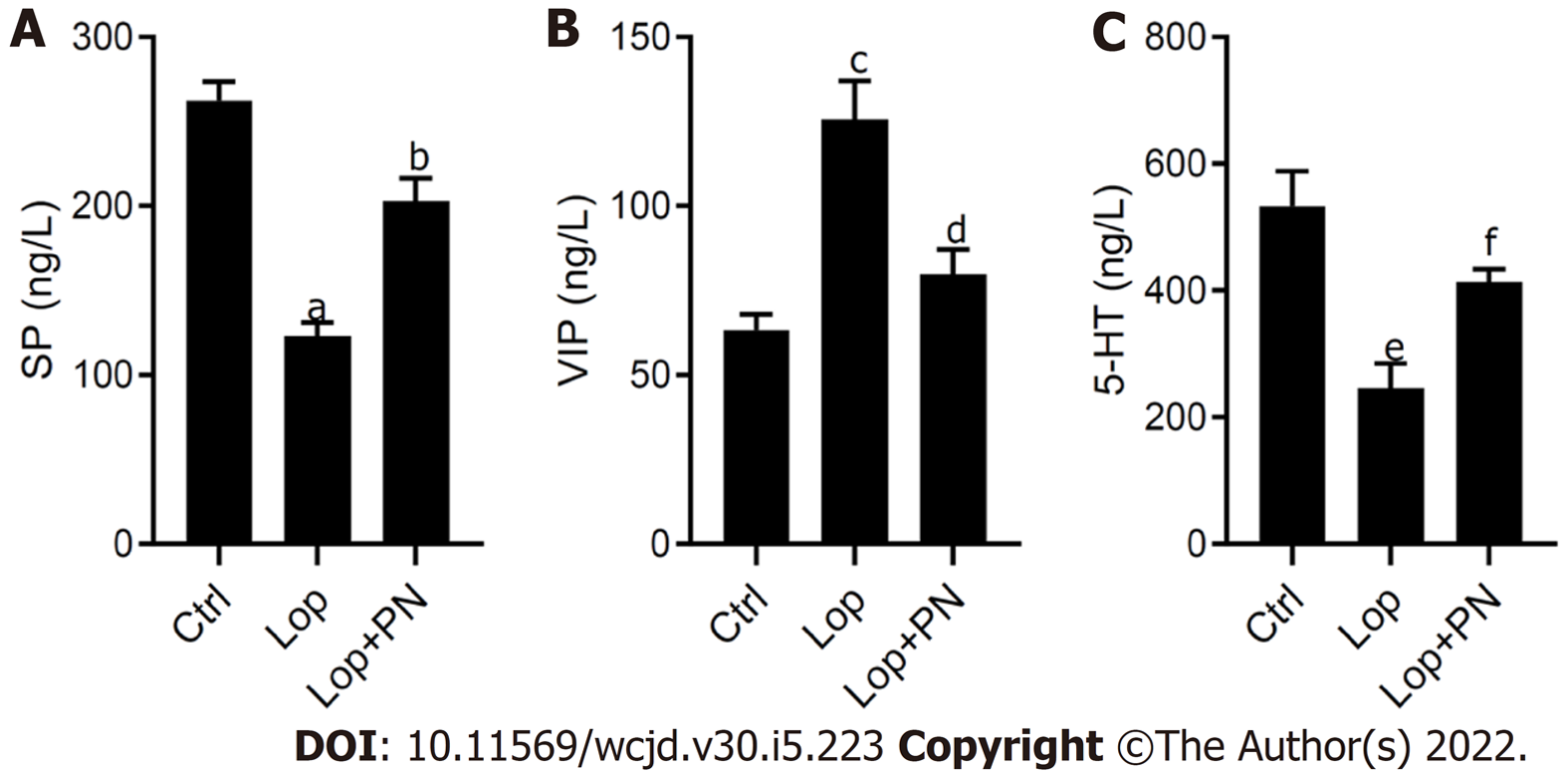
ELISA的检测结果显示, 与对照组比较, Lop组大鼠结肠组织中SP和5-HT(图4A和C)水平显著降低, VIP(图4B)水平显著升高; 与Lop组比较, 灌服PN可显著上调便秘大鼠结肠组织中SP和5-HT水平(图4A和C)的, 并显著下调VIP水平(图4B).
牵牛子是一种临床常用的传统中药, 其功效繁多, 可用于消化不良和便秘的治疗. 本研究的结果也证实, PN能促进Lop致功能性便秘大鼠的排便, 增加粪便含水量; 此外, PN还可增加小肠推进率, 增快结肠收缩频率. 这些结果提示, PN可促进肠蠕动, 缓解便秘.
寄生于肠道的微生物种类繁多, 数量庞杂, 彼此依存并互相制约, 维持动态平衡, 在此基础上调节肠道的功能以确保正常的生理机能[13]. 当内外环境发生变化导致菌群失调, 打破正常的生态平衡就会诱发或加重相关的肠道疾病, 功能性便秘即是其中之一, 同样修复肠道菌群失调能减轻功能性便秘的严重程度. 对便秘患者和正常人群肠道微生物的分析显示, 功能性便秘患者肠道中益生菌的数量显著降低[5-7]. Liang等[14]的研究提示, 在门水平上, Lop致便秘小鼠肠道中拟杆菌门丰度增加; 在属水平上, 便秘小鼠肠道中的拟杆菌属、Alistipes菌以及副拟杆菌属(Parabacteroides)等9种菌的表达丰度降低, 而乳杆菌属的表达丰度升高. 本研究的结果显示灌服PN可部分恢复便秘大鼠肠道中拟杆菌门和疣微菌门的丰度, 增加乳杆菌科和双歧杆菌科的表达. 其中拟杆菌是正常肠道中的优势菌, 乳杆菌科和双歧杆菌科均是肠道中的有益微生物[15,16], 其表达上调侧面说明PN可改善肠道微生态, 缓解便秘; 但肠道菌群对PN的代谢具体有何影响及两者之间的相互作用还有待进一步的研究.
随着对便秘病因病机的深入研究, 其与肠神经系统之间的关系日渐受到关注. 其中, SP、VIP以及5-HT等均是已被证实与胃肠道蠕动密切相关的神经递质[17,18]. 其中SP是一种重要的兴奋性神经递质, 可通过传导内脏痛觉、刺激壁内神经从以及促进消化道平滑肌收缩等方式促进胃肠蠕动[17,19]. 5-HT是广泛存在于神经系统及消化系统的一种兴奋性递质, 可通过与相应的受体结合, 调控胃肠道运动及胃肠激素的分泌[18,20]. VIP既是胃肠激素也是抑制性神经递质, 可扩血管、松弛肠道平滑肌, 减慢肠道推进型蠕动[21,22]. 本研究发现, 灌服PN可显著上调便秘大鼠结肠组织中SP和5-HT的表达, 并显著下调VIP表达. 这些结果显示, PN改善便秘症状的作用可能与上调兴奋性神经递质SP、5-HT和下调抑制性神经递质VIP相关.
综上所述, PN可缓解Lop所致的FC大鼠的便秘症状, 促进便秘大鼠的肠道蠕动,降低结肠肌电活动, 并改善结肠组织形态、肠道菌群失衡和肠神经系统失调.
功能性便秘指排除器质性便秘之外的主要由胃肠功能紊乱所引起的便秘, 严重影响患者的生活质量. 目前临床常用的药物虽对功能性便秘症状有改善作用, 但部分药物存在心血管不良的副作用且不能根治停药后易复发.
牵牛子具有泻下、利尿、消肿和抗炎的作用, 而其对功能性便秘的具体药理作用和机制并不完全清楚.
探索牵牛子提取物对功能性便秘大鼠的改善作用及其初步机制.
将大鼠分为对照组、模型组和牵牛子提取物治疗组. 观察各组大鼠的排便情况并测定各组大鼠的小肠运动、大肠肌电活动、结肠组织形态、肠道菌群以及神经递质.
牵牛子提取物增加功能性便秘大鼠的排便和粪便含水量, 增强小肠运动, 降低结肠的慢波的频率和振幅的变异程度, 改善结肠组织形态学和肠道菌群失调, 并增加结肠组织中P物质和5-羟色胺水平, 降低血管活性肠肽水平.
牵牛子提取物可通过促进肠蠕动, 修复肠道菌群失调, 上调兴奋性神经递质P物质和5-羟色胺以及下调抑制性神经递质血管活性肠肽, 进而缓解大鼠功能性便秘.
牵牛子提取物有望成为功能性便秘的潜在治疗药物.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Shin JE, Park KS, Nam K. [Chronic Functional Constipation]. Korean J Gastroenterol. 2019;73:92-98. [PubMed] [DOI] |
| 2. | Prichard DO, Bharucha AE. Recent advances in understanding and managing chronic constipation. F1000Res. 2018;7. [PubMed] [DOI] |
| 3. | Sumida K, Molnar MZ, Potukuchi PK, Thomas F, Lu JL, Yamagata K, Kalantar-Zadeh K, Kovesdy CP. Constipation and risk of death and cardiovascular events. Atherosclerosis. 2019;281:114-120. [PubMed] [DOI] |
| 4. | Guérin A, Mody R, Fok B, Lasch KL, Zhou Z, Wu EQ, Zhou W, Talley NJ. Risk of developing colorectal cancer and benign colorectal neoplasm in patients with chronic constipation. Aliment Pharmacol Ther. 2014;40:83-92. [PubMed] [DOI] |
| 6. | Ohkusa T, Koido S, Nishikawa Y, Sato N. Gut Microbiota and Chronic Constipation: A Review and Update. Front Med (Lausanne). 2019;6:19. [PubMed] [DOI] |
| 7. | Zhao Y, Yu YB. Intestinal microbiota and chronic constipation. Springerplus. 2016;5:1130. [PubMed] [DOI] |
| 8. | Xu Z, Liu T, Zhou Q, Chen J, Yuan J, Yang Z. Roles of Chinese Medicine and Gut Microbiota in Chronic Constipation. Evid Based Complement Alternat Med. 2019;2019:9372563. [PubMed] [DOI] |
| 9. | Dai L, Zhong LL, Ji G. Irritable bowel syndrome and functional constipation management with integrative medicine: A systematic review. World J Clin Cases. 2019;7:3486-3504. [PubMed] [DOI] |
| 11. | Jung HJ, Kang JH, Choi S, Son YK, Lee KR, Seong JK, Kim SY, Oh SH. Pharbitis Nil (PN) induces apoptosis and autophagy in lung cancer cells and autophagy inhibition enhances PN-induced apoptosis. J Ethnopharmacol. 2017;208:253-263. [PubMed] [DOI] |
| 12. | Shao Y, Park B, Song YJ, Park DW, Sohn EH, Kang SC. Renal-protective effects of n-hexane layer from morning glory seeds ethanol extract. Biomed Pharmacother. 2017;95:1661-1668. [PubMed] [DOI] |
| 13. | Sommer F, Anderson JM, Bharti R, Raes J, Rosenstiel P. The resilience of the intestinal microbiota influences health and disease. Nat Rev Microbiol. 2017;15:630-638. [PubMed] [DOI] |
| 14. | Liang YX, Wen P, Wang Y, OuYang DM, Wang D, Chen YZ, Song Y, Deng J, Sun YM, Wang H. The Constipation-Relieving Property of d-Tagatose by Modulating the Composition of Gut Microbiota. Int J Mol Sci. 2019;20. [PubMed] [DOI] |
| 15. | Jandhyala SM, Talukdar R, Subramanyam C, Vuyyuru H, Sasikala M, Nageshwar Reddy D. Role of the normal gut microbiota. World J Gastroenterol. 2015;21:8787-8803. [PubMed] [DOI] |
| 16. | Nowak A, Paliwoda A, Błasiak J. Anti-proliferative, pro-apoptotic and anti-oxidative activity of Lactobacillus and Bifidobacterium strains: A review of mechanisms and therapeutic perspectives. Crit Rev Food Sci Nutr. 2019;59:3456-3467. [PubMed] [DOI] |
| 17. | Holzer P, Farzi A. Neuropeptides and the microbiota-gut-brain axis. Adv Exp Med Biol. 2014;817:195-219. [PubMed] [DOI] |
| 18. | Keating DJ, Spencer NJ. What is the role of endogenous gut serotonin in the control of gastrointestinal motility? Pharmacol Res. 2019;140:50-55. [PubMed] [DOI] |
| 19. | Zhai X, Lin D, Zhao Y, Yang X. Bacterial Cellulose Relieves Diphenoxylate-Induced Constipation in Rats. J Agric Food Chem. 2018;66:4106-4117. [PubMed] [DOI] |
| 20. | Cao H, Liu X, An Y, Zhou G, Liu Y, Xu M, Dong W, Wang S, Yan F, Jiang K, Wang B. Dysbiosis contributes to chronic constipation development via regulation of serotonin transporter in the intestine. Sci Rep. 2017;7:10322. [PubMed] [DOI] |
| 21. | Yi R, Peng P, Zhang J, Du M, Lan L, Qian Y, Zhou J, Zhao X. Lactobacillus plantarum CQPC02-Fermented Soybean Milk Improves Loperamide-Induced Constipation in Mice. J Med Food. 2019;22:1208-1221. [PubMed] [DOI] |
| 22. | Yin J, Liang Y, Wang D, Yan Z, Yin H, Wu D, Su Q. Naringenin induces laxative effects by upregulating the expression levels of c-Kit and SCF, as well as those of aquaporin 3 in mice with loperamide-induced constipation. Int J Mol Med. 2018;41:649-658. [PubMed] [DOI] |