修回日期: 2022-11-01
接受日期: 2022-12-21
在线出版日期: 2022-12-28
幽门螺旋杆菌(Helicobacter pylori, H. pylori)感染是胃癌发生的因素之一, 但详细致癌机制尚不清楚, 人表皮生长因子受体2(human epidermal growth factor receptor 2, Her-2)、细胞周期蛋白D1(CyclinD1)、微小RNA-223(miR-223)在胃癌发生、发展中也具有重要作用, 猜想H. pylori感染可能影响Her-2、CyclinD1、miR-223从而影响病情进展.
探讨H. pylori感染与胃癌组织Her-2、CyclinD1、miR-223的相关性及对肿瘤侵袭性的影响.
选取2018-06/2020-06我院54例胃癌患者作为研究对象, 另取距离肿瘤5 cm以上的癌旁组织作为对照组. 对比胃癌组织及癌旁组织Her-2、CyclinD1、miR-223表达, H. pylori感染与未感染患者临床资料、Her-2、CyclinD1、miR-223表达, 分析胃癌组织Her-2、CyclinD1、miR-223表达与H. pylori感染的关系及不同病理特征胃癌H. pylori感染患者Her-2、CyclinD1、miR-223表达.
胃癌组织Her-2、CyclinD1、miR-223表达量高于癌旁正常组织, 差异有统计学意义(P<0.05); H. pylori感染与未感染胃癌患者浸润深度、淋巴结转移相比, 差异有统计学意义(P<0.05); H. pylori感染与未感染患者胃癌组织Her-2、CyclinD1、miR-223表达相比, 差异有统计学意义(P<0.05); Logistic回归分析可知, 胃癌组织Her-2、CyclinD1、miR-223表达、浸润深度、淋巴结转移与H. pylori感染有关(P<0.05); 胃癌H. pylori感染患者Her-2、CyclinD1、miR-223表达与分化程度、浸润深度、TNM分期、淋巴结转移有关(P<0.05).
H. pylori感染与胃癌组织Her-2、CyclinD1、miR-223表达相关, 可能共同参与胃癌浸润、转移过程.
核心提要: 胃癌幽门螺旋杆菌感染患者人表皮生长因子受体2、细胞周期蛋白D1、miR-223异常升高, 可能共同参与胃癌浸润、转移过程, 影响肿瘤侵袭性的影响.
引文著录: 陈进强, 马佳红. 幽门螺杆菌感染与胃癌组织Her-2、CyclinD1、miR-223的相关性及对肿瘤侵袭性的影响. 世界华人消化杂志 2022; 30(24): 1079-1085
Revised: November 1, 2022
Accepted: December 21, 2022
Published online: December 28, 2022
Helicobacter pylori (H. pylori) infection is one of the risk factors for gastric carcinogenesis, but its exact carcinogenic mechanism is not clear. Human epidermal growth factor receptor 2 (Her-2), cell cycle protein D1 (CyclinD1), and microRNA-223 (miR-223) also have important roles in gastric carcinogenesis and cancer progression. We hypothesized that H. pylori infection may affect Her-2, CyclinD1, and miR-223 expression and thus influence the progression of the disease.
To investigate the correlation between H. pylori infection and Her-2, CyclinD1, and miR-223 expression in gastric cancer tissues and their effects on tumor aggressiveness.
Fifty-four patients with gastric cancer treated at our hospital from June 2018 to June 2020 were selected as the study subjects. Tumor tissues and paraneoplastic tissues more than 5 cm away from the tumor were collected from the patients. The expression of Her-2, CyclinD1, and miR-223 was detected and compared between gastric cancer tissues and paraneoplastic tissues. Clinical data and the expression of Her-2, CyclinD1, and miR-223 were compared between H. pylori infected and uninfected patients. The relationship of Her-2, CyclinD1, and miR-223 expression in gastric cancer tissues with H. pylori infection and the clinical characteristics of patients with H. pylori infection were analyzed.
The expression of Her-2, CyclinD1, and miR-223 in gastric cancer tissues was significantly higher than that in normal tissues adjacent to the cancer (P < 0.05). Tumor infiltration depth and lymph node metastasis differed significantly between H. pylori infected and uninfected gastric cancer patients (P < 0.05). The differences in the expression of Her-2, CyclinD1, and miR-223 in gastric cancer tissues were also statistically significant between H. pylori-infected and uninfected patients (P < 0.05). Logistic regression analysis showed that the expression of Her-2, CyclinD1, and miR-223, tumor infiltration depth, and lymph node metastasis were associated with H. pylori infection in gastric cancer (P < 0.05). The expression of Her-2, CyclinD1, and miR-223 in gastric cancer patients with H. pylori infection was associated with the degree of differentiation, depth of infiltration, TNM stage, and lymph node metastasis (P < 0.05).
H. pylori infection is associated with the expression of Her-2, CyclinD1 and miR-223 in gastric cancer tissues, which may be jointly involved in the infiltration and metastasis of gastric cancer.
- Citation: Chen JQ, Ma JH. Correlation of Helicobacter pylori infection with Her-2, CyclinD1 and miR-223 in gastric cancer tissues: Effect on tumor aggressiveness. Shijie Huaren Xiaohua Zazhi 2022; 30(24): 1079-1085
- URL: https://www.wjgnet.com/1009-3079/full/v30/i24/1079.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i24.1079
胃癌是常见消化系统恶性肿瘤, 仍是我国第3大常见恶性肿瘤, 第2大致死性恶性肿瘤, 是危害国人健康的重大疾病之一[1,2]. 胃癌的早期诊断与及时治疗是改善预后的关键因素. 人表皮生长因子受体2(human epidermal growth factor receptor 2, Her-2)是人表皮生长因子受体家族成员, 细胞周期蛋白D1(CyclinD1)是调控细胞周期的重要蛋白, 研究表明, 二者在胃癌组织中表达异常升高[3,4]. 恶性肿瘤发生发展过程中, 伴随着多种微小RNA(miRNA)异常表达, 其中miR-223发挥着癌基因的作用[5]. 幽门螺旋杆菌(Helicobacter pylori, H. pylori)感染是诱发胃癌的最重要环境因素之一[6]. 研究发现[7,8], H. pylori与Her-2、CyclinD1、miR-223在胃癌发生、发展中发挥交互作用. 基于此, 本研究首次探讨H. pylori感染与胃癌组织Her-2、CyclinD1、miR-223的相关性及对肿瘤侵袭性的影响, 为揭示胃癌发生机制提供参考. 报道如下.
选取2018-06/2020-06我院54例胃癌患者作为研究对象, 另取距离肿瘤5 cm以上的癌旁组织作为对照组. 纳入标准: 均经病理学明确诊断为胃癌; 活检前或术前均未接受放化疗及免疫治疗; 患者签署知情同意书. 排除标准: 合并其他恶性肿瘤; 长期口服糖皮质激素、非甾体类消炎药. 年龄: <60岁24例, ≥60岁30例; 性别: 男34例, 女20例; 肿瘤大小: ≤5 cm, 32例, >5 cm, 22例; TNM分期: Ⅰ期9例, Ⅱ期13例, Ⅲ期20例, Ⅳ期12例; 肿瘤位置贲门、胃底15例, 胃体12例, 胃窦27例. 本研究符合医学伦理学标准, 经医院伦理委员会批准(批号: QY2368).
(1)胃癌组织及癌旁组织miR-223表达: Invitrogen公司组织总RNA提取试剂Trizol, TaKaRa公司反转录酶, 上海工硕生物技术有限公司实时定量聚合酶链式反应(PCR)的2×SYBR Green Master Mix. 利用Trizol试剂提取组织总RNA, 反转录酶的作用下合成cDNA, 按2×SYBR Green Master Mix要求行实时定量PCR反应, 在Bio-Rad实时定量PCR仪上进行, 反应条件: 95 ℃ 30 s, 紧接着40 个循环(95 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 30 s), 以U6 RNA为内参检测miR-223表达水平. 其中引物序列为F:5'-GCCGGCGCCCGAGCTCTGGCTC-3', R:5'-TGTCAGTTTGTCAAATACCCCA-3'. 内参为U6: F:5'-GTGCTCGCTTCGGCAGCACAT-3', R:5'-TACCTTGCGAAGTGCTTAAAC-3'; (2)胃癌组织及癌旁组织Her-2、CyclinD1表达: 英国Abcam公司兔抗人Her-2抗体, 北京中杉金桥生物技术有限公司兔抗人CyclinD1单克隆抗体. 免疫组织化学染色sp方法检测胃癌组织、癌旁组织Her-2、CyclinD1表达, 实施染色, 阳性对照: 已知Her-2、CyclinD1染色阳性的胃癌组织, 阴性对照: 磷酸缓冲盐溶液(phosphate-buffered saline, PBS)代替一抗. 观察切片, 每张切片随机选取5个(×400倍)高倍视野, 均计数100个细胞. 参照《胃癌HER2检测指南(2016版)》[9]判断HER2结果: HER2阳性表达为细胞膜出现棕黄色颗粒, 随机选取5个视野(×200倍), 均计数100个细胞, 细胞膜均无着色或≤10%呈淡黄色为(-); >10%细胞的细胞膜呈淡黄色或有隐约可见的膜染色, 未包绕细胞膜, 染色间断为(+); >10%细胞的细胞膜呈黄色或棕黄色, 包绕细胞膜, 染色连续为(2+); >10%细胞的细胞膜呈深棕色, 包绕细胞膜, 染色连续为(3+). CyclinD1: 着色强度: 无着色、淡黄色、棕黄色、棕褐色分别为0分、1分、2分、3分; 阳性细胞数范围: <5%、5%-25%、26%-50%、51-75%、>75%分别为0分、1分、2分、3分、4分; 两项结果相加<2分为阴性, >2分为阳性; (3)H. pylori感染判定: 胃粘膜组织快速尿素酶试验、组织切片染色、H. pylori培养3项中任意一项显示阳性. 14C尿素呼气试验结果显示阳性.
(1)胃癌组织及癌旁组织Her-2、CyclinD1、miR-223表达; (2)H. pylori感染与未感染胃癌患者临床资料; (3)H. pylori感染与未感染患者胃癌组织侵袭基因、Her-2、CyclinD1、miR-223表达; (4)胃癌组织Her-2、CyclinD1、miR-223表达、浸润深度、淋巴结转移与H. pylori感染的关系; (5)不同病理特征胃癌H. pylori感染患者Her-2、CyclinD1、miR-223表达.
统计学处理 采用统计学软件SPSS 22.0处理数据, 计数资料以例数描述, χ2检验, 计量资料采取Bartlett方差齐性检验与Kolmogorov-Smirnov正态性检验, 均确认具备方差齐性且近似服从正态布, 以(mean±SD)描述, 行t检验; 影响因素采用Logistic回归分析; 双变量正态分布采用Pearson分析相关性. 均采用双侧检验, P<0.05为差异有统计学意义.
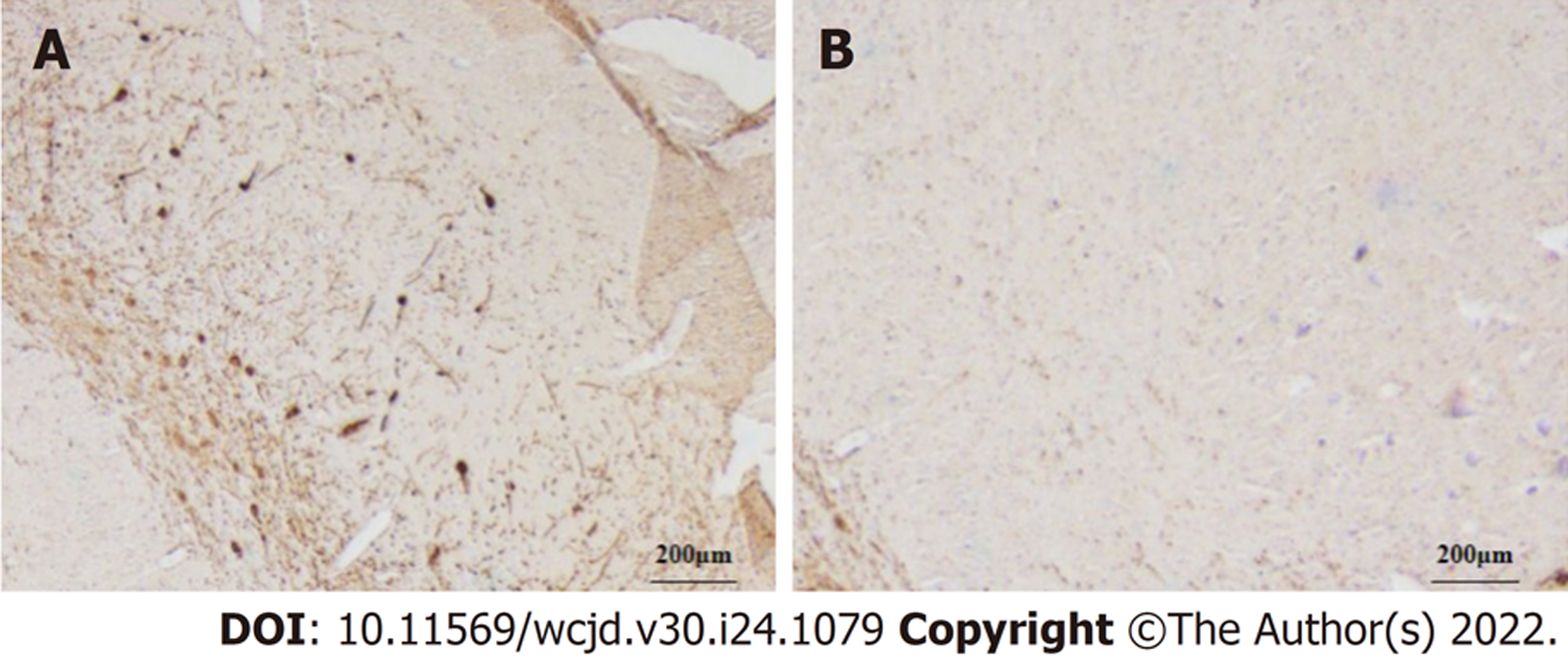
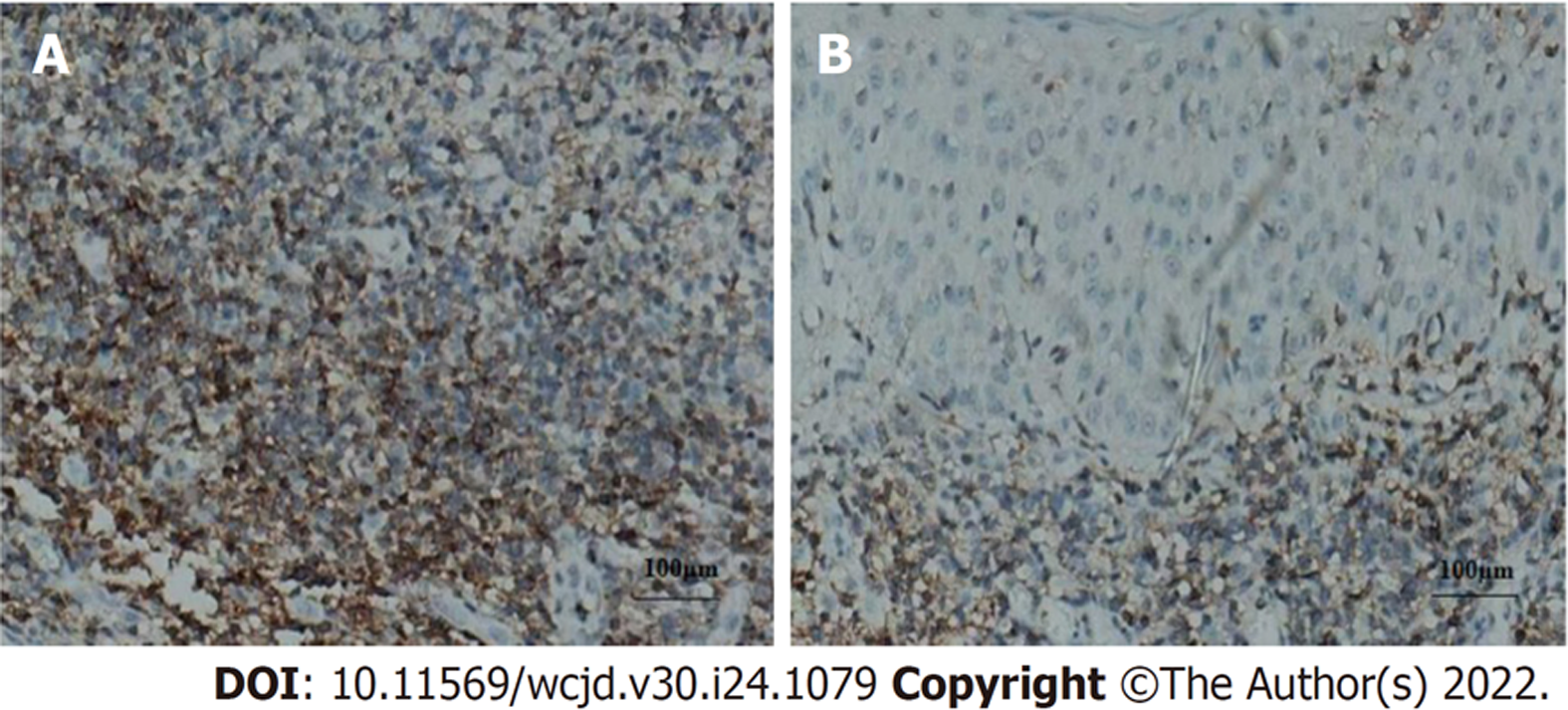
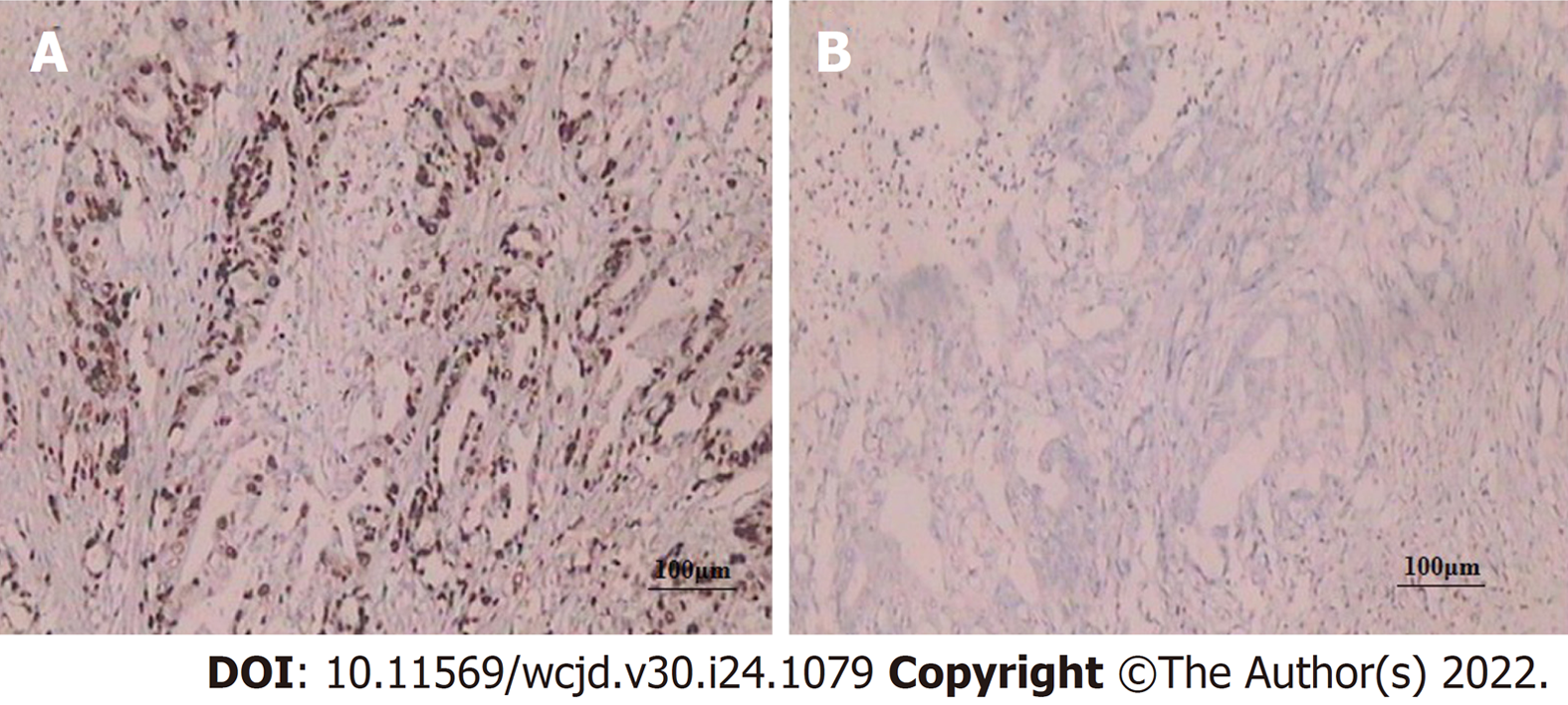
胃癌组织Her-2、CyclinD1、miR-223表达量高于癌旁正常组织, 差异有统计学意义(P<0.05). 见表1、图1-3.
| 组别 | 胃癌组织(n = 54) | 癌旁组织(n = 54) | t | P |
| Her-2 | 0.95±0.24 | 0.52±0.13 | 11.577 | <0.001 |
| CyclinD1 | 0.64±0.23 | 0.27±0.12 | 10.481 | <0.001 |
| miR-223 | 4.31±0.78 | 0.94±0.21 | 30.658 | <0.001 |
胃癌H. pylori感染患者Her-2、CyclinD1、miR-223表达与分化程度、浸润深度、TNM分期、淋巴结转移有关(P<0.05). 见表2.
| 组别 | 例数 | Her-2 | t/P/r | CyclinD1 | t/P/r | miR-223 | t/P/r | |
| 分化程度 | 高-中分化 | 23 | 0.94±0.27 | 2.170/0.037/0.527 | 0.61±0.12 | 4.386/<0.001/0.632 | 5.02±1.25 | 3.718/<0.001/0.702 |
| 低-未分化 | 14 | 1.15±0.31 | 0.80±0.14 | 6.74±1.54 | ||||
| 浸润深度 | T1+T2 | 14 | 0.92±0.15 | 2.898/0.006/0.618 | 0.62±0.12 | 2.113/<0.042/0.674 | 4.89±0.82 | 3.825/<0.001/0.684 |
| T3+T4 | 23 | 1.08±0.17 | 0.72±0.15 | 6.14±1.04 | ||||
| TNM分期 | Ⅰ、Ⅱ | 16 | 0.91±0.21 | 2.450/0.019/0.596 | 0.61±0.14 | 2.383/0.023/0.658 | 5.04±0.94 | 3.141/0.003/0.632 |
| Ⅲ、Ⅳ | 21 | 1.10±0.25 | 0.73±0.16 | 6.15±1.15 | ||||
| 淋巴结转移 | 无 | 18 | 0.96±0.13 | 2.594/0.014/0.604 | 0.63±0.12 | 2.428/0.021/0.621 | 5.12±0.92 | 3.081/0.004/0.597 |
| 有 | 19 | 1.08±0.15 | 0.73±0.13 | 6.19±1.17 | ||||
H. pylori感染与未感染胃癌患者浸润深度、淋巴结转移相比, 差异有统计学意义(P<0.05). 见表3.
| 指标 | H. pylori感染(n = 37) | 未感染(n = 17) | χ2 | P |
| 年龄 | ||||
| <60 | 17(45.95) | 7(41.18) | 0.107 | 0.743 |
| ≥60 | 20(54.05) | 10(58.82) | ||
| 性别 | ||||
| 男 | 21(56.76) | 13(76.47) | 1.941 | 0.164 |
| 女 | 16(43.24) | 4(23.53) | ||
| 肿瘤大小 | ||||
| ≤5 cm | 22(59.46) | 10(58.82) | 0.002 | 0.965 |
| >5 cm | 15(40.54) | 7(41.18) | ||
| 分化程度 | ||||
| 高-中分化 | 23(62.16) | 11(64.71) | 0.032 | 0.857 |
| 低-未分化 | 14(37.84) | 6(35.29) | ||
| 浸润深度 | ||||
| T1+T2 | 14(37.84) | 12(70.59) | 5.004 | 0.025 |
| T3+T4 | 23(62.16) | 5(29.41) | ||
| 临床分期 | ||||
| Ⅰ、Ⅱ | 16(43.24) | 6(35.29) | 0.305 | 0.581 |
| Ⅲ、Ⅳ | 21(56.76) | 11(64.71) | ||
| 肿瘤位置 | ||||
| 贲门、胃底 | 10(27.03) | 5(29.41) | 0.086 | 0.958 |
| 胃体 | 8(21.62) | 4(23.53) | ||
| 胃窦 | 19(51.35) | 8(47.06) | ||
| 淋巴结转移 | ||||
| 无 | 18(48.65) | 14(82.35) | 5.481 | 0.019 |
| 有 | 19(51.35) | 3(17.65) | ||
| 胃癌分型 | ||||
| 肠型胃癌 | 30(81.08) | 6(35.29) | 28.595 | <0.001 |
| 弥漫性胃癌 | 7(18.92) | 11(64.71) |
H. pylori感染与未感染患者胃癌组织Her-2、CyclinD1、miR-223表达相比, 差异有统计学意义(P<0.05). 见表4.
| 指标 | H. pylori感染(n = 37) | 未感染(n = 17) | t | P |
| Her-2 | 1.02±0.31 | 0.80±0.24 | 2.587 | 0.013 |
| CyclinD1 | 0.68±0.15 | 0.55±0.12 | 3.137 | 0.003 |
| miR-223 | 5.67±1.24 | 1.35±0.32 | 14.083 | <0.001 |
分析可知, 胃癌组织Her-2、CyclinD1、miR-223表达、浸润深度、淋巴结转移与H. pylori感染有关(P<0.05). 见表4.
目前, 胃癌确切机制尚不清楚, 深入研究胃癌病因及发病机理仍是胃癌基础研究的重中之重. 临床研究已证实, H. pylori感染是引发胃粘膜不典型增生、慢性萎缩性胃炎、胃溃疡等癌前病变的重要因素, 也是胃癌重要危险因素[10]. 世界卫生组织国际癌症研究机构已经将H. pylori列为Ⅰ类致癌因素[11]. 研究认为, H. pylori致病性主要依赖脂多糖(lipopolysaccharides, LPS)、CagA等毒力因子, LPS、CagA通过与宿主发生相互作用, 引起胃粘膜持续慢性炎症, 诱导胃癌发生、发展; 并上调Toll样受体4表达, 促进胃癌细胞增殖; 也可通过减弱γ干扰素介导的细胞免疫及单核细胞介导的抗肿瘤活性, 促进胃癌进展[12,13]. 但详细致癌机制尚不清楚. 本研究数据显示, 胃癌患者浸润深度、淋巴结转移与H. pylori感染有关, 提示H. pylori感染参与胃癌浸润、转移过程, 这与既往研究结果[14]类似, 又不完全相同, 可能与研究样本量、病例分期等不同有关.
Her-2属原癌基因, 定位在染色体17q12, 编码产物为Ⅰ型跨膜生长因子受体酪氨酸激酶, 可影响细胞生长、生存、分化及凋亡. 研究发现, 乳腺癌、食管癌、胃癌等恶性肿瘤组织均检测出Her-2过表达[15]. 细胞周期紊乱是肿瘤形成的决定因素之一. CyclinD1是细胞周期重要调节蛋白, 可促进细胞周期由G1期进入S期. 正常情况下, 细胞进入S期后, cyclinD1迅速分解, 若cyclinD1持续高表达, 可导致细胞提前进入S期, 出现增殖失控、紊乱, 促进恶性肿瘤的发生、发展. 本研究数据显示, 胃癌组织Her-2、CyclinD1表达量高于癌旁正常组织, 差异有统计学意义(P<0.05), 提示Her-2、CyclinD1表达均与胃癌发生有关, 与既往研究[16,17]一致. 恶性肿瘤发生发展过程中, 存在多种miRNA异常表达. 研究报道, 定位于肿瘤脆弱区域或肿瘤相关区域的miRNA达50%, 扮演着原癌或抑癌基因的角色. miR-223作为miRNA众多与肿瘤相关家族中的一员, 涉及细胞增殖、分化、凋亡等多种生物学功能, 与肿瘤形成及发展直接相关[18]. 体外研究显示[19], H. pylori感染可诱导AGS、GES-1胃癌细胞株的miR-223表达, 且进一步研究显示, miR-223模拟物转染不仅可以促进AGS胃癌细胞生长、促进其克隆形成, 还可以提高胃癌细胞的迁移和侵袭能力. 本研究数据显示, 胃癌组织miR-223表达量高于癌旁正常组织, 提示胃癌中miR-223可能发挥癌基因的作用.
为明确胃癌患者与H. pylori感染与胃癌组织Her-2、CyclinD1、miR-223表达的关系, 进一步深入了解胃癌发生机制, 本研究创新性探讨发现, H. pylori感染患者胃癌组织Her-2、CyclinD1、miR-223表达升高, 且与H. pylori感染有关. 推测H. pylori自身及其代谢产物具有潜在致癌活性, 可能引起Her-2、CyclinD1、miR-223扩增、激活, 促进胃癌浸润、转移过程. 但详细机制仍有待后续研究一步证实. 进一步分析发现, 胃癌H. pylori感染患者Her-2、CyclinD1、miR-223表达与分化程度、浸润深度、TNM分期、淋巴结转移有关. 分析机制可能为, HER-2过度表达, 通过上调血管内皮生长因子表达, 促进肿瘤新生血管生成, 参与肿瘤进展[20]; CyclinD1是细胞周期调控机制中的重要基因, 可促进细胞增殖[21]; miR-223可通过调控PI3K/AKT通路、JAK2/STAT3通路等, 增强胃癌细胞侵袭、转移能力, 抑制胃癌细胞凋亡[22]. Her-2、CyclinD1、miR-223亦可能通过与H. pylori相互影响, 共同促进胃癌进展.
综上可知, H. pylori感染可能通过影响胃癌组织Her-2、CyclinD1、miR-223表达而对肿瘤侵袭性产生影响. 本研究可能为胃癌及其转移患者的诊断与治疗提供新思路.
胃癌是常见消化系统恶性肿瘤, 仍是我国第3大常见恶性肿瘤, 第2大致死性恶性肿瘤. 胃癌的早期诊断与及时治疗是改善预后的关键因素. 幽门螺旋杆菌(Helicobacter pylori, H. pylori)感染是胃癌发生的因素之一, 但详细致癌机制尚不清楚, 人表皮生长因子受体2(human epidermal growth factor receptor 2, Her-2)、细胞周期蛋白D1(CyclinD1)、微小RNA-223(miR-223)、发展中也具有重要作用, 猜想H. pylori感染可能影响Her-2、CyclinD1、miR-223从而影响病情进展.
本研究首次探讨H. pylori感染与胃癌组织Her-2、CyclinD1、miR-223的相关性及对肿瘤侵袭性的影响, 为揭示胃癌发生机制提供参考.
探讨H. pylori感染与胃癌组织Her-2、 CyclinD1、miR-223的相关性及对肿瘤侵袭性的影响.
选取2018-06/2020-06我院54例胃癌患者作为研究对象, 另取距离肿瘤5 cm以上的癌旁组织作为对照组. 对比胃癌组织及癌旁组织Her-2、CyclinD1、miR-223表达, 采用Pearson相关性分析H. pylori感染与未感染患者临床资料、Her-2、CyclinD1、miR-223表达的相关性, 采用Logistic回归分析胃癌H. pylori感染的影响因素.
胃癌组织Her-2、CyclinD1、miR-223表达量高于癌旁正常组织; H. pylori感染与胃癌组织Her-2、CyclinD1、miR-223具有显著相关性及对肿瘤侵袭性产生影响, 揭示了胃癌发生机制, 设计合理, 数据详实.
H. pylori自身及其代谢产物具有潜在致癌活性, 可能引起Her-2、CyclinD1、miR-223扩增、激活, 促进胃癌浸润、转移过程. 且胃癌H. pylori感染患者Her-2、CyclinD1、miR-223表达与分化程度、浸润深度、TNM分期、淋巴结转移有关; Her-2、CyclinD1、miR-223亦可能通过与H. pylori相互影响, 共同促进胃癌进展.
本研究通过肿瘤新生血管生成、细胞周期调控基因和信号通路探讨了胃癌进展的作用机制, 设计合理, 数据详实, 切合实际, 值得推广继承和研究. 对临床具有指导意义, 可为胃癌及其转移患者的诊断与治疗提供新思路.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Fujitani K, Ando M, Sakamaki K, Terashima M, Kawabata R, Ito Y, Yoshikawa T, Kondo M, Kodera Y, Yoshida K. Multicentre observational study of quality of life after surgical palliation of malignant gastric outlet obstruction for gastric cancer. BJS Open. 2017;1:165-174. [PubMed] [DOI] |
| 4. | Takegawa N, Nonagase Y, Yonesaka K, Sakai K, Maenishi O, Ogitani Y, Tamura T, Nishio K, Nakagawa K, Tsurutani J. DS-8201a, a new HER2-targeting antibody-drug conjugate incorporating a novel DNA topoisomerase I inhibitor, overcomes HER2-positive gastric cancer T-DM1 resistance. Int J Cancer. 2017;141:1682-1689. [PubMed] [DOI] |
| 8. | 朱 文景, 李 智雄, 安 乃瑞, 张 凯光, 高 明太. 幽门螺杆菌感染性胃癌组织中cyclinD1、MMP-9的表达及其临床意义. 现代生物医学进展. 2020;6:1103-1106, 1176. [DOI] |
| 10. | Wang J, Yao Y, Zhang Q, Li S, Tang L. Inflammatory responses induced by Helicobacter pylori on the carcinogenesis of gastric epithelial GES1 cells. Int J Oncol. 2019;54:2200-2210. [PubMed] [DOI] |
| 11. | Fung C, Tan S, Nakajima M, Skoog EC, Camarillo-Guerrero LF, Klein JA, Lawley TD, Solnick JV, Fukami T, Amieva MR. High-resolution mapping reveals that microniches in the gastric glands control Helicobacter pylori colonization of the stomach. PLoS Biol. 2019;17:e3000231. [PubMed] [DOI] |
| 12. | 谢 正兴, 邸 雅南, 彭 德银, 张 波, 赵 可. 幽门螺旋杆菌感染与Sox2蛋白在胃癌发病中的相关性研究. 检验医学与临床. 2017;18:2711-2712, 2715. [DOI] |
| 13. | 付 保芹, 郭 成香, 王 珊珊, 万 相斌. 胃癌患者血清miR-204、HSP-70及IL-2与Hp感染及病情关系研究. 中华医院感染学杂志. 2020;7:1012-1015. [DOI] |
| 14. | 于 嫔, 朱 蔚远, 彭 文斌, 范 月娥. 胃癌患者Hp感染与TNM分期及肿瘤恶性程度的关系分析. 中国中西医结合消化杂志. 2020;9:663-667. [DOI] |
| 15. | Wang HB, Liao XF, Zhang J. Clinicopathological factors associated with HER2-positive gastric cancer: A meta-analysis. Medicine (Baltimore). 2017;96:e8437. [PubMed] [DOI] |
| 17. | Dozier C, Mazzolini L, Cénac C, Froment C, Burlet-Schiltz O, Besson A, Manenti S. CyclinD-CDK4/6 complexes phosphorylate CDC25A and regulate its stability. Oncogene. 2017;36:3781-3788. [PubMed] [DOI] |
| 21. | 刘 玉海, 刘 明明, 刘 新华. miR-637调控CDK6/cyclinD1/Rb信号通路对人胃癌细胞增殖、迁移和侵袭的影响. 安徽医科大学学报. 2019;11:1672-1677. [DOI] |
| 22. | 谢 琼, 胡 桂明, 王 洪涛. miRNA-223-3 p调控JAK2/STAT3信号通路对胃癌细胞增殖、凋亡、迁移的影响. 郑州大学学报(医学版). 2018;5:629-634. [DOI] |