修回日期: 2022-09-26
接受日期: 2022-10-24
在线出版日期: 2022-11-28
随着内镜、介入和外科微创手术的进步, 急性胰腺炎的治疗向着多学科协作诊治、有针对性的、微创的方向发展. 因此, 对于重症急性胰腺炎患者的局部和全身并发症干预的最佳时机、路线和治疗方案的选择需要进行重新评估. 本文主要针对重症急性胰腺炎微创治疗的新进展进行总结, 并提供前景展望.
核心提要: 重症急性胰腺炎病情凶险, 死亡率高, 是值得重点关注的急危重症. 本文主要针对重症急性胰腺炎并发症微创治疗的干预时机、路线和治疗方案的选择进行简单总结, 并对其治疗模式等提供前景展望.
引文著录: 马瑞光, 陈欣羽, 钟宁, 李真. 重症急性胰腺炎微创治疗新进展与前景展望. 世界华人消化杂志 2022; 30(22): 984-989
Revised: September 26, 2022
Accepted: October 24, 2022
Published online: November 28, 2022
In the past few years, the diagnosis and treatment of acute pancreatitis have moved towards a multidisciplinary, targeted, and minimally invasive approach. The optimal timing, route, and treatment strategy for intervention for local and systemic complications in patients with severe acute pancreatitis need to be re-evaluated. This review focuses on the development of minimally invasive management of severe acute pancreatitis in recent years and provides an outlook on future directions.
- Citation: Ma RG, Chen XY, Li Z, Zhong N. Minimally invasive management of severe acute pancreatitis: Current status and future perspectives. Shijie Huaren Xiaohua Zazhi 2022; 30(22): 984-989
- URL: https://www.wjgnet.com/1009-3079/full/v30/i22/984.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i22.984
急性胰腺炎(acute pancreatitis, AP)是一种难以预测且具有潜在致死性的疾病, 根据是否存在器官衰竭和局部或全身并发症分为3类: 轻症急性胰腺炎、中度重症急性胰腺炎和重症急性胰腺炎(severe acute pancreatitis, SAP)[1]. 大多数AP病例是轻度的、自限性的, 但约有20%的患者可发展为SAP[2]. 其中因局部和全身并发症导致死亡的SAP患者可高达30%[2]. 目前多学科协助诊治、有针对性微创治疗已经成为AP治疗的重要原则, 各种国内外指南和系统综述强调微创治疗的重要性, 本文主要针对SAP的微创治疗新进展进行综述.
AP在病程早期(<4 wk)可形成急性胰周液体积聚或急性坏死物质积聚(acute necrotic collection, ANC); 在病程晚期(>4 wk), 包膜包裹积聚的液体或坏死组织形成胰腺假性囊肿(pancreatic pseudocyst, PPC)或包裹性坏死(walled-off necrosis, WON), 当ANC和WON继发感染时, 称为感染性坏死, 引起感染坏死性胰腺炎(infected pancreatic necrosis, IPN), 死亡率高达40%[3].
既往认为清创治疗时机应推迟至感染性坏死被包裹后, 即发病的4 wk后, 以提升手术的安全性. 而2020年美国胃肠病协会临床实践专家共识对IPN的干预时间并未限定, 但是指出对于高度怀疑或证实有感染性坏死的AP患者, 在保守治疗失败后可以考虑在发病早期(<2 wk-4 wk)进行经皮置管引流(percutaneous drainage, PCD), 以实现对感染源头的控制[1]. 并且, Boxhoorn等[4]学者在2021年实施的一项多中心的随机对照试验对比了即刻引流与延迟引流的并发症、死亡率和平均干预次数(导管引流和坏死切除), 结果提示二者的不良事件发生率相似. 因此, 在发病早期病情迅速恶化的情况下, 早期引流可能有助于控制感染源头、减轻全身炎症反应, 从而减轻其它脏器的损伤, 实现与延迟引流相似的治疗效果, 但需要进一步的证据.
目前, 随着各种微创干预措施的引入和完善, "进阶(Step-up)"治疗模式成为当代IPN治疗的重要策略之一, 其第一步是经皮置管或内镜下引流积聚的坏死液体以缓解败血症; 若临床症状没有改善, 第二步应进行坏死组织清创术. 引流后是否需要清创, 主要取决于WON中坏死物质的固体成分. 当WON中坏死组织成分大于40%, 常需要内镜下或微创外科清创; 当坏死组织成分在10%-40%(特别是自膨式金属支架置入的患者), 则无需清创; 而坏死组织成分小于10%则只需引流[5]. 相比传统的开放性手术, 微创治疗减少了IPN的主要并发症, 降低了死亡的综合终点率[6]. 延迟原则可使大部分IPN患者获益, 但不可一概而论, 应结合患者自身状态、感染坏死程度及病情发展速度综合判定. 苗毅等[7]学者提出"Step-jump"跨越式外科干预治疗策略, 即跨越常规的"Step-up"循序渐进模式, 对一部分病人提前外科干预, 以降低病人病死率, 改善预后.
PCD是指在B超或CT的引导下经皮放置导管以引流坏死物质, 该方法既可作为单一治疗措施, 也可与其他微创治疗联合使用, 必要时可以进一步扩创更换三腔管冲洗引流. AP患者因为肠道功能紊乱往往伴有胃肠道扩张, 影响B超对腹部脏器的观察, 因此有研究提出在复杂的腹腔内或腹膜后积液穿刺置管引流前, 可行胸腹盆腔CT检查, 充分评估积液与周围脏器的关系[8]. PCD通常适用于内镜引流不可行的情况下, 例如: 坏死物质延伸到结肠旁沟和/或盆腔. 另外, 在急性坏死性胰腺炎的早期阶段(<2 wk-4 wk), 对怀疑或确认有感染性坏死、无完整包膜形成且保守治疗失败的患者, PCD可以提供安全有效的引流和感染源头控制[1]. PCD适用范围广泛, 在技术上对95%以上的患者是可行的[9], 但可能引起穿刺相关损伤、感染、出血、导管移位以及胰液皮肤瘘等并发症[8]. 另外, 由于组织液化坏死时间长, 需要长期置管, 降低生活质量. 一项包含10个回顾性研究和1个随机对照研究的系统回顾(n = 384)[10]显示, 有56%的患者在接受单一PCD治疗后不需要进一步的外科坏死切除术, 主要并发症为胰腺内瘘和外瘘, 总死亡率为17.4%. 2018年荷兰胰腺研究小组的随机优效性试验[11]显示, PCD(n = 47)术后51%的患者无需进行额外的坏死物质清创治疗. 目前研究[6,11]中单一PCD治疗仅作为过渡性引流治疗的策略, 其疗效仍需更大样本量的前瞻性临床试验进行验证.
内镜治疗可以分为内镜下经腔内引流术(endoscopic transluminal drainage, ETD)和直接内镜下坏死组织清创术(direct endoscopic necrosectomy, DEN). 目前的ETD多是在超声内镜(endoscopic ultrasound, EUS)的引导下选取引流部位, 扩张消化道与坏死腔之间的通道, 放置支架引流和(或)鼻囊管冲洗[12]. 穿刺部位主要选择经胃壁或者十二指肠壁引流, 坏死物质如果积聚在胰头则多经过十二指肠壁引流, 其他的多经过胃壁进行引流. 两个引流部位的成功率和安全性方面似乎没有明显差异, 但经胃的方法是更常使用的[1].
支架的选择从双猪尾塑料支架(plastic stents, PS)到直径更大的自膨式金属支架(self-expandable metal stents, SEMS), 发展到新型的双蘑菇头金属覆膜支架(lumen-apposing metal stents, LAMS). LAMS直径为15 mm-20 mm, 理论上可以改善胃肠道坏死组织的引流, 避免了后续DEN的管道扩张, 缩短手术时间[1,12]. 而且两端"蘑菇头"的结构可以使胃壁或十二指肠壁与坏死囊腔贴合更紧密, 有效防止支架移位及囊液渗漏. 并且, Bang等[13]学者总结了自2010-01/2020-08间单中心的共387例因胰周液体积聚(pancreatic fluid collections, PFCs)行内镜下引流的患者的临床资料, 总结提出了PFCs内镜处理的Orlando方案, 验证结果表明: 根据PFCs的不同表现, LAMS联合选择性使用塑料支架的综合方案的治疗效果显著优于单纯应用塑料支架. 然而,也有研究表明LAMS相关的不良事件发生率较高[14]. 因此, 最新的共识指南[15]指出如果在ETD中使用LAMS, 建议4周后撤除支架, 以尽量减少出血等并发症的风险.
DEN是在ETD的基础上取出留置的PS支架和(或)鼻囊管, 再次用扩张球囊对瘘管进行扩张从而使胃镜可以自由进出囊腔; 胃镜进至坏死腔内, 在直视下用网篮、圈套器、活检钳、鳄嘴钳、网篮和爪钳等器械对坏死组织进行分离和清除[12]. 对于使用SEMS或LAMS进行DEN的患者, 在支架置入当天可以进行球囊扩张后清创, 但临床更常采用的是在置入后2 d-3 d进行DEN操作. 然而, 尚缺乏随机对照研究和高质量循证医学证据以明确DEN清创的最佳时机, 因此现有指南对此未明确阐述. 目前国内外普遍采用的策略为若病情在ETD引流术后第3天进一步恶化或无明显改善, 且WON内主要为固体坏死物, 则建议进一步行坏死物质清除术[16-18].
微创外科手术治疗包括视频辅助下腹膜后清创术(video-assisted retroperitoneal debridement, VARD)、经胃坏死组织清创术、腹腔镜坏死组织清创术等. VARD手术是在PCD引流坏死物质不彻底的基础上, 在光纤镜辅助下彻底清除坏死组织. 该方法最适合坏死中心分布在胰腺周围或向下延伸到左侧结肠旁沟的患者, 但对于坏死物质到达肠系膜血管右侧的患者可能无效[1]. 2010年荷兰胰腺研究小组进行一项前瞻性研究显示[6], 阶梯式治疗组(PCD/VARD)和开腹手术组的术后死亡率(19% vs 16%, P = 0.70)未见明显差异, 但是前者术后多器官功能紊乱(12% vs 40%, P = 0.002)、切口疝(7% vs 24%, P = 0.03)、新发糖尿病(16% vs 38%, P = 0.02)发生率低.
经胃坏死组织清创术主要用于胃后壁的病灶, 在腹腔镜下经胃前壁做一切口进入胃后壁, 然后经后壁进入坏死腔并在直视下清除坏死物质. 难以直视的部位可借助胆道镜或经皮肾镜辅助清创. 该操作主要适用于胃后壁的WON病灶, 对于坏死物质延伸至两侧结肠旁沟者效果不佳[1]. 另外曹峰[19]等学者还提出腹腔镜经胃胰腺坏死组织清除术还应适用于坏死组织不超过50%的患者, 以降低彻底清创的风险和难度, 缩短WON术后闭合的时间. 2020年由三家医疗中心进行的一项迄今为止规模最大的回顾性研究(n = 178)[20]中, 术后常见并发症的发生率: 腹腔内感染(11%)、出血(6%)、胰瘘(4%), 术后病死率仅为2%. 在经过中位20个月的随访后, 症状完全缓解率为91%, WON复发率仅为7%. 说明外科经胃坏死组织清除术(腹腔镜或开腹)是一项具有较高的手术安全性及疗效的一期手术选择. Maatman等[21]学者在2021年进行了一项单中心的回顾性研究, 对比了内镜和外科经胃坏死组织清除术的新发脏器功能障碍发生率、病死率、术后住院时长. 结果证实两者新发脏器功能障碍发生率相差不大(13% vs 13%, P = 1.0), 但后者病死率低(7% vs 1%, P = 0.04), 术后住院时长更短[(13.8±20.8) vs (9.4 ± 6.1), P = 0.04]. 内镜和外科"进阶(Step-up)"治疗的优劣一直是AP研究的重点, 荷兰研究团队[11]提出, 内镜进阶法在减少IPN主要并发症或死亡率方面并不优于外科进阶式方法, 但内镜进阶组胰瘘的发生率及住院时间均低于外科进阶组.
SAP的胰腺导管断裂后可被炎症纤维壁所包裹, 在慢性压力和继发性感染作用下可导致近端器官的压力减低, 富含胰酶的液体在胰管上皮和其他上皮组织之间的形成异常交通, 即自发性的胰腺瘘(pancreatic fistula, PF)[22]. 当PF与周围脏器相通时, 即胰内瘘, 比如胰腺结肠瘘、胰胃瘘、胰支气管瘘等. AP相关的胃肠道瘘管(gastrointestinal fistulaes, GIFs)是SAP的并发症之一, 发生率在4.0%-41.0%之间[22], 可诱发出血、长时间的败血症、呼吸窘迫. AP伴发GIFs最常见的位置是横结肠和十二指肠. 对于保守治疗失败的GIFs患者, 内镜ERCP是首先考虑的进一步治疗手段.
结合国内外文献概括为两种治疗方法[22,23]: 其一, 在排除完全性胰管断裂后, 可行内镜下鼻胰管引流(endoscopic naso-pancreatic drainage, ENPD)、内镜下胰管支架植入(endoscopic retrograde pancreatic drainage, ERPD), 引流胰液, 减轻炎症, 促进瘘管愈合, 必要时可在EUS引导下进行. 其二, 当PF合并PPC、WON等胰周液体积聚时, 可行EUS引导下经胃壁/十二指肠壁穿刺引流术.
一项回顾性研究(n = 19)[24]示, 针对胃瘘、十二指肠瘘、结肠瘘, 可以在内镜下钛夹夹闭修补瘘口; 此外, 针对胃瘘、十二指肠瘘, 可放置空肠营养管, 越过瘘口, 恢复肠内营养; 针对小肠瘘、结肠瘘, 可行肠管临时性造瘘并择期还纳[25]. 但目前尚缺少大规模的研究以证明上述治疗方法的可靠性. 山东大学齐鲁医院对一例SAP恢复期合并多发隐匿消化道瘘的患者, 结合其病情特点, 在EUS引导下放置鼻囊管后实现了完全性治愈[26].
当坏死性胰腺炎累及胰管时, 可导致其部分或完全断裂. 据统计, 约44%的SAP患者会发生主胰腺管的损伤[27]. 胰管的远端部位断开后, 胰腺组织继续分泌胰液并积聚在胰腺周围. 当主胰管完全断裂时, 称为胰管离断综合征(disconnected pancreatic duct syndrome, DPDS). 轻者可自行吸收积液, 受损胰管愈合; 重者可继发PPC、WON、胰瘘、胰源性腹水[28]. 结合国内外关于治疗胰管断裂或断开的指南和文献报道[1,28], 当PPC和断裂的胰头部主胰管相通时, 可采用内镜下经乳头引流术(transpapillary drainage, TPD), 包括ERPD及ENPD[8]. 一般而言支架放置时间为4 wk-6 wk[29], 如果胰管支架置入时间超过3 mo, 则应根据复查情况明确是否拔除支架. 研究表明, ERCP引导下经十二指肠乳头引流的失败率高达74%, 并且增加了胰周液体积聚(pancreatic fluid collections, PFCs)复发的风险. 而EUS检查可评估坏死灶的内容物性质、毗邻脏器以及消化道大血管等情况, 进而选择最佳的穿刺部位. 王丹松等[30]纳入60例感染坏死性胰腺炎的患者, 比较开腹引流手术和EUS引导下ERPD治疗的疗效及安全性, 结果与开腹组相比, ERPD组患者的并发症发生率明显更低,但是两组的死亡率对比差异无统计学意义.
2020年美国胃肠病协会临床实践专家共识明确提出, 对于DPDS患者, 可在EUS引导下经胃壁或十二指肠壁放置PS, 将胰周积液引流入消化道[15]. 跨壁支架在胰周积液处理后通常需要取出, 但文献表明移除支架后, PFCs复发率会增加[27], 对于PFCs风险较低的病例, 例如: 胰体/尾胰管破裂、原位放置跨壁支架>6个月且出现糖尿病、脂肪泻和胰腺萎缩等胰腺功能不全的DPDS患者, 可以移除支架; 对于其他患者, 则需密切监测支架的移位和胰周液体集聚的复发情况[31]. 虽然DPDS对INP的预后影响极大, 但是不推荐内镜下预防性胰管支架置入. Karjula等[32]在2019年进行的一项随机对照试验提示坏死性胰腺炎预防性胰管支架置入会增加感染的风险. DPDS的内镜下治疗需要通过长期或永久的支架置入或建立瘘管进行持续引流. 但目前尚无DPDS规范化处理的诊疗指南, 当保守治疗或内镜治疗3 mo以上持续瘘管引流超过每天100 mL的患者, 应及时进行手术[33].
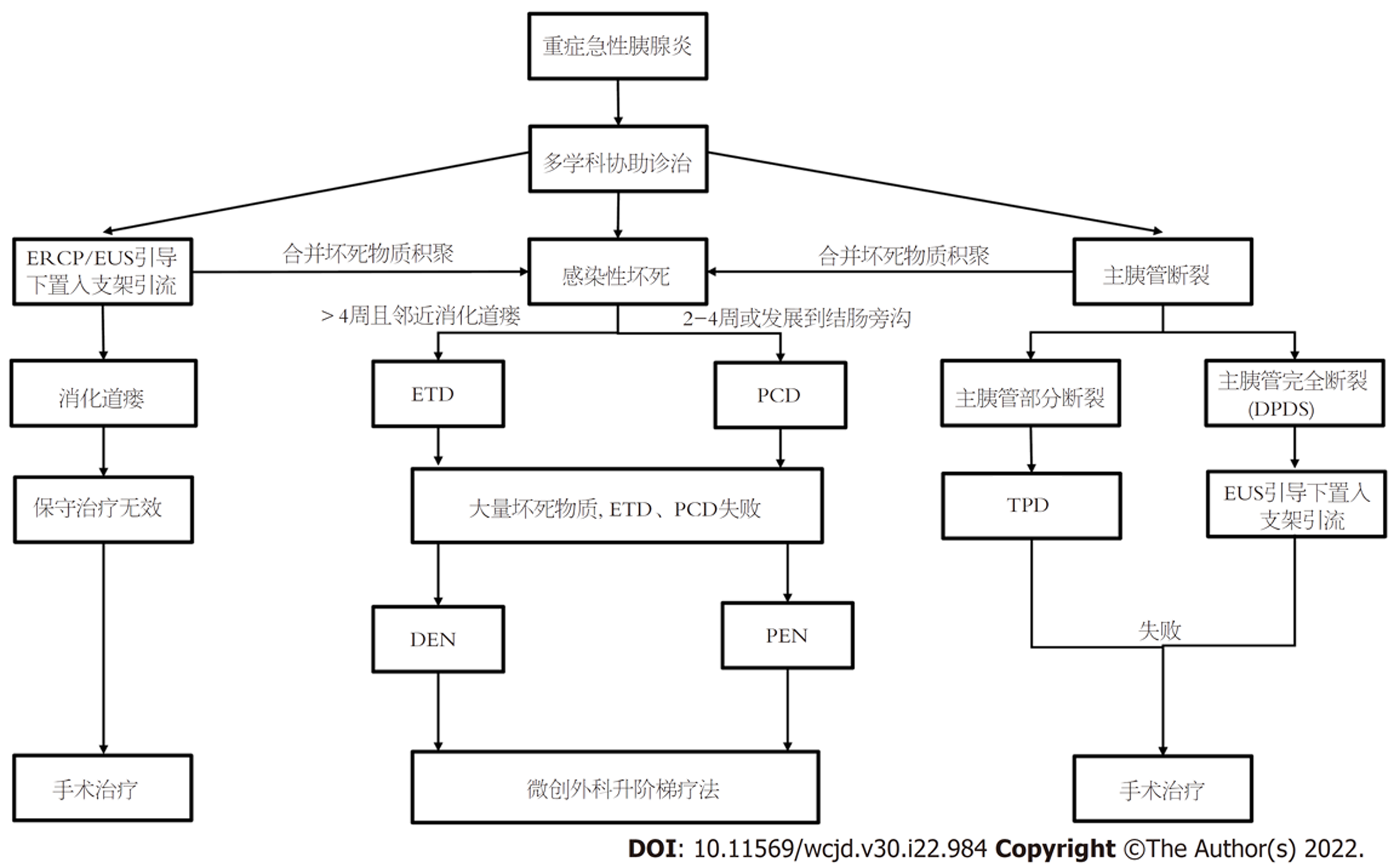
SAP病因和病情转归的复杂性决定了治疗手段的多元化. 我们结合国内外文献[12,22,23]对SAP的微创治疗升阶梯策略总结绘制流程图(图1), 然而流程上具体的诊疗方案的选择有待更多的临床数据支撑验证. 内镜阶梯治疗和外科微创孰优孰劣, 微创与小切口开腹手术的利弊之争, 各种方式在并发症、住院时间、总住院费用等方面研究的进展, 单中心模式与多学科协助诊治(multiple disciplinary team, MDT)模式的优劣都是SAP的热点话题. 因此, 应根据病情、MDT的经验和专业知识以及各医疗中心的资源, 为患者制定精准的治疗方案. 随着互联网的发展, 网络MDT也成为了一个热门话题, 借助互联网平台, 强化了专科之间的学术交流和跨区域的院际合作, 也为构建以SAP疾病为中心的高度一体化的MDT平台提供了土壤[7]. 笔者所在中心近年来致力于胰胆多学科协作诊疗, 利用手机APP Anymed和微信公众号建立在线MDT会诊平台、远程会诊及双向转诊系统, 希望利用这种新的模式为异地基层患者提供个体化诊疗方案.
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Baron TH, DiMaio CJ, Wang AY, Morgan KA. American Gastroenterological Association Clinical Practice Update: Management of Pancreatic Necrosis. Gastroenterology. 2020;158:67-75.e1. [PubMed] [DOI] |
| 2. | Trikudanathan G, Wolbrink DRJ, van Santvoort HC, Mallery S, Freeman M, Besselink MG. Current Concepts in Severe Acute and Necrotizing Pancreatitis: An Evidence-Based Approach. Gastroenterology. 2019;156:1994-2007.e3. [PubMed] [DOI] |
| 3. | Wolbrink DRJ, Kolwijck E, Ten Oever J, Horvath KD, Bouwense SAW, Schouten JA. Management of infected pancreatic necrosis in the intensive care unit: a narrative review. Clin Microbiol Infect. 2020;26:18-25. [PubMed] [DOI] |
| 4. | Boxhoorn L, van Dijk SM, van Grinsven J, Verdonk RC, Boermeester MA, Bollen TL, Bouwense SAW, Bruno MJ, Cappendijk VC, Dejong CHC, van Duijvendijk P, van Eijck CHJ, Fockens P, Francken MFG, van Goor H, Hadithi M, Hallensleben NDL, Haveman JW, Jacobs MAJM, Jansen JM, Kop MPM, van Lienden KP, Manusama ER, Mieog JSD, Molenaar IQ, Nieuwenhuijs VB, Poen AC, Poley JW, van de Poll M, Quispel R, Römkens TEH, Schwartz MP, Seerden TC, Stommel MWJ, Straathof JWA, Timmerhuis HC, Venneman NG, Voermans RP, van de Vrie W, Witteman BJ, Dijkgraaf MGW, van Santvoort HC, Besselink MG; Dutch Pancreatitis Study Group. Immediate versus Postponed Intervention for Infected Necrotizing Pancreatitis. N Engl J Med. 2021;385:1372-1381. [PubMed] [DOI] |
| 6. | van Santvoort HC, Besselink MG, Bakker OJ, Hofker HS, Boermeester MA, Dejong CH, van Goor H, Schaapherder AF, van Eijck CH, Bollen TL, van Ramshorst B, Nieuwenhuijs VB, Timmer R, Laméris JS, Kruyt PM, Manusama ER, van der Harst E, van der Schelling GP, Karsten T, Hesselink EJ, van Laarhoven CJ, Rosman C, Bosscha K, de Wit RJ, Houdijk AP, van Leeuwen MS, Buskens E, Gooszen HG; Dutch Pancreatitis Study Group. A step-up approach or open necrosectomy for necrotizing pancreatitis. N Engl J Med. 2010;362:1491-1502. [PubMed] [DOI] |
| 9. | van Grinsven J, van Brunschot S, Bakker OJ, Bollen TL, Boermeester MA, Bruno MJ, Dejong CH, Dijkgraaf MG, van Eijck CH, Fockens P, van Goor H, Gooszen HG, Horvath KD, van Lienden KP, van Santvoort HC, Besselink MG; Dutch Pancreatitis Study Group. Diagnostic strategy and timing of intervention in infected necrotizing pancreatitis: an international expert survey and case vignette study. HPB (Oxford). 2015;. [PubMed] [DOI] |
| 10. | van Baal MC, van Santvoort HC, Bollen TL, Bakker OJ, Besselink MG, Gooszen HG; Dutch Pancreatitis Study Group. Systematic review of percutaneous catheter drainage as primary treatment for necrotizing pancreatitis. Br J Surg. 2011;98:18-27. [PubMed] [DOI] |
| 11. | van Brunschot S, van Grinsven J, van Santvoort HC, Bakker OJ, Besselink MG, Boermeester MA, Bollen TL, Bosscha K, Bouwense SA, Bruno MJ, Cappendijk VC, Consten EC, Dejong CH, van Eijck CH, Erkelens WG, van Goor H, van Grevenstein WMU, Haveman JW, Hofker SH, Jansen JM, Laméris JS, van Lienden KP, Meijssen MA, Mulder CJ, Nieuwenhuijs VB, Poley JW, Quispel R, de Ridder RJ, Römkens TE, Scheepers JJ, Schepers NJ, Schwartz MP, Seerden T, Spanier BWM, Straathof JWA, Strijker M, Timmer R, Venneman NG, Vleggaar FP, Voermans RP, Witteman BJ, Gooszen HG, Dijkgraaf MG, Fockens P; Dutch Pancreatitis Study Group. Endoscopic or surgical step-up approach for infected necrotising pancreatitis: a multicentre randomised trial. Lancet. 2018;391:51-58. [PubMed] [DOI] |
| 13. | Bang JY, Wilcox CM, Arnoletti JP, Peter S, Christein J, Navaneethan U, Hawes R, Varadarajulu S. Validation of the Orlando Protocol for endoscopic management of pancreatic fluid collections in the era of lumen-apposing metal stents. Dig Endosc. 2022;34:612-621. [PubMed] [DOI] |
| 14. | Bang JY, Hasan M, Navaneethan U, Hawes R, Varadarajulu S. Lumen-apposing metal stents (LAMS) for pancreatic fluid collection (PFC) drainage: may not be business as usual. Gut. 2017;66:2054-2056. [PubMed] [DOI] |
| 15. | Boxhoorn L, Voermans RP, Bouwense SA, Bruno MJ, Verdonk RC, Boermeester MA, van Santvoort HC, Besselink MG. Acute pancreatitis. Lancet. 2020;396:726-734. [PubMed] [DOI] |
| 17. | Trikudanathan G, Tawfik P, Amateau SK, Munigala S, Arain M, Attam R, Beilman G, Flanagan S, Freeman ML, Mallery S. Early (<4 Weeks) Versus Standard (≥ 4 Weeks) Endoscopically Centered Step-Up Interventions for Necrotizing Pancreatitis. Am J Gastroenterol. 2018;113:1550-1558. [PubMed] [DOI] |
| 18. | Bang JY, Navaneethan U, Hasan MK, Sutton B, Hawes R, Varadarajulu S. Non-superiority of lumen-apposing metal stents over plastic stents for drainage of walled-off necrosis in a randomised trial. Gut. 2019;68:1200-1209. [PubMed] [DOI] |
| 20. | Driedger M, Zyromski NJ, Visser BC, Jester A, Sutherland FR, Nakeeb A, Dixon E, Dua MM, House MG, Worhunsky DJ, Munene G, Ball CG. Surgical Transgastric Necrosectomy for Necrotizing Pancreatitis: A Single-stage Procedure for Walled-off Pancreatic Necrosis. Ann Surg. 2020;271:163-168. [PubMed] [DOI] |
| 21. | Maatman TK, McGuire SP, Flick KF, Madison MK, Al-Haddad MA, Bick BL, Ceppa EP, DeWitt JM, Easler JJ, Fogel EL, Gromski MA, House MG, Lehman GA, Nakeeb A, Schmidt CM, Sherman S, Watkins JL, Zyromski NJ. Outcomes in Endoscopic and Operative Transgastric Pancreatic Debridement. Ann Surg. 2021;274:516-523. [PubMed] [DOI] |
| 22. | Singh A, Aggarwal M, Garg R, Walsh M, Stevens T, Chahal P. Spontaneous Internal Pancreatic Fistulae Complicating Acute Pancreatitis. Am J Gastroenterol. 2021;116:1381-1386. [PubMed] [DOI] |
| 23. | 中华医学会消化内镜学分会ERCP学组; 中国医师协会内镜医师分会; 北京医学会消化内镜学分会. 中国胰瘘消化内镜诊治专家共识(2020, 北京). 中华消化内镜杂志. 2021;38:276-287. [DOI] |
| 24. | 达 彬琳, 汪 立新, 汪 志明, 张 娟娟, 王 晓玮, 朱 楠, 朱 琳, 刁 艳青. 内镜吻合夹在治疗重症急性胰腺炎合并消化道瘘中的应用. 医学研究生学报. 2021;34:625-628. [DOI] |
| 26. | 马 瑞光, 王 方青, 李 广超, 张 凯, 张 晓明, 任 洪波, 王 磊, 钟 宁, 左 秀丽, 李 延青, 李 真. 急性胰腺炎恢复期隐匿的多发消化道瘘. 中华消化杂志. 2022;42:198-201. [DOI] |
| 27. | Wang L, Elhanafi S, Storm AC, Topazian MD, Majumder S, Abu Dayyeh BK, Levy MJ, Petersen BT, Martin JA, Chari ST, Vege SS, Chandrasekhara V. Impact of disconnected pancreatic duct syndrome on endoscopic ultrasound-guided drainage of pancreatic fluid collections. Endoscopy. 2021;53:603-610. [PubMed] [DOI] |
| 29. | Le Moine O, Matos C, Closset J, Devière J. Endoscopic management of pancreatic fistula after pancreatic and other abdominal surgery. Best Pract Res Clin Gastroenterol. 2004;18:957-975. [PubMed] [DOI] |
| 32. | Karjula H, Nordblad Schmidt P, Mäkelä J, Liisanantti JH, Ohtonen P, Saarela A. Prophylactic pancreatic duct stenting in severe acute necrotizing pancreatitis: a prospective randomized study. Endoscopy. 2019;51:1027-1034. [PubMed] [DOI] |
| 33. | Pearson EG, Scaife CL, Mulvihill SJ, Glasgow RE. Roux-en-Y drainage of a pancreatic fistula for disconnected pancreatic duct syndrome after acute necrotizing pancreatitis. HPB (Oxford). 2012;14:26-31. [PubMed] [DOI] |