修回日期: 2022-08-11
接受日期: 2022-10-24
在线出版日期: 2022-11-08
癌症的早期筛查一直是癌症研究领域的重点, 胃癌作为全世界常见的癌症, 发病率和死亡率常年居高不下, 且癌变不易察觉, 目前的检测方法对早期发现胃癌和癌前病变效果不理想.
探讨血清胃蛋白酶原(pepsinogen, PG)、胃泌素17(gastrin-17, G-17)、肝肠钙黏连蛋白-17(cadherin-17, CDH-17)检测联合窄带成像放大内镜在鉴别早期胃癌及癌前病变中的价值.
回顾性分析2018-01/2021-01我院早期胃癌患者(106例)及癌前病变患者(134例)的临床资料, 所有患者均行窄带成像放大内镜检查, 并检测血清PG(包括PGⅠ、PGⅡ)、G-17、CDH-17水平. 分析PG、G-17、CDH-17和窄带成像放大内镜单独和联合诊断早期胃癌、癌前病变的敏感度、特异度、准确度.
早期胃癌组的窄带成像放大内镜检查中, 病灶有边界限、黏膜微血管不规则、表层腺管不规则、腺间距增大发生率高于癌前病变组组(P<0.05); 窄带成像放大内镜对早期胃癌、癌前病变诊断符合率分别为83.02%、85.07%, 差异无统计学意义; 早期胃癌组的血清PGⅠ水平低于癌前病变组, 血清G-17、CDH-17水平高于癌前病变组(P<0.05), 两组血清PGⅡ无明显差异; 血清PGⅠ、G-17、CDH-17单独诊断符合率差异无统计学意义; 血清PGⅠ、G-17、CDH-17联合窄带成像放大内镜诊断早期胃癌、癌前病变的灵敏度、特异度、准确度高于单独血清(PGⅠ/G-17/CDH-17)诊断或单独窄带成像放大内镜(P<0.05).
血清PG、G-17、CDH-17检测联合窄带成像放大内镜鉴别诊断早期胃癌及癌前病变的敏感度、特异度、准确度较高, 具有较高应用价值.
核心提要: 胃蛋白酶原(pepsinogen, PG)、胃泌素17(gastrin-17, G-17)、肝肠钙黏连蛋白-17(cadherin-17, CDH-17)检测联合窄带成像放大内镜鉴别, 充分发挥各自的早检优势, 取长补短, 对胃癌早期和癌前病变检测的灵敏度、特异性均大大提高, 具有较高应用价值.
引文著录: 潘杰, 雷李美. 血清PG、G-17、CDH-17检测联合窄带成像放大内镜在鉴别早期胃癌及癌前病变中的价值研究. 世界华人消化杂志 2022; 30(21): 964-970
Revised: August 11, 2022
Accepted: October 24, 2022
Published online: November 8, 2022
The early screening of cancer has always been the focus of cancer research. As a common cancer in the world, gastric cancer has had a high incidence rate and mortality for many years, and canceration is difficult to detect. Current detection methods are not ideal for early detection of gastric cancer and precancerous lesions.
To assess the value of detection of serum pepsinogen (PG), gastrin (G-17), and hepato-intestinal cadherin-17 (CDH-17) combined with narrowband imaging magnifying endoscopy in the identification of early gastric cancer and precancerous lesions.
The clinical data of patients with early gastric cancer (106 cases) and precancerous lesions (134 cases) at our hospital from January 2018 to January 2021 were retrospectively analyzed. All patients underwent narrow-band imaging magnifying endoscopy and detection of serum PG (including PGⅠ and PGⅡ), G-17, and CDH-17 levels. The sensitivity, specificity, and accuracy of PG, G-17, CDH-17, and narrow-band imaging magnifying endoscopy, alone and in combination, in the diagnosis of early gastric cancer and precancerous lesions were calculated.
In the early gastric cancer group, the incidence of lesions with border limits, mucosal microvascular irregularities, irregular surface ducts, and increased glandular spacing as detected by narrow-band imaging magnifying endoscopy was higher than that in the precancerous lesion group (P < 0.05). The diagnostic coincidence rates of magnifying endoscopy for early gastric cancer and precancerous lesions were 83.02% and 85.07%, respectively, and the difference was not statistically significant (P > 0.05). Serum PGⅠ level in the early gastric cancer group was lower than that of the precancerous lesion group, but there was no significant difference in serum PGⅡ between the two groups (P > 0.05); serum G-17 and CDH-17 levels were higher than those of the precancerous lesion group (P < 0.05). There was no statistically significant difference in the diagnostic coincidence rates of serum PGI, G-17, and CDH-17 alone (P > 0.05). The sensitivity, specificity and accuracy of serum PGⅠ, G-17, and CDH-17 combined with narrow-band imaging magnifying endoscopy in the diagnosis of early gastric cancer and precancerous lesions were higher than those of any serum index alone (PGⅠ/G-17/CDH-17) or narrowband imaging magnifying endoscopy alone (P < 0.05).
The detection of serum PG, G-17, and CDH-17 combined with narrow-band imaging magnifying endoscopy has high sensitivity, specificity, and accuracy in the differential diagnosis of early gastric cancer and precancerous lesions.
- Citation: Pan J, Lei LM. Value of serum pepsinogen, gastrin, and cadherin-17 detection combined with narrowband imaging magnifying endoscopy in distinguishing early gastric cancer and precancerous lesions. Shijie Huaren Xiaohua Zazhi 2022; 30(21): 964-970
- URL: https://www.wjgnet.com/1009-3079/full/v30/i21/964.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i21.964
胃癌是发病率较高的消化道恶性肿瘤, 发病率占全球癌症发病率的6.8%, 全球每年新发病例约为95.1万, 死亡病例约72.3万[1]. 我国其发病率和死亡率仅次于肺癌, 高居第2位, 成为沉重的公共卫生负担. 我国多数胃癌患者发现时已发展成进展期胃癌, 预后差, 5年生存率仅为33%左右[2]. 提高早期胃癌的鉴别诊断水平是改善胃癌患者预后的关键. 窄带成像放大内镜是新型光学增强成像技术, 能够清晰显示病变部位黏膜表层形态、微血管状态, 提高黏膜毛细血管的成像质量, 为鉴别诊断癌前病变和早期胃癌提供影像依据[3]. 既往多项研究[5-7]显示, 相较于传统内镜, 窄带成像放大内镜能够显著提高诊断早期胃癌的效能. 但当前窄带成像放大内镜诊断早期胃癌仍未形成统一的标准. 此外, 早期病变不典型或受图像处理因素的影响, 窄带成像放大内镜鉴别诊断早期胃癌、癌前病变存在一定的难度. 随着胃癌的发生发展, 患者血清胃蛋白酶原(pepsinogen, PG)、胃泌素17(gastrin-17, G-17)、肝肠钙黏连蛋白-17(cadherin-17, CDH-17)会发生改变, 将血清PG、G-17、CDH-17联合窄带成像放大内镜对提高早期胃癌、癌前病变的鉴别诊断效果有一定的作用. 因此, 本研究观察了血清PG、G-17、CDH-17检测联合窄带成像放大内镜在鉴别早期胃癌及癌前病变中的价值, 报道如下.
回顾性分析2018-01/2021-01我院早期胃癌患者(106例)及癌前病变患者(134例)的临床资料. 纳入标准: (1)符合《中国早期胃癌筛查及内镜共识意见(2014年, 长沙)》[8]相关诊断标准, 且经病理检查确诊为早期胃癌、癌前病变; (3)初诊患者; (4)未接受放化疗、药物治疗等; (5)未进行手术治疗; (6)无窄带成像放大内镜禁忌症; (7)签署同意书. 排除标准: (1)合并严重造血系统疾病; (2)1周内使用非甾体类药物; (3)严重心、肝、肺功能不全; (4)合并消化道梗阻、穿孔、出血; (5)合并肺部感染; (6)不耐受检查者. 早期胃癌组男58例, 女48例, 年龄36-76岁, 平均(53.06±7.99)岁. 癌前病变组男70例, 女64例, 年龄34岁-77岁, 平均(52.95±8.03)岁. 两组性别、年龄差异不明显, 有可比性. 本研究经医院伦理委员会审批通过.
1.2.1 实验室检查: 空腹采集静脉血液5 mL, 3000 r/min离心10 min, 取血清冻存待测. 使用酶联免疫吸附法检测PG、G-17、CDH-17水平, PG、G-17 ELISA试剂盒为英国Abcam, CDH-17 ELISA试剂盒为美国USCN.
1.2.2 窄带成像放大内镜检查: 仪器为日本奥林巴斯260内镜, 检查前禁食禁水8 h, 检查前30 min给予盐酸达克罗宁胶浆(扬子江药业集团有限公司, 国药准字H20041523, 规格: 0.1 g: 10 mL)10 mL口服. 内镜探入胃腔, 常规行白光内镜检查, 找到可疑病灶后, 切换至窄带成像技术(NBI)模式, 逐渐放大观察病灶与邻近组织的关系、病灶的形态、黏膜表层微血管形态、胃小凹结构. 早期胃癌诊断标准: (1)胃黏膜下的微血管呈不规则或消失; (2)胃黏膜结构不规则或消失; 符合上述至少一项视为早期胃癌.
1.2.3 病理检查: 胃镜下常规取胃窦、胃体处2块黏膜组织; 胃镜下有发红、发白、形态隆起或凹陷的异常病变处, 常规取黏膜组织; 可疑病变者, 进行靶向活检或内镜下黏膜剥离. 将病理组织固定在10%福尔马林液中, 制备成石蜡片, 由医师对病理进行诊断.
(1)观察早期胃癌、癌前病变患者的窄带成像放大内镜征象; (2)观察早期胃癌、癌前病变患者的血清PG、G-17、CDH-17水平; (3)观察血清PG、G-17、CDH-17联合窄带成像放大内镜诊断结果.
统计学处理 用SPSS 25.0统计学软件分析, 计量资料用mean±SD表示, 行t检验, 计数资料用%表示, 行χ2检验, 采用(receiver operator characteristic curve, ROC)分析血清PG、G-17、CDH-17的诊断效能, P<0.05表示有统计学意义.
早期胃癌组的窄带成像放大内镜检查中, 有边界限、黏膜微血管不规则、表层腺管不规则、腺间距增大发生率高于癌前病变组(P<0.05), 见表1. 提示, 早期胃癌病变窄带成像放大内镜征象: 多数病灶有边界限、黏膜微血管及表层腺管紊乱、腺间距增大; 胃癌前病变窄带成像放大内镜征象: 多数病灶无边界限, 黏膜微血管较规则, 部分病灶表层腺体紊乱、腺间距增大.
| 组别 | n | 有边界限 | 黏膜微血管不规则 | 表层腺管不规则 | 腺间距增大 |
| 早期胃癌组 | 106 | 104(98.11) | 94(88.68) | 86(81.13) | 92(86.79) |
| 癌前病变组 | 134 | 48(35.82) | 26(19.40) | 70(52.24) | 64(47.76) |
| χ2 | 98.893 | 113.613 | 21.718 | 39.632 | |
| P | 0.000 | 0.000 | 0.000 | 0.000 |
窄带成像放大内镜对早期胃癌、癌前病变诊断符合率分别为83.02%、85.07%, 差异无统计学意义, 见表2. 提示, 窄带成像放大内镜对部分早期胃癌漏诊(16.98%), 对部分癌前病变(11.94%)作出过度诊断,即诊断为胃癌.
| 组别 | n | 窄带成像放大内镜诊断结果 | ||
| 早期胃癌 | 癌前病变 | 不明确 | ||
| 早期胃癌组 | 106 | 88(83.02) | 14(13.21) | 4(3.77) |
| 癌前病变组 | 134 | 16(11.94) | 114(85.07) | 4(2.98) |
| χ2 | 126.425 | |||
| P | 0.000 | |||
早期胃癌组的血清PGⅠ水平低于癌前病变组, 血清G-17、CDH-17水平高于癌前病变组(P<0.05), 两组血清PGⅡ无明显差异, 见表3. 提示, 低PGⅠ水平、高G-17、CDH-17水平的患者存在较高的胃癌变风险.
| 组别 | n | PGⅠ(ng/mL) | PGⅡ(ng/mL) | G-17(pmol/L) | CDH-17(pg/mL) |
| 早期胃癌组 | 106 | 46.73±4.21 | 12.03±4.90 | 21.57±2.05 | 65.54±6.39 |
| 癌前病变组 | 134 | 57.12±5.39 | 11.29±5.35 | 12.16±1.17 | 58.71±5.27 |
| t | 16.297 | 1.104 | 44.732 | 9.074 | |
| P | 0.000 | 0.116 | 0.000 | 0.000 |
血清PGⅠ、G-17、CDH-17诊断早期胃癌、癌前病变的ROC曲线分析显示, 血清PGⅠ、G-17、CDH-17单独诊断符合率差异无统计学意义, 见表4.
| 组别 | 截断值 | 曲线下面积 | 早期胃癌诊断符合 | 癌前病变诊断符合 |
| PGⅠ | 41.63 ng/mL | 0.739 | 77.36(82/106) | 80.60(108/134) |
| G-17 | 23.02 pmol/L | 0.672 | 71.70(76/106) | 79.10(106/134) |
| CDH-17 | 67.95 pg/mL | 0.653 | 75.47(80/106) | 77.61(104/134) |
| χ2 | 0.935 | 0.361 | ||
| P | 0.626 | 0.835 |
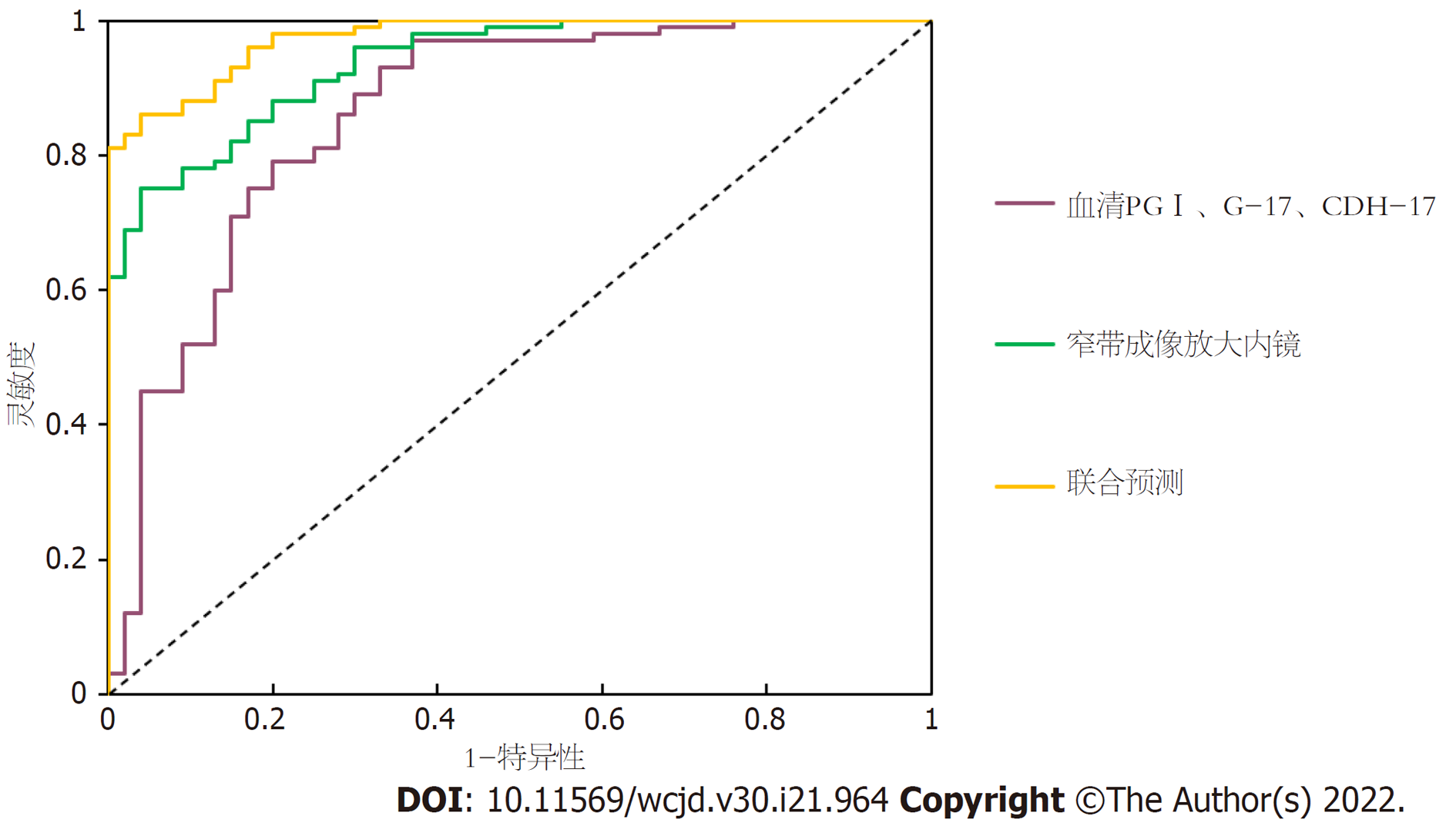
早期胃癌联合诊断: 窄带成像放大内镜诊断为早期胃癌或PGⅠ、G-17、CDH-17三项全阳性+窄带成像放大内镜诊断为非早期胃癌. 血清PGⅠ、G-17、CDH-17联合窄带成像放大内镜诊断早期胃癌、癌前病变的灵敏度、特异度、准确度高于单独血清(PGⅠ/G-17/CDH-17)诊断或单独窄带成像放大内镜(P<0.05), 见表5、图1.
| 组别 | 灵敏度 | 特异度 | 准确度 |
| 血清(PGⅠ/G-17/CDH-17) | 79.25%(84/106) | 82.09%(110/134) | 80.83%(194/240) |
| 窄带成像放大内镜 | 83.02%(88/106) | 85.07%(114/134) | 84.17%(202/240) |
| 联合诊断 | 94.34%(100/106) | 95.52%(132/134) | 95.00%(228/240) |
| χ2 | 10.573 | 20.228 | 22.789 |
| P | 0.005 | 0.000 | 0.000 |
胃癌起源于胃黏膜上皮病变, 病变早期的肿瘤组织侵袭至黏膜层或黏膜下层, 未达肌层, 且无转移灶, 预后较好, 术后5年生存率可高达90%; 若肿瘤组织侵袭至肌层, 则术后5年生存率降低至50%-60%; 肿瘤组织侵袭至浆膜层、浆膜外, 5年生存率降低至不足20%[9]. 胃癌前病变是正常胃黏膜向胃癌转化的重要阶段, 包括肠上皮化生、异型增生, 其中胃黏膜上皮中重度不典型增生、不完全性肠上皮化生具有高度恶化风险[10]. 对早期胃癌、癌前病变的诊断对预后有重要的意义.
一般情况下, 早期胃癌与正常组织的黏膜血管结构存在差异, 使窄带成像放大内镜能够有效鉴别早期胃癌、癌前病变. 窄带成像放大内镜是新型内镜技术, 具有以下优点: (1)清晰显示病变部位及周围黏膜内微血管的形态、血管走形, 易于识别异常组织; (2)能够详细观察黏膜表面及病变的精细结构、腺管开口分型; (3)显示平坦型病变或微小病变, 指导靶向活检; (4)窄带成像的窄带光波难扩散, 能被血液吸收, 从而能够清晰显示黏膜血管、上皮, 并增强病变边界. 当胃黏膜发生病变时, 可出现胃黏膜形态结构出现不同程度的改变, 本研究中早期胃癌患者多数在窄带成像放大内镜下可观察到边界限(98.11%)以及黏膜微血管不规则(88.68%)、表层腺管不规则(81.13%)、腺间距增大(86.79%), 而癌前病变较少出现这些征象, 分别占35.82%、19.40%、52.24%、47.76%. 提示, 早期胃癌病变的病灶以有边界限, 黏膜微血管及表层腺管紊乱, 腺间距增大为主, 而癌前病变则主要表现为病灶无边界限, 黏膜微血管较规则. 相关研究[11,12]亦显示, 早期胃癌的窄带成像技术联合放大内镜主要征象为病灶有边界线及黏膜微血管、表层腺管的异常改变. 这可能是由于胃癌细胞增殖异常所致.
胃癌的发生发展过程中, 会导致相关的标志物含量出现变化, PG来源于胃, 在不同胃部疾病中血清PG含量不同, 其能够反映胃黏膜状态及功能, 分为PGⅠ、PGⅡ, PGⅠ由胃底腺的主细胞、颈黏液细胞产生. PGⅡ由主细胞、颈黏液细胞及其他组织腺体合成并分泌. 早期胃癌、癌前病变患者由于胃黏膜萎缩, 主细胞、颈黏液细胞减少, 其分泌功能受损, 使PGⅠ分泌减少, 而PGⅡ受影响较小[13]. G-17是一种胃肠激素, 有调节胃酸分泌、胃黏膜生长及分泌等作用, 在胃肠肿瘤的增殖与调控中也起到重要的作用, 早期胃癌由于胃黏膜萎缩, 胃体部壁细胞数量减少, 胃酸分泌减少, 促使胃窦G细胞分泌G-17分泌, 从而使血清G-17含量升高[14,15]. 正常情况下, CDH-17在胃黏膜组织中基本无表达, 在胃癌中呈高表达[16]. 本研究结果显示, 早期胃癌组的血清PGⅠ水平低于癌前病变组, 血清G-17、CDH-17水平高于癌前病变组(P<0.05), 两组血清PGⅡ差异不明显. 表明, 早期胃癌、癌前病变患者的血清PGⅠ、G-17、CDH-17存在差异, 低PGⅠ水平、高G-17、CDH-17水平的患者存在较高的胃癌变风险, 这对鉴别早期胃癌、癌前病变具有一定的价值. 相关研究[17]显示, 血清PG联合智能分光比色放大内镜能够提高胃癌、癌前病变的诊断率. 本研究中, 与单独血清PG、G-17、CDH-17或单独窄带成像放大内镜诊断结果比较, 两者联合诊断早期胃癌、癌前病变的灵敏度、特异度、准确度明显提高(P<0.05). 表明, 血清PG、G-17、CDH-17联合窄带成像放大内镜能够提高早期胃癌、癌前病变的鉴别诊断效能.
综上所述, 血清PG、G-17、CDH-17检测联合窄带成像放大内镜鉴别诊断早期胃癌及癌前病变的敏感度、特异度、准确度较高, 具有较高应用价值. 本研究存在一定局限, 胃癌的最准确判断方法是手术切除胃、清扫淋巴结等并作出综合判断, 由于手术切除胃并不适用于癌前期病变、早期胃癌的筛查, 因而本研究中的最终癌前期病变、早期胃癌通过胃镜取活检病理明确, 而胃镜活检结果本身有一定的误差, 这种误差会在一定程度上影响研究结果. 同时, 纳入的病例数较少, 且为单中心研究, 在一定程度上增大结果误差, 今后仍需大样本, 开展多中心研究进行进一步研究证实.
早期胃癌症状不明显, 发现不及时一旦进入中晚期会导致病情难以控制, 降低生存时间. 通过有效的诊断设备和手段在早期或者癌前病变发现胃癌是治疗的关键.
尽早准确发现胃癌早期和癌前病变是治疗胃癌的关键. 但是目前的检测手段并不理想, 受图像处理因素的影响, 窄带成像放大内镜鉴别诊断早期胃癌、癌前病变存在一定的难度. 因此, 如何提高检测灵敏度和准确度是早检的关键.
为了寻找提高检测胃癌早期和癌前病变准确度、灵敏度的方法, 本研究将胃蛋白酶原(pepsinogen, PG)、胃泌素17(gastrin-17, G-17)、肝肠钙黏连蛋白-17(cadherin-17, CDH-17)血清学的检测与窄带成像放大内镜鉴别诊断的影响学相结合, 取长补短.
本研究主要通过血清学检测和内镜影像学诊断相结合的方法, 通过对检测数据进行分析, 得到联合检测与准确性、灵敏度和特异性相关的结果.
与癌前病变组相比, 早期胃癌组影响观察有边界限、黏膜微血管不规则、表层腺管不规则、腺间距增大发生率更高; 血清PGⅠ水平更低, 血清G-17、CDH-17水平更高. 血清PGⅠ、G-17、CDH-17联合窄带成像放大内镜诊断早期胃癌、癌前病变的灵敏度、特异度、准确度更高.
血清学检测联合窄带成像放大内镜鉴别诊断能够更准确、更灵敏地发现早期胃癌及癌前病变的指征变化, 为胃癌的早发现早治疗提供新方法, 有较高应用价值.
本研究在一定程度上提高了早期胃癌及癌前病变的检测准确性和灵敏性, 但是由于本研究结果建立在活检病理的基础上, 受病理切片只能反映局部组织的限制, 结果本身有一定的误差. 同时, 纳入的病例数较少, 且为单中心研究, 今后仍需大样本, 开展多中心研究进行进一步研究证实.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 2. | Yoshida N, Doyama H, Yano T, Horimatsu T, Uedo N, Yamamoto Y, Kakushima N, Kanzaki H, Hori S, Yao K, Oda I, Katada C, Yokoi C, Ohata K, Yoshimura K, Ishikawa H, Muto M. Early gastric cancer detection in high-risk patients: a multicentre randomised controlled trial on the effect of second-generation narrow band imaging. Gut. 2021;70:67-75. [PubMed] [DOI] |
| 4. | White JR, Sami SS, Reddiar D, Mannath J, Ortiz-Fernández-Sordo J, Beg S, Scott R, Thiagarajan P, Ahmad S, Parra-Blanco A, Kasi M, Telakis E, Sultan AA, Davis J, Figgins A, Kaye P, Robinson K, Atherton JC, Ragunath K. Narrow band imaging and serology in the assessment of premalignant gastric pathology. Scand J Gastroenterol. 2018;53:1611-1618. [PubMed] [DOI] |
| 5. | 滕 腊梅, 章 庆伟, 张 昕恬, 陈 锦南, 王 奇雯, 周 菁. 白光内镜与放大内镜联合窄带成像技术对肠型胃腺瘤与早期胃癌的诊断价值. 胃肠病学. 2019;24:389-394. [DOI] |
| 6. | Horiuchi Y, Tokai Y, Yamamoto N, Yoshimizu S, Ishiyama A, Yoshio T, Hirasawa T, Yamamoto Y, Nagahama M, Takahashi H, Tsuchida T, Fujisaki J. Additive Effect of Magnifying Endoscopy with Narrow-Band Imaging for Diagnosing Mixed-Type Early Gastric Cancers. Dig Dis Sci. 2020;65:591-599. [PubMed] [DOI] |
| 7. | Matsumoto K, Ueyama H, Yao T, Abe D, Oki S, Suzuki N, Ikeda A, Yatagai N, Akazawa Y, Komori H, Takeda T, Matsumoto K, Hojo M, Nagahara A. Diagnostic limitations of magnifying endoscopy with narrow-band imaging in early gastric cancer. Endosc Int Open. 2020;8:E1233-E1242. [PubMed] [DOI] |
| 9. | Yoshimizu S, Yamamoto Y, Horiuchi Y, Omae M, Yoshio T, Ishiyama A, Hirasawa T, Tsuchida T, Fujisaki J. Diagnostic performance of routine esophagogastroduodenoscopy using magnifying endoscope with narrow-band imaging for gastric cancer. Dig Endosc. 2018;30:71-78. [PubMed] [DOI] |
| 10. | Barbeiro S, Libânio D, Castro R, Dinis-Ribeiro M, Pimentel-Nunes P. Narrow-Band Imaging: Clinical Application in Gastrointestinal Endoscopy. GE Port J Gastroenterol. 2018;26:40-53. [PubMed] [DOI] |
| 12. | Horiuchi Y, Aoyama K, Tokai Y, Hirasawa T, Yoshimizu S, Ishiyama A, Yoshio T, Tsuchida T, Fujisaki J, Tada T. Convolutional Neural Network for Differentiating Gastric Cancer from Gastritis Using Magnified Endoscopy with Narrow Band Imaging. Dig Dis Sci. 2020;65:1355-1363. [PubMed] [DOI] |
| 14. | Yu G, Wang GX, Wang HG, Mo FF, Tang BB. The value of detecting pepsinogen and gastrin-17 levels in serum for pre-cancerous lesion screening in gastric cancer. Neoplasma. 2019;66:637-640. [PubMed] [DOI] |
| 15. | Horii Y, Dohi O, Naito Y, Takayama S, Ogita K, Terasaki K, Nakano T, Majima A, Yoshida N, Kamada K, Uchiyama K, Ishikawa T, Takagi T, Handa O, Konishi H, Yagi N, Yanagisawa A, Itoh Y. Efficacy of Magnifying Narrow Band Imaging for Delineating Horizontal Margins of Early Gastric Cancer. Digestion. 2019;100:93-99. [PubMed] [DOI] |
| 17. | Fujiwara K, Tsuji AB, Sudo H, Sugyo A, Akiba H, Iwanari H, Kusano-Arai O, Tsumoto K, Momose T, Hamakubo T, Higashi T. 111In-labeled anti-cadherin17 antibody D2101 has potential as a noninvasive imaging probe for diagnosing gastric cancer and lymph-node metastasis. Ann Nucl Med. 2020;34:13-23. [PubMed] [DOI] |